2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
近年来,由于育种成本、时间和操作等因素的影响,相比淡水鱼类,海水养殖鱼类遗传改良研究进展缓慢。随着越来越多海水养殖鱼类全基因组测序的完成(Chen et al, 2014; Shao et al, 2016),许多与重要经济性状相关的基因亟需被发掘、解析甚至改良。目前,通过显微注射介导的转基因和基因组编辑技术已经在淡水养殖鱼类遗传育种和基因功能研究领域被广泛应用(朱作言等, 1999; Dunham, 2009; Li et al, 2013; Qin et al, 2016)。但海水养殖鱼类相关研究报道却较少,原因是建立海水养殖鱼类相应的显微注射技术难度较大。
显微注射技术是一种通过显微操作仪在解剖镜或显微镜下将外源物质、细胞核或细胞注入到受体中的生物微操作技术(沙珍霞等, 2005),此技术具有应用广泛、可靠性强、效果较好的特点(Rembold et al, 2006; Grabher et al, 2008)。显微注射技术在鱼类中的应用相对较早,童第周等(1963)率先建立了鱼类细胞核移植的显微注射技术。20世纪80年代,Zhu等(1985)通过显微注射技术创制了世界上第1尾转基因鱼。目前,显微注射技术广泛应用于淡水鱼类中。由于海水鱼类的受精卵属于浮性卵,卵膜紧贴胚胎,不易剥落(刘洋等, 2004),孵化培育困难等等,因此,建立显微注射技术难度较大。仅见花鲈(Lateolabrax japonicus) (刘洋等, 2004)、真鲷(Pagrus major) (Kato et al, 2007)、太平洋蓝鳍金枪鱼(Thunnus orientalis) (Otani et al, 2008)、箕作黄姑鱼(Nibea mitsukurii) (Yoji et al, 2011)、半滑舌鳎(Cynoglossus semilaevis) (Cui et al, 2017)等有成功报道。
大菱鲆(Scophthalmus maximus)属于鲆科(Bothidae)、菱鲆属(Scophthalmus),自1992年首次引进以来,已成为我国北方沿海重要的养殖鱼类之一(雷霁霖等, 2003)。近年来,大菱鲆养殖面临种质退化和病害频发问题,其雌性个体比雄性个体大20%~60%。本研究以GFP基因为报告基因,建立大菱鲆显微注射技术,不仅为大菱鲆性别决定机制、抗病基因筛选及良种培育等研究奠定了技术基础,也将丰富海水鱼类基因功能分析和遗传育种研究。
1 材料与方法 1.1 材料 1.1.1 受精卵大菱鲆亲鱼于2017年4月18日取自山东青岛市通用水产有限公司。选取性腺发育良好的个体作为亲鱼,亲鱼雌鱼经过强化培育达到性腺隆起明显时,进行人工催产。将成熟卵子和精子人工挤出,采用干法授精,加海水激活后,挑选质量好的受精卵(近似球状、透明)作为显微注射的实验材料。
1.1.2 smyd1 : gfp质粒中国水产科学研究院黄海水产研究所水产生物技术与基因组研究室保存的smyd1 : gfp质粒是由5.3 kb肌肉特异启动子smyd1与GFP基因连接构建的(Du et al, 2006)。将其转化至大肠杆菌(Escherichia coli) TOP 10菌株中扩大培养,使用质粒提取试剂盒(Omega)提取质粒。用1.5%琼脂糖凝胶电泳检测质粒,并用NanoVue plus超微量紫外-可见光分光光度计测定质粒的浓度,将浓度调整为50 ng/μl,-20℃保存备用。
1.1.3 显微注射针和凹槽板参考半滑舌鳎显微注射技术(Cui et al, 2017),使用Sutter公司的水平拉针仪制备注射大菱鲆胚胎用的玻璃微量注射针(图 1)。使用磨针仪打磨注射针的针尖。制备一个带有凹槽(凹槽宽度为0.95 mm±0.05 mm, 深度为1.00 mm±0.05 mm)的浓度为2%的琼脂糖平板(图 2)。

|
图 1 大菱鲆和斑马鱼胚胎显微注射玻璃针的比较 Figure 1 Comparison of turbot and zebrafish needles used in microinjection |

|
图 2 大菱鲆受精卵显微注射用凝胶凹槽板 Figure 2 The microinjection plate for turbot zygote |
将大菱鲆受精卵用13℃~14℃的海水进行漂洗,然后放入相同温度的无菌海水中培育约2 h,达到Ⅰ细胞期(雷霁霖等, 2003)开始进行显微注射,直至到Ⅳ细胞期为止。期间及时清除注射后的死卵。
1.2.2 显微注射取少量受精卵在解剖镜下观察,至大部分受精卵动物极隆起后,开始准备进行显微注射,注射时的室温为11℃~16℃。将发育正常的Ⅰ~Ⅳ细胞期的受精卵用拨卵针整齐排列在琼脂糖胶板的凹槽中,吸除掉大部分海水,使胚胎落到凹槽上。用拨卵针将受精卵轻轻压进凹槽里,旋转受精卵使动物极朝上。凹槽里的受精卵数量不宜过多,根据操作速度来定,避免受精卵长时间脱离海水并承受挤压导致破碎。
使用Eppendorf的微量上样针将smyd1 : gfp质粒装入注射针中,注射针安装到WPI公司的PV820显微注射仪上,注射针与凹槽平板呈45°;将100~300 pg的smyd1 : gfp质粒注入受精卵的动物极,为避免注射过程中细胞质逆流,设置显微注射仪的保持压为0.1~3 psi (Pounds per square inch),注射过的受精卵在凹槽内停留时间不宜超过4 min,以防受精卵破裂。及时将受精卵拨离凹槽,转移到无菌海水中。
1.2.3 受精卵的孵化转入smyd1 : gfp质粒的受精卵和未注射受精卵各1000粒,分别放入装有13℃~ 14℃的无菌海水的500 ml烧杯中进行培养,注射多余的受精卵放入另1个烧杯培养,烧杯进行水浴,温度为13℃。向无菌海水中加入亚甲基蓝溶液,每100 ml无菌海水中加入2 μl 10000×的1%亚甲基蓝溶液。每隔3~5 h换1次烧杯中加入亚甲基蓝溶液的无菌海水,并清除沉到杯底的死卵。在烧杯中培养约108 h后,将胚胎转移到体积为30~50 L的玻璃钢水槽中培养,水槽中海水体积为20~30 L,水温为13℃~14℃。
1.2.4 存活率每24 h统计注射胚胎和未注射胚胎存活率。计算公式:
| $ 存活率\left({{\rm{Survival}}\;{\rm{rate, SR, \% }}} \right) = \frac{{成活胚胎数}}{{总受精卵数}} \times 100\% $ |
从受精后60 h开始至胚胎出膜后24 h为止,取样观察。在Nikon荧光显微镜(Nikon Eclipse 80i)下,使用蓝色滤光片,观察GFP表达情况并拍摄记录。
1.2.6 胚胎DNA的提取胚胎发育到肌节期时(受精后约65 h)取样,每组取10尾,共3组;出膜24 h后,取3尾有GFP荧光的仔鱼,用95%乙醇固定。用海洋动物基因组DNA提取试剂盒(天根生化科技)提取基因组DNA。
1.2.7 PCR检测根据smyd1 : gfp质粒中GFP基因序列设计特异引物。上游引物为5'-TTAATTTTATTTGCACTACTGG-3';下游引物为5'-TTCTTTGGTTTGTCTCCC-3',预扩增片段为346 bp。反应体系:25 μl, 加1 μl DNA (~50 ng/μl)作为模板,3 μl 10× Buffer (MgCl2+),2 μl dNTPs,0.25 μl Taq DNA聚合酶(TaKaRa),引物各0.75 μl (10 μmol/L),18.25 μl ddH2O。反应程序:95℃预变性5 min;每个循环95℃ 30 s,60℃ 30 s,72℃ 30 s,共25个循环;72℃延伸10 min。浓度为1.5%的琼脂糖凝胶电泳,Gel-100凝胶成像系统(Bio-rad)检测。切胶后用凝胶回收试剂盒(康为世纪)回收,然后与pMD-18T载体(TaKaRa)连接,转化到Top 10感受态细胞,涂平板培养挑单克隆后,送睿博兴科生物技术公司测序,测序结果与smyd1 : gfp质粒序列用BioEdit Sequence Alignment Editor软件比对。
2 结果与分析 2.1 显微注射对胚胎存活率的影响本研究将smyd1 : gfp质粒显微注射到大菱鲆受精约2 h后的Ⅰ~Ⅳ细胞的受精卵里。共注射了2批,每批约1250粒。将大约2500粒显微注射的胚胎和1000粒未注射胚胎,分别放到13℃~14℃的无菌海水中孵化,每24 h统计胚胎存活率(图 3)。从图 3可以看出,随着胚胎的发育,有大量胚胎死亡,48 h时死亡率最高,只有19.0%左右的注射胚胎存活,之后存活率缓慢地下降。受精后120 h左右,大菱鲆孵化出膜,注射组的仔鱼存活率约为4.8%(约120尾)。而对照组的胚胎存活率随着发育的进行也呈现下降的趋势,鱼苗出膜时统计存活率为19.0%左右(约190尾)。

|
图 3 大菱鲆胚胎和初孵仔鱼的存活曲线 Figure 3 Survival of turbot embryos and larvae |
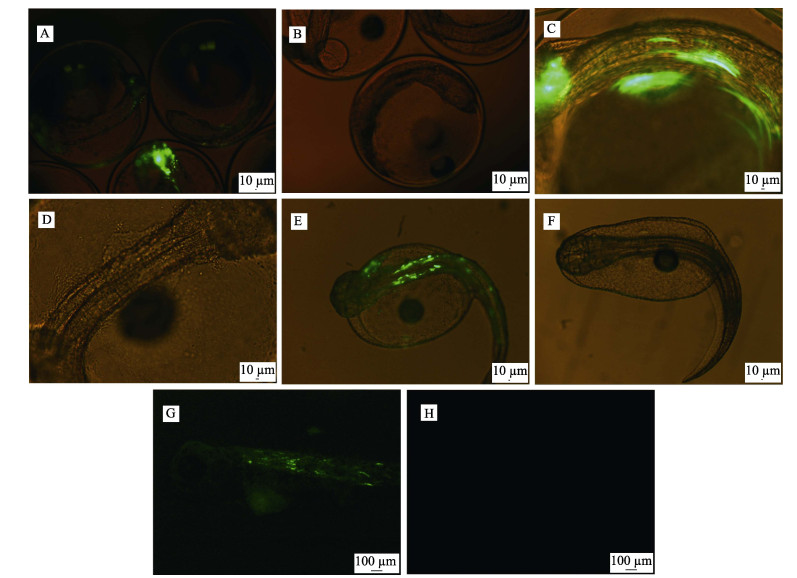
受精后约60 h,在荧光显微镜下观察到GFP在大菱鲆胚胎中开始表达(图 4A),随着发育的进行,表达量逐渐升高(图 4E、图 4G)。由于体色变深的原因,出膜后24 h观察表达量有所减弱(图 4G)。GFP的表达呈现出嵌合性,并且只在胚胎的肌肉组织中表达。观察初孵仔鱼时发现,大约56%(28/50)的仔鱼在骨骼肌中可观察到GFP荧光信号(图 4),表明GFP基因已经在仔鱼肌肉中表达,从而说明大菱鲆受精卵的显微注射技术已经成功建立。
|
图 4 外源基因GFP在大菱鲆转基因胚胎肌肉中的表达 Figure 4 The transient expression of GFP in the muscle of turbot transgenic embryo A~B:受精后61 h的胚胎;C~D:A~B胚胎的放大照片;E~F:初孵仔鱼;G~H:出膜后24 h的仔鱼;A,C,E:蓝色滤光片和白光下注射GFP的胚胎和仔鱼;B,D,F:蓝色滤光片和白光下未注射GFP的胚胎及仔鱼;G:蓝色滤光片下注射GFP的仔鱼;H:蓝色滤光片下未注射GFP的仔鱼 A~B: 61 h post-fertilization embryos; C~D: Larger magnification of A and B; E~F: Newly hatched fry; G~H: 24h post-hatching fry; A, C, E: Embryos and fries injected with GFP in blue filter and white-light; B, D, F: Embryos and fries uninjected with GFP in blue filter and white-light; G: Fry injected with GFP in blue filter; H: Fry uninjected with GFP in blue filter |
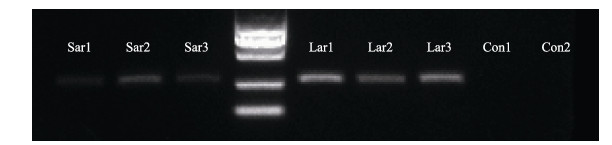
分别提取胚胎和仔鱼的基因组DNA,进行PCR扩增。凝胶成像结果显示,注射GFP质粒的实验组都有约340 bp的PCR特异片段,而对照组没有相关片段(图 5)。由于10粒胚胎中存在没有表达GFP的胚胎,并且胚胎比仔鱼的细胞量少,所含的GFP量少,所以PCR扩增后,凝胶成像结果中胚胎的PCR条带比仔鱼的弱(图 5)。PCR扩增产物单克隆测序结果显示,PCR扩增片段确为注射质粒中的GFP片段(图 6)。
|
图 5 大菱鲆胚胎和仔鱼基因组DNA PCR产物检测 Figure 5 Electrophoresis of PCR of turbot embryo and larva genome Sar:实验组肌节期的胚胎;Lar:实验组出膜后24 h的仔鱼;Con1:对照组肌节期的胚胎;Con2:对照组出膜后24 h的仔鱼;DL2000 Marker:2 kb分子量标准 Sar: Somite stage embryos of experimental group; Lar: 24 h post-hatching fries of experimental group; Con1: Somite stage embryos of control group; Con2: 24 h post-hatching fries of control group; DL2000 Marker: 2 kb DNA marker |

|
图 6 GFP片段序列比对 Figure 6 Sequence alignment of GFP fragment |
有关大菱鲆显微注射技术的研究迄今为止尚未见报道。尽管斑马鱼(Danio rerio)、青鳉(Oryzias latipes)及一些淡水鲤科鱼类的受精卵显微注射技术已建立并效果良好(Hwang et al, 2013; Ansai et al, 2014; Li et al, 2013),并且部分海水鱼类也建立了显微注射技术(刘洋等, 2004; Kato et al, 2007; Otani et al, 2008; Yoji et al, 2011)。对于海水鲆鲽鱼类来说,受精卵显微注射难度更大。这是因为海水鲆鲽鱼除了具有海水鱼受精卵共有的特点之外,还具有(1)卵膜很硬,很难将外源基因DNA、mRNA或蛋白质显微注射到受精卵的动物极;(2)仔鱼具有变态的特点,在变态前后仔鱼死亡率较高,通常需要有数千尾以上的仔鱼才能培育长大,即使采用受精卵显微注射技术获得数百个显微注射的胚胎,也很难培育长大为成鱼。因此,有关海水鲆鲽类显微注射技术研究迄今国内外仅见半滑舌鳎(Cui et al, 2017),这也成为限制基因组编辑技术在海水鲆鲽鱼类基因功能分析和基因定点突变育种中成功应用的瓶颈因子。因此,要想建立大菱鲆基因组编辑技术,首先要突破大菱鲆受精卵显微注射技术。
约4.8%的大菱鲆注射胚胎最终孵化出膜,其比例低于未注射胚胎。可能的原因包括注射时,细胞受到机械损伤、外源DNA对胚胎的毒性和注射剂量等。合适的显微注射针不仅能够将对胚胎的机械损伤降到最低,而且还能够提高操作效率。本研究中,根据海水鲆鲽类受精卵的特点,利用Sutter公司的水平拉针仪制备玻璃微量注射针,其与注射半滑舌鳎(Cui et al, 2017)的相似。注射方式和注射剂量的多少直接影响到胚胎存活率和转基因的成功率(李智等, 1998)。王亚丽等(2017)分析了转基因显微注射的注射剂量对鸡(Gallus gallus domesticus)胚胎孵化和转基因效率的影响,研究表明,影响胚胎发育的主要因素是注射剂量的大小。沈延等(2013)对TALEN技术的研究表明,mRNA的注射量越大,TALEN的作用效率就越高,但斑马鱼胚胎的畸形率也随之上升,而存活率就会下降。本研究根据半滑舌鳎、花鲈、斑马鱼的注射浓度及注射量(Cui et al, 2017; 刘洋等, 2004; Du et al, 2006)设定大菱鲆显微注射浓度为50 ng/μl、注射量为100~300 pg。
外源DNA在被注射胚胎的发育过程中以多种形式存在,朱作言等(1989)和刘洋等(2004)研究发现,外源DNA与受体基因组从囊胚期开始整合,而且能够瞬时表达。本研究注射质粒的启动子为肌肉特异启动子smyd1,其在肌肉中特异表达质粒(Du et al, 2006),因此,在肌节期开始检测荧光表达情况。随着发育的进行,鱼苗体内的核酸酶能够降解游离的外源DNA。因此,出膜后的仔鱼中,游离的外源DNA存在的可能性很小,以此为模板,PCR扩增仍能得到特异性的片段,再者胚胎中的GFP表达量随着发育的进行越来越多,到仔鱼时,肌肉组织中荧光亮度远大于胚胎,从而说明外源基因整合到了大菱鲆基因组中。
将外源基因、蛋白质、mRNA或细胞导入到受体中的方法主要包括显微注射、电脉冲、精子携带、脂质体融合、逆转录病毒转染和激光介导等(朱作言, 1999)。电脉冲转导的方法是直接将受精卵浸泡在溶液中,通过适合强度电脉冲处理将外源DNA、RNA或蛋白转到受精卵动物极中。这个方法操作简单,可同时处理大量的受精卵,但是效率很低(朱作言等, 1999; Heather et al, 2003)。精子携带方法对受精卵不会产生机械损伤,但需要电脉冲处理雄鱼,对雄鱼造成损伤。并在处理后,精子的受精能力会减弱,转移效率也很低(朱作言等, 1999)。显微注射技术可直接在分子和细胞水平上改变研究对象的特征。虽然,对实验操作者的技术水平和熟练程度有一定的要求,但该技术目前广泛应用于生命科学各个研究领域。
本研究在海水养殖鱼大菱鲆上建立了显微注射技术,成功使smyd1 : gfp质粒在大菱鲆鱼苗肌肉组织中表达,为海水鱼类基因组编辑技术的研究奠定基础,对大菱鲆基因功能和遗传育种等方面的研究具有重大意义和应用价值。
Ansai S, Kinoshita M. Targeted mutagenesis using CRISPR/Cas system in medaka. Biology Open, 2014, 3(5): 362-371 DOI:10.1242/bio.20148177 |
Chen SL, Zhang G, Shao CW, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle. Nature Genetics, 2014, 46(3): 253-260 DOI:10.1038/ng.2890 |
Cui ZK, Liu Y, Wang WW, et al. Genome editing reveals dmrt1 as an essential male sex-determining gene in Chinese tongue sole (Cynoglossus semilaevis). Scientific Reports, 2017, 7: 42213 DOI:10.1038/srep42213 |
Du SJ, Rotllant J, Tan XG. Muscle-specific expression of the smyd1 gene is controlled by its 5.3-kb promoter and 5'-flanking sequence in zebrafish embryos. Developmental Dynamics, 2006, 235(12): 3306-3315 DOI:10.1002/dvdy.v235:12 |
Dunham RA. Transgenic fish resistant to infectious diseases, their risk and prevention of escape into the environment and future candidate genes for disease transgene manipulation. Comparative Immunology Microbiology and Infectious Disease, 2009, 32(2): 139-161 DOI:10.1016/j.cimid.2007.11.006 |
Grabher C, Wittbrodt J. Recent advances in meganuclease- and transposon-mediated transgenesis of medaka and zebrafish. Methods Molecular Biology, 2008, 461: 521-539 DOI:10.1007/978-1-60327-483-8 |
Heather AH, Stephanie LP, William MM. High efficiency production of germ-line transgenic Japanese medaka (Oryzias latipes) by electroporation with direct current-shifted radio frequency pulses. Transgenic Research, 2003, 12: 413-424 DOI:10.1023/A:1024248300592 |
Hwang WY, Fu Y, Reyon D, et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature Biotechnology, 2013, 31(3): 227-229 DOI:10.1038/nbt.2501 |
Kato K, Takagi M, Tamaru Y, et al. Construction of an expression vector containing a β-actin promoter region for gene transfer by microinjection in red sea bream Pagrus major. Fisherues Science, 2007, 73(2): 440-445 DOI:10.1111/fis.2007.73.issue-2 |
Lei JL, Ma AJ, Liu XF, et al. Study on the development of embryo, larval and juvenile of turbot Scophthalmus maximus L. Oceanologia et Limnologia Sinica, 2003, 34(1): 9-18 [ 雷霁霖, 马爱军, 刘新富, 等. 大菱鲆胚胎及仔稚幼鱼发育研究. 海洋与湖沼, 2003, 34(1): 9-18 DOI:10.11693/hyhz200301002002] |
Li MH, Yang HH, Li MR, et al. Antagonistic roles of Dmrt1 and Foxl2 in sex differentiation via estrogen production in tilapia as demonstrated by TALENs. Endocrinology, 2013, 154(12): 4814-4825 DOI:10.1210/en.2013-1451 |
Liu Y, Sha ZX, Chen SL, et al. Expression of green fluorescent protein gene transferred into newly fertilized sea perch (Lateolabrax japonicus) embryos by microinjection. Journal of Fishery Sciences of China, 2004, 11(5): 385-390 [ 刘洋, 沙珍霞, 陈松林, 等. 绿色荧光蛋白基因向花鲈胚胎的转移及其表达. 中国水产科学, 2004, 11(5): 385-390] |
Li Z, Yu S, Du TG, et al. Effect analysis of transgenic microinjection dose. Chinese Journal of Laboratory Animal Science, 1998, 8(2): 65-69 [ 李智, 俞生, 都同功, 等. 转基因显微注射的剂量控制与效果分析. 中国实验动物学杂志, 1998, 8(2): 65-69] |
Otani S, Ohara M, Miyashita S, et al. A method for the microinjection into naturally spawned eggs of marine fish, especially cultured Pacific bluefin tuna Thunnus orientalis. Fisheries Science, 2008, 74(1): 208-210 DOI:10.1111/fis.2008.74.issue-1 |
Qin ZK, Li Y, Su BF, et al. Editing of the luteinizing hormone gene to sterilize channel catfish, Ictalurus punctatus, using a modified zinc finger nuclease technology with electroporation. Marine Biotechnology (NY), 2016, 18(2): 255-263 DOI:10.1007/s10126-016-9687-7 |
Rembold M, Lahiri K, Foulkes NS, et al. Transgenesis in fish:Efficient selection of transgenic fish by co-injection with a fluorescent reporter construct. Nature Protocols, 2006, 1(3): 1133-1139 DOI:10.1038/nprot.2006.165 |
Sha ZX, Chen SL, Liu Y, et al. Progress on the application of microinjection technique in fish cell transplantation and in transgenic marine fish. Marine Fisheries Research, 2005, 26(3): 86-90 [ 沙珍霞, 陈松林, 刘洋, 等. 显微注射技术在制备鱼类嵌合体和转基因海水鱼上的应用. 海洋水产研究, 2005, 26(3): 86-90] |
Shao CW, Bao BL, Xie ZY, et al. The genome and transcriptome of Japanese flounder provide insights into flatfish asymmetry. Nature Genetics, 2016, 49(1): 119-124 |
Shen Y, Huang P, Zhang B. A protocol for TALEN contruction and gene targeting in zebrafish. Hereditas(Beijing), 2013, 35(4): 533-544 [ 沈延, 黄鹏, 张博. TALEN构建与斑马鱼基因组定点突变的实验方法与流程. 遗传(北京), 2013, 35(4): 533-544] |
Tong DZ, Wu SQ, Ye YF, et al. Migration of fish nuclei. Chinese Science Bulletin, 1963, 13(7): 60-61 [ 童第周, 吴尚懃, 叶毓芬, 等. 鱼类细胞核的移植. 科学通报, 1963, 13(7): 60-61] |
Wang YL, Wang SS, Zhang L, et al. Effect of microinjection dose of transgene on transgenic efficiency and embryo development of chicken. China Poultry, 2017, 39(4): 4-7 [ 王亚丽, 王赛赛, 张丽, 等. 转基因显微注射剂量对鸡胚转基因效率和胚胎发育的影响. 中国家禽, 2017, 39(4): 4-7] |
Yoji Y, Naoki K, Yutaka T, et al. Establishment of a stable transgenic strain in a pelagic egg spawning marine teleost, Nibe croaker Nibea mitsukurii. Aquaculture, 2011, 313(1-4): 42-49 DOI:10.1016/j.aquaculture.2011.01.042 |
Zhu Z, Li G, He L, et al. Novel gene transfer into the fertilized eggs of goldfish (Carassius auratus L. 1758). Journal of Applied Ichthyology, 1985, 1(1): 31-34 DOI:10.1111/jai.1985.1.issue-1 |
Zhu ZY, Wang YP. Transgenic fish. Bulletin of Biology, 1999, 34(5): 1-3 [ 朱作言, 汪亚平. 转基因鱼. 生物学通报, 1999, 34(5): 1-3] |
Zhu ZY, Xu KS, Xie YF, et al. A model of transgnic fish. Scientia Sinica (Ser B), 1989, 19(2): 147-155 [ 朱作言, 许克圣, 谢岳峰, 等. 转基因模型鱼的建立. 中国科学B辑, 1989, 19(2): 147-155] |



