2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071
近海有着渔业生物的重要栖息地和渔场,支撑着渔业种群的补充和繁衍,但近海又是受人类活动和环境变化压力最为明显的区域,生态系统演变和生物资源的可持续产出严重受损(金显仕等, 2015)。渤海属于北温带半封闭内海,包括辽东湾、渤海湾、莱州湾、黄河口、渤海中部和渤海海峡,黄河、海河和辽河等主要入海河流为近岸输入了大量的泥沙和营养盐,影响到其初级生产和食物网过程。渤海是多种经济渔业生物的产卵场、索饵场和育幼场(万瑞景等, 1998),而围填海、陆源污染物排放、海水养殖等过程的加剧,导致浮游植物赤潮频发、物种多样性降低、饵料基础及其结构失衡,对渔业种群的早期补充过程构成威胁。
浮游植物作为海洋生态系统的初级生产者,是浮游动物和早期渔业生物的重要饵料基础。渤海浮游植物的生态研究始于21世纪30年代,早期的研究以物种分类及其生态习性为主(朱树屏等, 1957; 金德祥等, 1965),阶段性渤海综合调查开展以后,关注点也逐渐转向浮游植物与水体富营养化、近海环境变化以及渔业生物之间的关系研究(康元德, 1991; 俞建銮等, 1993; 王俊等, 1998; 孙军等, 2002; 孙雪梅等, 2016)。近年来,渤海产卵场、索饵场和育幼场的自然生境不断退化,洄游通道破坏严重,本研究从浮游植物基础饵料的角度出发,通过分析群落结构及其多样性水平的长期变化趋势,探讨浮游植物群落对渤海环境变化的年代际响应特征及其产生的深层原因,旨在为阐明渤海主要渔业种群对环境变化的适应性响应机制提供基础资料和参考依据。
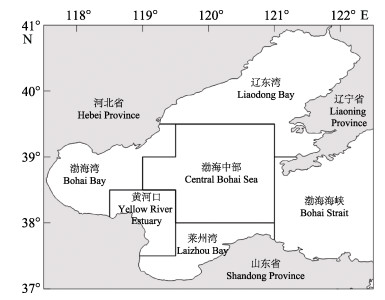
1 材料与方法 1.1 样品采集本研究浮游植物网采样品来源于中国水产科学研究院黄海水产研究所自1959年以来开展的渤海年代际大面综合调查(图 1)。在辽东湾、渤海湾、莱州湾、黄河口以及渤海中部海域,20个航次的季节性调查共计采集了1181网浮游植物样品(表 1)。于各采样点使用浅水3型浮游生物网(网口面积0.1 m2,筛孔77 μm)自底至表进行垂直拖网,样品随后转移至1 L的塑料广口瓶中,加入甲醛水溶液至样品终浓度为5%,常温避光保存。
|
图 1 渤海浮游植物拖网采集区域 Figure 1 Sampling regions of phytoplankton net-tows in the Bohai Sea |
|
|
表 1 渤海浮游植物网采样品基本信息 Table 1 Baseline information on net-tow samplings of phytoplankton in the Bohai Sea |
浮游植物群落分析于实验室内进行,网采样品根据浮游植物的多少进行稀释或浓缩,取0.5 ml的亚样品置于朱树屏计数框(类似于Sedgwick-Rafter),然后在光学显微镜(Leica Biomed)下进行物种鉴定与丰度统计,物种分类主要依据形态学差异,并参考已有分类标准(朱树屏等, 1957; 金德祥等, 1965; Tomas, 1997)。
1.3 数据处理浮游植物群落的物种丰富度、多样性、均匀度和优势度,分别采用Margalef指数、Shannon-Weaver指数、Pielou指数和Dufrene-Legendre指数进行计算,具体公式参考文献(栾青杉等, 2017)。浮游植物对环境变化的年代际响应特征采用SIMPER分析进行,利用PAST软件(3.18版)实现。
2 结果 2.1 物种组成及其年代际转换本研究共记录渤海网采浮游植物77属170种,其中硅藻61属133种,甲藻15属36种,硅鞭藻1种,硅藻占到了物种数的78.2%,是渤海浮游植物的主要类群,物种的生态类型主要为温带近岸性本地种。角毛藻属(Chaetoceros)和圆筛藻属(Coscinodiscus)出现了37种和12种,分别占到总物种数的21.8%和7.1%,是硅藻的主要属种,此外海链藻属(Thalassiosira)和根管藻属(Rhizosolenia)亦分别出现了8种和5种。甲藻中的原多甲藻属(Protoperidinium)和角藻属(Tripos:Ceratium和Neoceratium的同属异名)各出现了11种和7种,是渤海常见的甲藻属种。
近50多年来,能够在渤海浮游植物群落中形成优势的物种有49种,其中又以硅藻居多,达到45种(表 2)。从年代际变化来看,能够在各个时期形成优势的物种有6种,分别为硅藻类群的星脐圆筛藻(Coscinodiscus asteromphalus)、布氏双尾藻(Ditylum brightwellii)、具槽帕拉藻(Paralia sulcata)、尖刺拟菱形藻(Pseudo-nitzschia pungens)和伏氏海线藻(Thalassionema frauenfeldii)以及甲藻类群的牟氏角藻(Tripos muelleri)。
|
|
表 2 渤海浮游植物优势种组成的年代际变化 Table 2 Interdecadal changes on dominant phytoplankton composition in the Bohai Sea |
从优势种年代际演替来看,浮游植物从在20世纪形成绝对优势的柔弱角毛藻(C. debilis)、拟垂缘角毛藻(C. pseudocrinitus)、琼氏圆拱形藻(Coscinodiscopsis jonesiana)、辐射圆筛藻(C. radiatus)、萎软几内亚藻(Guinardia flaccida)、中国半管藻(Hemiaulus chinensis)和中肋骨条藻(Skeletonema costatum),转换到在21世纪形成绝对优势的窄隙角毛藻(C. affinis)、旋链角毛藻(C. curvisetus)、威氏圆筛藻(C. wailesii)、舟形藻(Navicula)、具槽帕拉藻、伏氏海线藻、夜光藻(Noctiluca scintillans)和梭形角藻(T. fusus)。总体来看,渤海浮游植物群落在20世纪以角毛藻和圆筛藻等较大的中心目硅藻为主,进入21世纪后,海线藻(Thalassionema)和舟形藻等羽纹目硅藻逐渐形成优势,底栖性的具槽帕拉藻在2010年季节调查中优势度之和高达0.54,此外甲藻在21世纪亦开始形成优势,比如夜光藻和角藻。
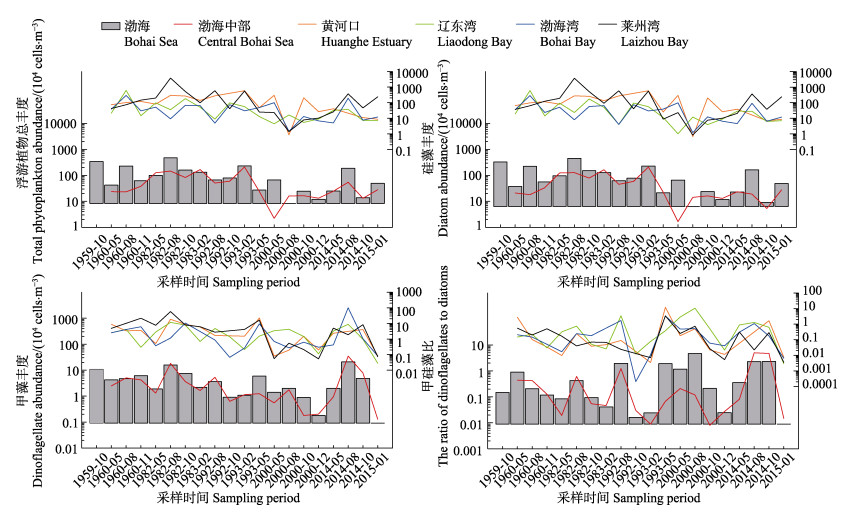
2.2 细胞丰度的年代际变化近50多年来,渤海浮游植物总丰度变化在(8.33~ 472)×104 cells/m3之间,平均为116×104 cells/m3,最高值和最低值分别出现在1982年夏季和2000年夏季(图 2)。年代际均值在1960s、1980s、1990s、2000s和2010s分别为(168、216、101、28.0和68.7)× 104 cells/m3,总丰度在20世纪末降低到最低值,较1980s最大降幅87.0%,进入21世纪后逐步回升,有1.5倍增加。从类群结构来看,硅藻50多年平均丰度为111×104 cells/m3,平均占到了浮游植物总丰度的92.5% (65.3%~99.8%),冬季硅藻所占丰度比例最高,达到平均99.0%的水平,2014年秋季占比最低。甲藻50多年来平均丰度只有4.84×104 cells/m3,其在渤海的地位明显不如硅藻,甲藻的丰度高值主要出现在夏、秋季,比如在2014年夏季、1982年夏季和1959年秋季分别达到了(20.7、15.8和10.7)×104 cells/m3的丰度水平。
|
图 2 渤海浮游植物丰度的长期变化 Figure 2 Long-term changes on phytoplankton abundances in the Bohai Sea |
从渤海浮游植物甲硅藻比来看,在1960s、1980s、1990s、2000s和2010s的年代际平均水平分别为0.34、0.16、0.97、1.52和1.24,21世纪甲硅藻比的平均水平较20世纪有了2.82倍的提升。按季节来看,渤海甲硅藻比在春、夏、秋、冬季分别为0.88、1.90、0.48和0.02,可见夏季是渤海甲藻旺发的主要时段,比如2000年夏季甲硅藻比为4.65(辽东湾高达10.6),夜光藻丰度平均为1.67×104 cells/m3(辽东湾高达3.93× 104 cells/m3);2014年夏季为2.27(渤海中部高达4.98),牟氏角藻、叉状角藻[(Tripos furca (Ehrenberg) F.Gómez)]和梭形角藻的丰度分别达到了(13.3、3.14和2.40)× 104 cells/m3的平均水平。
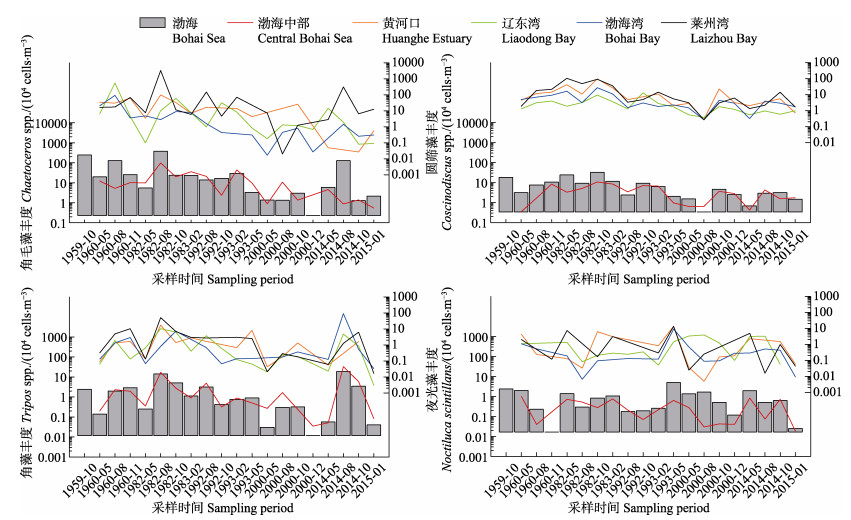
从渤海浮游植物优势种的年代际变动来看(图 3),角毛藻丰度50多年来平均为53.0×104 cells/m3,最高值为1982年夏季的381×104 cells/m3,且主要为莱州湾高丰度(3301×104 cells/m3)所贡献。角毛藻在1960s、1980s、1990s、2000s和2010s各年代际平均分别为(105、108、15.7、1.48和34.3)×104 cells/m3,其丰度于20世纪持续降低,进入21世纪有所回升,但较1980s仍有68.2%的下降。圆筛藻各年代际平均7.75×104 cells/m3,最高值32.9×104 cells/m3出现在1982年秋季,且为黄河口的丰度高值(96.7×104 cells/m3)所控制。渤海圆筛藻丰度的高值主要出现在秋季,平均高达13.1×104 cells/m3,其他三季平均5.44×104 cells/m3。
|
图 3 渤海浮游植物优势种丰度的长期变化 Figure 3 Long-term changes on abundances of dominant phytoplankton in the Bohai Sea |
角藻是渤海重要的甲藻类群,50多年来平均丰度为2.84×104 cells/m3,高值出现在2014年夏季和1982年夏季,平均达到18.9×104 cells/m3和14.4× 104 cells/m3,分别为渤海湾(92.5×104 cells/m3)和莱州湾(51.8×104 cells/m3)的丰度高值所控制。渤海夜光藻长期平均丰度为1.02×104 cells/m3,最大值为4.94× 104 cells/m3出现在1993年春季,且主要为莱州湾的高值(平均13.7×104 cells/m3)贡献。从季节来看,春季渤海夜光藻平均高达2.32×104 cells/m3,其余三季平均仅为0.57×104 cells/m3。
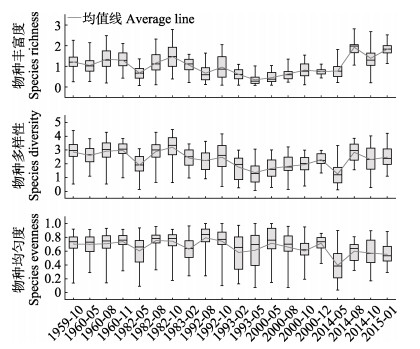
2.3 多样性的长期变化50多年来,渤海浮游植物的物种丰富度Margalef指数变动在0.35~1.92之间,平均为1.02,其在1960s、1980s、1990s、2000s和2010s各年代际平均分别为1.22、1.09、0.65、0.66和1.48,长期变化趋势为:由20世纪60年代到21世纪末逐渐降低,最大降幅为46.7%,进入21世纪后开始逐渐回升,较1990s有1.28倍的升高(图 4)。物种多样性Shannon-Weaver指数在各年代际变化在1.26~3.20之间,平均为2.31,其在1960s、1980s、1990s、2000s和2010s各年代际平均分别为2.84、2.60、1.96、1.93和2.22,长期变化趋势与物种丰富度相一致,20世纪下降幅度为32.0%,21世纪以来有15.0%的回升。物种均匀度Pielou指数50多年来变化在0.39~0.79之间,平均为0.66,自1960s~2000s,物种均匀度一直保持在0.69±0.06的稳定水平,但是进入2010s (平均0.53±0.09)出现了23.0%的下降。
|
图 4 渤海浮游植物多样性长期变化的Box-Whisker Figure 4 Box-Whisker plots on long-term changes of phytoplankton diversity in the Bohai Sea |
为了能更好地认识50多年来在渤海环境变化和区域气候变化的共同影响下,渤海浮游植物各属种出现了哪些变化,以及在渤海各地理区域的响应程度如何,对21世纪和20世纪的浮游植物群落结构进行了SIMPER差异性分析(表 3)。研究发现,在所有77属170种中,仅18属种的差异贡献率就已经达到了90%。角毛藻对群落结构差异的贡献最大,达到了21.9%,以莱州湾的变化最为明显(高达26.9%)。圆筛藻对群落结构的差异贡献率达到了14.5%,以渤海湾-黄河口-莱州湾一线的变化最为显著,平均差异贡献率18.5%。渤海甲藻中主要是角藻和夜光藻对群落差异的贡献较大,特别是在渤海中部和辽东湾海域,差异贡献率分别高达11.7%和9.6%。
|
|
表 3 渤海浮游植物在2000s-2015与1959-1990s群落结构组成的差异贡献率 Table 3 Percent contribution to dissimilarity in phytoplankton community structure between 2000s~2015 and 1959~1990s in the Bohai Sea |
渤海浮游植物已记录了400余种,其中绝大多数为硅藻物种,生态类型主要为温带近岸性(孙军等, 2002)。细胞丰度的季节变化具有典型的温带海区双峰型特征,在上下半年各出现1次丰度高值(康元德, 1991; 俞建銮等, 1993)。郭术津等(2014)研究表明,近年来渤海浮游植物群落出现明显的物种演替现象,角毛藻在群落中的优势地位下降,具槽帕拉藻、角藻逐渐兴盛,群落结构逐渐由硅藻单一控制转向硅、甲藻共同控制。本研究结果也进一步证实了渤海浮游植物的这些新现象,比如在2010s的季节调查中,具槽帕拉藻优势度之和最高,且在全年都形成优势;角藻中仅梭形角藻一种优势度各季之和就已高达0.20。
莱州湾海域栖息地多样、食物饵料资源丰富,是渤海最重要的渔业生物产卵场和索饵场(吴强等, 2016)。通过本研究浮游植物各属种对群落结构年代际差异贡献率大小的探讨后发现,角毛藻在莱州湾的丰度平均水平21世纪较20世纪下降程度高达87.2%,在渤海的平均丰度下降了76.6%,已有资料也表明浮游植物丰度在莱州湾呈逐年下降的趋势(王俊, 2000)。渤海湾海域浮游植物群落结构的年代际变化主要由圆筛藻丰度的下降所主导,其对群落结构的差异贡献高达19.8%,尽管渤海圆筛藻平均丰度在21世纪降低了81.2%,其在浮游植物群落中还是能形成一定的优势,比如星脐圆筛藻的优势度在21世纪有了1.48倍的增加,这与渤海湾浮游植物研究结果一致(张秋丰等, 2007),并且星脐圆筛藻在渤海全年都能作为优势种出现(杨阳等, 2016)。辽东湾海域甲藻的年代际变化明显,夜光藻丰度平均水平在21世纪有了3.04倍的增加,这一点也印证了辽东湾是渤海夜光藻赤潮的高发海域(周遵春等, 2002)。渤海中部海域具槽帕拉藻的变化最为明显,对群落结构的差异贡献高达17.0%,其渤海年代际平均丰度在2000s降至最低,进入2010s后升至5.13×104 cells/m3,此外在渤海中部甲藻中角藻的年代际变化亦较为显著,其丰度在21世纪出现了75.0%的增加。黄河口海域的浮游植物长期变动主要集中在角毛藻和圆筛藻2个硅藻属种上,其平均丰度在21世纪分别下降了78.1%和76.2%,而且已有黄河口海域研究也同样表明角毛藻和圆筛藻在浮游植物群落中的优势地位呈现下降的趋势(栾青杉等, 2017)。
3.2 渤海浮游植物长期变化的原因分析通常来说影响海洋浮游植物分布的因素主要以海水温盐、光照、营养盐等上行控制因素为主,从渤海来看,莱州湾的黄河、渤海湾的海河以及辽东湾的辽河等近岸入海河流,为渤海输入了大量的泥沙和淡水,使得渤海近岸水体光照、盐度、营养盐等理化要素发生改变,进而直接影响到浮游植物的初级生产过程。因此,渤海众多入海河流的陆源排放给浮游植物变动带来的影响是首位的,其次才是渤海热盐环流、层化、混合等过程的影响。当然,人类活动过程,比如大规模的围填海、湿地破坏减少、近岸水产养殖等,也是通过高强度地改变邻近海域的水动力条件等物理过程,对浮游植物变动产生影响。
已有的渤海长期研究表明(Ning et al, 2010),自20世纪60年代至20世纪末,渤海水温有一定程度的增加,盐度呈现大幅上升的趋势,这与人类活动和气候变化导致的黄河在1972~1999年间的长期断流不无关系。温盐的升高有利于适温、盐较高的浮游植物类群在群落中形成优势,比如角藻、圆筛藻等(俞建銮等, 1993),而这也进一步解释了本研究角藻在渤海增加的原因。20世纪黄河断流引起的陆源营养盐输入的减少,是造成20世纪渤海浮游植物丰度和多样性持续降低的主要原因,但是进入21世纪后开展的黄河调水调沙等活动,则显著改善了渤海的浮游植物格局,丰度和物种多样性水平逐步恢复,底栖性的物种如具槽帕拉藻开始形成绝对的优势。
渤海无机氮的上升和磷酸盐的下降直接导致海水N/P比在20世纪的长期上升趋势,特别是在渤海南部海域,N/P比已经远高于浮游植物元素吸收的Redfield比值(~16),并导致渤海浮游植物由N限制逐渐向P限制转变(Ning et al, 2010; 魏皓等, 2003)。进入21世纪,渤海的N/P比水平仍在持续升高,比如莱州湾海域在2009年的N/P比高达199(张锦峰等, 2015)。研究表明N/P比的升高会引起浮游植物演替转向甲藻或者非硅藻主导的群落结构,硅藻在高N/P比的环境条件中不占优势(Egge, 1998; 郭术津等, 2014)。渤海营养盐结构改变的直接后果,就是引起了浮游植物群落结构的变化,这一点从本研究渤海甲硅藻比的长期变化趋势得到验证,自20世纪90年代以来,渤海的甲硅藻比升高了3.97倍。
3.3 渤海浮游植物变动对渔业生物饵料基础的影响浮游植物的年代际变动决定了渤海初级生产过程和渔业生物饵料基础的格局转换,但是这种丰度和结构的改变给渤海主要渔业种群的补充带来何种影响尚无定论。研究表明,在渤海,毛虾的主要饵料为圆筛藻和具槽帕拉藻,合计占到食物组成的约80%;对虾幼体主要以原多甲藻为食,仔虾则主要摄食舟形藻、斜纹藻(Pleurosigma)和圆筛藻(康元德, 1991)。渤海鮻和斑鰶幼鱼的食物组成以海链藻、圆筛藻、裸甲藻(Gymnodinium)和原甲藻(Prorocentrum)等饵料为主(吕末晓, 2016)。本研究结果发现,角毛藻在渤海浮游植物群落的长期变化中已不占优势,而圆筛藻物种却能够继续保持其优势地位;特别是近10年来,具槽帕拉藻形成了绝对优势,这表明尽管渤海浮游植物丰度存在年代际的波动,但是主要饵料种的优势能够保持且有一定程度的提升。
从群落结构变动来看,不论是本研究还是已有研究(郭术津等, 2014),渤海甲硅藻比的持续升高已经成为事实,渤海的浮游植物群落也正在由硅藻控制转向硅、甲藻共同控制,但是甲藻丰度的增加对海洋生态系统的影响并不一定是消极的,除局地的有害藻华和赤潮以外(周遵春等, 2002),部分甲藻物种优势度的提升或许能够对渔业生物的早期补充产生积极的影响。比如,已有研究表明,自然海域斑块分布的甲藻为鳀仔鱼的开口摄食及其早期生活史阶段提供重要的营养支撑(Lasker, 1975),实验室研究也显示血红阿卡藻(Akashiwo sanguinea (K.Hirasaka) G.Hansen & Moestrup)一旦被仔鳀发现就会引起它们的停留摄食(Hunter, 1977)。多种浮游植物投喂仔鳀的实验证据显示(Scura et al, 1977),绝对大多的仔鳀仅开口摄食甲藻,而不摄食硅藻和小的鞭毛藻;血红阿卡藻是鳀仔鱼孵化后10 d内的重要的营养来源,投喂血红阿卡藻和微型浮游动物的鳀仔鱼,比仅投喂微型浮游动物的个体生长快;而投喂多边舌甲藻[(Lingulodinium polyedra (F.Stein) J.D.Dodge)]之后,比起仅投喂微型浮游动物,鳀仔鱼的存活率显著提高。
总之,浮游植物饵料基础的变动与渤海渔业生物的早期摄食、存活和补充之间有着复杂的过程和机制。尽管近年来渤海硅藻饵料种的优势地位能够保持,甲藻的丰度水平有所提升,但是,要搞清关键资源种群补充的动力学及其对近海环境变化的适应性响应,还需要更多的学科交叉研究和基础调查工作来补充和完善。
致谢: 感谢天津渤海水产研究所张雪在2014年春秋季渤海样品分析中的帮助。
Egge JK. Are diatoms poor competitors at low phosphate concentrations?. Journal of Marine Systems, 1998, 16(3-4): 191-198 DOI:10.1016/S0924-7963(97)00113-9 |
Guo SJ, Li YQ, Zhang CX, et al. Phytoplankton community in the Bohai Sea and its relationship with environmental factor. Marine Science Bulletin, 2014, 33(1): 95-105 [ 郭术津, 李彦翘, 张翠霞, 等. 渤海浮游植物群落结构及与环境因子的相关性分析. 海洋通报, 2014, 33(1): 95-105 DOI:10.11840/j.issn.1001-6392.2014.01.013] |
Hunter JR. Behavior and survival of northern anchovy Engraulis mordax larvae. California Cooperative Oceanic Fisheries Investigations Reports, 1977, 19: 138-146 |
Jin DX, Chen JH, Huang KG. Planktonic diatoms in China Seas. Shanghai: Shanghai Scientific & Technical Publishers, 1965: 1-230 [ 金德祥, 陈金环, 黄凯歌. 中国海洋浮游硅藻类. 上海: 上海科学技术出版社, 1965: 1-230]
|
Jin XS, Dou SZ, Shan XJ, et al. Hot spots of frontiers in the research of sustainable yield of Chinese inshore fishery. Progress in Fishery Sciences, 2015, 36(1): 124-131 [ 金显仕, 窦硕增, 单秀娟, 等. 我国近海渔业资源可持续产出基础研究的热点问题. 渔业科学进展, 2015, 36(1): 124-131 DOI:10.11758/yykxjz.20150119] |
Kang YD. Distribution and seasonal variations of phytoplankton in the Bohai Sea. Marine Fisheries Research, 1991, 11061106(12): 31-54 [ 康元德. 渤海浮游植物的数量分布和季节变化. 海洋水产研究, 1991, 11061106(12): 31-54] |
Lasker R. Field criteria for survival of anchovy larvae:the relationship between inshore chlorophyll maximum layers and successful first feeding. Fishery Bulletin, 1975, 73(3): 453-462 |
Lü MX. Study on the diet composition of juvenile of Liza haematocheila and Konosirus punctatus and its relationship with ambient phytoplankton. Master's Thesis of Shanghai Ocean University, 2016, 1-52 [吕末晓. 鮻、斑鰶幼鱼食物组成及其与环境浮游植物的关系研究. 上海海洋大学硕士研究生学位论文, 2016, 1-52] http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912392.htm
|
Luan QS, Kang YD, Wang J. Long-term changes of phytoplankton community and diversity in adjoining waters of the Yellow River estuary (1960-2010). Journal of Fishery Sciences of China, 2017, 24(5): 913-921 [ 栾青杉, 康元德, 王俊. 黄河口邻近海域浮游植物群落及其多样性的长期变化(1960-2010). 中国水产科学, 2017, 24(5): 913-921] |
Ning XR, Lin CL, Su JL, et al. Long-term environmental changes and the responses of the ecosystems in the Bohai Sea during 1960-1996. Deep-Sea Research Ⅱ, 2010, 57(11): 1079-1091 |
Scura ED, Jerde CW. Various species of phytoplankton as food for larval northern anchovy, Engraulis mordax, and relative nutritional value of the dinoflagellates Gymnodinium splendens and Gonyaulax polyedra. Fishery Bulletin, 1977, 75(3): 577-583 |
Sun J, Liu DY, Yang SM, et al. The preliminary study on phytoplankton community structure in the Central Bohai Sea and the Bohai Strait and its adjacent area. Oceanologia et Limnologia Sinica, 2002, 33(5): 461-471 [ 孙军, 刘东艳, 杨世民, 等. 渤海中部和渤海海峡及邻近海域浮游植物群落结构的初步研究. 海洋与湖沼, 2002, 33(5): 461-471] |
Sun XM, Xu DH, Xia B, et al. Species composition and seasonal variation of netz-phytoplankton in the Central Bohai Sea. Progress in Fishery Sciences, 2016, 37(4): 19-27 [ 孙雪梅, 徐东会, 夏斌, 等. 渤海中部网采浮游植物种类组成和季节变化. 渔业科学进展, 2016, 37(4): 19-27 DOI:10.11758/yykxjz.20150526002] |
Tomas CR. Identifying marine phytoplankton. San Diego: Academic Press, 1997: 1-858
|
Wan RJ, Jiang YW. The distribution and variation of eggs and larvae of Osteichthyes in the Bohai Sea. Journal of Fishery Sciences of China, 1998, 5(1): 43-50 [ 万瑞景, 姜言伟. 渤海硬骨鱼类鱼卵和仔稚鱼分布及其动态变化. 中国水产科学, 1998, 5(1): 43-50] |
Wang J, Kang YD. Study on population dynamics of phytoplankton in the Bohai Sea. Marine Fisheries Research, 1998, 19(1): 43-52 [ 王俊, 康元德. 渤海浮游植物种群动态的研究. 海洋水产研究, 1998, 19(1): 43-52] |
Wang J. Study on population dynamics of phytoplankton in Laizhou Bay. Marine Fisheries Research, 2000, 21(3): 33-38 [ 王俊. 莱州湾浮游植物种群动态研究. 海洋水产研究, 2000, 21(3): 33-38] |
Wei H, Zhao L, Yu ZG, et al. Variation of the Phytoplankton Biomass in the Bohai Sea. Journal of Ocean University of Qingdao, 2003, 33(2): 173-179 [ 魏皓, 赵亮, 于志刚, 等. 渤海浮游植物生物量时空变化初析. 青岛海洋大学学报, 2003, 33(2): 173-179] |
Wu Q, Jin XS, Luan QS, et al. Analysis on the reproduction of Fenneropenaeus chinensis and Portunus trituberculatus based on their food sources and predators in the Laizhou Bay of China. Progress in Fishery Sciences, 2016, 37(2): 1-9 [ 吴强, 金显仕, 栾青杉, 等. 基于饵料及敌害生物的莱州湾中国对虾(Fenneropenaeus chinensis)与三疣梭子蟹(Portunus trituberculatus)增殖基础分析. 渔业科学进展, 2016, 37(2): 1-9 DOI:10.11758/yykxjz.20150312001] |
Yang Y, Sun J, Guan XY, et al. Seasonal variation of netz-phytoplankton community in Bohai Sea. Marine Science Bulletin, 2016, 35(2): 121-131 [ 杨阳, 孙军, 关翔宇, 等. 渤海网采浮游植物群集的季节变化. 海洋通报, 2016, 35(2): 121-131 DOI:10.11840/j.issn.1001-6392.2016.02.001] |
Yu JL, Li RX. The study on the phytoplankton ecology in the Bohai and Yellow Seas. Journal of Oceanography of Huanghai & Bohai Seas, 1993, 11(3): 52-59 [ 俞建銮, 李瑞香. 渤海、黄海浮游植物生态的研究. 黄渤海海洋, 1993, 11(3): 52-59] |
Zhang JF, Gao XL, Li PM, et al. Nutrient distribution characteristics and long-term trends in the southwest of the Laizhou Bay and its adjacent rivers. Marine Science Bulletin, 2015, 34(2): 222-232 [ 张锦峰, 高学鲁, 李培苗, 等. 莱州湾西南部海域及其毗邻河流水体营养盐的分布特征及长期变化趋势. 海洋通报, 2015, 34(2): 222-232 DOI:10.11840/j.issn.1001-6392.2015.02.015] |
Zhang QF, Yin CL, Xu YS, et al. The phytoplankton community sampled by nets in the dominant area monitoring red tide in Bohai Bay in summer, 2006. Journal of Tianjin University of Science & Technology, 2007, 22(3): 19-23 [ 张秋丰, 尹翠玲, 徐玉山, 等. 2006年夏季渤海湾赤潮重点监控区的网采浮游植物群落. 天津科技大学学报, 2007, 22(3): 19-23] |
Zhou ZC, Ma ZQ, Xue K, et al. Study on the red tides caused by Noctiluca scientillans and Ceratium furca in Liaodong Wan Bay. Fisheries Science, 2002, 21(2): 9-12 [ 周遵春, 马志强, 薛克, 等. 对辽东湾夜光藻赤潮和叉状角藻赤潮成因的初步研究. 水产科学, 2002, 21(2): 9-12] |
Zhu SP, Guo YJ. Studies on the genus Chaetoceros Ehrenberg from the fishing ground of the mackerel, Pneumatophorus japonicus (Houttuyn), off the Shantung coast from Chefoo to Weihai. Part Ⅰ. A systematic study. Oceanologia et Limnologia Sinica, 1957, 1(1): 27-94 [ 朱树屏, 郭玉洁. 烟台、威海鲐鱼渔场及其附近海区角毛硅藻属的研究Ⅰ.分类的研究. 海洋与湖沼, 1957, 1(1): 27-94] |



