2. 上海海洋大学食品学院 上海 201306
2. College of Food Sciences & Technology, Shanghai Ocean University, Shanghai 201306
环糊精(CD)是由环糊精葡萄糖基转移酶(CGTase)作用于直链淀粉而产生的环状低聚糖(Valle et al, 2004),常见的有α-、β-和γ-环糊精。环糊精可以包埋形状各异和适当大小的疏水性客体分子,进而改变它们的理化性质(Biwer et al, 2002)。环糊精的化学性质均较稳定,α-环糊精在体内的代谢作用最慢且无毒(Arima et al, 2011)。环糊精在医药(朱征等, 2016),化妆品(李姝静等, 2016)、环保领域(张洪伟, 2014)等有良好的应用前景,而且作为一种新型的膳食纤维逐渐走入人们的视野(Artiss et al, 2006)。
大多数CGTase生成的是多种环糊精的混合体。Bharat等(2001)利用来自肺炎克雷伯菌AS-22分泌的CGTase酶生产α-环糊精。Duan等(2013)以α-CGTase和异淀粉酶作用于马铃薯淀粉,CD的总产量达到84.6%,比单独使用α-CGTase的转化率提高了31.2%。目前,环糊精的应用依然受到环糊精产量的制约,继续研究提高环糊精产率的方法具有重要意义。
本研究对前期筛选到的来自黄海海域的海洋芽孢杆菌Y112的α-CGTase生产α-环糊精的条件进行优化,旨在提高α-环糊精的产量,以便应用于食品药品等领域。
1 材料与方法 1.1 酶的来源α-CGTase酶:由菌株海洋芽孢杆菌Y112(与Bacillus agaradhaerens DSM8721的同源性为100%,本实验室分离自中国黄海水域)发酵提取制备获得。
1.2 主要试剂α-环糊精标准品(Aladdin, HPLC级);可溶性淀粉,玉米淀粉,马铃薯淀粉,麦芽糊精(索莱宝);水溶性淀粉-底物(Aladdin, 药用级);甲基橙(Aladdin, AR);其他化学试剂,国药集团化学试剂有限公司。
1.3 α-CGTase酶活力的测定实验组:取4 g水溶性淀粉,用配制好的pH=8.5的0.2 mol/L的NaOH-甘氨酸缓冲液100 ml (现用现配)溶解并进行加热糊化作为底物,待其冷却后取0.9 ml液体在试管中,放入50℃水浴锅中预热5 min,然后加入适当稀释倍数的粗酶液0.1 ml混合均匀,50℃水浴反应4 min,取出后迅速加入1 ml盐酸溶液(1 mol/L)终止反应,最后加入4 ml稀释4倍的甲基橙溶液,混匀,室温静置20 min。
对照组:取底物0.9 ml于试管中,预热5 min。随实验组放入水浴反应4 min后,加入1 ml盐酸溶液混合均匀后,再加入与实验组相同的粗酶液,其他处理与实验组相同。用分光光度计在507 nm测定实验组与对照组的吸光度。1个单位酶活定义为上述条件下生成1 μg α-环糊精需要的酶量(张晓磊等, 2015)。
1.4 绘制标准曲线取一支试管,分别加入1 ml梯度浓度的α-环糊精标准溶液和1 ml 1 mol/L的盐酸,再加入4 ml稀释4倍的甲基橙溶液于试管中,摇匀,室温静置20 min,在507 nm处测吸光度。其中,空白不含α-环糊精,其余操作相同。以环糊精浓度为横坐标,吸光度差值为纵坐标,绘制标准曲线。吸光度差值(DOD)=空白溶液吸光度-样品吸光度。
1.5 α-环糊精含量测定将待测溶液按照1.4的步骤进行测定,根据标准曲线计算得到α-环糊精的浓度,然后得出α-环糊精的含量值。
1.6 单因素法优化α-CGTase作用淀粉产α-环糊精条件 1.6.1 底物种类对α-CD产量的影响取5%浓度的玉米淀粉、马铃薯淀粉、麦芽糊精和可溶性淀粉溶液各100 ml加热溶解,待冷却后,温度30℃,pH为9,加酶量200 U/g淀粉,200 r/min,6 h取出煮沸灭活测α-CD产量。每个梯度做3次,取平均值。
1.6.2 底物浓度对α-CD产量的影响分别取3%、5%、8%、10%、15%、20%浓度的马铃薯淀粉溶液各100 ml加热溶解,待冷却后,温度30℃,pH为9,加酶量200 U/g淀粉,200 r/min,6 h取出煮沸灭活测α-CD产量。每个梯度做3次,取平均值。
1.6.3 酶添加量对α-CD产量的影响5%浓度的马铃薯淀粉溶液100 ml,温度为30℃,pH为9,分别加入100、150、200、250、300 U/g马铃薯淀粉的α-CGTase进行反应,200 r/min摇床反应6 h后灭活测α-CD产量。每个梯度做3次,取平均值。
1.6.4 温度对α-CD产量的影响5%浓度的马铃薯淀粉溶液100 ml,pH为9,加酶量200 U/g马铃薯淀粉,分别在20℃、30℃、40℃、50℃、60℃反应,200 r/min摇床反应6 h后煮沸灭活测定α-CD产量。每个梯度做3次,取平均值。
1.6.5 反应时间对α-CD产量的影响5%浓度的马铃薯淀粉溶液100 ml加热溶解,待冷却后,温度为30℃,pH为9,加酶量为200 U/g马铃薯淀粉,200 r/min,反应分别进行1、2、4、6、8、10、12、24 h后煮沸灭活测定α-CD产量。每个梯度做3次,取平均值。
1.6.6 pH对α-CD产量的影响5%浓度的马铃薯淀粉溶液100 ml,温度30℃,加酶量200 U/g马铃薯淀粉,分别在pH为6、7、8、9、10条件下反应,200 r/min摇床反应6 h后煮沸灭活,测定α-CD产量。每个梯度做3次,取平均值。
1.6.7 Mg2+浓度对α-CD产量的影响5%浓度的马铃薯淀粉溶液100 ml,pH值为9,温度为30℃,加酶量为200 U/g马铃薯淀粉,分别加入终浓度为0~60 mmol/L的镁离子,200 r/min摇床反应6 h后灭酶测定α-CD产量。每个梯度做3次,取平均值。
1.7 响应面法优化产α-环糊精条件 1.7.1 Plackett-Burman实验根据单因素实验,选取底物浓度、加酶量、温度、时间和pH共5个因素,通过PB实验为响应面实验筛选出酶催化淀粉生成α-环糊精的主要影响因子。
|
|
表 1 Plackett-Burman实验设计 Table 1 Experiment design of Plackett-Burman |
根据PB实验结果用Design-Expert 8.06软件设计BBD实验并进行分析(表 2)(董延娟等, 2016)。
|
|
表 2 Box-Behnken实验设计 Table 2 Experiment design of Box-Behnken |
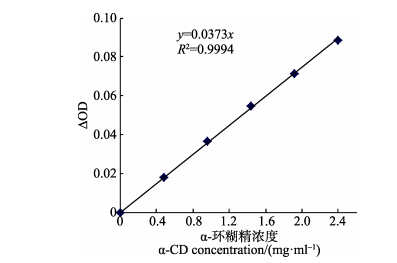
α-环糊精的标准曲线见图 1,方程为y=0.0373x (R2=0.9994)。
|
图 1 α-环糊精的标准曲线 Figure 1 Standard curve of α-cyclodextrin |
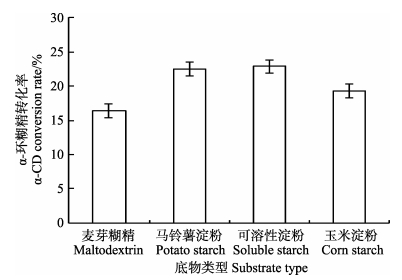
底物种类对α-环糊精转化率的影响如图 2所示。由图 2可以看出,可溶性淀粉的环糊精转化率最高,麦芽糊精的转化率最低。马铃薯淀粉的转化率略低于可溶性淀粉。
|
图 2 不同底物对α-CD产量的影响 Figure 2 Effects of different substrate on yield of α-CD |
环糊精可以由环糊精酶作用于不同种类的淀粉、糊精、直链淀粉和支链淀粉产生,得到高转化率环糊精的底物是淀粉。而淀粉是由直链淀粉和支链淀粉组成,由于直链淀粉与脂质容易形成复合物,不易酶活性的作用;支链淀粉有更多的还原端,与直链淀粉相比再生缓慢,以支链淀粉为底物的环糊精产量高于直链淀粉(Pishtiyski et al, 2006)。马铃薯淀粉的价格比较低,使得生产环糊精的成本降低,因此,本研究中马铃薯淀粉是适合生产环糊精的底物。
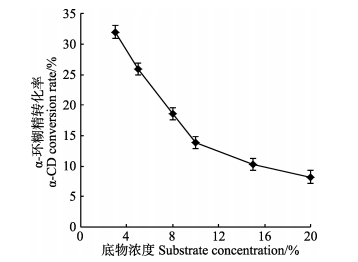
2.2.2 底物浓度对α-环糊精生产的影响底物浓度对环糊精转化率的影响如图 3所示。由图 3可以看出,当淀粉浓度为5%时,α-环糊精的转化率为25.9%,当淀粉浓度升到10%时,α-环糊精的转化率和5%时相比下降50%,二者相差较大,继续增大底物浓度,转化率降低越明显。可能是因为马铃薯淀粉浓度过大,加热糊化后粘性过大,不利于酶与底物的反应过程。相反,底物浓度越小,环糊精转化率越高,但成本升高,总的产量过低,综合考虑,选用5%的马铃薯淀粉作为生产α-环糊精的淀粉浓度。
|
图 3 底物浓度对α-CD产量的影响 Figure 3 Effect of substrate concentration on yield of α-CD |
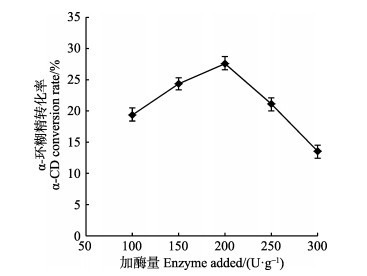
图 4显示,在一定范围内,α-环糊精的转化率随着加酶量的增加呈现先上升后下降的趋势。当加酶量为200 U/g时,转化率达到最高。
|
图 4 酶添加量对α-CD生产的影响 Figure 4 Effect of enzyme addition on α-CD production |
环化反应的逆反应是耦合反应,加酶量的增加,使酶的歧化、耦合反应能力均增强,增加了体系中小分子糖的存在,促进耦合反应的进行,使得α-环糊精向β-环糊精转化,不利于α-环糊精的生产。控制酶的添加量可以有效提高α-环糊精的产量,减少酶的用量也可以降低成本。通过单因素实验,选择200 U/g的加酶量。
2.2.4 温度对α-环糊精生产的影响从图 5可以看出,不同的温度对转化率的影响比较明显,转化率在30℃时最高,之后随着温度的继续升高,α-环糊精的转化率降低幅度增大。该酶的最适反应温度是55℃,在40℃以下稳定,高于50℃对酶活影响较大,与实验结果基本保持一致,在不失活的状态下,30℃时最有利于α-环糊精的生产。
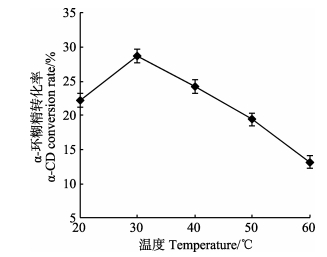
|
图 5 温度对α-CD生产的影响 Figure 5 Effects of temperature on α-CD production |
由图 6可知,α-环糊精转化率达到最高点的时间为6 h,继续增加反应时间,转化率并没有增高,反而有明显的降低趋势。随着反应时间的加长,酶的其他作用增强,造成α-环糊精的分解。另一方面,反应时间的减少,更有利于节约成本。
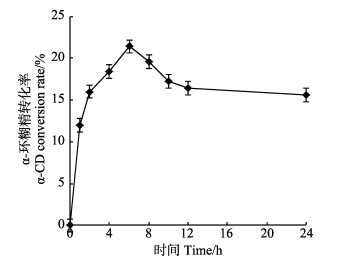
|
图 6 反应时间对α-CD生产的影响 Figure 6 Effects of reactional time on α-CD production |
通过考察不同pH下α-环糊精的转化率,结果显示(图 7),初始pH为9时,转化率最高,此时即为α-环糊精转化的最适反应pH。不同的CGT酶反应的体系的pH值是不同的,大多数是弱碱性或中性介质(Jung et al, 2007)。有研究表明,底物种类-缓冲液类型对环糊精有重要的作用(Mau et al, 2007),在此未对缓冲液的类型是否对转化率有一定的影响做进一步的探讨。
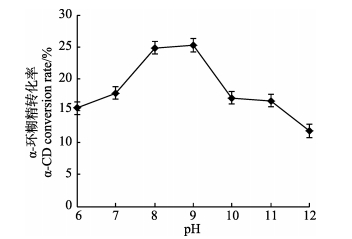
|
图 7 pH值对α-CD生产的影响 Figure 7 Effects of pH on α-CD production |
之前的实验中,Mg2+对酶活性有一定的促进作用,本实验考察反应过程中添加量对反应的影响。由图 8可知,由于生产α-环糊精的时间比较短,在一定范围内Mg2+浓度的增减对环糊精的转化率并没有很大的影响,因此,后期实验中不考率金属离子的添加量。
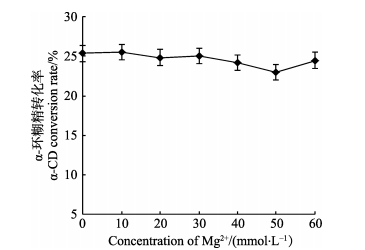
|
图 8 Mg2+浓度对α-CD生产的影响 Figure 8 Effects of Mg2+ concentration on α-CD production |
用Design-Expert 8.0.6软件对实验结果进行处理,得到PB实验设计分析如表 4,底物浓度、温度和pH的P值小于0.055为显著,因此,确定三者为酶转化淀粉生产α-环糊精的主要影响因子。
|
|
表 3 PB实验设计及结果 Table 3 Design and results in PB |
|
|
表 4 PB实验结果分析 Table 4 The analysis of the results of PB |
利用Design- Expert 8.06软件对实验结果进行多元回归拟合(表 6),发现该模型是显著的,F值为506.71表示仅有0.01%的可能是由噪音引起的,其中A、B、C、AC、A2、B2、C2的P值均小于0.05,是显著模型项,失拟F值为0.96(P=0.4921)表示该模型的失拟不显著,因此该模型是合适的。方程的R2=0.9985,说明α-环糊精转化率的实测值与预测值的拟合度较好,该模型能较好解释环糊精产率的变化。F值越大,表明影响因子对实验指标的影响越大。由方差分析表可得出,FA=369.36,FC=303.67,FB=33.64,即各因素对产物制备的影响程度大小顺序为底物浓度 > pH > 温度。
|
|
表 5 Box-Behnken实验设计及结果 Table 5 Design of Box-Behnken and results |
|
|
表 6 回归模型系数的显著性 Table 6 Significance of regression coefficients for the model |
二次多项式回归方程为:
Y=+28.58-0.91A+0.28B-0.83C+0.012AB+0.57AC- 0.13BC-1.30A2-2.30B2-2.76C2
根据回归方程,做响应面图(图 9)。
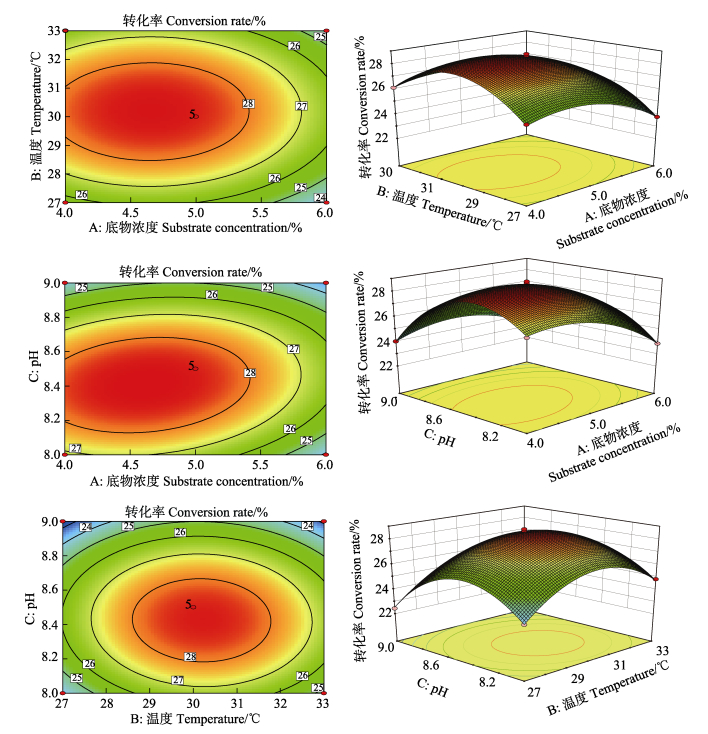
|
图 9 两两因素交互作用3D图和等高线图 Figure 9 3D and contour plot of interaction between two factors |
软件分析得到最大响应值(产量)时A、B、C对应的最佳实验条件为:底物浓度4.61、温度30.2℃、pH=8.4、反应时间6 h,α-环糊精最大预测转化率为28.84%。按照实验筛选出的最佳条件,为方便实验操作,在底物浓度5%、温度30℃、pH=8.4、加酶量200 U/g、反应6 h条件下进行反应,实际转化率为28.67%,与理论值接近。
3 讨论郭永华等(2016)通过定点饱和突变技术得到CGTase突变体N623T,在酶的最适温度60℃和pH为6.5条件下反应24 h,淀粉总转化率从11.3%提高至39.7%,其中,α-环糊精、γ-环糊精所占比例分别为32.8%和7.7%,α-环糊精的总转化率为13.02%。王琰等(2017)利用重组的α-CGTase酶转化5%的马铃薯淀粉,58℃反应15 h后,环糊精的总转化率可达40.7%,转化生成α-CD、β-CD和γ-CD比例分别为43.6%、41.8%和14.6%,即α-CD的转化率为17.75%。与已报道的产环糊精最高的酶相比(Duan et al, 2013),菌株Y112产的CGTase酶在碱性环境中更加稳定,反应时间仅为6 h,大大降低了生产成本,且在不添加有机试剂的条件下,转化率可达到28.67%,减小了环糊精的毒性,使得环糊精应用范围更广,特别是医药,食品,化妆等方面,具有不可比拟的优势。
4 结论本研究采用单因素实验分析了α-CGTase催化淀粉制备α-环糊精的条件,初步筛选得到的条件为:以马铃薯淀粉溶液为底物,5%的浓度,加酶量200 U/g (淀粉),温度30℃,pH为9,反应时间6 h;利用Plackett-Burman实验设计对影响α-环糊精转化率的5个因素进行筛选,通过分析得知主要影响因素为底物浓度、温度和pH值。采用响应面分析法对α-CGTase转化淀粉制备α-环糊精条件进行优化,得到的最佳转化条件为底物浓度5%、pH 8.4、温度30℃、200 r/min、反应6 h。在最佳条件下制备α-CD转化率均值为28.67%,比优化前的产率提高了2.48倍。
|
|
表 7 与其他研究成果的比较 Table 7 Comparison with other research results |
Arima H, Motoyama K, Irie T, et al. Recent findings on safety profiles of cyclodextrins, cyclodextrin conjugates and polypseudorotaxanes. John Wiley & Sons, Inc., Hoboken, 2011, 32: 91-123 |
Artiss JD, Brogan K, Brucal M, et al. The effects of a new soluble dietary fiber on weight gain and selected blood parameters in rats. Metabolism, 2006, 55(2): 195-202 DOI:10.1016/j.metabol.2005.08.012 |
Bharat G, Anant P. Alpha-cyclodextrin production using cyclodextrin glycosyltransferase from Klebsiella pneumoniae AS-22. Starch Starke, 2001, 53(2): 75-83 DOI:10.1002/(ISSN)1521-379X |
Biwer A, Antranikian G, Heinzle E. Enzymatic production of cyclodextrins. Applied Microbiology and Biotechnology, 2002, 59(6): 609-617 DOI:10.1007/s00253-002-1057-x |
Dong YJ, Hao JH, Zhang HF, et al. Optimization of the fermentation conditions for xylanase-producing strain YS1069. Progress in Fishery Sciences, 2016, 37(3): 154-159 [ 董延娟, 郝建华, 郑鸿飞, 等. 产木聚糖酶菌株YS1069的产酶条件优化. 渔业科学进展, 2016, 37(3): 154-159] |
Duan X, Chen S, Chen J, et al. Enhancing the cyclodextrin production by synchronous utilization of isoamylase and α-CGTase. Applied Microbiology and Biotechnology, 2013, 97(8): 3467-3474 DOI:10.1007/s00253-012-4292-9 |
Guo YH, Chen JC, Cai HS, et al. Saturated mutation effects on catalytic efficiency and product specificity of starch binding site N623 of cyclodextrin glucanotransferase from Geobacillus sp. CHB1. China Biotechnology, 2016, 36(11): 30-38 [ 郭永华, 陈济琛, 蔡海松, 等. Geobacillus sp. CHB1环糊精葡萄糖基转移酶淀粉结合位点N623饱和突变对催化效率与产物特异性的影响. 中国生物工程杂志, 2016, 36(11): 30-38] |
Jung SW, Kim TK, Lee KW, et al. Catalytic properties of beta-cyclodextrin glucanotransferase from alkalophilic Bacillus sp. BL-12 and intermolecular transglycosylation of stevioside. Biotechnology and Bioprocess Engineering, 2007, 12(3): 207-212 |
Li SJ, Zhou ZR. Application of cyclodextrins in the cosmetic field. Applied Chemical Industry, 2016, 45(10): 1942-1945 [李姝静, 周自若, 邓小锋, 等.环糊精在化妆品领域中的应用研究.应用化工, 2016, 45(10): 1942-1945] http://kns.cnki.net/KCMS/detail/detail.aspx?filename=SXHG201610035&dbname=CJFD&dbcode=CJFQ
|
Mau GK, Muhammad MN, Osman H, et al. The effects of reaction conditions on the production of γ-cyclodextrin from tapioca starch by using a novel recombinant engineered CGTase. Journal of Molecular Catalysis, B: Enzymatic, 2007, 9(1-4): 118-126 |
Pishtiyski I, Zhekova B. Effect of different substrates and their preliminary treatment on cyclodextrin production. World Journal of Microbiology and Biotechnology, 2006, 22(2): 109-114 DOI:10.1007/s11274-005-9004-5 |
Valle D, Martin EM. Cyclodextrins and their uses: A review. Process Biochemistry, 2004, 39(9): 1033-1046 DOI:10.1016/S0032-9592(03)00258-9 |
Wang Y, Li J, Yang GW, et al. Study of soluble expression in Escherichia coli of α-cyclodextrin glycosyl transferase produced by Paenibacillus macerans and properties of its derivatives. China Food Additives, 2017(2): 81-86 [ 王琰, 李皎, 杨国武, 等. 多黏芽孢杆菌产ɑ-环糊精葡萄糖基转移酶在大肠杆菌中的可溶性表达及其转化产物特异性研究. 中国食品添加剂, 2017(2): 81-86 DOI:10.3969/j.issn.1006-2513.2017.02.005] |
Zhang HW. Structural characteristics of cyclodextrin and its research status in environmental protection. Environment and Life, 2014(22): 319-320 [ 张洪伟. 环糊精的结构特性及其在环保领域的研究现状. 环境与生活, 2014(22): 319-320] |
Zhang XL, Hao JH, Zhang HF, et al. Optimized fermentation of α-cyclodextrin glucosyltransferase producing strain. Chinese Journal of Marine Drugs, 2015, 34(5): 63-70 [ 张晓磊, 郝建华, 郑鸿飞, 等. 1株产α-环糊精葡萄糖基转移酶菌株的产酶条件优化. 中国海洋药物, 2015, 34(5): 63-70] |
Zhu Z, Yang M. Evaluation of the effect of high blood fat elimination by alpha cyclodextrin to the clinical biochemical measurement. Sichuan Medical Journal, 2016, 37(9): 1048-1052 [ 朱征, 杨敏. α-环糊精消除高脂血对临床生化测定影响的效果评价. 四川医学, 2016, 37(9): 1048-1052] |



