2. 中国水产科学研究院黄海水产研究所 山东省渔业资源与生态环境重点实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Shandong Provincial Key Laboratory for Fishery Resources and Eco-Environment, Qingdao 266071
云纹石斑鱼(Epinephelus moara Temminck & Schlegel 1842)俗称草斑、油斑,为中下层礁栖鱼类,主要分布于太平洋西岸的日本、韩国和中国海域(郭明兰等, 2008)。其个体大、生长速度快、适应能力强、肉质鲜嫩可口,是我国东南沿海重要经济养殖对象,具有良好的养殖开发前景(陆丽君等, 2011)。然而,因其人工催产和苗种培育技术难度较高,日本在2001年才实现云纹石斑鱼苗种规模化繁育(王民生, 2001)。在我国,中国水产科学研究院黄海水产研究所在2010年突破了其苗种规模化繁育技术(林时雨, 2010; 宋振鑫等, 2012)。近几年,有关云纹石斑鱼的研究主要集中在种间杂交(李炎璐等, 2012; 张梦淇等, 2016)、生长营养(陆丽君等, 2011; 宋振鑫等, 2014; 张廷廷等, 2016)、免疫抗逆(Tian et al, 2017; 廖雅丽等, 2016; 潘桂平等, 2016; 施兆鸿等, 2015)以及养殖技术(梁友等, 2014; 宋振鑫等, 2012)等方面,仍缺乏该鱼种质遗传多样性相关研究。本文研究了日本东京湾云纹石斑鱼染色体核型,并与该鱼厦门群体的染色体核型进行比较,以期为云纹石斑鱼种质资源的保护及遗传育种研究提供理论依据。
1 材料与方法 1.1 实验材料所用材料采自山东省烟台开发区天源水产有限公司养鱼场,为日本东京湾海域捕获的幼鱼,引种后在室内24 m2水泥池人工驯养1个月,养殖期间投喂鲜杂鱼饵料,日投饵2~3次,总的投饵量约为体重的8%。本实验随机挑选6尾幼鱼,体长为20.3~23.6 cm,体重为127~161 g。
1.2 实验方法 1.2.1 染色体标本的制备参照PHA(植物凝集素)(林义浩, 1982)体腔直接注射法制备染色体标本,略作修改。取充气暂养于25℃海水24 h后的云纹石斑鱼,按PHA剂量为10 μg/g鱼体重进行腹腔活体注射,3 h后按1 μg/g鱼体重的剂量注射秋水仙素,1 h后剪鳃放血,然后取出头肾于生理盐水中洗涤、剪碎,用纱布过滤细胞悬浮液至离心管中,1000 r/min离心5 min,收集细胞,用生理盐水洗涤细胞2次,1000 r/min离心10 min收集细胞,加入0.075 mol/L的KCl溶液于32℃低渗处理20 min,1000 r/min离心10 min,收集细胞,加入预冷新配制的卡诺氏固定液(甲醇:乙酸=3: 1, V: V) (固定90 min,每30 min更换固定液,共换液2次。冷滴片法制片,空气干燥过夜。染色体玻片用10%吉姆萨染色液染色30 min,自然干燥后显微镜(Olympus BX51)观察拍照。
1.2.2 核型分析选取清晰的染色体中期分裂相计数确定染色体众数。选取10个分散效果良好、着丝粒清晰、长度适中、2条染色单体适度分开的中期分裂相放大、测量、统计,使用Photoshop软件依据相对大小从大到小编号,根据Levan等(1964)的标准进行核型分析。
2 结果与分析 2.1 染色体数目本实验对464个中期分裂相计数、统计。结果显示,76.72%的中期分裂相染色体数目为48 (表 1),据此确定云纹石斑鱼日本东京湾群体二倍体染色体众数是48,即:2n = 48。
|
|
表 1 云纹石斑鱼染色体数目统计结果 Table 1 Chromosome numbers of E. moara |
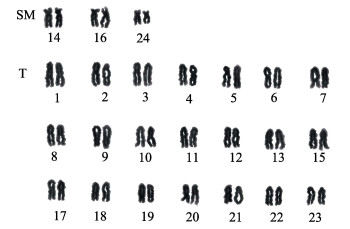
对10个中期分裂相进行镜检和测量,统计了染色体的相对长度和臂比以及染色体类型,结果见表 2。分析显示,云纹石斑鱼日本东京湾群体的染色体可配对成24对同源染色体,按Levan命名法可分为2组,其中,具亚中部着丝粒(sm)3对;其余21对染色体为端部着丝粒(t)染色体(图 1和图 2)。24对染色体中,第24对染色体的相对长度明显短于其他23对染色体,其他23对染色体彼此相对长度差异不明显,从5.13±0.15均匀递减至2.81±0.13(表 2),根据染色体的相对长度、着丝点位置和特征,确定云纹石斑鱼日本东京湾群体染色体核型公式为:2n = 48,6sm + 42t,NF = 54。
|
|
表 2 云纹石斑鱼各染色体的相对长度和臂比值 Table 2 Relative length and arm ratio of chromosomes of E. moara (n = 10; X±SD) |
|
图 1 云纹石斑鱼染色体核型 Figure 1 Karyotype of E. moara |
|
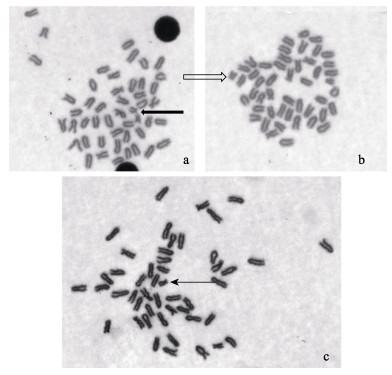
图 2 云纹石斑鱼不同中期分裂相中第24对染色体(不同箭头所指)三种形态 Figure 2 Polymorphism of chromosome pair No. 24 (indicating by different arrows) of E. moara a:丝状; b: T型; c: SM型 a: Filiform; b: T type; c: SM type |
对云纹石斑鱼中期分裂相进行镜检后发现:第24对染色体的短臂的形态具有可变性。部分中期分裂相中短臂形态清晰,为sm型染色体(图 2c);部分中期分裂相中短臂变短消失,为t型染色体(图 2b),或变长表现为丝状,为次缢痕(图 2a)。
3 讨论生物遗传信息一般以染色体为主要载体,染色体核型在很大程度上反映了该物种的进化历史及其物种间的亲缘关系。染色体核型的变异可能会导致该物种生物学特征的变异、生殖隔离的发生,乃至新物种产生(郭明兰, 2008)。对已报道的国内外鱼类的染色体核型进行统计比较研究,结果显示,淡水鱼类染色体二倍数变化较大,多数为48和50 (Yu et al, 1987; 余先觉等, 1989),海水鱼类的染色体二倍数则相对一致,多数为48 (Junior et al, 2006)。据此推测,淡水鱼类的基本二倍体数目是2n = 48和2n = 50,其原始染色体核型为2n = 48t或50t;海水鱼类的基本二倍体数目是2n = 48,其原始染色体核型为2n = 48t。有关研究指出,石斑鱼属的原始染色体核型也为2n = 48t,符合海水鱼类原始核型特征(刘莉等, 2016; 钟声平等, 2010)。其他具有中部、亚中部和亚端部着丝粒染色体应该是由端部着丝粒染色体经易位、倒位等染色体重组的方式进化而来,属于比较特化的类型(王世锋, 2007)。日本东京湾云纹石斑鱼的染色体核型公式为:2n = 48,6sm + 42t,NF = 54,其染色体臂数为54,高于石斑鱼属鱼类的原始核型染色体臂数48,属于石斑鱼属的特化类群,推测是石斑鱼属演化过程中较晚出现的物种之一。郭明兰(2008)对厦门群体云纹石斑鱼的核仁组织区银染(Ag-NORs)实验结果显示,其中期分裂相中主要有2对Ag-NORs,也高于石斑鱼属具有1对Ag-NORs数目的原始核仁组织区特征,推测其原始1对核仁组织区在进化中由于染色体易位重组,导致2对染色体都具有核仁组织区。核仁组织区结果同样显示,云纹石斑鱼属于石斑鱼属的特化类群。此外,郭明兰(2008)研究表明,石斑鱼属鱼类核仁组织区位置具有很高的同源性,一般位于最小的1对染色体(第24对染色体)上,且石斑鱼属大多数种类第24对染色体形态高度保守,为该属原始核型的T型染色体。迄今,包括本研究在内的已报道的26种石斑鱼中,仅有4种石斑鱼[云纹石斑鱼(郭明兰, 2008),斜带石斑鱼(E. coioides)(丁少雄等, 2004; 王云新等, 2004),褐点石斑鱼(E. fuscoguttatus) (廖经球等, 2006),褐石斑鱼(E. bruneus) (郭明兰, 2008; 王世锋, 2007)]的第24对染色体形态发生了改变,为SM型染色体。该结果也支持云纹石斑鱼属于石斑鱼属的特化类群的推论。
研究显示,一个物种的染色体核型特征,包括染色体数目和染色体类型是相对稳定的,海水鱼类中同物种不同地理群体,甚至同个体不同细胞、不同发育阶段染色体核型特征有差异时有发生(郭明兰, 2008)。在石斑鱼类中有研究报道,斜带石斑鱼、褐石斑鱼及云纹石斑鱼厦门群体个体中第24对染色体在不同中期分裂相中存在不同形态的短臂。推测其原因,可能与核仁组织区的rDNA表达活性相关,表达活性强时,短臂明显,反之则不可见。本研究结果显示,云纹石斑鱼东京湾群体个体中第24对染色体形态也存在多态性,表现为sm型染色体、t型染色体,或变长表现为丝状,为次缢痕,与该鱼厦门群体研究结果相同,推测其多态性也与第24对染色体上核仁组织区的rDNA表达活性相关。另外,比较大黄鱼(Pseudosciaena crocea)岱衢族和闽粤东族群体的染色体核型,显示2个地理群体间染色体核型存在显著差异:岱衢族群体的染色体核型公式为2n = 48,6m + 6sm + 36t,NF = 60;而闽粤东族群体的染色体核型公式为2n = 48,6st + 42t,NF = 48。因适应不同生长环境、长期地理隔离,可能是大黄鱼不同地理群体间染色体核型存在显著差异重要原因之一(王德祥等, 2006)。此外,花尾胡椒鲷(Plectorhinchus cinctus) (曹伏君等, 2008; 覃映雪等, 2003)、中华乌塘鳢(Bostrichthys sinensis) (费志清等, 1987; 沈亦平等, 1994)和黑鲷(Sparus macrocephalus) (刘静等, 1991; 喻子牛等, 1993)等海水鱼类均报道存在染色体核型多态。石斑鱼属鱼类中,拟青石斑鱼(E. fasciatomaculosus) (王世锋, 2007; 郑莲等, 2005)、赤点石斑鱼(E. akaara)(王世锋, 2007; 王云新等, 2004)和鲑点石斑鱼(E. fario)(陈毅恒等, 1990; 郑莲等, 2005)等种类也存在染色体核型多态。本研究结果表明,云纹石斑鱼日本东京湾群体与厦门群体染色体核型也存在显著差异:日本东京湾群体的染色体核型公式为2n = 48,6sm + 42t,NF = 54;而厦门群体染色体核型公式为2n = 48,4sm + 44t,NF = 52。云纹石斑鱼不同地理群体间存在丰富的遗传多样性,可利用不同地理群体间遗传差异加速该鱼的种质改良进展。推测其可能因为长期的地理隔离,导致该鱼2个地区群体染色体进化重组而存在差异,有待进一步证实。该结果也提示,云纹石斑鱼不同地理群体间存在丰富的遗传多样性,可利用不同地理群体间遗传差异加速该鱼的种质改良进展。
Cao FJ, Liu CW. Studies on karyotype and Ag-NORS banging of Plectorhinchus cinctus and Plectorhinchus pictus. Journal of Oceanography in Taiwan Strait, 2008, 27(1): 47-50 [ 曹伏君, 刘楚吾. 花尾胡椒鲷、胡椒鲷的染色体核型与Ag-NORs带研究. 台湾海峡, 2008, 27(1): 47-50 DOI:10.3969/j.issn.1000-8160.2008.01.009] |
Chen YH, Rong SP, Liu SQ. The karyotypes of Epinephelus fario. Fujian Fisheries, 1990, 12(1): 23-25 [ 陈毅恒, 容寿柏, 刘绍琼. 鲑点石斑鱼的核型. 福建水产, 1990, 12(1): 23-25] |
Ding SX, Wang SF, Wang DX, et al. Karyotypes of Epinephelus coioides and Epinephelus akaara. Journal of Xiamen University (Natural Science), 2004, 43(3): 426-428 [ 丁少雄, 王世锋, 王德祥, 等. 斜带石斑鱼染色体核型分析. 厦门大学学报(自然科学版), 2004, 43(3): 426-428 DOI:10.3321/j.issn:0438-0479.2004.03.035] |
Fei ZQ, Tao RQ. The karyotype studies of four Goby fish. Journal of Zhejiang College of Fisheries, 1987, 6(2): 127-131 [ 费志清, 陶荣庆. 鰕虎鱼亚目四种鱼的染色体组型的初步研究. 浙江水产学院学报, 1987, 6(2): 127-131] |
Guo ML, Su YQ, Chen XF, et al. Comparative studies on morphology of Epinephelus moara and E. bruneus. Acta Oceanologica Sinica, 2008, 30(6): 106-114 [ 郭明兰, 苏永全, 陈晓峰, 等. 云纹石斑鱼与褐石斑鱼形态比较研究. 海洋学报, 2008, 30(6): 106-114 DOI:10.3321/j.issn:0253-4193.2008.06.013] |
Guo ML. Comparative studies of Epinephelus moara and Epinephelus bruneus. Doctoral Dissertation of Xiamen University, 2008: 51-70 [ 郭明兰. 云纹石斑鱼与褐石斑鱼的比较研究. 厦门大学博士研究生学位论文, 2008: 51-70]
|
Junior PMG, Molina WF, Affonso PRA, et al. Assessing genetic diversity of Brazilian reef fishes by chromosomal and DNA markers. Genetica, 2006, 126(1): 161-177 |
Levan A, Fredga K, Sandberg AA. Nomenclature for centromeric position on chromosomes. Hereditas, 1964, 52(2): 201-220 |
Li YL, Wang QY, Chen C, et al. Embryonic and morphological development in larva, juvenile, and young stages of F1 by Epinephelus moara (♀) × E. septemfasciatus (♂). Journal of Fishery Sciences of China, 2012, 19(5): 821-832 [ 李炎璐, 王清印, 陈超, 等. 云纹石斑鱼(♀)七带石斑鱼(♂)杂交子一代胚胎发育及仔稚幼鱼形态学观察. 中国水产科学, 2012, 19(5): 821-832] |
Liang Y, Lei JL, Ni Q, et al. The industrial farming technology of Epinephelus moara in recirculation aquaculture water system. Fishery Modernization, 2014, 41(4): 26-28 [ 梁友, 雷霁霖, 倪琦, 等. 云纹石斑鱼工厂化循环水养殖技术. 渔业现代化, 2014, 41(4): 26-28 DOI:10.3969/j.issn.1007-9580.2014.04.006] |
Liao JQ, Yi SW, Chen GH, et al. The karyotype of grouper Epinephelus fuscoguttatus. Fisheries Science, 2006, 25(11): 567-569 [ 廖经球, 尹绍武, 陈国华, 等. 褐点石斑鱼的核型研究. 水产科学, 2006, 25(11): 567-569 DOI:10.3969/j.issn.1003-1111.2006.11.008] |
Liao YL, Zhang CJ, Peng SM, et al. Effects of salinity on activities of liver antioxidant enzymes and plasma lysozyme of Epinehelus moara. Journal of Shanghai Ocean University, 2016, 25(2): 169-176 [ 廖雅丽, 张晨捷, 彭士明, 等. 盐度对云纹石斑鱼抗氧化酶及溶菌酶活性的影响. 上海海洋大学学报, 2016, 25(2): 169-176] |
Lin SY. 2010-11-08. Epinephelus moara achieve large-scale seed breeding. China Fishery News |
林时雨. 2010-11-08.云纹石斑鱼实现规模化苗种繁育. 中国渔业报 |
Lin YH. A PHA injection method in vivo for the rapid obtainment of large numbers of metaphase figures from kindeny cells of teleosts. Journal of Fisheries of China, 1982, 6(3): 201-208 [ 林义浩. 快速获得大量鱼类肾细胞中期分裂相的PHA体内注射法. 水产学报, 1982, 6(3): 201-208] |
Liu J, Tian MC. A chromosome study on two sparid fishes (Pagrosomus major and Sparus macrocephalus). Marine Sciences, 1991, 15(3): 64-67 [ 刘静, 田明诚. 真鲷和黑鲷的染色体组型研究. 海洋科学, 1991, 15(3): 64-67] |
Liu L, Zhan Y, Chen C, et al. Preparation of chromosomes and analysis of karyotypes of hybrid F1 (Epinephelus fuscoguttatus♀ × Epinephelus lanceolatus♂) groupers. Progress in Fishery Sciences, 2016, 37(2): 33-40 [ 刘莉, 张岩, 陈超, 等. 棕点石斑鱼(Epinephelus fuscoguttatus♀)鞍带石斑鱼(Epinephelus lanceolatus♂)F1染色体制备方法及核型分析. 渔业科学进展, 2016, 37(2): 33-40] |
Lu LJ, Chen C, Ma AJ, et al. Studies on the feeding behavior and morphological developments of Epinephelus moara in early development stages. Oceanologia et Limnologia Sinica, 2011, 42(6): 822-829 [ 陆丽君, 陈超, 马爱军, 等. 云纹石斑鱼(Epinephelus moara)早期发育阶段的摄食与生长特性. 海洋与湖沼, 2011, 42(6): 822-829] |
Pan GP, Liu BW, Zhou WY. The effects of cold stress on the antioxidant defense and immune parameters of juvenile Epinehelus moara. Journal of Shanghai Ocean University, 2016, 25(1): 78-85 [ 潘桂平, 刘本伟, 周文玉. 低温胁迫对云纹石斑鱼幼鱼抗氧化和免疫指标的影响. 上海海洋大学学报, 2016, 25(1): 78-85] |
Qin YY, Su YQ, Wang SQ, et al. The karyotypes of Plectorhinchus cinctus. Acta Oceanologica Sinica, 2003, 25(4): 147-150 [ 覃映雪, 苏永全, 王胜强, 等. 花尾胡椒鲷染色体组型分析. 海洋学报(中文版), 2003, 25(4): 147-150 DOI:10.3321/j.issn:0253-4193.2003.04.019] |
Shen YP, Wang XJ, Chen XH, et al. Karyotype study of Bostrichthys sinensis lacepede. Journal of Wuhan University (Natural Science), 1994, 65(4): 120-122 [ 沈亦平, 王孝举, 陈晓汉, 等. 中华乌塘鳢染色体核型研究. 武汉大学学报(自然科学版), 1994, 65(4): 120-122 DOI:10.3321/j.issn:1671-8836.1994.04.002] |
Shi ZH, Zhang YL, Gao QX, et al. Effects of low-temperature stress on serum biochemical parameters and metabolic enzyme activity in juvenile Epinephelus moara. Chinese Journal of Ecology, 2015, 34(8): 2222-2228 [ 施兆鸿, 张艳亮, 高权新, 等. 云纹石斑鱼幼鱼血清生化指标对低温胁迫的响应. 生态学杂志, 2015, 34(8): 2222-2228] |
Song ZX, Chen C, Wu LM, et al. Growth characteristics of Epinephelus septemfasciatus and Epinephelus moara in recirculating aquaculture systems (RAS). Progress in Fishery Sciences, 2014, 35(5): 91-96 [ 宋振鑫, 陈超, 吴雷明, 等. 七带石斑鱼和云纹石斑鱼幼鱼在封闭循环水条件下的生长特性. 渔业科学进展, 2014, 35(5): 91-96] |
Song ZX, Chen C, Zhai JM, et al. Biological characteristics and progress of artificial breeding technique for kelp bass, Epinephelus moara. Fishery Information and Strategy, 2012, 27(1): 47-53 [ 宋振鑫, 陈超, 翟介明, 等. 云纹石斑鱼生物学特性及人工繁育技术研究进展. 渔业信息与战略, 2012, 27(1): 47-53 DOI:10.3969/j.issn.1004-8340.2012.01.009] |
Tian Y, Chen Z, Tang J, et al. Effects of cryopreservation at various temperatures on the survival of kelp grouper (Epinephelus moara) embryos from fertilization with cryopreserved sperm. Cryobiology, 2017, 75: 37-44 DOI:10.1016/j.cryobiol.2017.02.007 |
Wang DX, Su YQ, Wang SF, et al. The karyotypes and their polymorphisms of the Pseudosciaena crocea from different populations. Acta Oceanologica Sinica, 2006, 28(6): 176-178 [ 王德祥, 苏永全, 王世锋, 等. 不同地理种群大黄鱼染色体核型的比较研究. 海洋学报, 2006, 28(6): 176-178 DOI:10.3321/j.issn:0253-4193.2006.06.026] |
Wang MS. Japanese Epinephelus septemfasciatus and E. moara seed production success. Chinese Fisheries Economics, 2001, 20(6): 54 [ 王民生. 日本七带石斑鱼和云纹石斑鱼苗种批量生产成功. 中国渔业经济, 2001, 20(6): 54] |
Wang SF. Comparative karyotype characterization and chromosomal evolution of six groupers. Doctoral Dissertation of Xiamen University, 2007: 33-62 [ 王世锋. 种石斑鱼核型特征比较和染色体进化研究. 厦门大学博士研究生学位论文, 2007: 33-62]
|
Wang YX, Wang HD, Zhang HF, et al. Karyotypes of Epinephelus coioides and Epinephelus akaara. Journal of Zhanjiang Ocean University, 2004, 24(3): 4-8 [ 王云新, 王宏东, 张海发, 等. 斜带石斑鱼与赤点石斑鱼的核型研究. 湛江海洋大学学报, 2004, 24(3): 4-8 DOI:10.3969/j.issn.1673-9159.2004.03.002] |
Yu X, Zhou T, Li K, et al. On the karyosystematics of cyprinid fishes and a summary of fish chromosome studies in China. Genetica, 1987, 72(3): 225-235 DOI:10.1007/BF00116227 |
Yu XJ, Zhou D, Li YC, et al. China's freshwater fish chromosomes. Beijing: Science Press, 1989 [ 余先觉, 周暾, 李渝成, 等. 中国淡水鱼类染色体. 北京: 科学出版社, 1989]
|
Yu ZN, Kong XY, Xie ZY, et al. Studies on the karyotypes and Ag-NOR banding of Pagrosomus major and Sparus macrocephalus. Journal of Ocean University of Qingdao, 1993, 35(3): 107-115 [ 喻子牛, 孔晓瑜, 谢宗墉, 等. 真鲷Pagrosomus major和黑鲷Sparus macrocephalus的核型及Ag-NOR带研究. 青岛海洋大学学报, 1993, 35(3): 107-115] |
Zhang MQ, Chen C, Li YL, et al. Effect of salinity on the hatching of the fertilized eggs of (Epinehelus moara ♀) (Epinehelus lanceolatus ♂) and the observation of the morphological development of larvae, juvenile and young fish. Progress in Fishery Sciences, 2016, 37(4): 81-89 [ 张梦淇, 陈超, 李炎璐, 等. 盐度对云纹石斑鱼(Epinehelus moara ♀) ×鞍带石斑鱼(Epinehelus lanceolatus ♂)受精卵孵化的影响及杂交仔稚幼鱼形态发育观察. 渔业科学进展, 2016, 37(4): 81-89] |
Zhang TT, Chen C, Shao YX, et al. Adaptation of juvenile Epinephelus moara fed diets with high energy and low nitrogen. Chinese Journal of Animal Nutrition, 2016, 28(9): 2977-2986 [ 张廷廷, 陈超, 邵彦翔, 等. 云纹石斑鱼幼鱼对高能低氮饲料的适应性. 动物营养学报, 2016, 28(9): 2977-2986 DOI:10.3969/j.issn.1006-267x.2016.09.038] |
Zheng L, Liu CW, Li CL. Studies on the karyotype of 4 groupers. Marine Sciences, 2005, 29(4): 51-55 [ 郑莲, 刘楚吾, 李长玲. 4种石斑鱼染色体核型研究. 海洋科学, 2005, 29(4): 51-55 DOI:10.3969/j.issn.1000-3096.2005.04.012] |
Zhong SP, Chen C, Wang J, et al. Chromosome karyotype of seven-band grouper Epinephelus septemfasciatus (Thunberg, 1793). Journal of Fishery Sciences of China, 2010, 17(1): 150-155 [ 钟声平, 陈超, 王军, 等. 七带石斑鱼染色体核型研究. 中国水产科学, 2010, 17(1): 150-155] |



