2. 上海海洋大学食品学院 上海 201306;
3. 农业农村部水产品质量安全风险评估实验室 青岛 266071
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306;
3. Laboratory of Quality & Safety Risk Assessment for Aquatic Products, Ministry of Agriculture and Rural Affairs, Qingdao 266071
甲砜霉素(Thiamphenicol, TAP)又称为甲砜氯霉素、硫霉素等,是氯霉素类第二代广谱抗菌药。其抗菌机理与抗菌谱、氯霉素基本相似,对革兰氏阳性菌和阴性菌均有较强的抑制作用,但毒性有所降低(Yoo et al, 2003; Park et al, 2004)。TAP作为氯霉素替代物,抗菌效果佳且物美价廉,常用于治疗细菌性烂鳃病、白皮病、白头白嘴病等水产养殖病害(陈玉露, 2009)。目前,国内外对甲砜霉素药物代谢动力学研究已有开展,畜禽动物主要集中在牛(Bovine)、羊(Caprinae)、猪(Sus scrofa domesticus)和鸡(Gallus domesticus)等动物中(Al-Nazawi, 2005; Gamez et al, 1992; Mestorino et al, 1993;Haritova et al, 2002; 唐海蓉等, 2013);在水产动物中,对松浦镜鲤(Songpu mirror carp)、鲫鱼(Carassius auratus)、鲈鱼(Lateolabrax japonicus)、红笛鲷(Lutjanus sanguineus)、凡纳滨对虾(Litopenaeus vannamei)、眼斑拟石首鱼(Sciaenops ocellatus)、罗非鱼(Oreochromis spp)等均有报道(杨洪波等, 2013a、b; Castells et al, 2000; 秦青英等, 2013; 陈玉露, 2009; 黄郁葱等, 2017; 冯敬宾等, 2005)。鲤鱼(Cyprinus carpio),别称鲤拐子、鲤子和红鱼等,是我国重要的经济鱼类。近年来,鲤鱼的高密度养殖在带来高经济效益的同时也引发多种鱼类病害问题,致使养殖户在养殖过程中存在过度使用或滥用甲砜霉素和其他抗生素药物现象(蔡林宏, 2016),对环境污染和人类健康都有很大影响。因此,进行有关TAP在鲤鱼体内的药物代谢动力学研究十分有必要。然而,目前有关TAP在鲤鱼体内的药代动力学研究尚未见报道,仅杨洪波等(2013a)对鲤鱼的杂交亚种松浦镜鲤进行了口灌TAP的代谢动力学研究。不同于其他研究学者对水产动物的口灌和肌注给药方法,本实验采用投喂药饵方法模拟实际养殖中的用药过程。实验在(26±2)℃的养殖水温下,以30 mg/(kg·bw)的投喂剂量对鲤鱼进行单次投喂药饵给药,研究了TAP在鲤鱼体内的组织分布和药物代谢随时间的变化规律,以期为水生动物疾病防治和药物休药期制定提供理论参考。
1 材料与方法 1.1 材料 1.1.1 药品与试剂TAP标准品的纯度为99.0% (Dr. Ehrenstorfer GmbH公司, 德国);TAP原料药纯度98.0%(Macklin公司),氘代氯霉素(d5-氯霉素)纯度为99.0%(Dr. Ehrenstorfer GmbH公司, 德国)。乙酸乙酯(色谱纯, CNW公司);氨水(优级纯,国药集团化学试剂有限公司);正己烷(色谱纯,CNW公司);甲醇(色谱纯, Merck公司);无水硫酸钠(分析纯, 天津博迪化工股份有限公司);水为超纯水。
1.1.2 仪器设备TSQ Endura液相色谱-串联质谱仪(Thermo Fisher),CR 22G冷冻离心机(日立),小型高速离心机(1-14, Sigma),GHG-9203J干燥箱(上海三发科学仪器有限公司),HR2014均质机(珠海经济特区飞利浦家庭电器有限公司),KQ-600DE超声波清洗器(昆山市超声仪器有限公司),涡旋混合器(TAlBOYS),N-EVAP氮吹仪(24孔,Organomation公司),Gradient A10Mill-Q超纯水器(Millipore)。
1.1.3 实验动物健康鲤鱼150条,平均规格为(1000±50) g,由赣榆佳信水产开发有限公司提供。
1.2 实验方法 1.2.1 实验设计本实验2016年8月1日~9月7日于江苏省连云港市赣榆佳信水产开发有限公司进行。实验以体重为(1000±50) g的健康鲤鱼为对象,实验前经检测无TAP残留,暂养在内设淡水循环设备的水池中,池长7 m、宽5 m、水深1.5 m,养殖密度为150尾/池。实验期间的水温保持在(26±2)℃,每天换水1次,持续充氧。以30 mg/(kg·bw)的剂量对鲤鱼进行单次投喂药饵。正式投喂前1 d禁食并采集鲤鱼肌肉、肝脏、肾脏、脾脏、血浆和鳃的空白组织样品。药饵停喂后分别在1、2、4、6、8、12、16、20、24、36、48、96、144、192、240、288、384、480、576、672和768 h采样。每个时间点各采集鲤鱼6尾作为1组平行样,取鲤鱼尾静脉血5 ml,放置预先涂抹肝素钠的玻璃离心管中,4500 r/min离心8 min,取上层血浆,保存于4℃冷藏箱中,取血后快速取鲤鱼躯体两侧背鳍处的肌肉、肾脏、肝脏、鱼皮、鳃和脾脏放入样品袋中,保存于-20℃的冰箱中。
1.2.2 标准储备液制备称取10.0 mg甲砜霉素标准品,用甲醇溶液溶解并定容至100 ml的棕色容量瓶中,浓度为100 μg/ml,-20℃冰箱中避光冷冻保存,有效期1年。
1.2.3 氘代内标标准储备液制备称取10.0 mg内标物d5-氯霉素,用甲醇溶液溶解并定容至100 ml的棕色容量瓶中,浓度为100 μg/ml,-20℃冰箱中避光冷冻保存,有效期1年。
1.2.4 标准工作曲线制备移取1.2.2中的标准储备液,用流动相稀释成10 ng/ml、100 ng/ml和1 μg/ml标准液,待用。在6个进样瓶中分别加入适量工作液,并分别加1.0 μg/ml氘代内标工作液50 μl,用流动相定容至1.0 ml,配制成流动相空白溶液、2、5、10、20、50和100 ng/ml的标准液。系列标准液用液相色谱-串联质谱检测,以外标标准物质浓度作为横坐标(X),以外、内标物的峰面积(响应值)比值作为纵坐标(Y),得出标准曲线,并计算回归方程和相关系数。
1.3 样品处理 1.3.1 样品制备和提取将血浆和各组织样品放置室温解冻,用均质机将各组织部位均质,待用。称取各组织样品[(1.0±0.1) g]和血浆[(1.0±0.1) ml]于15 ml聚丙烯离心管中,加入1.2.3中氘代内标工作液50 μl,再加入5 ml乙酸乙酯,1 g无水硫酸钠,100 μl氨水,涡旋提取5 min,超声提取5 min,以4500 r/min离心5 min,上清液转移至15 ml比色管中。残渣中再分别加入3 ml的乙酸乙酯,重复上述操作,合并上清液至15 ml的比色管中,在温度为40℃下氮吹至干。
1.3.2 净化将比色管中的残渣用3 ml的超纯水溶解,超声5 min,加入3 ml正己烷,涡旋混合1 min,静置分层,弃掉上层的正己烷,再加入3 ml的正己烷,涡旋混合30 s,静置分层。最后移取1 ml的水相于1.5 ml的聚丙烯离心管中,以12000 r/min离心10 min,取上清液过0.22 μm水相滤膜,供液相色谱-串联质谱测定。
1.4 仪器条件 1.4.1 色谱条件色谱柱:MGⅡ C18(2.0 mm × 100 mm, 3 μm);流动相:流动相A为甲醇,流动相B为超纯水;流速:200 μl/min,柱温:40℃,进样量:10 μl;梯度洗脱条件见表 1。
|
|
表 1 流动相梯度洗脱条件 Table 1 Gradient elution conditions of mobile phase |
离子源:电喷雾离子源(ESI);扫描方式:负离子模式;电喷雾电压:2500 V;鞘气压力:40 Arb;辅助气压力:25 Arb;碰撞气压:2 mTorr;离子传输毛细管温度:340℃;检测方式:选择反应监测(SRM);选择反应监测母离子、子离子和碰撞能见表 2。
|
|
表 2 SRM监测模式下目标物质谱参数 Table 2 Spectral parameters of target material under SRM monitoring model |
实验用各组织空白样进行加标回收,在空白样中加入TAP标准液,使其药物浓度为20.0、50.0和100.0 μg/kg的3个添加水平,每个水平5个平行,连续3 d,计算回收率、日内和日间精密度。
1.6 数据分析数据采用Excel 2007和DAS 2.0数据分析软件对TAP在鲤鱼体内各组织药物浓度进行药-时数据处理。
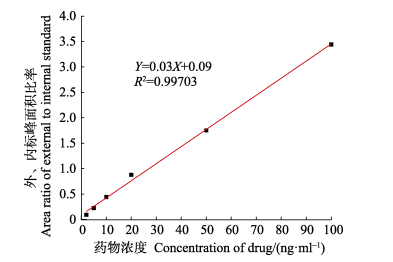
2 结果 2.1 标准曲线和最低检测限采用内标法定量,以TAP浓度(X)为横坐标,以TAP标准物和氘代内标物峰面积的比值(Y)为纵坐标作图,如图 1所示。TAP标准液在2.0~100.0 ng/ml浓度范围内线性关系良好,相关系数(R2)为0.99703,线性回归方程为Y=0.03X+0.09,该法最低检测限为0.3 μg/kg (信噪比S/N=3)。结果表明,该方法灵敏度高,能够满足实验要求。
|
图 1 TAP标准品标准曲线 Figure 1 Standard curve of TAP standard |
取鲤鱼的肌肉、鱼皮、肾脏、肝脏、鳃、脾脏和血浆为测回收率与精密度的组织,每份称取(1.00±0.05) g/ml,加入TAP标准液,使其药物浓度为20.0、50.0和100.0 μg/kg,每个水平5个平行,连续进行3 d,结果见表 3。
|
|
表 3 回收率与精密度 Table 3 Recovery and precision |
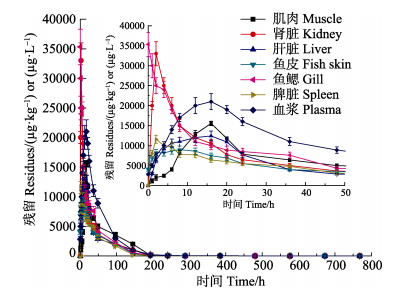
本实验在(26±2)℃的养殖水温下,以30 mg/(kg·bw)的剂量对鲤鱼进行模拟投饵给药,研究TAP在鲤鱼体内的药代动力学。采用高效液相色谱-串联质谱法分析TAP在鲤鱼体内各组织的残留量随时间变化的药-时曲线,见图 2(内嵌0~50 h药时曲线图)。如图 2显示,鲤鱼肾脏和鳃中的TAP残留达峰浓度分别为35300.1和33009.5 μg/kg,且明显高于其他组织;脾脏和肾脏中药物达峰时间一致,均在给药后2 h达到峰值,后随着时间变化逐渐降低;肌肉、肝脏和血浆的药物达峰时间较接近,在给药后16 h达到峰值,随后TAP浓度持续下降;鱼鳃中药物浓度给药后即达到峰值,分析可能是由于鳃是鲤鱼主要呼吸器官,血液灌流量较大,且鳃丝表面布满微细血管,部分溶解于水中的药物极易在短时间内通过微血管进入鳃中,双重效果下出现鳃中的即时药物浓度达最大值。
|
图 2 TAP药-时曲线 Figure 2 TAP drug-time curve |
TAP在鲤鱼各组织中的药-时残留数据通过DAS 2.0软件分析及房室模型嵌和计算得出符合动力学最佳模型:一级吸收二室模型,TAP在鲤鱼各组织的残留浓度随时间变化的主要药代动力学参数见表 4。
|
|
表 4 TAP在鲤鱼体内药动学参数 Table 4 Pharmacokinetic parameters of TAP in carp |
在(26±2)℃的养殖水温下,对鲤鱼进行模拟投饵给药30 mg/(kg·bw)的剂量,体内各组织药-时数据经DAS 2.0软件和Excel软件拟合,符合一级吸收二室模型。此结果与红笛鲷、鲫鱼、凡纳滨对虾、大菱鲆(Scophthalmus maximus)、中华绒螯蟹(Eriocheir sinensis)和日本鳗鲡(Anguilla japonica Temminck et Schlegel)(秦青英等, 2013; 杨洪波等, 2013a、b; 陈玲珍等, 2010; 林茂等, 2011; 梁俊平等, 2015)等动物的房室模型基本一致,但与肉鸡、家兔(Oryctolagus cuniculus f. domesticus)、牛和羊(郭桂芳等, 2010; 邢晓玲等, 2009; Mengozzi et al, 2002; Abdennebi et al, 1994)等动物的研究结果存在差异,这可能和研究动物的种属、给药方式、给药剂量和实验环境的差异有关。
3.2 吸收和分布特征本实验数据采用经典房室模型和统计矩原理分析TAP在鲤鱼体内各组织的药时动态变化规律。达峰时间Tpeak和达峰浓度Cmax是衡量药物吸收速度和程度的重要参数。本实验中,TAP在鲤鱼的肌肉、肾脏、肝脏、鱼皮、鳃、脾脏和血浆的达峰时间Tpeak分别为16、2、16、8、0、2和16 h,达峰浓度Cmax分别为15.6、35.3、12.4、9.0、33.0、11.6 mg/kg和21.0 mg/L。实验结果表明,TAP进入鲤鱼体内后迅速在各组织扩散并在短时间内达到峰值;鱼鳃的Tpeak最短,为零,但不符合实际,分析可能是由于鳃是鲤鱼主要呼吸器官且表面布满微细血管,因此,部分溶解于水中的药物在短时间内极易通过微血管进入鳃中;肾脏中TAP含量达峰时间短且峰值明显高于其他组织,TAP在血管丰富、渗透性好的组织中吸收量较大(Wu et al, 2006),因此,推测TAP在组织中分布速率与残留浓度和血流量有关。
药-时曲线下面积(AUC)是反应药物进入循环系统药量的多少,是衡量药物在实验动物体内各组织器官吸收的重要指标。结果显示,TAP在鲤鱼体内肌肉、肾脏、肝脏、鱼皮、鳃、脾脏和血浆的AUC分别为1084.5、1578.1、777.3、541.1、0.1、478.1 mg/(kg·h)和485.1 mg/(L·h)。结果表明,TAP在肾脏中的吸收量明显高于在肌肉、肝脏、鱼皮、鳃和脾脏中的吸收量。此结果与杨洪波(2013a)以30 mg/(kg·bw)的剂量单次口灌松浦镜鲤的药代动力学研究结果一致。
3.3 消除特征结果表明,停药后前期TAP在鲤鱼各组织的下降速度较快,后期的消除速率较为缓慢。消除半衰期(t1/2β)是衡量药物在研究对象体内消除速率的一个重要动力学参数。TAP在不同研究对象中的消除半衰期差异较大。本研究TAP在鲤鱼体内肌肉、肾脏、肝脏、鱼皮、鳃、脾脏和血浆各组织的t1/2β分别为11.4、100.2、54.2、41.1、69.5、38.0和71.9 h。结果表明,TAP在肾脏中的消除半衰期较长,推测TAP可能是通过血液吸收分布在各组织中,再经肾脏代谢排出。另外,消除相速率常数β宏观体现从中央室向外消除的浓度变化速率。TAP各组织在鲤鱼体内各组织消除速率常数大小为β肾脏0.061>β脾脏0.018>β鱼皮 0.017>β肝脏0.013>β血浆0.01>β肌肉0.007>β鳃0,本实验符合Ingebrigtsen(1991)的研究结果。Ingebrigtsen(1991)在研究影响鱼药药效中提出药物在鱼肾脏的消除相速率常数高于其他组织,这可能与肾脏血液灌流量较大有关(Ingebrigtsen et al, 1991; Kowalski, 2007)。
综上所述,TAP在鲤鱼体内吸收迅速且分布广泛,不同组织间的差异较大。按照农业部《动物性食品中兽药最高残留限量》文件规定TAP在水产动物中最高残留限量(MRL)不得高于50 μg/kg。休药期通常以代谢较为缓慢的组织作为残留靶组织,以此来确定休药期。本研究中肌肉、肾脏、肝脏、鱼皮、鳃、脾脏和血浆的TAP残留量低于MRL的时间分别从16、16、12、12、12、10和12 d开始,因此,建议以鲤鱼肌肉和肾脏作为靶组织确定休药期。在(26±2)℃养殖水温下,以30 mg/(kg·bw)剂量对鲤鱼进行单次投喂TAP药饵时,建议休药期不低于16 d。
A1-Nazawi MH. Pharmacokinetics and tolerance of thiamphenicol in camels and sheep. International Journal of Pharmacology, 2005, 1(1): 25-28 DOI:10.3923/ijp.2005.25.28 |
Abdennebi EH, Khales N, Sawchuk RJ, et al. Thiamphenicol pharmacokinetics in sheep. Journal of Veterinary Pharmacology and Therapeutics, 1994, 17(1): 12-16 |
Cai LH. Carp breeding industry is in decline? Might just need a change. Ocean and Fishery, 2016(8): 13 [ 蔡林宏. 鲤鱼养殖产业正在衰退?需要的也许仅仅是一种转变. 海洋与渔业·水产前沿, 2016(8): 13 DOI:10.3969/j.issn.1672-4046.2016.08.011] |
Castells G, Intorre L, Bertini S, et al. Oral single-dose pharmacokinetics of thiamphenicol in the sea-bass (Dieentrarchus labrax). Journal of Veterinary Pharmacology and Therapeutics, 2000, 23(1): 53-54 DOI:10.1046/j.1365-2885.2000.00246.x |
Chen LZ, Yang HS, Wu GH, et al. Pharmacokinetics of florfenicol in the Chinese mitten-handed crab (Eriocheir sinensis): Dose effect. Chinese Journal of Zoology, 2010, 45(4): 102-109 [ 陈玲珍, 杨洪生, 吴光红, 等. 给药剂量对氟苯尼考在中华绒螯蟹体内的药代动力学影响. 动物学杂志, 2010, 45(4): 102-109] |
Chen YL. Studies on pharmacokinetics and impact to drug metabolic enzyme of thiamphenicol and florfenicol in Litopenaeus vannamei. Masterxs Thesis of Sichuan Agricultural University, 2009 [陈玉露.甲砜霉素和氟甲砜霉素在凡纳滨对虾体内的药代动力学和对药酶影响的研究.四川农业大学硕士研究生学位论文, 2009] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1580982
|
Feng JB, Jia XP, Li LD, et al. High-performance liquid chromatographic determination of florfenicol in tilapia. South China Fisheries Science, 2005, 1(1): 35-42 [ 冯敬宾, 贾晓平, 李刘冬, 等. 罗非鱼体内氟甲砜霉素的高效液相色谱测定方法研究. 南方水产, 2005, 1(1): 35-42 DOI:10.3969/j.issn.2095-0780.2005.01.006] |
Gamez A, Perez Y, Marti G, et al. Pharmacokinetics of thiamphenicol in veal calves. British Veterinary Journal, 1992, 148(6): 535-539 DOI:10.1016/0007-1935(92)90009-P |
Guo GF, Yang DW, Li YJ, et al. Pharmacokinetics of thiamphenicol in experimentally infected chickens with Pasteurella multocida. Chinese Journal of Veterinary Science, 2010, 30(6): 815-817 [ 郭桂芳, 杨大伟, 李勇军, 等. 甲砜霉素在感染多杀性巴氏杆菌鸡体内的药物动力学. 中国兽医学报, 2010, 30(6): 815-817] |
Haritova A, Lashev L, Pashov D. Phamlacokinetics of thiamphenicol in pigs. Journal of Veterinary Pharmacology and Therapeutics, 2002, 25(6): 464-466 DOI:10.1046/j.1365-2885.2002.00439.x |
Huang YC, Tang JF, Qing QY, et al. Pharmacokinetics of thiamphenicol in Sciaenops ocellatus. Journal of Zhanjiang Ocean University, 2017, 37(1): 52-57 [ 黄郁葱, 汤菊芬, 秦青英, 等. 甲砜霉素在眼斑拟石首鱼体内的药代动力学研究. 广东海洋大学学报, 2017, 37(1): 52-57 DOI:10.3969/j.issn.1673-9159.2017.01.009] |
Ingebrigtsen K. Factors affecting drug disposition in fish. Acta Veterinaria Scandinavica Supplementum, 1991, 87: 44-56 |
Kowalski P. Capillary electrophoretic determination of thiamphenicol in turkeys serum and its phamacokinetic application. Journal of Pharmaceutical & Biomedical Analysis, 2007, 43(1): 222-227 |
Liang JP, Duan YF, Li J, et al. Pharmacokinetics of difloxacin in turbot (Scophthalmus maximus) following intravenous and oral administration. Progress in Fishery Sciences, 2015, 36(3): 131-136 [ 梁俊平, 段亚飞, 李健, 等. 二氟沙星在大菱鲆(Scophthalmus maximus)体内的药代动力学特征. 渔业科学进展, 2015, 36(3): 131-136] |
Lin M, Ji RX, Chen ZQ, et al. Pharmacokinetics of florfenicol in A. japonica and A. anguilla. Journal of Anhui Agricultural Sciences, 2011, 39(36): 22341-22343, 22517 [ 林茂, 纪荣兴, 陈政强, 等. 氟苯尼考在日本鳗鲡和欧洲鳗鲡体内的药代动力学. 安徽农业科学, 2011, 39(36): 22341-22343, 22517 DOI:10.3969/j.issn.0517-6611.2011.36.057] |
Mengozzi G, Intorre L, Bertini S, et al. A comparative kinetic study of thiamphenicol in preruminant lambs and calves. Research in Veterinary Science, 2002, 73(3): 291-295 DOI:10.1016/S0034-5288(02)00110-8 |
Mestorino N, Landoni MF, Ah M, et al. The pharmacokinetics of thiamphenieol in lactating cows. Veterinary Research Communications, 1993, 17(4): 295-303 DOI:10.1007/BF01839220 |
Park IS, Kim DK, Adanyi N, et al. Development of a direct-binding chloramphenicol sensor based on thiol or sulfide mediated self-assembled antibody monolayers. Biosensors and Bioelectronics, 2004(19): 667-674 |
Qin QY, Tang JF, Huang YC, et al. The distribution and pharmacokinetics of thiamphenicol in tissues of Luthjanus sanguineus. Chinese Journal of Veterinary Drug, 2013, 47(11): 31-36 [ 秦青英, 汤菊芬, 黄郁葱, 等. 甲砜霉素在红笛鲷体内的组织分布和药代动力学研究. 中国兽药杂志, 2013, 47(11): 31-36] |
Tang HR, Chen SJ, Liu XY, et al. Poisoning effect of thiamphenicol on testis morphology in broilers. Hubei Agricultural Sciences, 2013, 52(8): 1880-1882 [ 唐海蓉, 陈仕均, 刘兴友, 等. 甲砜霉素对肉鸡睾丸组织结构的影响. 湖北农业科学, 2013, 52(8): 1880-1882 DOI:10.3969/j.issn.0439-8114.2013.08.036] |
Wu YB, Wang ZS, Liao XT, et al. Effects of enroflixacin on microanisms in wet lands. Acta Ecologica Sinica, 2006, 26(8): 2640-2645 |
Xing XL, Wang DD, Yuan XQ, et al. The pharmacokinetic comparison between thiamphenicol and HP-β-CD thiamphenicol in rabbit. Hunan Agricultural Sciences, 2009, 12: 5 [ 邢晓玲, 王妲妲, 袁小秋, 等. 甲砜霉素及HP-β-CD甲砜霉素在家兔体内的药代动力学比较研究. 湖南农业科学, 2009, 12: 5] |
Yang HB, Wang D, Lu TY, et al. Pharmacokinetics of thiamphenicol in Songpu common carp Cyprinus carpio. Journal of Dalian Fisheries University, 2013a, 28(3): 298-302 [ 杨洪波, 王荻, 卢彤岩, 等. 甲砜霉素在松浦镜鲤体内的药物代谢动力学研究. 大连海洋大学学报, 2013a, 28(3): 298-302] |
Yang HB, Wang D, Lu TY, et al. Pharmacokinetics of thiamphenicol in Carassius auratus. Freshwater Fisheries, 2013b, 43(3): 72-76 [ 杨洪波, 王荻, 卢彤岩, 等. 甲砜霉素在鲫体内的药物代谢动力学研究. 淡水渔业, 2013b, 43(3): 72-76] |
Yang XL, Zhen J, Hu K. The comparative pharmacokinetics of chloramphenicol in Oreochromis niloticus. Journal of Fisheries of China, 2005, 29(1): 60-65 [ 杨先乐, 湛嘉, 胡鲲. 氯霉素在尼罗罗非鱼血浆中的药代动力学研究. 水产学报, 2005, 29(1): 60-65] |
Yoo MH, Huh MD, Kim E, et al. Characterization of chloramphenicol acetyltransferase gene by multiplex polymerase chain reaction in multiplex polymerase chain reaction in multidrug-resistant strains isolated from aquatic environments. Aquaculture, 2003, 217(1): 11-21 |



