丝氨酸羟甲基转移酶(Serine hydroxyl methyl- transferase, SHMT)(Schirch et al, 2005)广泛存在于真核生物和原核生物中,在高等植物的一碳化合物代谢和光呼吸过程发挥着重要作用,其主要功能是为蛋白质和嘌呤的生物合成提供甘氨酸,并生成N5, N10-亚甲基四氢叶酸(McClung et al, 2000)。四氢叶酸是植物体内参与C1转移反应的重要辅酶,并且在植物的甲基循环过程中发挥重要作用(Bekaert et al, 2008)。生成的亚甲基四氢叶酸参与了DNA和RNA的合成,并在亚甲基四氢叶酸还原酶的作用下,再经过一系列的转化,最终生成S-腺苷甲硫氨酸(S-adenosyl-methionine, SAM),从而直接参与DNA的甲基化过程(Du et al, 2017)。植物在缺少SHMT时,会发生严重的生长延迟。同时,已有的研究也表明,SHMT在植物抵抗非生物胁迫时也发挥着重要的作用。例如,谷胱甘肽是清除活性氧的重要抗氧化剂,而谷胱甘肽的合成主要依赖于甘氨酸(Graham et al, 1997; 李朝霞等, 2003)。Graham等(1997)对杨树在逆境胁迫下谷胱甘肽合成的研究中发现,SHMT基因参与了光呼吸过程并产生甘氨酸。李朝霞等(2003)认为,在逆境胁迫条件下,光呼吸不仅可以促进卡尔文循环参与抗逆反应,而且可以参与甘氨酸的合成进而合成谷胱甘肽清除活性氧。此外,对拟南芥SHMT突变体的研究表明,抑制SHMT基因的表达,植株抵抗非生物胁迫的能力显著下降,更易受到胁迫的侵害(Moreno et al, 2005)。由此可见,SHMT基因在植物的逆境胁迫应答中发挥着重要的作用。因此,研究逆境胁迫条件下植物体中SHMT基因的表达变化并应用于转基因实验中,是抗逆植物基因工程研究的一个重要方向。
坛紫菜(Pyropia haitanensis)是我国南方沿海广泛栽培的大型经济海藻之一,其产量占全国紫菜产量的70%以上(李晓川, 2011)。坛紫菜生活在潮间带的中高潮区,退潮时,坛紫菜叶状体会直接暴露于空气当中,遭遇高温、失水和高光强等环境因子的逆境胁迫。由于生存环境特殊,使得坛紫菜具备了独特的抵抗逆境胁迫的能力(Blouin et al, 2011)。此外,近年来受到全球气候变暖的影响,海水水温过高严重影响坛紫菜栽培的产量和经济效益(Xu Y et al, 2014; 李兵等, 2013; 张元等, 2011)。因此,研究坛紫菜的抗高温机制,克隆抗高温相关基因,对于后期海藻乃至经济作物抗逆基因工程的研究具有十分重要的理论价值和实际意义。目前,尚无在大型海藻中克隆获得SHMT相关基因的报导,研究SHMT基因在抵抗高温等逆境胁迫时如何发挥作用,对于研究大型海藻在抵抗逆境胁迫时的一碳化合物代谢和光呼吸变化十分必要。本研究克隆获得了2条坛紫菜SHMT基因的全长,并通过实时荧光定量PCR(Real-time fluorescence quantitative PCR, qRT-PCR)技术分析SHMT基因在高温胁迫下的表达水平变化,不仅丰富了坛紫菜的基因库,而且可为坛紫菜抗逆机制研究提供理论参考。
1 材料与方法 1.1 坛紫菜样品及胁迫处理本实验中所采用的实验材料取自福建省坛紫菜种质资源库,Z-61品系是经人工诱变和杂交选育出的坛紫菜耐高温纯系(陈昌生等, 2008)。正常条件下培养的坛紫菜Z-61叶状体用于总RNA的提取,反转录成cDNA后进行相关基因的全长克隆。提取各高温胁迫下培养的Z-61叶状体总RNA,用于基因表达水平的qRT-PCR分析。
坛紫菜Z-61叶状体的正常培养条件:培养温度(21.0±0.5)℃,光照强度50~60 μmol/(m2·s),光照周期12L:12D,每48 h更换一次新鲜的叶状体培养液。叶状体叶片长度培养至(16±2) cm时,选取叶面平滑、无卷曲且生长状况良好的藻体作为实验材料。
坛紫菜Z-61叶状体的高温胁迫培养条件:取(16± 2) cm的健康藻体,分别于(31.0±0.5)℃的恒温光照培养箱中进行高温胁迫处理(其余培养条件同适宜条件),胁迫处理时间为0、3、6、12、24、48、96、144 h。
1.2 引物及其序列基因序列的PCR扩增、阳性克隆筛选和不同胁迫处理下基因表达水平分析所用的引物序列均由厦门铂尚生物有限公司合成(表 1)。
|
|
表 1 实验中所用引物 Table 1 Primers used in the experiment |
用滤纸吸干坛紫菜表面水分后,称取0.1 g藻体用于总RNA提取。总RNA提取采用E.Z.N.A植物RNA提取试剂盒(OMEGA, 德国)。所提取的总RNA的完整性通过凝胶电泳进行检查,并通过Cary50紫外分光光度计(Varian, 美国)分别测定OD260 nm和OD280 nm值。根据测定结果判断核酸和蛋白质的污染情况,并计算所提取的RNA浓度。
1.4 PhSHMT基因的全长克隆根据坛紫菜转录组数据库(GenBank登录号:GFOM00000000)unigene的注释结果,筛选出2条注释结果为皱波角叉菜(Chondrus crispus)SHMT基因的unigene(Cluster-3452.15441,Cluster-3452.16340)序列,进行PhSHMT基因的克隆。通过Blast序列比对分析,发现Unigene15441已包含所编码基因5'端起始密码子和3'端终止密码子,因此,根据Unigene15441的序列设计普通PCR引物进行序列扩增验证(表 1);而对Unigene16340进行Blast比对,同样也已包含了5'端起始密码子和3'端终止密码子,因此,同样根据Unigene16340序列设计普通PCR引物进行序列扩增验证(表 1)。采用普通PCR方法对坛紫菜SHMT基因进行克隆。扩增产物经琼脂糖凝胶电泳后使用通用型DNA纯化回收试剂盒(TIANGEN)对目的片段进行回收,与pMD19-T载体(TaKaRa)连接后导入感受态细胞E.coli DH5α中,筛选出阳性克隆后进行放大培养,采用质粒小提试剂盒(TIANGEN)提取质粒后寄送厦门铂尚生物工程有限公司测序。根据测序结果,获得2个PhSHMT基因全长序列。
1.5 PhSHMT基因的生物信息学分析基因序列同源性检测:利用NCBI的Blastn (http://blast.ncbi.nlm.nih.gov/Blast.cgi)程序对所获得的PhSHMT全长基因序列进行检测。
开放阅读框(Open Reading Frame, ORF)分析:采用ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)软件分析PhSHMT基因的开放阅读框以及其所编码氨基酸序列。
蛋白质序列一级结构分析:使用在线软件ExPASy ProtParam(http://web.expasy.org/protparam/)分析PhSHMT基因所编码蛋白质的一级结构。
蛋白质序列二级结构分析:使用在线软件PredictProtein(https://www.predictprotein.org/)分析PhSHMT基因所编码蛋白质的二级结构。
蛋白质跨膜结构分析:通过在线软件TMHMM Serverv.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析PhSHMT基因所编码蛋白质是否存在跨膜结构域。
亚细胞定位预测:通过在线软件WoLFPSORT (http://www.wolfpsort.org/)对PhSHMT基因进行亚细胞定位预测。
采用ClustalX进行氨基酸多重序列比对,并采用MEGA 6.06软件最大似然法(Maximum Likelihood, ML)构建PhSHMT蛋白系统进化树。
1.6 PhSHMT基因表达水平的qRT-PCR分析根据已获得的PhSHMT基因序列设计荧光定量PCR引物(表 1),并以PhUBC作为内参基因,分别进行PhSHMT在不同高温胁迫条件下基因表达水平的qRT-PCR分析。
提取的各样品总RNA按PrimeScript RtreagentKit (TaKaRa, 大连)的流程将RNA反转录成cDNA定量模板。qRT-PCR扩增以10×梯度稀释的cDNA为模板进行,用于制作PhSHMT1、PhSHMT2和内参基因的标准曲线。每个反应设3个平行复孔。通过SPSS 19.0和Excel软件对实验最终定量数据进行统计分析,并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异(P<0.05表示差异显著,P<0.01表示极显著差异)。
qRT-PCR扩增的20 μl反应体系:10 μl 2×SYBR Premix ExTaqTMⅡ(TaKaRa),6.8 μl ddH2O,0.4 μl Rox Reference DyeⅠ,0.4 μl正反向引物和2 μl反转录产物。扩增程序:95℃变性30 s;95℃ 5 s,60℃ 31 s,40个循环。循环结束后从55℃缓慢升温至95℃,绘制熔解曲线。qRT-PCR扩增在7300型定量PCR仪(ABI, 美国)上进行。
2 结果与分析 2.1 PhSHMT基因的全长克隆及序列分析以坛紫菜Cluster-3452.15441为核心序列,通过普通PCR扩增和测序获得一条1710 bp的基因序列(图 1)。经过Blast比对,确定该基因为坛紫菜的PhSHMT基因,命名为PhSHMT-1。该基因已提交到GenBank数据库中,收录号为MF687405。通过ORF Finder在线软件分析发现,该基因107~1598个碱基为完整的开放阅读框。使用ExPASy ProtParam程序进行一级结构分析发现,PhSHMT-1编码的蛋白质包含497个氨基酸,分子式为C4235H6978N1494O1762S450,分子量为121.443 kDa,理论等电点为4.93,不稳定系数为48.77,脂肪系数为17.60,总平均疏水度为0.807。通过Predict Protein程序预测PhSHMT-1的二级结构中构成螺旋(H)、片层(E)和环状(L)的氨基酸残基占总氨基酸比例分别为43.46%、12.68%和34.00%。TMHMM软件检测发现该蛋白无跨膜结构域,亚细胞定位软件WoLFPSORT预测PhSHMT-1定位于线粒体中。
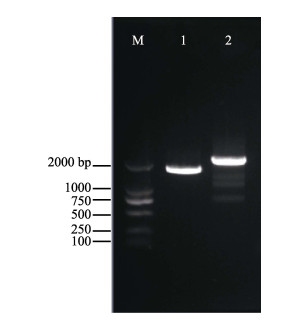
|
图 1 PhSHMT基因克隆产物电泳 Figure 1 Agarose electrophoresis of PCR products of PhSHMT genes 1: PhSHMT-1普通PCR扩增产物; 2: PhSHMT-2普通PCR扩增产物; M: DL2000 DNA marker 1: PCR products of PhSHMT-1; 2: PCR products of PhSHMT-2; M: DL2000 DNA marker |
以坛紫菜Cluster-3452.16340为核心序列,通过普通PCR扩增和测序获得一条1957 bp的基因序列(图 1)。经过blast比对,确定该基因为坛紫菜的PhSHMT基因,命名为PhSHMT-2。该基因已提交到GenBank数据库中,收录号为MF687406。通过ORF Finder在线软件分析发现,该基因269~1664个碱基为完整的ORF。使用ExPASy ProtParam程序进行一级结构分析发现,PhSHMT-2基因编码的蛋白质包含465个氨基酸,分子式为C3992H6588N1398O1670S408,分子量为113.969 kDa,理论等电点为4.95,不稳定系数为51.09,脂肪系数为17.60,总平均疏水度为0.775。通过Predict Protein程序预测PhSHMT-2的二级结构中构成螺旋(H)、片层(E)和环状(L)的氨基酸残基占总氨基酸比例分别为43.23%%、16.34%%和29.46%%。TMHMM软件检测发现,该蛋白无跨膜结构域,亚细胞定位软件WoLFPSORT预测PhSHMT-2定位于细胞质中。
多序列比对结果表明,PhSHMT-1和PhSHMT-2间同源性较高,且都具有SHMT家族特有的保守结构域,在PhSHMT-1和PhSHMT-2序列中均发现了磷酸吡哆醛的结合位点(图 2),说明SHMT是以磷酸吡哆醛作为辅酶进行反应的。

|
图 2 PhSHMT蛋白氨基酸序列的多重序列比对 Figure 2 Multi-alignment of amino acid sequence of PhSHMT 下划线部分为SHMT基因家族特有的保守结构域,阴影标记为磷酸吡哆醛的结合位点,“*”和“:”分别表示一致性和相似性的氨基酸残基 The underlined sections were the conserved amino acids motif of SHMT gene family. The gray background were marked as the pyridoxal phosphate binding site. Asterisks (*) and colons (:) indicated identical and similar amino acid residues, respectively |
为进一步分析PhSHMT与其他物种的亲缘关系,从NCBI的GenBank数据库中选取10条SHMT相关氨基酸序列,通过MEGA 6.06程序采用最大似然法(Maximum likelihood, ML)构建系统进化树。结果显示,PhSHMT-1基因与一种红藻(Cyanidioschyzon merolae strain)和邹波角叉菜(Chondrus crispus)聚为一类,而PhSHMT-2与三角褐指藻(Phaeodactylum tricornutum)、一种温泉红藻(Galdieria sulphuraria)和假微型海链藻(Thalassiosira pseudonana)聚为一类,且藻类的SHMT基因与高等植物遗传距离较大(图 3),说明藻类中SHMT基因与高等植物亲缘关系较远。

|
图 3 SHMT基因的蛋白系统进化树 Figure 3 Phylogenetic tree of SHMT protein constructed by the maximum likelihood method |
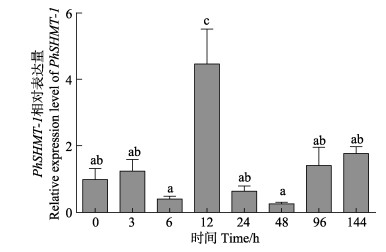
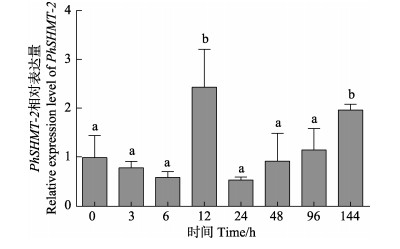
为研究PhSHMT基因在坛紫菜响应逆境胁迫中所发挥的功能,本研究对PhSHMT基因表达水平进行了定量检测。通过qRT-PCR技术对2条PhSHMT基因在高温胁迫下的表达特征进行了相对定量分析(图 4、图 5)。
|
图 4 PhSHMT-1在高温胁迫水平下的相对表达 Figure 4 Relative expression levels of PhSHMT-1 gene under high temperature stress 具有不同字母上标的数据间差异显著(P < 0.05),下同 Bar of each column with different small letters mean significant difference (P < 0.05). The same as below |
|
图 5 PhSHMT-2在高温胁迫下的相对表达 Figure 5 Relative expression levels of PhSHMT-2 gene under high temperature stress |
结果表明,在31℃高温胁迫不同时间下,PhSHMT-1和PhSHMT-2基因的表达模式基本一致:在高温胁迫12 h时,PhSHMT-1和PhSHMT-2基因的表达水平受到高温刺激,表达水平显著上调(P < 0.05);当高温胁迫超过12 h后,PhSHMT-1和PhSHMT-2基因可能已适应高温过程,表达水平恢复到正常值;当高温胁迫超过4 d时,PhSHMT-1和PhSHMT-2基因的表达水平又显著上调(P < 0.05),这可能是由于过久的高温胁迫,藻体需要更多的谷胱甘肽以清除活性氧,而藻体中的甘氨酸通过合成谷胱甘肽导致含量下降,需要重新合成更多的甘氨酸。
3 讨论甘氨酸作为一种植物抗逆调节剂,通过合成谷胱甘肽来清除活性氧(Yan et al, 2013)。植物可以通过光呼吸过程将丝氨酸转化为甘氨酸(马莉等, 2008),而SHMT在植物光呼吸过程中发挥着重要作用。研究表明,如果将SHMT基因敲除,植株的抗逆能力明显降低,更容易受到活性氧的毒害(Moreno et al, 2005)。不仅如此,SHMT在光呼吸过程产生的四氢叶酸可以进一步生成SAM,其可以调控CpG岛胞嘧啶DNA的甲基化(Kim, 2005)。然而,目前对于大型海藻中SHMT基因的研究尚处于空白。本研究以转录组测序获得的SHMT基因序列为基础,通过普通PCR扩增技术成功克隆了2条坛紫菜的SHMT基因。
植物在逆境胁迫下会导致卡尔文循环障碍,并产生大量的活性氧,对植物机体结构造成氧化损伤(Mittler, 2002)。而光呼吸可以促进卡尔文循环进而提高植物抵抗逆境胁迫的能力,并且光呼吸过程的代谢中间产物也发挥了重要作用(赵宏伟等, 2016),如脯氨酸与谷胱甘肽。其中,脯氨酸是一种重要的细胞渗透调节剂,其合成主要受到谷氨酸含量的影响,而光呼吸过程产生的NH3参与了谷氨酸的合成。谷胱甘肽是一种重要的抗氧化物质,在清除活性氧方面扮演着重要角色,谷胱甘肽的合成主要依赖于甘氨酸,而甘氨酸是光呼吸过程的重要代谢产物。SHMT作为一类参与光呼吸与一碳代谢的重要酶类,目前已经在许多物种中被鉴定出。植物体内存在3种形式的SHMT,包括细胞质cSHMT、线粒体mSHMT和叶绿体SHMT(Bauwe et al, 2003; Garrow et al, 1993)。在本研究中,对克隆出的2条PhSHMT基因进行亚细胞定位发现,PhSHMT-1基因定位于线粒体上,而PhSHMT-2基因定位于细胞质上。这说明,坛紫菜中可能存在细胞质型和线粒体型的SHMT,而是否存在叶绿体型的SHMT尚待进一步的研究。根据以往的研究(Kamalay et al, 1980、1984)推测:坛紫菜线粒体型的SHMT首先在光呼吸过程发挥作用,将甘氨酸分解形成CO2和NH3,进而生成丝氨酸;而随着丝氨酸进入细胞质中被分解,坛紫菜细胞质型的SHMT又将丝氨酸催化生成甘氨酸。
植物在应对逆境胁迫时的响应是一个非常复杂的生理生化过程,其中包括了多种基因、多种生理机制的共同调控。植物在遭受高温胁迫时会产生大量的活性氧,在植物长期的演变过程中形成了一系列复杂的活性氧清除机制,例如激活抗氧化酶基因的表达和增强抗氧化酶活性等。坛紫菜的早期研究发现,坛紫菜在应对高温胁迫时,其过氧化氢酶基因会在短时间内迅速大幅度上调表达以清除细胞内多余的过氧化物(仵燕青, 2016);此外,谷胱甘肽过氧化物酶基因在12 h时显著上调表达(张晗晗等, 2016)。本研究发现,在31℃高温胁迫条件下,随着胁迫时间的增加,坛紫菜2条PhSHMT基因均表现出先上调后下调再上调的趋势,在高温胁迫时间为12 h时,2条基因的表达水平均达到最高;随着胁迫时间的增加,2条基因的表达水平下降,在高温胁迫时间为4 d时,2条基因表达水平又显著上调。通过以上结果可以推测:坛紫菜在高温胁迫下,光呼吸通过促进卡尔文循环参与到抗逆反应中,光呼吸代谢的许多中间产物在这个阶段也发挥了重要作用。光呼吸过程产生甘氨酸,甘氨酸通过合成谷胱甘肽来清除多余的活性氧。SHMT基因作为植物光呼吸过程中关键的基因,在高温胁迫下通过大量的上调表达以促进光呼吸过程,进而产生更多甘氨酸用于合成谷胱甘肽来清除多余的氧化活性物质。在这个过程中可能伴随坛紫菜甲基化的过程:高温引起PhSHMT基因的大量上调表达,这个过程中不仅可以合成甘氨酸用以应对高温胁迫,还产生大量的四氢叶酸。由于四氢叶酸参与SAM的合成(Du et al, 2017),高温胁迫下,推测可能伴随着坛紫菜甲基化水平的上升,这与许多物种在高温条件下甲基化水平变化相似(Naydenov et al, 2015; Xu et al, 2014; 胡能兵等, 2016),但该推测还需要进一步的实验进行验证。
SHMT基因作为植物中一类响应逆境胁迫的基因,在坛紫菜响应高温胁迫时发挥了重要的作用。SHMT可以通过参与植物体中谷胱甘肽的合成,以清除高温胁迫条件下产生的活性氧,维持坛紫菜细胞内的氧化还原稳态环境。因此,本研究为理解坛紫菜的耐高温机制以及耐高温品系的培育提供了新的视野和理论基础。
Bauwe H, Kolukisaoglu U. Genetic manipulation of glycine decarboxylation. Journal of Experimental Botany, 2003, 54(387): 1523-1535 DOI:10.1093/jxb/erg171 |
Bekaert S, Storozhenko S, Mehrshahi P, et al. Folate biofortification in food plants. Trends in Plant Science, 2008, 13(1): 28-35 DOI:10.1016/j.tplants.2007.11.001 |
Blouin, Nicolas A, Brodie, et al. Porphyra: A marine crop shaped by stress. Trends in Plant Science, 2011, 16(1): 29-37 DOI:10.1016/j.tplants.2010.10.004 |
Chen CS, Ji DH, Xie CT, et al. Preliminary study on selecting the high temperature resistance strains and economic traits of Porphyra haitanensis. Acta Oceanologica Sinica, 2008, 30(5): 100-106 [ 陈昌生, 纪德华, 谢潮添, 等. 坛紫菜耐高温品系选育及经济性状的初步研究. 海洋学报, 2008, 30(5): 100-106 DOI:10.3321/j.issn:0253-4193.2008.05.014] |
Du J, Wang S, He C, et al. Identification of regulatory networks and hub genes controlling soybean seed set and size using RNA sequencing analysis. Journal of Experimental Botany, 2017, 68(8): 1955-1972 |
Garrow TA, Brenner AA, Whitehead VM, et al. Cloning of human cDNAs encoding mitochondrial and cytosolic serine hydroxymethyltransferases and chromosomal localization. Journal of Biological Chemistry, 1993, 268(16): 11910 |
Graham N, Arisi ACM, Lise J, et al. The role of glycine in determining the rate of glutathione synthesis in poplar: Possible implications for glutathione production during stress. Physiologia Plantarum, 1997, 100(2): 255-263 DOI:10.1111/ppl.1997.100.issue-2 |
Hu NB, Sui YH, Su YJ, et al. Effect of heat stress on isoenzyme and DNA methylation of different heat-sensitive peppers. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(1): 131-138 [ 胡能兵, 隋益虎, 舒英杰, 等. 高温胁迫对不同热敏型辣椒同工酶及DNA甲基化的影响. 西北植物学报, 2016, 36(1): 131-138] |
Kamalay JC, Goldberg RB. Organ-specific nuclear RNAs in tobacco. Proceedings of the National Academy of Sciences of the United States of America, 1984, 81(9): 2801-2805 DOI:10.1073/pnas.81.9.2801 |
Kamalay JC, Goldberg RB. Regulation of structural gene expression in tobacco. Cell, 1980, 19(4): 935-946 DOI:10.1016/0092-8674(80)90085-9 |
Kim YI. Nutritional epigenetics: Impact of folate deficiency on DNA methylation and colon cancer susceptibility. Journal of Nutrition, 2005, 135(11): 2703 DOI:10.1093/jn/135.11.2703 |
Li B, Xu Y, Ji DH, et al. Effects of high temperature and non-aeration stress on the quality of Porphyra haitanensis. Marine Fisheries Research, 2013, 34(3): 104-110 [ 李兵, 徐燕, 纪德华, 等. 高温静水胁迫培养对坛紫菜品质的影响. 渔业科学进展, 2013, 34(3): 104-110 DOI:10.3969/j.issn.1000-7075.2013.03.014] |
Li XC. Industry development, standard and safety assessment of seaweed in China. Chinese Fishery Quality & Standards, 2011, 1(3): 9-12 [ 李晓川. 我国紫菜产业发展、标准状况及安全性评价. 中国渔业质量与标准, 2011, 1(3): 9-12] |
Li ZX, Zhao SJ, Meng QW. Pathways and function of photorespiration. Chinese Bulletin of Botany, 2003, 20(2): 190-197 [ 李朝霞, 赵世杰, 孟庆伟. 光呼吸途径及其功能. 植物学报, 2003, 20(2): 190-197] |
Ma L, Chen LM, Liu DQ, et al. Research progresses on the molecular properties and physiological functions of plant serine hydroxymethyltransferase. Journal of Anhui Agricultural Sciences, 2008, 36(4): 1357-1359 [ 马莉, 陈丽梅, 刘迪秋, 等. 植物丝氨酸羟甲基转移酶及其生理作用研究进展. 安徽农业科学, 2008, 36(4): 1357-1359 DOI:10.3969/j.issn.0517-6611.2008.04.037] |
McClung CR, Hsu M, Painter JE, et al. Integrated temporal regulation of the photorespiratory pathway. Circadian regulation of two Arabidopsis genes encoding serine hydroxymethyltransferase. Plant Physiology, 2000, 123(1): 381-392 DOI:10.1104/pp.123.1.381 |
Mittler R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, 2002, 7(1): 405-410 |
Moreno JI, Mart NR, Castresana C. Arabidopsis SHMT1, a serine hydroxymethyltransferase that functions in the photorespiratory pathway influences resistance to biotic and abiotic stress. Plant Journal, 2005, 41(3): 451-463 |
Naydenov M, Baev V, Apostolova E, et al. High-temperature effect on genes engaged in DNA methylation and affected by DNA methylation in Arabidopsis. Plant Physiology & Biochemistry, 2015, 87: 102-108 |
Schirch V, Szebenyi DM. Serine hydroxymethyltransferase revisited. Current Opinion in Chemical Biology, 2005, 9(5): 482-487 DOI:10.1016/j.cbpa.2005.08.017 |
Wu YQ, Xiao HD, Xu K, et al. Cloning and expression pattern analysis of catalase (CAT) gene from Pyropia haitanensis. Journal of Fisheries of China, 2016, 40(10): 1576-1585 [ 仵燕青, 肖海东, 许凯, 等. 坛紫菜过氧化氢酶基因的克隆及表达特征. 水产学报, 2016, 40(10): 1576-1585] |
Xu X, Lei J, Zhang C, et al. Methylation-sensitive amplified polymorphism analysis of DNA methylation in hot pepper under high temperature and air humidity stress. Journal of Nuclear Agricultural Sciences, 2014, 28(7): 1175-1180 |
Xu Y, Chen C, Ji D, et al. Proteomic profile analysis of Pyropia haitanensis in response to high-temperature stress. Journal of Applied Phycology, 2014, 26(1): 607-618 DOI:10.1007/s10811-013-0066-8 |
Yan H, Mao P, Xia F. Research progress in plant antioxidant glutathione (Review). Acta Agrestia Sinica, 2013, 21(3): 428-434 |
Zhang HH, Xu Y, Ji DH, et al. Cloning and expression analysis of the glutathione peroxidase gene from Pyropia haitanensis. Journal of Fishery Sciences of China, 2016, 23(4): 791-799 [ 张晗晗, 徐燕, 纪德华, 等. 坛紫菜谷胱甘肽过氧化物酶基因的克隆及表达特征. 中国水产科学, 2016, 23(4): 791-799] |
Zhang Y, Xie CT, Chen CS, et al. Physiological responses of gametophytic blades of Porphyra haitanensis to rising temperature stresses. Journal of Fisheries of China, 2011, 35(3): 379-386 [ 张元, 谢潮添, 陈昌生, 等. 高温胁迫下坛紫菜叶状体的生理响应. 水产学报, 2011, 35(3): 379-386] |
Zhao HW, Wang XP, Yu MF, et al. Effect of drought stress and rewatering on antioxidant system and proline in rice during tillering stage. Journal of Northeast Agricultural University, 2016, 47(2): 1-7 [ 赵宏伟, 王新鹏, 于美芳, 等. 分蘖期干旱胁迫及复水对水稻抗氧化系统及脯氨酸影响. 东北农业大学学报, 2016, 47(2): 1-7] |



