2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 中国海洋大学海洋生命学院 青岛 266100;
5. 山东东方海洋科技股份有限公司 烟台 264003
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. College of Marine Life Sciences, Ocean University of China, Qingdao 266100;
5. Shandong Oriental Ocean Technology Limited Liability Company, Yantai 264003
鳗弧菌(Vibrio anguillarum)是一种分布广泛的条件致病菌,能感染多种经济鱼类,引起宿主出血性败血症,严重时可导致宿主死亡,造成水产业巨大经济损失。自首例鳗弧菌商品疫苗——抗弧菌引起的红嘴病疫苗问世以来,许多学者投入到鳗弧菌疫苗免疫的研发中,目前,鳗弧菌疫苗已成功用于养殖鱼类的鳗弧菌病防治,如针对大西洋鲑(Salmo salar)、虹鳟(Oncorhyncus mykiss)、鳕鱼(Gadus morhua)、鲈鱼(Dicentrarchus labrax)、鲷鱼(Sparus aurata)、香鱼(Plecoglossus altivelis)、大菱鲆(Scophthalmus maximus)的商品化鳗弧菌疫苗已经在挪威、西班牙、日本、韩国及欧洲等国家和地区得到广泛应用(Plant et al, 2011)。我国不少学者也相继开展了鳗弧菌疫苗的研究,在实验室阶段评价了灭活菌苗(朱开玲等, 2004; 张振冬等, 2007; 潘燕华等, 2009; Zhang et al, 2012)、口服疫苗(肖鹏等, 2007)、减毒疫苗(Zhang et al, 2012)、DNA疫苗(Hui et al, 2009)、亚单位疫苗(Xing et al, 2017)、疫苗佐剂(Liu et al, 2015)的免疫保护效果。其中,灭活疫苗因成本低廉,且能有效对抗胞外细菌侵袭,被认为是水产行业最理想的疫苗(Sommerset et al, 2005)。
鳗弧菌血清型十分复杂,在已知的23种血清型中(Grisez et al, 1995; Pedersen et al, 1999),O1、O2以及部分O3血清型为致病血清型(Pedersen et al, 1999),从流行病学调查结果来看,O1、O2和O3血清型鳗弧菌均在我国海水鱼养殖环境中流行(赵鲁宁等, 2011)。然而,目前国内鳗弧菌疫苗的研究均为以单个血清型为抗原的单价疫苗,而且很少进入中试临床研究阶段。为填补这一空白,本研究以鳗弧菌O1、O2和O3血清型菌株为疫苗株,制备了三价疫苗,免疫大菱鲆后监测该疫苗的抗体持续期和免疫保护期,旨在获取鳗弧菌三价疫苗的免疫效力数据,推动鳗弧菌三价疫苗的临床中试研究。
1 材料与方法 1.1 实验菌株、培养基和培养条件鳗弧菌VAM003(O1血清型)、VAM007(O2血清型)和M2016261(O3血清型)分离自患病海水养殖鱼,由中国水产科学研究院黄海水产研究所病研室保藏,复壮后保存于-80℃冰箱。实验所用液体培养基为胰蛋白胨大豆肉汤(TSB)或含有3%葡萄糖的TSB,固体培养基为胰蛋白胨大豆肉汤平板(TSA,TSB+1.5%琼脂)。培养温度为28℃,转速为150 r/min。
1.2 实验用鱼实验大菱鲆购自山东省烟台市东方海洋科技有限公司,体重为(80.2±4.7) g,体长为(12.0±0.34) cm。实验鱼暂养于7 m×7 m×1 m水泥池中,每天早、中、晚各投喂1次,按鱼体重的1.2%~1.5%进行投喂,每次投喂后均换水1次,每次换水量约为池水总体积的2/3,养殖水温为14~16℃。实验前,随机取3~5尾鱼进行细菌分离,确定从鱼的肝、脾、肾中均无细菌检出后,暂养鱼方可用于后续实验。
1.3 疫苗制备将3株菌(VAM003、VAM007和M2016261)从-80℃冰箱接出,在TSA平板上活化,28℃恒温培养。挑取3~5个单菌落接种到5 ml TSB试管,在28℃、150 r/min摇床培养过夜得到种子液,再将种子液按1%接种量转接到200 ml TSB(含3%葡萄糖),28℃、150 r/min摇床培养。取24 h培养产物,向培养产物中加入37%福尔马林溶液至甲醛终浓度为0.2% (V/V),在28℃、150 r/min条件下灭活。取灭活12 h和24 h时的菌液分别种到TSA平板和TSB试管,均无活菌检出后,确定完全灭活。将灭活完全的菌液6000 r/min、4℃离心10 min,收集菌体,用PBS缓冲液(0.2 mol/L, pH=7.6)洗涤2遍,再用含有0.1%甲醛的PBS缓冲液悬浮菌体,将3种菌悬液调整到相同OD600 nm,按1:1:1比例混合制备109 cells/ml的三价灭活,在4℃保存待用。
1.4 疫苗免疫大菱鲆实验于2016年5月~2016年10月在山东东方海洋科技股份有限公司进行,共计150 d。将暂养大菱鲆分为2组(免疫组和对照组),每组2500尾。免疫组用连续注射器(德国汉克萨斯)将浓度为109 cells/ml的三价疫苗腹腔注射大菱鲆,注射量为0.1 ml/尾,即免疫剂量为108 cells/尾;对照组注射等量的灭菌PBS。在一次免疫后60 d,以同等剂量对疫苗免疫的大菱鲆进行二次免疫,二免鱼尾鳍打上橘色标签后与一免鱼混养。
1.5 血清抗体效价检测在首次免疫后3、7、14、21、28、44、56、63、70、77、90、120、150 d,免疫组和空白组分别随机取5尾鱼,从尾静脉取血;二次免疫后3、7、14、21、28、44、60、90 d,从二免组中随机取5尾鱼,从尾静脉取血。所得血液析出血清后,将各尾鱼的血清等体积混合,分装后于-80℃保存。分别以VAM003、VAM007和M2016261灭活细胞(108 cells/ml)为抗原,用微量凝集法(Nguyen et al, 2017)检测血清抗体效价。具体方法步骤为:将血清按2n梯度稀释,将各组稀释好的血清按稀释倍数由低到高逐孔加入96孔板中,每孔50 μl,每个血清样品设置3个重复。将抗原等体积逐孔加入96孔板并吹打混匀,放入28℃培养箱孵育4 h后,转入4℃静置15 h,用倒置显微镜观察凝集情况。以能观察到凝集反应的最大血清稀释倍数为血清抗体效价,效价值以log2N(N为最大稀释倍数)表示。
1.6 相对免疫保护率检测在免疫后7、14、28、60、90、120及150 d,二免后30、60和90 d,从各免疫组和PBS对照组大菱鲆取鱼,20尾/组,用VAM003、VAM007和M2016261活菌进行攻毒。攻毒前取对照组鱼评估各菌株的LD50 (50% lethal dose, 半数致死量),以10倍LD50作为攻毒浓度,确定7~90 d的攻毒浓度为107 CFU/ml,120~150 d的攻毒浓度为108 CFU/ml。攻毒时,从鱼的背部肌肉注射0.1 ml/尾。攻毒后观察鱼发病症状,待死亡情况稳定后(即攻毒后14 d)统计累计死亡数,按照如下公式计算疫苗的相对免疫保护率(Relative percent survival, RPS):
RPS=(1-免疫组死亡率/对照组死亡率)×100% (Amend, 1981)。
1.7 实验鱼体重检测分别于首次免疫后0、67、83、126、150 d,从免疫组和对照组随机取鱼30尾检测实验鱼体重,并计算其特定生长率(SGR):
SGR=(lnWf-lnWi)/t×100%
式中,Wf、Wi和t分别为终末体重(g)、初始体重(g)和养殖天数(d)。
1.8 数据处理血清抗体效价表示为平均值±标准差(Mean± SD),用SPSS 19.0进行单因素方差分析(One-way ANOVA),检验标准采用Duncan法,以P < 0.05为差异显著。
2 结果 2.1 血清特异性抗体效价以剂量为108 cells/尾的三价菌苗一次注射免疫大菱鲆后,在不同的时间取免疫组鱼和对照组鱼的血清,检测VAM003、VAM007和M2016261的抗体效价。如图 1所示,在整个实验期间对照组鱼的抗体效价在1:2.0~1:5.1波动,而免疫鱼的血清抗体效价呈现先快速升高后保持相对稳定的趋势。免疫后14 d即可检测到3种抗体水平在1:66.7~1:80,显著高于对照组(1:2.0~1:2.9)(P < 0.05),3种抗体水平在免疫后28 d均上升到最高水平1:320.0(P < 0.05),在28~150 d稳定保持在较高水平,为1:106.7~1:320.0,显著高于同时期对照组鱼的抗体水平(1:3.0~ 1:5.1)(P < 0.05)。结果表明,以剂量为108 cells/尾的鳗弧菌三价菌苗一次注射免疫大菱鲆,3种抗体的持续期超过150 d。
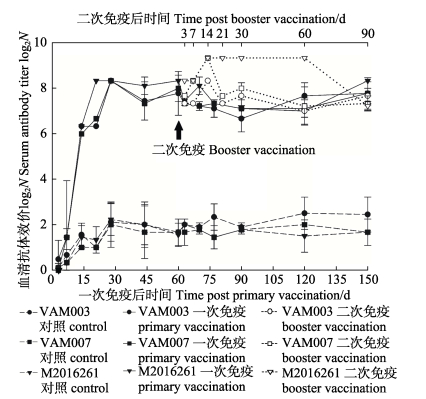
|
图 1 鳗弧菌三价疫苗免疫大菱鲆后的血清抗体效价 Figure 1 The serum antibody titer of turbot immunized with V. anguillarum trivalent vaccine |
二次免疫后60 d内,与同期一免鱼相比,二免鱼3种抗体水平均显著提高(P < 0.05)(图 1)。在二免后3 d可检测到二免组抗体水平快速上升,3种抗体水平分别为1:160.0(VAM003)、1:213.3(VAM007)和1:320.0(M2016261),均不低于同期一免鱼(63 d)的抗体水平,1:160.0(VAM003)、1:160.0(VAM007)和1:177.7(M2016261);在二免后14 d,3种抗体水平分别为1:320.0(VAM003)、1:640.0(VAM007)和1:640.0(M2016261),显著高于同时期一免鱼(70 d)的抗体水平,1:133.3(VAM003)、1:151.1(VAM007)和1:284.4(M2016261),并且二免后14~60 d,M2016261的抗体效价保持在最高水平;二免后90 d,3种抗体水平分别下降至1:213.3(VAM003)、1:68.9 (VAM007)和1:151.1(M2016261),与同期一免鱼(150 d)的抗体水平无显著差异(P > 0.05)。上述结果表明,二次免疫能够显著提高三价疫苗的抗体水平。
2.1 相对免疫保护率在一次免疫后的不同时间,用VAM003、VAM007和M2016261分别对免疫大菱鲆进行攻毒,评估三价疫苗的免疫保护率。如图 2所示,大菱鲆免疫后7 d获得RPS分别为43.8%(VAM003)、38.9%(VAM007)、16.7%(M2016261);在一免后14~120 d,针对3种病原的攻毒,免疫大菱鲆的RPS为70%~100%;一免后150 d,免疫鱼获得的RPS分别为35%(VAM003)、65%(VAM007)和100%(M2016261)。
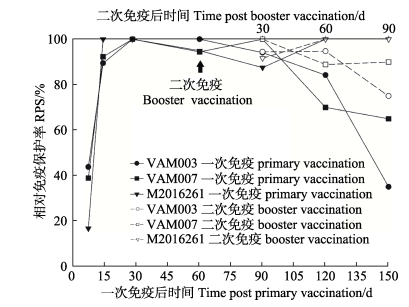
|
图 2 鳗弧菌三价疫苗免疫大菱鲆后的免疫保护率 Figure 2 The RPS of of turbot after immunization with V. anguillarum trivalent vaccine |
在二免后30、60和90 d进行疫苗RPS的检测。与同期的一免大菱鲆相比,二免大菱鲆的RPS均有所提高;特别是,二免后90 d的大菱鲆获得的RPS为75%(VAM003)、90%(VAM007)、100%(M2016261),高于同期一免后150 d的大菱鲆。结果表明,加强免疫后,大菱鲆获得的RPS提高。若以RPS > 70%为有效免疫保护期,则一免大菱鲆的有效免疫保护期为14~120 d,加强免疫后有效免疫保护期超过150 d,加强免疫后免疫保护期明显延长。
2.2 免疫过程中鱼体长和体重的变化实验过程中,不定期从免疫组和对照组取鱼测量其体重,并计算特定生长率(SGR),结果如图 3所示。免疫组的SGR(0.76)稍低于对照组(0.78),但二者没有明显差别,表明鳗弧菌三价疫苗对大菱鲆的生长未产生不良影响。

|
图 3 免疫后大菱鲆体重增长 Figure 3 Weight growth of turbot after immunization with V. anguillarum trivalent vaccine |
本研究以鳗弧菌的O1、O2和O3血清型菌株为抗原,制备了鳗弧菌三价灭活疫苗对养殖大菱鲆进行了一次免疫和二次免疫,结果显示,鳗弧菌三价疫苗对大菱鲆起到了有效的免疫保护作用。在整个实验期间,免疫组大菱鲆的生长与未免疫大菱鲆未有明显区别,表明该疫苗对大菱鲆的生长没有影响。免疫苗血清抗体效价是评价疫苗免疫保护效果的重要参数之一,实验结果显示,鳗弧菌三价疫苗能够有效地刺激大菱鲆产生特异抗体,3种抗原的抗体水平在短期内快速上升到最高水平,之后进入稳定期,在检测的150 d里保持较高水平。Spinos等(2017)的实验也得到了相似结果,他们以鳗弧菌O1血清型菌株和美人鱼发光杆菌(Photobacterium damselae)为抗原制备的二联疫苗免疫欧洲鲈鱼(Dicentrarchus labrax),免疫后22~29 d针对鳗弧菌的特异抗体水平上升到最高,并在免疫后346 d保持相对稳定的抗体水平。本研究发现,一免后7 d免疫组的3种特异抗体的水平迅速升高,说明鳗弧菌疫苗抗原能够快速地被大菱鲆机体免疫系统识别并产生特异性免疫应答。鳗弧菌灭活疫苗的主要抗原成分为脂多糖LPS(O抗原)(Schrøder et al, 2006),LPS不需要抗原递呈细胞的加工处理便能直接激活B细胞诱导体液免疫,因而,能在较短时间内刺激特异抗体的产生。
相对免疫保护率RPS是评价免疫保护效果的另一个重要参数,结果表明,鳗弧菌三价疫苗能为免疫鱼提供很好的免疫保护。大菱鲆在一免后7 d便获得较高的RPS,在免疫后14~120 d针对3种抗原的RPS维持在70%以上。这些结果表明,鳗弧菌三价疫苗一次免疫大菱鲆,能提供至少120 d的有效免疫保护期。一次免疫大菱鲆获得的RPS的变化趋势与特异抗体水平的变化趋势一致,一免后14 d血清抗体显著升高的同时,RPS也明显升高;免疫后28 d,血清抗体效价达最大值,RPS也达到最大值100%;免疫后28~120 d血清抗体水平维持在较高水平(> 1:106),RPS维持在70%以上。RPS与特异抗体水平的一致性说明疫苗产生的免疫保护作用主要来自于抗体介导的免疫应答,Sun等(2011)也提出了相同观点。此外,RPS与抗体效价间的相关性提示,可以通过免疫鱼的特异抗体水平来预测RPS,但还需要多次重复实验来建立抗体水平与RPS的数值关系。
二次免疫能够提高宿主的抗体水平、延长抗体持续时间,从而延长疫苗的免疫保护期。为了探究鳗弧菌三价疫苗二次免疫的免疫保护效果,在一免后60 d对大菱鲆进行了二次免疫,并对比了二免鱼和一免鱼特异抗体的变化和RPS。结果显示,在二免后3 d便检测到二免鱼的特异抗体水平显著高于同期一免鱼的抗体水平,并在60 d内维持较高于一免鱼的抗体水平,表明大菱鲆的免疫系统对鳗弧菌疫苗快速产生了二次免疫应答,并合成和分泌更多的特异抗体。同时,二免后,大菱鲆获得的RPS也显著高于同期的一免大菱鲆,有效免疫保护期(RPS > 70%)大于150 d,表明鳗弧菌三价疫苗进行二次免疫后能够提高大菱鲆的免疫保护率、延长免疫保护时间。加强免疫时残留的疫苗抗体滴度直接影响抗体应答,且通常表现为负影响。可能是形成了抗原-抗体复合物,降低了可与B细胞结合的抗原量。通常一般会在宿主的特异抗体效价下降到较低、RPS也较低的时候进行二次免疫,以便有效延长抗体持续时间和免疫保护期。在本研究中,一免大菱鲆的特异抗体水平在免疫后150 d仍保持较高水平,而RPS在120 d已下降至70%,因此,认为鳗弧菌三价灭活疫苗的二免时间在首次免疫后120 d左右较合适。
综上所述,鳗弧菌三价灭活疫苗为大菱鲆提供了有效的免疫保护,一次免疫的抗体持续期大于150 d,有效免疫保护期不低于120 d;二次免疫的抗体持续期大于150 d,有效免疫保护期不低于150 d。在整个实验期间,免疫后的大菱鲆的生长与未免疫大菱鲆没有明显区别。
Amend DF. Potency testing of fish vaccine. Developments in Biological Standardization, 1981, 49: 447-454 |
Frans I, Michiels CW, Bossier P, et al. Vibrio anguillarum as a fish pathogen: Virulence factors, diagnosis and prevention. Journal of Fish Diseases, 2011, 34(9): 643-661 DOI:10.1111/jfd.2011.34.issue-9 |
Grisez L, Ollevier F. Comparative serology of the marine fish pathogen Vibrio anguillarum. Applied & Environmental Microbiology, 1995, 61(12): 4367 |
Hui Y, Chen JX, Yang GP, et al. Protection of Japanese flounder (Paralichthys olivaceus) against Vibrio anguillarum with a DNA vaccine containing the mutated zinc-metalloprotease gene. Vaccine, 2009, 27(15): 2150 DOI:10.1016/j.vaccine.2009.01.101 |
Liu X, Hua Z, Yuan G, et al. Efficacy of chitosan oligosaccharide as aquatic adjuvant administrated with a formalin- inactivated Vibrio anguillarum, vaccine.. Fish & Shellfish Immunology, 2015, 47(2): 855-860 |
Nguyen HT, Thu Nguyen TT, Tsai MA, et al. A formalin- inactivated vaccine provides good protection against Vibrio harveyi infection in orange-spotted grouper (Epinephelus coioides). Fish & Shellfish Immunology, 2017, 65: 118-126 |
Pan YH, Ma Y, Zhao DL, et al. Study on immune response of Paralichthys olivaceus induced by live attenuated V. anguillarum vaccine. Food and Drug, 2009(5): 12-15 [ 潘燕华, 马悦, 赵东玲, 等. 鳗弧菌减毒活疫苗对牙鲆免疫效果的研究. 食品与药品, 2009(5): 12-15] |
Pedersen K, Grisez L, Houdt RV, et al. Extended serotyping scheme for Vibrio anguillarum with the definition and characterization of seven provisional o-serogroups. Current Microbiology, 1999, 38(3): 183-189 DOI:10.1007/PL00006784 |
Plant KP, Lapatra SE. Advances in fish vaccine delivery. Developmental & Comparative Immunology, 2011, 35(12): 1256 |
Schrøder MB, Mikkelsen H, Børdal S. Early vaccination and protection of Atlantic cod (Gadus morhua L.) juveniles against classical vibriosis. Aquaculture, 2006, 254(1): 46-53 |
Sommerset I, Krossøy B, Biering E, et al. Vaccines for fish in aquaculture. Expert Review of Vaccines, 2005, 4(1): 89-101 DOI:10.1586/14760584.4.1.89 |
Spinos E, Kokkoris GD, Bakopoulos V. Prevention of sea bass (Dicentrarchus labrax, L. 1758) photobacteriosis and vibriosis. Long term efficacy study of intraperitoneally administered bivalent commercial vaccines. Aquaculture, 2017, 471: 172-184 |
Sun Y, Liu C, Sun L. A multivalent killed whole-cell vaccine induces effective protection against Edwardsiella tarda and Vibrio anguillarum. Fish & Shellfish Immunology, 2011, 31(4): 595-599 |
Xiao P, Mo ZL, Zou YX, et al. Immune responses and efficacy of an oral-emulsified bivalent vaccine against Vibrio anguillarum in turbot (Scophthalmus maximus). Chinese High Technology Letters, 2007, 17(9): 979-985 [ 肖鹏, 莫照兰, 邹玉霞, 等. 鳗弧菌油乳化二价口服疫苗免疫养殖大菱鲆的免疫应答及免疫效果的研究. 高技术通讯, 2007, 17(9): 979-985 DOI:10.3321/j.issn:1002-0470.2007.09.020] |
Xing J, Xu H, Wang Y, et al. Protective efficacy of six immunogenic recombinant proteins of Vibrio anguillarum and evaluation them as vaccine candidate for flounder (Paralichthys olivaceus). Microbial Pathogenesis, 2017, 107: 155 DOI:10.1016/j.micpath.2017.03.027 |
Zhang Z, Wu H, Xiao J, et al. Immune responses of zebrafish (Danio rerio) induced by bath-vaccination with a live attenuated Vibrio anguillarum vaccine candidate. Fish & Shellfish Immunology, 2012, 33(1): 36 |
Zhang ZD, Zhang PJ, Mo ZL, et al. Effect of inactivted Vibrio anguillarum vaccine on phagocytosis of Paralichthys olivaceus peripheral blood cells. Studia Marine Sinica, 2007, 48: 132-137 [ 张振冬, 张培军, 莫照兰, 等. 鳗弧菌灭活疫苗对牙鲆外周血细胞吞噬活性的影响. 海洋科学集刊, 2007, 48: 132-137] |
Zhao LN, Li GY, Li J, et al. Serotyping and antibiotics sensitivity of Vibrio anguillarum starins isolated from marine farmed fish. Oceanologia et Limnologia Sinica, 2015, 46(5): 1109-1118 |
赵鲁宁, 李贵阳, 李杰, 等. 海水养殖鱼类鳗弧菌(Vibrio anguillarum)临床分离株的血清型和抗生素耐药谱. 海洋与湖沼, 2011, 46(5): 1109-1118 |
Zhu KL, Chen JX, Li Y, et al. Study on the vaccination against anguillarum in farmed marine turbot. High Technology Letters, 2004, 14(2): 76-80 [ 朱开玲, 陈吉祥, 李筠, 等. 鳗弧菌灭活疫苗对海水养殖大菱鲆的免疫预防研究. 高技术通讯, 2004, 14(2): 76-80 DOI:10.3321/j.issn:1002-0470.2004.02.018] |



