2. 水产科学国家级实验教学示范中心 上海海洋大学 上海 210306;
3. 广州大学生命科学学院 广州 510006
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 210306;
3. College of Life Science, Guangzhou University, Guangzhou 510006
拟穴青蟹(Scylla paramamosain)俗称青蟹,具有生长迅速、肉鲜味美、营养价值高等特点,是我国东南沿海地区重要的养殖蟹类之一,2016年我国青蟹养殖总产量达到了15万t (2017中国渔业统计年鉴)。但随着青蟹养殖业的迅猛发展,其养殖水质不断恶化,致使一些有害的环境因子激增,从而导致青蟹病害频发,严重威胁青蟹养殖业的健康发展(张迪等, 2013)。氨氮是养殖水体中一种重要的污染因子,其对养殖水生动物的生长代谢及非特异性免疫功能等具有严重影响(Racotta et al, 2000; Cheng et al, 2002; Hong et al, 2007; 王芸等, 2013; 邓康裕等, 2015)。研究表明,在30 d的慢性氨氮胁迫下,吉富罗非鱼(Oreochromis niloticus)幼鱼的增重率(WGR)和特定生长率(SGR)随着氨氮浓度的升高而降低(肖炜等, 2015)。奥尼罗非鱼(Oreochromis niloticus×O.areus)幼鱼在低浓度氨氮胁迫24 h后,其肝脏的过氧化氢酶(CAT)活力显著下降(P < 0.05)(韩春艳等, 2014)。而青鱼(Mylopharyngodonpiceus)、团头鲂(Megalobrama amblycephala)和刺参(Apostichopus japonicus)等水产养殖动物的组织器官及部分免疫酶活也会在长时间的氨氮胁迫下受到不同程度的损伤及抑制作用(胡毅等, 2012; 张武肖等, 2015; 刘洪展等, 2012)。另外,细角滨对虾(Litopenaeus stylirostris)对氨氮的耐受力会随着胁迫时间的延长不断降低,其死亡率会显著升高(Mugnier et al, 2008)。而中华绒螯蟹(Eriocheir sinensis)的血细胞总数和吞噬能力、三疣梭子蟹(Portunus trituberculatus)的血细胞数量及酚氧化酶原活力等也会随着氨氮浓度的升高而降低(黄鹤忠等, 2006; 岳峰等, 2010)。此外,一些虾蟹类体内的腺苷三磷酸酶(ATPase)、溶菌酶(LZM)、谷胱甘肽合成酶(GPX)等也会因氨氮胁迫而受到不同程度的影响,而使其正常生长代谢受到严重威胁(艾春香等, 2011; 洪美玲等, 2007; 曾媛媛等, 2011; Wang et al, 2004)。
该实验主要研究氨氮对拟穴青蟹的急性毒性及对其血清中碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)、超氧化物歧化酶(SOD)和酚氧化酶(PO)活力的影响,以期探究养殖水体中的氨氮对拟穴青蟹的毒理作用及对其免疫机能的影响,为青蟹的健康养殖提供理论参考。
1 材料与方法 1.1 实验材料实验所用青蟹购自江门市,选取活力旺盛、体色正常的健康青蟹,平均体重为(29.41±4.12) g,平均壳长为(52.09±2.26) mm,平均壳宽为(37.40±2.28) mm。于直径0.8 m、高1.2 m的圆柱形塑料桶中暂养7 d,每缸10~15只青蟹,海水盐度为14.62±1.08,温度为(27.17±0.14)℃,溶氧为(5.38±0.35) mg/L,pH为8.16±0.06。暂养期间连续充氧,每天投喂新鲜方形马珂蛤(Mactra veneriformis) 1次并及时清理食物残渣和排泄物,每天换水1次,换水量为总水体的50%,暂养阶段未见青蟹有蜕壳现象。
1.2 实验方法 1.2.1 急性毒性实验以分析纯NH4Cl为氨氮源,配制成浓度为4 g/L的母液,根据实验要求,再将母液稀释为40、60、80、100、120和140 mg/L的6个梯度,每个梯度设3个平行,每个平行10只蟹,实验期间不投饵,每天用相应氨氮浓度的海水换水,换水量为总水体的50%,及时清理青蟹排泄物。实验期间密切观察青蟹活动,详细记录48 h内的死亡个体数,并及时清理死亡青蟹。
根据实验结果,以直线内插法求出24 h和48 h的半致死浓度(Median lethal concentration) LC50,根据Turubell公式(黄鹤忠等, 1998)求出其安全浓度(Safe concentration):
SC=(48 h LC50×0.3)/(24 h LC50/48 h LC50)2
并根据以下公式计算所对应的非离子氨的浓度:
| $ {C_{{\rm{N}}{{\rm{H}}_3}}} = {C_{{\rm{N}}{{\rm{H}}_3} - {\rm{N}}}}/({10^{{\rm{p}}Ka}}{_{{\rm{S}},{\rm{T}}}\ ^{ - {\rm{pH}}}} + 1) $ | (1) |
| $ {\rm{p}}K{a_{{\rm{S, T}}}} = 9.24 + 0.003091S + 0.0324(298 - T) $ | (2) |
(1)、(2)式中,CNH3-N表示水体总氨氮浓度,T表示绝对温度(T=273℃+t),t为摄氏温度,S为盐度,pKaS, T为电离常数,pH为水体pH值(钱佳慧等, 2016)。
1.2.2 血清免疫相关酶实验免疫相关酶实验所设氨氮浓度分别为0(C0组,对照组)、10(C10组)、20(C20组)、30(C30组)、40(C40组)和50 mg/L(C50组),每个浓度设3个平行,每个平行15只蟹,在氨氮胁迫0、6、24、48与72 h时采血。采血时,每个平行组随机选取8只蟹,用1 ml的一次性注射器从青蟹的第3步足基关节处抽取150~200 μl血液,并将其混匀收集于2 ml的EP管中,4℃、8000 r/min离心10 min,再用移液枪抽取上层血清分装到1.5 ml的离心管中,于–20℃保存备用。采完血的青蟹,用酒精棉球擦拭采血部位并放回原组。
青蟹血清PO活力的测定采用改进的Ashida (1971)方法进行测定,血清中的ACP、AKP、LZM、SOD的测定则采用南京建成生物试剂盒,参照厂家提供的说明书进行测定。
1.2.3 数据处理实验数据结果以平均值±标准差(Mean±SD)表示,使用SPSS 18.0软件对数据进行统计分析,并采用单因素方差分析(One-way ANOVA)和Duncan法进行多重比较,取P < 0.05为显著性差异水平,P < 0.01为极显著性差异水平。
2 结果 2.1 急性毒性该实验条件下,对照组青蟹未出现死亡(表 1)。在实验组中,同一胁迫时间下,随着氨氮浓度的升高,青蟹的死亡率不断增高;而在同一氨氮浓度下,随着胁迫时间的延长,青蟹的死亡率也在不断升高,在胁迫时间为48 h、氨氮浓度为120 mg/L及以上时青蟹的死亡率达到100%。
|
|
表 1 氨氮对拟穴青蟹急性毒性实验 Table 1 The acute toxicity test of ammonia nitrogen on S. paramamosain |
经线性回归分析(图 1),氨氮对青蟹24、48 h的LC50分别为104.793、66.124 mg/L,SC为7.90 mg/L。并由公式(1)、(2)计算,得非离子氨对青蟹24、48 h的LC50分别为8.396、5.298 mg/L,SC为0.63 mg/L。
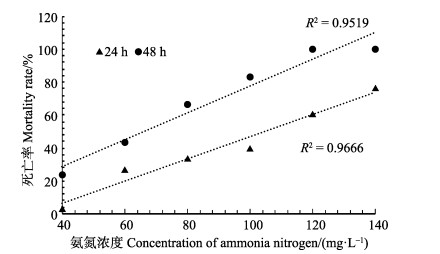
|
图 1 氨氮对拟穴青蟹急性毒性 Figure 1 The acute toxicity of ammonia nitrogen on S. paramamosain |
如图 2所示,对照组(C0)的PO活力随时间无显著变化;与对照组相比,C10、C20组的PO活力随胁迫时间先上升后下降,而C30、C40及C50组的PO活力则随胁迫时间先下降后上升;其中,C10组在24 h显著高于对照组(P < 0.05),C30、C40及C50组在72 h显著高于对照组(P < 0.05),且C40组与对照组有极显著差异(P < 0.01)。
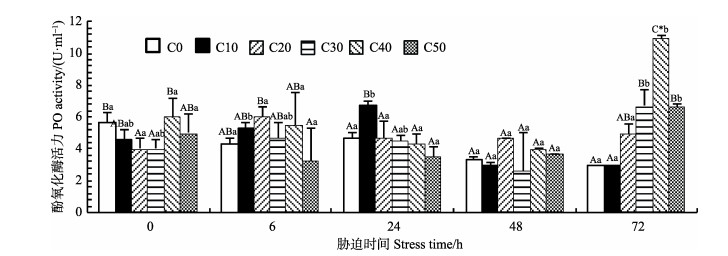
|
图 2 氨氮对拟穴青蟹血清PO活力的影响 Figure 2 Effects of ammonia nitrogen on PO activity in serum of S. paramamosain 图中大写字母表示同一胁迫时间点各组间差异,小写字母表示同组内各胁迫时间点差异,其中,相同字母间表示差异不显著,不同字母间表示差异显著(P < 0.05),“*”表示同一时间点对照组与实验组差异极显著(P < 0.01),下同 Capital letters in the figure represent differences between groups at the same stress time, the lowercase indicate the difference of the stress time in the same group, among which the same letters indicate no significant difference, but the different letters indicate significant difference (P < 0.05), "*" indicates highly significant difference between the control group and test groups at the same stress time, the same below |
由图 3可知,C10、C20、C40组的AKP活力均在胁迫24 h达到最高水平,且与对照组(C0)差异显著(P < 0.05),之后持续下降,至72 h又再次升高;C30组的AKP活力则在胁迫72 h达到最高水平,且显著高于C10和C50组(P < 0.05);C50组的AKP活力则随胁迫时间先下降后上升,且一直低于对照组水平(除48 h外)。

|
图 3 氨氮对拟穴青蟹血清AKP活力的影响 Figure 3 Effects of ammonia nitrogen on AKP activity in serum of S. paramamosain |
如图 4所示,对照组(C0)的ACP活力随时间无显著变化;与对照组相比,各实验组ACP活力均随胁迫时间先上升后下降,至72 h又趋于对照组水平,其中,C10、C20及C40组的ACP活力在24 h达到最高水平(P < 0.05),且在24 h显著高于对照组(P < 0.05),而C50组的ACP活力则在24 h显著低于对照组及其他各实验组(P < 0.05)。
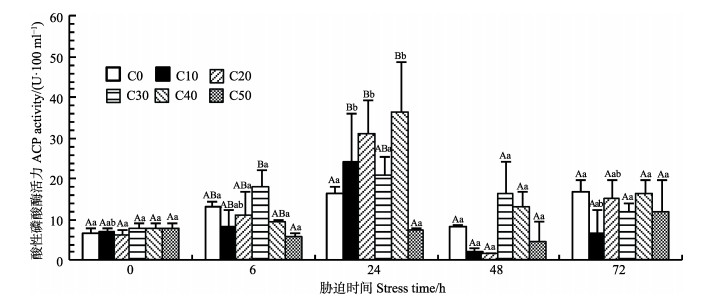
|
图 4 氨氮对拟穴青蟹血清ACP活力的影响 Figure 4 Effects of ammonia nitrogen on ACP activity in serum of S. paramamosain |
由图 5可知,与对照组(C0)相比,各实验组的LZM活力随着胁迫时间的延长而不断降低,在胁迫6、24、48和72 h时的LZM活力均显著低于0 h (P < 0.05),且在上述时间段内各实验组的LZM活力均极显著低于对照组(P < 0.01)。
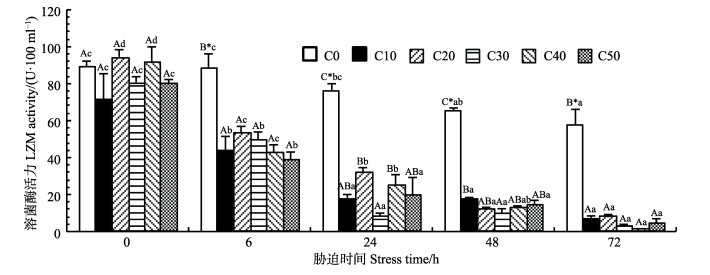
|
图 5 氨氮对拟穴青蟹血清LZM活力的影响 Figure 5 Effects of ammonia nitrogen on LZM activity in serum of S. paramamosain |
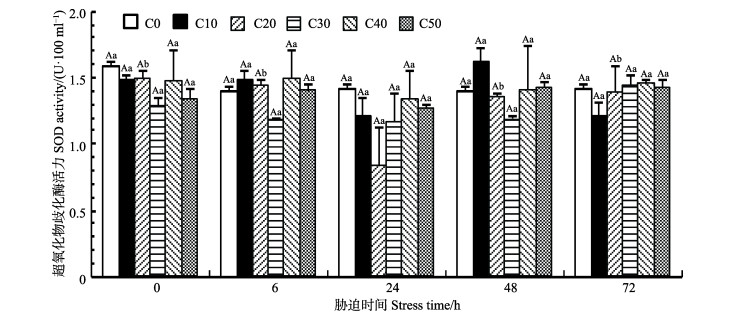
如图 6所示,对照组(C0)的SOD活力随胁迫时间无显著变化;与对照组相比,除C20组在24 h的SOD活力显著低于其他胁迫时间点(P < 0.05),其余各组的SOD活力在胁迫周期内无显著变化。
|
图 6 氨氮对拟穴青蟹血清SOD活力的影响 Figure 6 Effects of ammonia nitrogen on SOD activity in serum of S. paramamosain |
养殖水体中的氨氮分为离子氨和非离子氨,能降低机体的血液载氧能力而引起机体中毒,对机体的免疫系统具有一定的损伤作用(董玉波等, 2011)。邵鑫斌等(2011)报道,在水体盐度为30.6、pH为8±1的条件下,当氨氮浓度为100 mg/L、胁迫24 h后锯缘青蟹(Scylla serrata)开始出现死亡,死亡率为10%。本研究结果显示,在氨氮浓度为40 mg/L、胁迫24 h后青蟹即开始出现死亡;而当氨氮浓度为100 mg/L时、胁迫24 h后青蟹的死亡率达到40%。当水体的总氨氮浓度及其他条件不变时,非离子氨的浓度与盐度成反比。由于该实验所设水体盐度低于上述报道的盐度,故在相同氨氮浓度(100 mg/L)下,其所含非离子氨的浓度(8.012 mg/L)比上述水体的非离子氨浓度(3.568 mg/L)更高,而相同浓度下的非离子氨比离子氨对机体具有更强的毒性(Ruyet et al, 1995),因此,该实验青蟹的死亡率也更高。本研究结果还显示,氨氮对青蟹的SC为7.90 mg/L,高于其对团头鲂(SC=5.649 mg/L)和墨吉明对虾(SC=3.531 mg/L)的安全浓度(张武肖, 2015; 钱佳慧等, 2016)。可见,与鱼虾相比,青蟹对氨氮具有一定的耐受性。
PO受酚氧化酶原(Prophenoloxidase, proPO)激活系统调控,在甲壳动物体内发挥着重要的免疫防御作用(Ashida et al, 1984)。研究表明,氨氮胁迫凡纳滨对虾(Litopenaeus vannamei)可使其24 h内的血清PO活力明显上升(Le Moullac et al, 2000);以20 mg/L的氨氮处理三疣梭子蟹,其酚氧化酶原活力在6 h后显著低于对照组,但其酚氧化酶原mRNA的表达量却显著高于对照组(Yue et al, 2010)。该结果显示,C10、C20组可分别使青蟹的PO活力在24 h和6 h明显升高,C30、C40及C50组可使其PO活力在72 h显著升高(P < 0.05),表明各实验组氨氮在胁迫周期内对青蟹血清中的PO活力有明显的促进作用(P < 0.05)。
AKP和ACP是水解酶体系的重要组成部分,AKP能将磷酸基团转移到底物分子上,在磷化物的消化与吸收中起着重要作用,同时,也参与机体的解毒过程;而ACP能增强血细胞对异物的识别和吞噬作用,是机体杀灭病原体的物质基础(何海琪等, 1992)。艾春香等(2011)研究发现,10 mg/L组的拟穴青蟹鳃中的AKP、ACP比活力在72 h达到最高水平,之后持续下降;40 mg/L组的AKP比活力在胁迫周期内一直低于对照组水平。而本研究结果显示,C10、C20、和C40组的血清AKP、ACP活力在胁迫24 h即达到最高水平(P < 0.05),表现为急性促进作用,之后开始显著下降。本结果与上述结果存在部分差异,这可能是因为相较于鳃组织,磷酸酶及其同工酶主要存在于血细胞的溶酶体中,而氨氮可导致青蟹血细胞解体(艾春香等, 2011),故上述浓度的氨氮可在短时间内使血清中的磷酸酶激增,但随着胁迫时间的延长及氨氮浓度的升高(C50组),机体的结构可能受到不可逆的损伤,以致其磷酸酶的活力受到抑制。
LZM广泛存在于动植物及微生物的多种组织、体液和分泌物中,能破坏革兰氏阳性细菌的细胞壁,使其溶解而失去感染活性,在生物体的非特异性免疫中起着重要作用(Grinde et al, 1988)。王贞杰等(2017)发现,氨氮胁迫可使圆斑星鲽(Verasper variegatus)的溶菌酶活力在12~96 h内持续下降,且氨氮浓度越高,酶活下降越快。凡纳滨对虾的溶菌酶活性也会因为氨氮胁迫而持续降低(Qiu et al, 2008)。本研究结果表明,氨氮对青蟹血清LZM的活力具有显著的抑制作用。Yue等(2010)发现,将三疣梭子蟹暴露在氨氮浓度为20 mg/L的水中,其溶菌酶基因的表达量显著降低(P < 0.05),由此说明,氨氮可能是通过抑制机体中溶菌酶基因的正常表达而使LZM活力显著降低。
青蟹血细胞的吞噬过程会产生过氧化氢(H2O2)和超氧阴离子自由基(O2·–)等氧化物质,这些氧化物质除了具有杀菌作用外,也会对自身细胞产生一定的损害作用(姚翠鸾等, 2003),而SOD具有清除机体内这些氧化活性物质的作用,使机体免于因氧化作用而产生损伤(孔祥会等, 2003)。本研究发现,短时间的氨氮胁迫对甲壳动物血清中SOD活力影响并不显著。黄鹤忠等(2006)报道,当氨氮浓度为5.0 mg/L、胁迫10 d或3.0~5.0 mg/L、胁迫20 d时,中华绒螯蟹的SOD活性才有明显下降(P < 0.05)。而经氨氮胁迫4 d,罗氏沼虾(Macrobrachium rosenbergii)的SOD活性显示为增高,至10 d才表现为降低(王玥等, 2006)。由此可见,长时间的氨氮胁迫才有可能会导致机体结构的破坏,致使其免疫系统受损,从而导致SOD活力受到影响。
4 结论综上所述,不同浓度氨氮在实验周期内对SOD活力无显著影响,但其会通过急性促进AKP、ACP和PO或显著抑制LZM等酶活力的方式来影响拟穴青蟹的非特异性免疫反应,且这种急性促进作用通常是血细胞受到破坏而产生的结果,是不可逆的,说明略高于安全浓度的氨氮(≥10 mg/L)即会对拟穴青蟹产生明显的毒害作用。因此,该研究建议在拟穴青蟹养殖生产中,要定时检测养殖水体中的氨氮含量并通过适时更换养殖用水等方式将氨氮控制在安全浓度(CNH3-N, 7.90 mg/L; CNH3, 0.63 mg/L)以下,从而为青蟹提供持续健康的养殖环境。
Ai CX, Zeng YY. The effects of ammonia-N stress on the activities of ATPase, ACP and AKP in different tissues and organs of mud crab Scylla paramamosain. Journal of Xiamen University (Natural Science), 2011, 50(4): 772-778 [ 艾春香, 曾媛媛. 氨氮胁迫对拟穴青蟹腺苷三磷酸酶和磷酸酶比活力的影响. 厦门大学学报(自然科学版), 2011, 50(4): 772-778] |
Ashida M, Söderhäll K. The prophenoloxidase activating system in crayfish. Comparative Biochemistry and Physiology, 1984, 77B(1): 21-26 |
Ashida M. Purification and characterization of prophenoloxidase from hemolymph of the silkworm Bombyx mori. Archives of Biochemistry & Biophysics, 1971, 144(2): 749-762 |
Cheng W, Chen JC. The virulence of Enterococcus to freshwater prawn Macrobrachium rosenbergii and its immune resistance under ammonia stress. Fish & Shellfish Immunology, 2002, 12(2): 97-109 |
Deng KY, Meng XH, Kong J, et al. Effects of poly-β- hydroxybutyrate on non-specific immunity and expression of immune gene under the ammonia stress of Litopenaeus vannamei. Progress in Fishery Sciences, 2015, 36(6): 71-78 [ 邓康裕, 孟宪红, 孔杰, 等. 聚β-羟基丁酸酯对凡纳滨对虾(Litopenaeus vannamei)非特异性免疫力及氨氮胁迫后免疫基因表达量的影响. 渔业科学进展, 2015, 36(6): 71-78] |
Dong YB, Wang K, Wang LT. Research progress in toxicity of ammonia nitrogen to aquatic organisms. Tianjin Fisheries, 2011(Z1): 8-13 [ 董玉波, 王轲, 王林同. 氨氮对水生生物毒性的研究进展. 天津水产, 2011(Z1): 8-13] |
Grinde B, Jollés J, Jollés P. Purification and characterization of two lysozymes from rainbow trout (Salmo gairdneri). European Journal of Biochemistry, 1988, 173: 269-273 DOI:10.1111/ejb.1988.173.issue-2 |
Han CY, Zheng QM, Chen GD, et al. Effect of ammonia-N stress on non-specific immunity of tilapia (Oreochromis niloticus×O.areus). South China Fisheries Science, 2014(3): 47-52 [ 韩春艳, 郑清梅, 陈桂丹, 等. 氨氮胁迫对奥尼罗非鱼非特异性免疫的影响. 南方水产科学, 2014(3): 47-52 DOI:10.3969/j.issn.2095-0780.2014.03.007] |
He HQ, Sun F. Research on acidic and alkaline phosphatase characteristics of Penaeus chinensis. Oceanologia et Limnologia Sinica, 1992, 23(5): 555-560 [ 何海琪, 孙凤. 中国对虾酸性和碱性磷酸酶的特性研究. 海洋与湖沼, 1992, 23(5): 555-560] |
Hong M, Chen L, Sun X, et al. Metabolic and immune responses in Chinese mitten-handed crab (Eriocheir sinensis) juveniles exposed to elevated ambient ammonia. Comparative Biochemistry & Physiology, Part C: Toxicology & Pharmacology, 2007, 145(3): 363-369 |
Hong ML, Chen LQ, Gu SZ, et al. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten crab (Eriocheir sinensis). Journal of Fishery Sciences of China, 2007, 14(3): 412-418 [ 洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响. 中国水产科学, 2007, 14(3): 412-418 DOI:10.3321/j.issn:1005-8737.2007.03.010] |
Hu Y, Huang Y, Zhong L, et al. Effects of ammonia stress on the gill Na+/K+-ATPase, microstructure and some serum physiological-biochemical indices of juvenile black carp (Mylopharyngodon piceus). Journal of Fisheries of China, 2012, 36(4): 538-545 [ 胡毅, 黄云, 钟蕾, 等. 氨氮胁迫对青鱼幼鱼鳃丝Na+/K+-ATP酶、组织结构及血清部分生理生化指标的影响. 水产学报, 2012, 36(4): 538-545] |
Huang HZ, Li Y, Song XH, et al. NH4+-N stress on immune function of Eriocheir sinensis. Oceanologia et Limnologia Sinica, 2006, 37(3): 198-205 [ 黄鹤忠, 李义, 宋学宏, 等. 氨氮胁迫对中华绒螯蟹(Eriocheir sinensis)免疫功能的影响. 海洋与湖沼, 2006, 37(3): 198-205 DOI:10.3321/j.issn:0029-814X.2006.03.002] |
Huang HZ, Liang SR. Toxicity treatment of 3 kinds of drugs on Eriocheir sinensis larvae. Reservoir Fisheries, 1998(6): 15-16 [ 黄鹤忠, 梁守仁. 3种药物对河蟹幼体的毒性试验. 水生态学杂志, 1998(6): 15-16] |
Kong XH, Wang GZ, Ai CX, et al. Comparative research on total antioxidant capacity and SOD activity in different organs and tissues in Scylla serrata. Journal of Applied Oceanography, 2003, 22(4): 469-474 [ 孔祥会, 王桂忠, 艾春香, 等. 锯缘青蟹不同器官组织中总抗氧化能力和SOD活性的比较研究. 应用海洋学学报, 2003, 22(4): 469-474 DOI:10.3969/j.issn.1000-8160.2003.04.010] |
Le Moullac G, Haffner P. Environmental factors affecting immune responses in Crustacea. Aquaculture, 2000, 191: 121-131 DOI:10.1016/S0044-8486(00)00422-1 |
Liu HZ, Zheng FR, Sun XQ, et al. Effect of exposure to ammonia nitrogen stress on immune enzyme of holothurian Apostichopus japonicus. Marine Science, 2012, 36(8): 47-52 [ 刘洪展, 郑风荣, 孙修勤, 等. 氨氮胁迫对刺参几种免疫酶活性的影响. 海洋科学, 2012, 36(8): 47-52] |
Mugnier C, Zipper E, Goarant C, et al. Combined effect of exposure to ammonia and hypoxia on the blue shrimp Litopenaeus stylirostris survival and physiological response in relation to molt stage. Aquaculture, 2008, 274(2-4): 398-407 DOI:10.1016/j.aquaculture.2007.11.033 |
Qian JH, Li ZM, Liu JY, et al. Acute toxicity of ammonia-N and its effect on the immune parameters of Fenneropenaeus merguiensis. Journal of Applied Oceanography, 2016, 35(2): 211-216 [ 钱佳慧, 栗志民, 刘建勇, 等. 氨氮对墨吉明对虾的急性毒性及对其免疫因子的影响. 应用海洋学学报, 2016, 35(2): 211-216 DOI:10.3969/J.ISSN.2095-4972.2016.02.009] |
Qiu DQ, Zhou XJ, Qiu MS, et al. Research on anti-disease ability of Litopenaeus vannamei and the biological control of Vibrio parahaemolyticus bacteriophage under stresses of ammonia nitrogen. Acta Hydrobiologica Sinica, 2008, 32(4): 455-461 [ 邱德全, 周鲜娇, 邱明生. 氨氮胁迫下凡纳滨对虾抗病力和副溶血弧菌噬菌体防病效果研究. 水生生物学报, 2008, 32(4): 455-461 DOI:10.3321/j.issn:1000-3207.2008.04.002] |
Racotta IS, Hernándezherrera R. Metabolic responses of the white shrimp, Penaeus vannamei, to ambient ammonia. Comparative Biochemistry & Physiology Part A: Molecular & Integrative Physiology, 2000, 125(4): 437-443 |
Ruyet PL, Chartois H, Quemener L. Comparative acute ammonia toxicity in marine fish and plasma ammonia response. Aquaculture, 1995, 136(1-2): 181-194 DOI:10.1016/0044-8486(95)01026-2 |
Shao XB, Lü YL, Li K, et al. The acute toxicity of ammonia nitrogen to Scylla serrata, and the effects of temperature to the rate of oxygen consumption and suffocation point. Journal of Zhejiang Ocean University (Natural Science), 2011, 30(6): 511-514 [ 邵鑫斌, 吕永林, 李凯, 等. 氨氮对锯缘青蟹的急性毒性和温度对其耗氧率、窒息点的影响. 浙江海洋学院学报(自然科学版), 2011, 30(6): 511-514 DOI:10.3969/j.issn.1008-830X.2011.06.008] |
Wang WN, Wang AL, Zhang YJ, et al. Effects of nitrite on lethal and immune response of Macrobrachium nipponense. Aquaculture, 2004, 232(1): 679-686 |
Wang Y, Hu YB, Jiang NC. Effect of ammonia nitrogen and nitrite nitrogen on immune enzymes of Macrobrachium rosenbergii. Journal of Zhejiang University (Science Edition), 2005, 32(6): 698-705 |
王玥, 胡义波, 姜乃澄. 氨态氮、亚硝态氮对罗氏沼虾免疫相关酶类的影响. 浙江大学学报(理学版), 2006, 32(6): 698-705 |
Wang Y, Li J, Zhang Z, et al. Effect of pH and ammonia-N stresses on HSP90 gene expression of Fenneropenaeus chinensis. Progress in Fishery Sciences, 2013, 34(5): 43-50 [ 王芸, 李健, 张喆, 等. pH、氨氮胁迫对中国对虾HSP90基因表达的影响. 渔业科学进展, 2013, 34(5): 43-50 DOI:10.3969/j.issn.1000-7075.2013.05.007] |
Wang ZJ, Chen SQ, Cao DZ, et al. Effects of acute ammonia nitrogen stress on histopathology of gill and liver and enzyme activities of juvenile Verasper variegatus. Progress in Fishery Sciences, 2017, 38(2): 61-69 [ 王贞杰, 陈四清, 曹栋正, 等. 急性氨氮胁迫对圆斑星鲽(Verasper variegatus)幼鱼鳃和肝组织结构及相关酶活性的影响. 渔业科学进展, 2017, 38(2): 61-69] |
Xiao W, Li DY, Xu Y, et al. Effects of chronic external ammonia stress on growth, immunity and metabolism of juvenile GIFT tilapia (Oreochromis niloticus). South China Fisheries Science, 2015, 11(4): 81-87 [ 肖炜, 李大宇, 徐杨, 等. 慢性氨氮胁迫对吉富罗非鱼幼鱼生长、免疫及代谢的影响. 南方水产科学, 2015, 11(4): 81-87 DOI:10.3969/j.issn.2095-0780.2015.04.012] |
Yao CL, Wang WN, Wang AL. Research progress of superoxide dismutase in aquatic animals. Marine Science, 2003, 27(10): 18-21 [ 姚翠鸾, 王维娜, 王安利. 水生动物体内超氧化物歧化酶的研究进展. 海洋科学, 2003, 27(10): 18-21 DOI:10.3969/j.issn.1000-3096.2003.10.005] |
Yue F, Pan LQ, Xie P, et al. Effects of ammonia exposure on prophenoloxidase system and immune parameters of swimming crab Portunus trituberculatus. Journal of Fishery Sciences of China, 2010, 17(4): 761-770 [ 岳峰, 潘鲁青, 谢鹏, 等. 氨氮胁迫对三疣梭子蟹酚氧化酶原系统和免疫指标的影响. 中国水产科学, 2010, 17(4): 761-770] |
Yue F, Pan LQ, Xie P, et al. Immune responses and expression of immune-related genes in swimming crab Portunus trituberculatus exposed to elevated ambient ammonia-N stress. Comparative Biochemistry & Physiology Part A: Molecular & Integrative Physiology, 2010, 157(3): 246-251 |
Zeng YY, Jiang YX, Ai CX7. Effects of ammonia-N stress on the activities of superoxide dismutase and glutathione peroxidase in different tissues and organs of Scylla paramamosain. Journal of Applied Oceanography, 2011, 30(2): 210-215 [ 曾媛媛, 蒋云霞, 艾春香. 氨氮胁迫对拟穴青蟹组织器官中SOD及GPX活性的影响. 应用海洋学学报, 2011, 30(2): 210-215 DOI:10.3969/J.ISSN.1000-8160.2011.02.009] |
Zhang D, Yang K, Su YL, et al. A duplex nested-PCR assay for detection of mud crab reovirus and mud crab dicistrovirus-1. Journal of Fishery Sciences of China, 2013, 20(4): 808-815 [ 张迪, 杨铿, 苏友禄, 等. 青蟹呼肠孤病毒和青蟹双顺反子病毒-1双重巢式PCR检测方法的建立. 中国水产科学, 2013, 20(4): 808-815] |
Zhang WX, Sun SM, Ge XP, et al. Acute effects of ammonia exposure on histopathology of gill, liver and kidney in juvenile Megalobrama amblycephala and the post-exposure recovery. Journal of Fishery Sciences of China, 2015, 39(2): 233-244 [ 张武肖, 孙盛明, 戈贤平, 等. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响. 水产学报, 2015, 39(2): 233-244] |



