2. 农业农村部极地渔业开发重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室 青岛 266071;
4. 上海海洋大学食品学院 上海 201306
2. Key Laboratory of Sustainable Development of Polar Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Drugs and Byproducts of Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. College of Food Sciences and Technology, Shanghai Ocean University, Shanghai 201306
南极磷虾(Euphausia superba)是南极海域资源量最大的单物种生物之一,蕴藏量约为6~10亿t,是南极动物的重要食物来源(岳冬冬等, 2015; Auerswald et al, 2015; Siegel et al, 2010)。南极磷虾的商业开发从20世纪70年代开始,2016年捕捞量为25.83万t (李励年, 2017)。南极磷虾营养丰富、全面,蛋白含量(干样)高达60%-65%,富含8种人体必需氨基酸且比例适宜,是一种优质动物性蛋白质源(聂玉晨等, 2016),且富含磷脂、不饱和脂肪酸、酶、多糖、氨基酸等多种活性物质,是虾糜类制品、蛋白粉、虾油、功能肽等产品的良好原料。目前,世界各国对南极磷虾资源的可持续开发利用均采取非常谨慎的态度,其生产许可和配额发放也极为严格,因此,如何有效提高南极磷虾及其制品的利用率及质量具有重要的现实意义(刘丽, 2015)。在南极磷虾的加工过程中,受船舶设施装备条件以及加工技术水平制约,目前,很大一部分南极磷虾原料均采用船上冷冻保藏并运输到陆地进行二次加工(王南平等, 2012)。在此过程中,南极磷虾在微生物和自身蛋白酶的作用下容易发生自溶、黑化,导致品质劣变,严重影响了南极磷虾品质(Sjödahl et al, 2002; Kimoio et al, 2006)。本文对南极磷虾粗酶液中蛋白酶的基础酶学性质进行了研究,阐明了影响南极磷虾粗酶液酶活的因素,开发了针对南极磷虾粗酶液中蛋白酶活性的抑制剂,为南极磷虾在食品领域的开发利用提供了基础理论数据。
1 材料与方法 1.1 实验材料南极磷虾由辽渔集团提供,为2015年10月在南极海域捕获,在-80℃条件下冷冻保存。
1.2 试剂与仪器 1.2.1 主要试剂三羟甲基氨基甲烷(Tris)·HCl、三氯乙酸(TCA)、二甲基亚砜(DMSO)、抗坏血酸、EDTA·2Na、ZnCl2、MgCl2、CuCl2、FeCl3、AlCl3、CaCl2等金属盐购自国药集团化学试剂有限公司;N-α-D, L-亮氨酸-4-硝基苯胺(BApNA)、碘乙酰胺(Iodoacetamide)、苯甲基磺酰氟(PMSF)、对甲苯磺酰-苯丙氨酰氯甲基酮(TPCK)均购自日本TCI公司。
1.2.2 主要仪器UV-2450UV spectrophotometer (日本Shimadzu公司),HH-1电热恒温水浴锅(常州国华电器有限公司),G154D高压蒸汽灭菌锅(美国ZEALWAY公司);Mettler Toledo S20 pH计[梅特勒-托利多仪器(上海)有限公司];CR21GⅢ高速冷冻离心机(日本日立),层析柜(北京松源华兴科技发展有限公司),恒温金属浴CHB-100(杭州博日科技有限公司)。
1.3 实验方法 1.3.1 粗酶液的制备取冰冻南极大磷虾,4℃静置解冻,取适量南极磷虾虾头,按虾头:缓冲液=1:2 (m:v)的比例加入事先预冷至4℃、pH为8.0的Tris-HCl缓冲液(50 mmol/L),匀浆,4℃ 11180(×g)离心30 min,取上清液,得粗酶液,并将1%的抗坏血酸溶液加到粗酶液中。
1.3.2 蛋白酶活性测定参考Wu等(2014)方法并做相应改进,将酶液混匀于pH=8.0的50 mmol/L缓冲液中,40℃预热2 min;加入BApNA(10 mmol/L),混匀,40℃反应20 min,加入三氯乙酸(10%)终止反应,对照管为预先加入三氯乙酸(10%)破坏了酶活力的反应体系。每个样品设1个对照、3个平行样。
将每秒转换1 μmol底物所需的酶量定义为1个酶活力单位,即:
酶活力单位=ΔA410 nm/8800×10-6×60×20
式中,ΔA410 nm为样品管吸收值与空白对照管光吸收值的差值;8800为底物BApNA的摩尔消光系数;10-6为单位mol与μmol之间的转换值;20为酶反应时间(min);60为反应时间分钟与秒之间的转换值(Sjödahl et al, 1998)。
1.3.3 最适反应温度的测定以BApNA为底物,将酶置于不同温度条件下(25℃、30℃、35℃、40℃、45℃、50℃和55℃),以确定最适反应温度,测定方法同上。
1.3.4 最适反应pH的测定将粗酶液置于不同pH(5.0、6.0、7.0、8.0、9.0、10.0和11.0)的缓冲溶液中,以BApNA为底物测定酶活力(测定方法同1.3.2),确定最适反应pH值。所用的缓冲液分别为50 mmol/L的K2HPO4-KH2PO4(pH 5.0~6.0)、50 mmol/L的Tris- HCl (pH 7.0~9.0)、50 mmol/L的Na2CO3-NaHCO3 (pH 10.0~11.0)。
1.3.5 金属离子对酶活的影响在pH=8.0、40℃条件下,研究Zn2+、Mg2+、Cu2+、Fe3+、Ca2+和Al3+金属离子对南极磷虾粗酶液中蛋白酶活性的影响,将上述金属离子与酶液混匀,并在pH=8.0、温度30℃的条件下孵育30 min,然后进行酶活测试,测定方法同上,计算不同金属离子对酶活的影响。
抑制率计算公式:抑制率(%)=(不含抑制剂的酶活力-含抑制剂的酶活力)/不含抑制剂的酶活力×100%。
1.3.6 抑制剂对酶活的影响配制不同浓度的苯甲基磺酰氟(PMSF)、EDTA·2Na、碘乙酰胺(IAM)和甲苯磺酰-苯丙氨酸氯甲基酮(TPCK),在pH=8.0、温度30℃的条件下孵育30 min后,测试系列抑制剂对南极磷虾粗酶液中蛋白酶活性的影响,测定方法同上。
1.3.7 EDTA·2Na在不同温度下对蛋白酶活性的影响分别设定5℃、10℃、15℃、20℃、25℃和30℃共6个温度梯度,测定在pH=8.0时,浓度为0.6 mmol/L的EDTA·2Na对南极磷虾粗酶液中蛋白酶活性的影响。
2 结果与讨论 2.1 最适反应温度的测定温度较大程度控制着虾的生长发育,从而影响其体内蛋白酶的活性(薛素燕, 2015)。由图 1可见,当pH=8.0时,温度为25~55℃的反应体系中,该蛋白酶都有活性。在温度为25~40℃范围内,随着温度的逐渐升高,蛋白酶的活性也在逐渐升高,在40℃时,蛋白酶的活性达到最大,在40~55℃范围内,其活性随着温度的升高而降低,最适反应温度为40℃。低温蛋白酶的最适反应温度大多在30~40℃,而目前所用蛋白酶一般为中温蛋白酶,最适反应温度多在50℃左右(Jiang et al, 1992);南极水域水温常年在1~3℃,经过长期的进化适应,南极来源酶已具有适应低温环境的特殊机构和生理生化机制,也具有相对较低的最适反应温度(Salamanca et al, 2001),在低温下仍具有较高的活性。
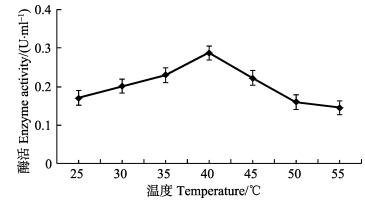
|
图 1 温度对南极磷虾粗酶液中蛋白酶酶活的影响 Figure 1 Effects of temperature on protease activity in Antarctic krill crude enzyme |
酶的活性受环境pH值的影响极为显著,pH值是酸碱度大小的反映,其对磷虾类生理活动的影响是多方面的。酸碱度的作用一方面是衡量环境因素的主要标志,另一方面也为蛋白酶提供适宜的pH值。通常各种酶只有在一定的pH值范围内才表现它的活性(李加儿等, 2009),在不同的pH条件下,影响酶的空间构象或影响酶分子活性中心有关基团的解离或是中间产物的解离状态,从而影响酶的活性。温度为40℃、不同pH(5.0~11.0)下,蛋白酶活性随pH的变化情况如图 2所示。在pH为7.0~8.0时,蛋白酶活性随pH的升高而急剧增加,在pH为8.0~9.0时,蛋白酶活性随pH的升高而急剧下降,表明南极磷虾粗酶液中蛋白酶的最适反应pH为8.0。
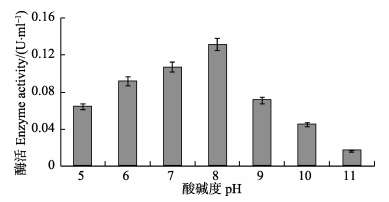
|
图 2 pH对南极磷虾粗酶液中蛋白酶酶活的影响 Figure 2 Effects of pH on protease activity in Antarctic Krill crude enzyme |
金属离子可以通过与小分子或酶分子活性中心的活性基团键合,导致蛋白酶的活性下降(王璋, 1997)。在pH=8.0、40℃条件下,Zn2+、Mg2+、Cu2+、Fe3+、Al3+和Ca2+金属离子对南极磷虾粗酶液中蛋白酶活性的影响如图 3所示,前5种金属离子均能有效抑制蛋白酶活性,且抑制效果随金属离子浓度增加而增强;当离子浓度为0.5 mmol/L时,Zn2+、Mg2+、Cu2+、Fe3+和Al3+金属离子对蛋白酶酶活的抑制率分别为55.02%、55.02%、35.39%、20.67%和41.12%,表明这些金属离子的加入能够有效抑制蛋白酶的催化活性,可以作为辅助的抑制剂。Ca2+是金属蛋白酶活性中心的辅助因子,在一定浓度下,能有效地激活该类蛋白酶的活性(李静等, 2017)。实验结果表明,随着Ca2+浓度的增加,南极磷虾粗酶液的活性也逐渐增加,表明该粗酶液中含有金属蛋白酶。
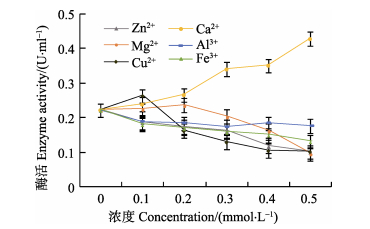
|
图 3 金属离子对南极磷虾粗酶液中蛋白酶酶活的影响 Figure 3 Effects of metal ions on protease activity in Antarctic Krill crude enzyme |
在pH=8.0、40℃条件下,向南极磷虾粗酶液中分别加入苯甲基磺酰氟(PMSF)、EDTA·2Na、碘乙酰胺(IAM)或甲苯磺酰-苯丙氨酸氯甲基酮(TPCK)抑制剂,蛋白酶活性的变化情况见图 4。PMSF(图 4a)和EDTA·2Na(图 4b)对蛋白酶酶活具有较为显著的抑制作用,抑制率随抑制剂浓度的增加而增大,PMSF浓度为8.0 mmol/L时,抑制率为60%;EDTA·2Na浓度为0.6 mmol/L时,抑制率为86.67%;IAM的抑制效果呈现随底物浓度增加先增大再减小的趋势,浓度为2.5 mmol/L时,抑制率为66.67%(图 4c);TPCK低浓度时抑制效果不明显,浓度升高时有一定的抑制作用(图 4d)。甲壳类中大多数消化酶属于丝氨酸蛋白酶和金属蛋白酶(Garcia-Carreño et al, 1994)。苯甲基磺酰氟(PMSF)和EDTA·2Na是典型的丝氨酸蛋白酶和金属蛋白酶抑制剂(Bustos et al, 1999),对本研究中南极磷虾粗酶液抑制效果明显。由于PMSF严重损害呼吸道粘膜、眼睛及皮肤,因此,不能用于食品加工行业。EDTA·2Na是一种金属离子螯合剂,含有4个羧基基团,可与金属离子结合从而抑制蛋白酶的活性(戚正武, 2009),可作为有效的蛋白酶抑制剂应用于南极磷虾的贮藏及运输过程中,延缓南极磷虾的自溶及蛋白的降解,提高南极磷虾的品质。
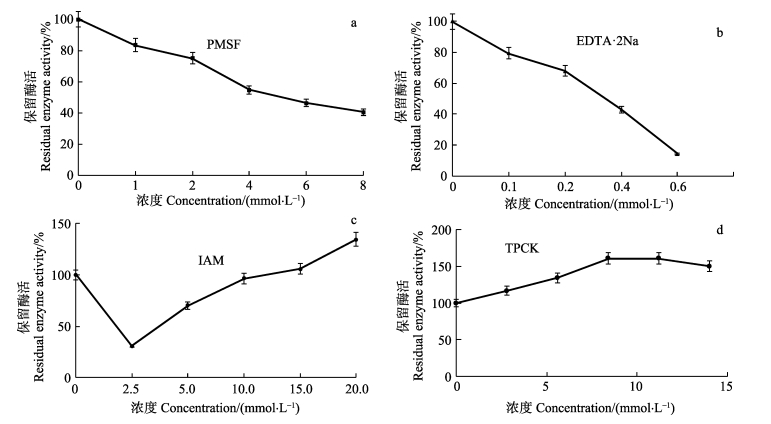
|
图 4 抑制剂对南极磷虾粗酶液中蛋白酶酶活的影响 Figure 4 Effects of inhibitors on protease activity in Antarctic Krill crude enzyme |
为了进一步深入探讨EDTA·2Na在南极磷虾低温贮藏及运输过程中的应用,研究了当pH=8.0、EDTA·2Na浓度为0.6 mmol/L时,温度对酶活抑制率的影响(图 5)。由图 5可知,在5~30℃的低温范围内,随着温度的升高,EDTA·2Na对酶活的抑制效果逐渐增加,到室温25℃时,抑制率已经到达72.82%,当温度为30℃时,抑制率达到85.02%。由此可知,EDTA·2Na能够作为南极磷虾蛋白酶的抑制剂用于南极磷虾的贮藏和运输。
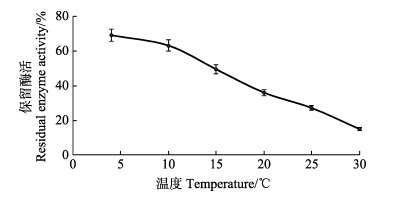
|
图 5 EDTA·2Na在不同温度下对粗酶液中蛋白酶活性的影响 Figure 5 Effects of EDTA·2Na at different temperature on protease activity in Antarctic krill crude enzyme |
从1984年首次南极考察开始,我国就把南极磷虾资源的研究作为重要的考察内容,经过几十年的探索与积累,对其生态系统功能与结构已经有了较为系统的认知,其商业性开发方兴未艾(苏学锋等, 2012)。在传统海洋生物资源日趋衰退或枯竭的背景下,南极磷虾作为全球最大的单种生物资源之一,对缓解人类对水产品的需求具有重要意义(刘志东等, 2012)。本研究阐明了南极磷虾粗酶中蛋白酶的基础酶学性质,开发的抑制剂能够有效抑制酶的活性,能够有效缓解南极磷虾及其制品的品质劣化,对南极磷虾及其制品的加工存储提供了实验支撑。
Auerswald L, Meyer B, Teschke M, et al. Physiological response of adult Antarctic krill, Euphausia superba, to long-term starvation. Polar Biology, 2015, 38(6): 763-780 DOI:10.1007/s00300-014-1638-z |
Bustos RO, Romo CR, Healy MG. Purification of protease-like enzymes from Antarctic krill processing wastewater. Process Biochemistry, 1999, 35(3-4): 327-333 DOI:10.1016/S0032-9592(99)00075-8 |
Garcia-Carreño FL, Hernandez-Cortes PM, Haard NF. Enzymes with peptidase and proteinase activity from the digestive systems of a freshwater and a marine decapod. Journal of Agricultural and Food Chemistry, 1994, 42(7): 1456-1461 DOI:10.1021/jf00043a013 |
Jiang ST, Moody MW, Chen HC. Purification and characterization of protease from digestive tract of grass shrimp. Food Science, 1992, 56(2): 322-326 |
Kimoio K, Kusama S, Murakami K. Purification and characterization of serine proteinases from Euphausia superba. Bioscience Biotechnology and Biochemistry, 2006, 47(3): 529-534 |
Li J, Zhang J, Zhao YX. Progress in research work field with respect to effects of metal ions on protease. China Surfactant Detergent & Cosmetics, 2017, 47(6): 345-351 [ 李静, 张剑, 赵永祥. 金属离子对蛋白酶作用的研究进展. 日用化学工业, 2017, 47(6): 345-351] |
Li JR, Zhang JQ, Xu XJ, et al. Effects of temperature and pH on the protease and amylase activities in skewband grunt Hapalogenys nitens. Progress in Fishery Sciences, 2009, 30(3): 8-12 [ 李加儿, 张建强, 许晓娟, 等. 温度和pH值对斜带髭鲷蛋白酶、淀粉酶活性的影响. 渔业科学进展, 2009, 30(3): 8-12] |
Li LN. Total production of krill fishing in the Antarctic in 2016 is 25. 83×104 t. Fishery Information and Strategy, 2017(1): 77-78 [ 李励年. 2016年南极磷虾捕捞总产量25.83×104 t. 渔业信息与战略, 2017(1): 77-78] |
Liu L. Biological characteristics and development prospect of Antarctic krill. Farm Products Processing, 2015(5): 60-61 [ 刘丽. 南极磷虾的生物特性及其开发前景. 农产品加工, 2015(5): 60-61] |
Liu ZD, Qu YH, Wang Y, et al. The development of the bioactive substances of the Antarctic krill. Natural Product Research and Development, 2012, 24(10): 1491-1495 [ 刘志东, 曲映红, 王媛, 等. 南极磷虾生物活性物质的研究进展. 天然产物研究与开发, 2012, 24(10): 1491-1495 DOI:10.3969/j.issn.1001-6880.2012.10.037] |
Nie YC, Zhang B, Zhao XY, et al. Seasonal variation in lipids and protein content of Antarctic krill (Euphausia superba). Progress in Fishery Sciences, 2016, 37(3): 1-7 [ 聂玉晨, 张波, 赵宪勇, 等. 南极磷虾(Euphausia superba)脂肪与蛋白含量的季节变化. 渔业科学进展, 2016, 37(3): 1-7] |
Qi ZW. Research retrospect on small molecule protease inhibitors and peptide toxins. Chinese Science Bulletin, 2009, 54(18): 2734-2745 [ 戚正武. 小分子蛋白酶抑制剂及多肽毒素的研究回顾. 科学通报, 2009, 54(18): 2734-2745] |
Salamanca MH, Barria C, Asenjo JA, et al. Isolation, purification and preliminary characterization of cryophilic proteases of marine origin. Bioseparation, 2001, 10(4): 237-241 |
Siegel V. The Antarctic krill: Resource and climate indicator, 35 years of German krill research. Journal of Applied Ichthyology, 2010, 26(S1): 41-46 |
Sjödahl J, Emmer Å, Karlstam B, et al. Separation of proteolytic enzymes originating from Antarctic krill (Euphausia superba) by capillary electrophoresis. Journal of Chromatography B: Biomedical Sciences and Applications, 1998, 705(2): 231-241 DOI:10.1016/S0378-4347(97)00552-5 |
Sjödahl J, Emmer Å, Vincent J, et al. Characterization of proteinases from Antarctic krill (Euphausia superba). Protein Expression and Purification, 2002, 26(1): 153-161 DOI:10.1016/S1046-5928(02)00519-3 |
Su XF, Feng DN. Development characteristics and trends of Antarctic krill industry. Food Research and Development, 2012, 33(12): 214-217 [ 苏学锋, 冯迪娜. 南极磷虾产业开发特点及发展趋势. 食品研究与开发, 2012, 33(12): 214-217] |
Wang NP, He L, Cao J, et al. Characteristics and utilization of Antarctic krill. Fisheries Science & Technology Information, 2012, 39(3): 128-131 [ 王南平, 何兰, 曹俊, 等. 南极磷虾的特性和利用. 水产科技情报, 2012, 39(3): 128-131 DOI:10.3969/j.issn.1001-1994.2012.03.005] |
Wang Z. Food Enzymology. Beijing: China Light Industry Press, 1997: 176-202 [ 王璋. 食品酶学. 北京: 中国轻工出版社, 1997: 176-202]
|
Wu ZQ, Wang JR, Shang XM. Purification and characterization of cold adapted proteases from Antarctic krill (Euphausia superba). International Journal of Peptide Research and Therapeutics, 2014, 20(4): 531-543 DOI:10.1007/s10989-014-9415-y |
Xue SY, Mao YZ, Zhao FZ, et al. Effects of temperature on the feeding rate and the digestive enzymes activities of Eogammarus possjeticus. Progress in Fishery Sciences, 2015, 36(4): 95-98 [ 薛素燕, 毛玉泽, 赵法箴, 等. 温度对中华原钩虾(Eogammarus possjeticus)摄食率和消化酶活力的影响. 渔业科学进展, 2015, 36(4): 95-98] |
Yue DD, Wang LM, Huang HL, et al. Status of development and countermeasures on utilization technology of Antarctic krill resources in China. Journal of Agricultural Science and Technology, 2015, 17(3): 159-166 [ 岳冬冬, 王鲁民, 黄洪亮, 等. 我国南极磷虾资源开发利用技术发展现状与对策. 中国农业科技导报, 2015, 17(3): 159-166] |



