菲律宾蛤仔(Ruditapes philippinarum)是我国四大养殖贝类之一。目前,我国蛤仔年产量约300万t, 约占世界蛤仔总产量的90%(张国范等, 2010)。但近年来,由于水质环境恶化,养殖生产盲目扩大,主要蛤仔养殖区病害频发,使产业遭受了巨大的损失,其中弧菌属(Vibrio)的病原菌是蛤仔疾病的主要致病因素(Moreira et al, 2012)。
副溶血弧菌(Vibrio parahaemolyticus)是一种嗜盐的革兰氏阴性菌,是弧菌属的一个种类。副溶血弧菌是海水养殖动物主要病原菌之一,虾蟹(王小玉等, 2006; Krantz et al, 1969)及贝类(Bartley et al, 1971)等水产动物都是其侵染对象。它通过与宿主细胞间相互作用产生致病毒素直至宿主死亡。沈亚林等(1993)报道了副溶血弧菌对健康文蛤(Meretrix meretrix)具有很强的致病性,患病文蛤足伸出、对刺激反应迟纯、外壳边缘附有粘液、离水不久体液溢出。林强等(2012)研究表明,牡蛎(Crassostrea)养殖中水温和副溶血弧菌总量呈正相关,盐度和副溶血弧菌总量呈负相关。副溶血弧菌感染菲律宾蛤仔的研究只有零星报道。仅见于菲律宾蛤仔胃蛋白酶酶解产物能够抑制副溶血弧菌活性的报道(万慧一, 2012; 刘淇等, 2013)。
β-葡聚糖(β-1, 3-glucans)是由β(1→3)糖苷键连接α-D-葡萄糖形成的葡萄糖聚合物,具有增强水产养殖动物自身的免疫力,提高抗逆性,减少死亡率,改善生长状况和饲料利用的效率,促进营养物质代谢等生物功能。现已被广泛认为是一种潜力巨大的免疫促进剂(Williams et al, 1991; Brown et al, 2003)和非特异性免疫的免疫激活剂(杜肖娜等, 2001)。目前,β-葡聚糖作为免疫促进剂在贝类中的应用,仅见于王晶(2007)对菲律宾蛤仔的酚氧化酶的影响的研究,在其他贝类中尚无报道。
与其他无脊椎动物一样,蛤仔缺乏特异性免疫系统,只能依赖其非特异性免疫来防御疾病。TLR2 (Toll- like receptor 2)具有识别病原体,启动天然免疫等功能,在抗感染过程中起到尤为重要的作用(唐深等, 2004)。TLR2信号途径的激活,可以产生促凋亡蛋白(FADD,Fas-associated death domain protein)和Caspase-8,导致表达TLR2的细胞发生凋亡,从而可降低过度的免疫应答,调控机体对入侵病原体的免疫应答在适度的水平(Means et al, 1999)。而动物凝集素也是无脊椎动物抵御病原体入侵过程中的极其重要的因子,可以识别外源物质。此外,动物凝集素能与体液中或细胞表面的糖配体结合,对细胞产生信号,调节细胞与细胞、细胞与基质间的反应(朱月, 2005)。Wang等(2011)在对栉孔扇贝(Chlamys farreri)凝集素基因研究发现,其存在于扇贝TLR信号通路的免疫系统中,在抵御鳗弧菌(Vibrio anguillarum)侵染过程中起着至关重要的作用。
本研究旨在通过不同浸泡浓度β-葡聚糖对蛤仔存活及免疫基因表达的影响,初步了解β-葡聚糖对蛤仔免疫力的作用,为蛤仔亲贝的保种、苗种繁育及池塘养殖的疾病防控提供理论依据。
1 材料与方法 1.1 材料来源本研究菲律宾蛤仔采自大连黑石礁海区的野生群体。蛤仔壳长为2.5~3.5 cm,在实验室暂养1周,养殖水温为18℃~21℃,24 h连续充气培养。副溶血弧菌取自大连海洋大学水产病害研究室。
1.2 菌株的制备菌株接种于NA营养培养基上(取33 g NA培养基用1000 ml蒸馏水加热溶解,于121℃高压灭菌锅中灭菌20 min,倒板备用),7℃时培养24 h,然后用灭菌海水洗下菌苔,以2000 r/min离心10 min,弃掉上清液,收集沉淀,再用灭菌海水洗3次,配成浓度为3×109 cell/ml [108~109 CFU/ml (CFU/ml指的是每毫升样品中含有的细菌菌落总数;CFU/g指的是每克样品中含有的细菌菌落总数)]的菌悬液,用于活菌免疫诱导。
1.3 蛤仔病原菌的人工感染共设置5个实验组,分别为副溶血弧菌感染的蛤仔实验组(C)、100 mg/L β-葡聚糖浸浴蛤仔实验组(A1)、1000 mg/L β-葡聚糖浸浴蛤仔实验组(A2)、100 mg/L β-葡聚糖浸浴后副溶血弧菌感染的蛤仔实验组(B1)、1000 mg/L β-葡聚糖浸浴后副溶血弧菌感染的蛤仔实验组(B2)。每组设3个平行,每个实验组38个健康蛤仔。
用天平称取200 g β-葡聚糖粉末(河北银峰食品科技有限公司,白色粉末,化学式[C6H10O5]n),在容量瓶中加入20 L海水和称取好的粉末,配制成10 g/L的母液(无色透明粘稠液体)备用。向容积为30 L水槽中加入β-葡聚糖母液,配置浓度为100 mg/L(A1,B1)和1000 mg/L(A2,B2)的β-葡聚糖母液。分别向各个实验组放入38个健康蛤仔。β-葡聚糖浸泡1 d后,向B1、B2、C水槽中的蛤仔注射副溶血弧菌,用注射器吸取浓度为3×109 CFU/ml的副溶血弧菌10 μl,从蛤仔壳后缘倾斜插入到壳顶部位,吸取到血液后连同血液和菌液一起注入血腔内,立即放回水槽中。向A1、A2中,以同样的方式注入PBS。
1.4 实时荧光定量PCR在注射副溶血弧菌后的0、1.5、3、6、12和24 h,分别对5个实验组的蛤仔取样。每个时间点取3个个体的鳃组织和外套膜组织,用液氮速冻,储存在–80℃冰箱中备用。将保存好的鳃和外套膜从–80℃冰箱取出,在液氮下研磨后,按照天根生化科技(北京)有限公司的动物组织总RNA提取试剂盒说明书进行总RNA提取,再按照TaKaRa Primer Script TM RT Reagent Kit说明合成cDNA。从本实验室菲律宾蛤仔转录组中选取核心序列,用Primer 5.0设计引物,由大连万泽生物公司合成TLR2,Lectin引物。本研究采用β-actin作为内参基因,由生工生物工程(上海)股份有限公司合成(表 1)。
|
|
表 1 引物序列 Table 1 Primer sequence |
将反转录所得的全部cDNA各取2 μl混合,做为cDNA的混合模板,按照50、51、52、53、54、55倍数梯度稀释,制备目的基因和内参基因的扩增曲线。在每个扩增效率合格后(1.9~2.1),使用SYBR® Premix Ex Taq™Ⅱ(TliRNaseH Plus)试剂盒(TaKaRa,大连)在LightCycler® 480定量PCR仪(Roche,上海)上对候选基因进行扩增,反应体系为20 μl,每个样品3组重复,反应体系见表 2。实验采用两步法PCR反应程序,反应条件为95℃ 30 s;95℃ 5 s;60℃ 30 s,共40个循环。熔解曲线反应条件为95℃ 15 s,60℃ 1 min,60℃~95℃;50℃ 30 s。
|
|
表 2 实时荧光定量PCR反应体系 Table 2 Quantitative real-time PCR detecting system |
24 h后统计各实验组存活率。对于荧光定量结果的分析采用二阶导数2–∆∆Ct法计算2种蛤仔的免疫基因在β-葡聚糖对副溶血弧菌感染的鳃和外套膜中相对表达量的变化。2种蛤仔免疫相关基因的平均标准化表达量均用C组表达量校准。最终计算结果用平均值±标准差(Mean±SD)表示。
2–∆∆Ct具体计算方法如下:
∆Ct=目的基因Ct-内参基因Ct;
∆∆Ct=实验组△Ct-对照组△Ct;
最后,计算2–∆∆Ct值,得出的值就是基因的相对表达量。
结果分析比较采用单因素方差分析(One-way ANOVA),用SPSS20.0处理数据,差异显著性设置为P < 0.05。
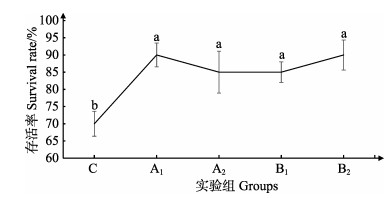
2 结果 2.1 各实验组存活率比较各实验组蛤仔存活率见图 1。从图 1可以看出,A1、A2、B1和B2组的存活率显著高于对照组(P < 0.05),但彼此之间无显著差异(P > 0.05)。
|
图 1 不同实验组的存活率 Figure 1 Survival rate of different experimental groups C:未经β-葡聚糖浸泡,感染副溶血弧菌;A1:100 mg/L β-葡聚糖浸泡,未感染副溶血弧菌;A2:1000 mg/L β-葡聚糖浸泡,未感染副溶血弧菌;B1:100 mg/L β-葡聚糖浸泡,感染副溶血弧菌;B2:1000 mg/L β-葡聚糖浸泡,感染副溶血弧菌。下同。相同字母表示无显著差异(P > 0.05),不同字母表示具有显著性差异(P < 0.05) C: Without β-glucan, infected with V. parahaemolyticus; A1: 100 mg/L β-glucan, without V. parahaemolyticus infection; A2: 1000 mg/L β-glucan, without V. parahaemolyticus infection; B1: 100 mg/L β-glucan, with V. parahaemolyticus infection; B2: 1000 mg/L β-glucan, with V. parahaemolyticus infection. The same as below. There is no significant difference between the same letters (P > 0.05), and the different letters mean significant difference (P < 0.05) |
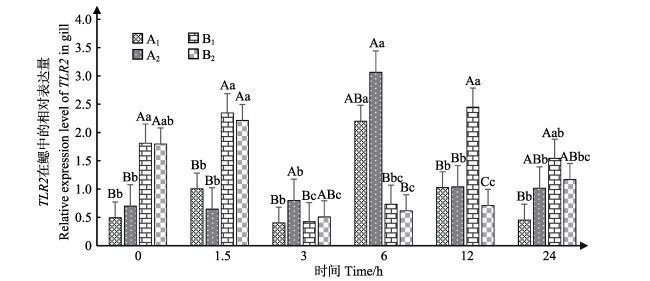
蛤仔鳃中TLR2表达情况见图 2。结果显示,A1和A2组中,TLR2在6 h时达到峰值,显著高于其他时间(P < 0.05),其他时间段均无显著差异(P > 0.05)。在B1和B2组中,TLR2呈先升高后降低的趋势,在1.5 h时达到峰值。在6 h时,B1、B2组TLR2相对表达量显著低于A1、A2组(P < 0.05)。12 h时,B1组中,TLR2相对表达量显著高于其他组(P < 0.05)。24 h时,B1组表达量仍显著高于A1组(P < 0.05)。B1组0、1.5和12 h时,TLR2基因相对表达量无显著差异,但都显著高于3和6 h时TLR2相对表达量(P < 0.05)。B2组在0、1.5 h时,TLR2相对表达量显著高于其他时间(24 h除外)(P < 0.05)。
|
图 2 鳃组织中TLR2的表达 Figure 2 The expression level of TLR2 in gill 同一时间,大写字母表示组间差异显著(P < 0.05),相同字母表示无显著差异(P > 0.05);同一实验条件下,不同小写字母表示各组在不同时间点差异显著(P < 0.05),相同字母者表示差异不显著(P > 0.05)。下同 In the same experimental period, different capital letters indicate significant difference (P < 0.05), the same letter indicate no significant difference (P > 0.05); In the same experimental treatment, different small letters indicate significant difference(P < 0.05), the same letter indicate no significant difference (P > 0.05). The same as below |
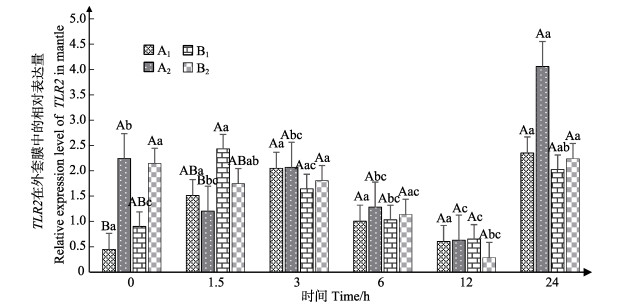
蛤仔外套膜中TLR2表达情况见图 3。结果显示,同一时间下,0 h时A1组TLR2相对表达量显著低于A2组(P < 0.05)。所有实验组TLR2在3~12 h之间表达量逐渐降低,而在24 h时,A2组表达量最高。但3~ 24 h时,各实验组TLR2相对表达量无显著差异(P > 0.05)。相同实验条件下,A2、B1、B2组的TLR2相对表达量在24 h显著高于12 h时各组对应的TLR2相对表达量(P < 0.05)。
|
图 3 外套膜中TLR2的表达 Figure 3 The expression of TLR2 in mantle |
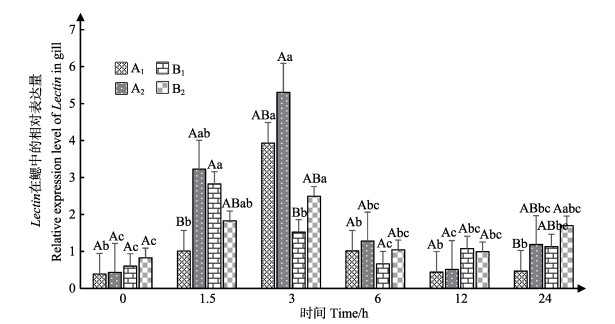
蛤仔鳃中Lectin表达情况见图 4。结果表明,各个实验组Lectin表达趋势均为先升高后下降。在1.5~3 h之间Lectin表达出现峰值。1.5 h时,A2、B1组的Lectin相对表达量显著高于A1组(P < 0.05)。3 h时,A1组的Lectin相对表达量显著高于B1组(P < 0.05)。6、12 h时,各实验组的Lectin相对表达量无显著差异(P > 0.05),且在6~24 h之间,各实验组Lectin表达模式趋于稳定,无显著变化(P > 0.05)。
|
图 4 鳃组织中Lectin的表达 Figure 4 The expression of Lectin in gill |
蛤仔外套膜中Lectin表达情况见图 5。结果表明,相同时间下,0 h时,B2实验组Lectin相对表达量显著高于其他实验组。3 h时,各实验组Lectin相对表达量无显著差异(P > 0.05)。12 h时,A1、A2和B1、B2组之间,Lectin相对表达量无显著差异,但B1、B2组Lectin相对表达量显著高于A1、A2组(P < 0.05)。24 h时,B2组Lectin相对表达量显著高于其他实验组(P < 0.05)。B2组Lectin表达量始终高于B1组,但只有0和24 h时差异显著(P < 0.05)。
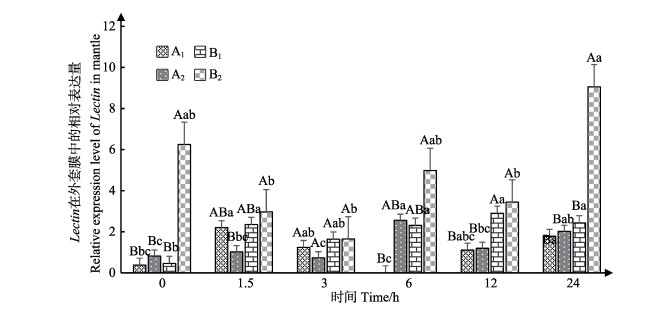
|
图 5 外套膜中Lectin的表达 Figure 5 The expression of Lectin in mantle |
β-葡聚糖是一种广泛地存在于细菌、真菌、植物内部用于构筑多种细胞壁的材料。β-葡聚糖有很好的应用前景,已被广泛认为是一种非特异性免疫激活剂,也可促进与补体相关的特异性抗体应答。本研究结果表明,β-葡聚糖可有效提高副溶血弧菌感染的蛤仔的存活率,且浸泡1000 mg/Lβ-葡聚糖的蛤仔的存活率高于浸泡100 mg/Lβ-葡聚糖的蛤仔。目前,关于β-葡聚糖对鱼类免疫作用的研究已有较多报道(刘露等, 2017; Robertsen et al, 1990; Rørstad et al, 1993; Aakre et al, 1994)。但β-葡聚糖在双壳贝类的研究相对较少,Anderson等(2011)在弗吉尼亚牡蛎(Crassostrea virginica)中发现,β-葡聚糖能提高循环血细胞的数量用于防御反应,促进血细胞的免疫活性,并加强血液凝集。
菲律宾蛤仔为滤食性动物,滤食水中的β-葡聚糖会产生一系列免疫作用。本研究发现,在鳃中,A1和A2组的TLR2在6 h时达到峰值,显著高于其他时间(P < 0.05),在其他时间段均无显著差异(P > 0.05)。在B1和B2组中,TLR2呈先升高后降低的趋势,在1.5 h时达到峰值。可以看出,感染组较未感染组提前出现基因表达峰,说明副溶血弧菌感染蛤仔后,蛤仔能迅速的表达TLR2来应对LPS的感染。但相同时间下,不同β-葡聚糖浸浴浓度感染组内(即B1和B2组)数据无明显规律更没有显著差异,不同β-葡聚糖浸浴浓度的未感染组(即A1和A2组)在3~6 h时,A2组高于A1组,但差异不显著。而外套膜中,感染组与未感染组之间基因表达量无显著差异。目前,在露斯塔野鲮(Labeo rohita)(Samanta et al, 2012)、大菱鲆(Scophthalmus maximus)(Zhang et al, 2016)和石斑鱼(Epinephelus coioides)(Li et al, 2011a)的相关研究中发现,TLR2的表达在寄生虫和细菌感染下,均出现显著的升高。另外,在贝类相关的研究中,栉孔扇贝存在一个相当典型的MyD88依赖的TLR信号通路,并确定该通路在扇贝固有免疫系统,特别是在抵御鳗弧菌(Vibrio anguillarum)侵染过程中起至关重要的作用,其具体机制可能包括调控抗氧化基因的表达、维持内环境稳定以及调控抗菌蛋白基因的表达(Wang et al, 2011)。Qiu等(2007)发现,栉孔扇贝血细胞中,cftoll-1在1 μg/ml LPS刺激下表达量在6 h时增加了2倍,但在100 ng/ml浓度时,出现表达下调。结果表明,cftoll-1的表达可能受LPS的诱导,这种调节是剂量依赖性的。关于长牡蛎(Crassostrea gigas)中TLR的研究表明,TLR定位于内涵体中发挥作用,并且TLR通路中TLR被Oyster Herpesvirus-1 (Oshv-1)诱导上调并且在一些时间点与对照形成显著差异(P < 0.05)(杜以帅, 2013)。
在本研究中,各个实验组的鳃组织中,Lectin表达趋势均为先升高后下降。在1.5~3 h之间,Lectin表达出现峰值。说明β-葡聚糖对Lectin表达有促进作用且副溶血弧菌的感染引起了机体内的免疫应答。外套膜B组内浸泡浓度1000 mg/L的实验组比100 mg/L组各时段都有更高的表达量,但只有0和24 h时差异显著(P < 0.05)。相对表达量的增值与β-葡聚糖浓度的关系仍需要进一步探究。在甲壳纲中,段亚飞等(2017)报道,粪肠球菌(Enterococcusfaecalis)能引起脊尾白虾(Exopalaemon carinicauda)血细胞和肝胰腺中的C型凝集素基因(CTL)表达出现先增加后下降的趋势。CTL可作为脊尾白虾感染粪肠球菌疾病的监测指标。对于双壳贝类Lectin,谈艳苗(2013)研究发现,栉孔扇贝Cflec290在血细胞以及其他各组织中均有表达,但在外套膜、肾脏以及性腺中的转录水平最高,血细胞、鳃和肝胰腺次之,在肌肉中的转录水平较弱。另外,王昊(2006)研究发现,在革兰氏阳性菌溶壁微球菌(Micrococcus lysodeikticus)和革兰氏阴性菌鳗弧菌刺激后,栉孔扇贝血液中CFLec-1的表达均显著高于对照组,并且呈明显的随时间变化趋势,其结果说明,CFLec-1不仅具有识别入侵微生物的功能,而且可能作为效应因子起到直接杀灭入侵微生物的作用。其他贝类的相关研究也得到了相同的表达趋势(吴彪等, 2013; 李猛等, 2015),这表明,凝集素基因参与对外源生物入侵的免疫应答,有助于提高免疫防御能力。关于菲律宾蛤仔Lectin免疫应答方面的研究,Adhya等(2010)发现,各组织中Lectin在帕金虫(Perkinsus olseni)和弧菌(Vibrio tapetis)感染后表达量均显著上升。Li等(2011b)发现,鳗弧菌刺激后,菲律宾蛤仔血细胞中唾液酸结合凝集素(SABL)表达呈先下降后上升的趋势。
本研究表明,β-葡聚糖浸浴蛤仔会增加TLR2和Lectin的相对表达量。被β-葡聚糖浸浴过的蛤仔被副溶血弧菌感染后,会快速表达TLR2和Lectin,识别异体物质。本研究为蛤仔亲贝的保种、苗种繁育及池塘养殖的疾病防控提供一定的理论依据。
Aakre R, Wergeland HI, Aasjord PM, et al. Enhanced antibody response in Atlantic salmon (Salmo salar L.) to Aeromonas salmonicida cell wall antigens using a bacterin containing β-1, 3-M-Glucan as adjuvant. Fish & Shellfish Immunology, 1994, 4(1): 47-61 |
Adhya M, Choi KS, Yu Y, et al. Expression and localization of MCsialec, a sialic acid-specific lectin in the marine bivalve Manila clam, Ruditapes philppinarum. Journal of Fish Diseases, 2010, 33(11): 889-899 DOI:10.1111/jfd.2010.33.issue-11 |
Anderson RS, Ozbay G, Kingsley DH, et al. Oyster hemocyte mobilization and increased adhesion activity after beta-glucan administration. Journal of Shellfish Research, 2011, 30(3): 635-641 DOI:10.2983/035.030.0306 |
Bartley CH, Slanetz LW. Occurrence of Vibrio parahaemolyticus in estuarine waters and oysters of New Hampshire. Applied Microbiology, 1971, 21(5): 965-966 |
Brown GD, Gordon S. Fungal beta-glucans and mammalian immunity. Immunity, 2003, 19(3): 311-315 DOI:10.1016/S1074-7613(03)00233-4 |
Du XN, Wang RT, Liu DW, et al. Preliminary study on anti-tumor mechanism of polyporus polysaccharide. Chinese Journal of Microbiology and Immunology, 2001, 21(3): 296-297 [ 杜肖娜, 王润田, 刘殿武, 等. 中药猪苓多糖抑瘤作用机理的初探. 中华微生物学和免疫学杂志, 2001, 21(3): 296-297 DOI:10.3760/j:issn:0254-5101.2001.03.022] |
Du YS. Study on the Toll like receptor and RIG-I like receptor signal pathways and their immune functions in Pacific oyster (Crassostrea gigas). Doctoral Dissertation of University of Chinese Academy of Sciences, 2013 [杜以帅.长牡蛎(Crassostrea gigas)TLR和RLR信号通路的免疫功能研究.中国科学院大学博士研究生学位论文, 2013] http://cdmd.cnki.com.cn/Article/CDMD-80068-1015387780.htm
|
Duan YF, Li J, Li JT, et al. The expression profiles of immunity-related genes after pathogenic Enterococcus faecalis challenge in Exopalaemon carinicauda. Progress in Fishery Sciences, 2017, 38(5): 148-155 [ 段亚飞, 李健, 李吉涛, 等. 致病性粪肠球菌对脊尾白虾(Exopalaemon carinicauda)免疫相关基因表达的影响. 渔业科学进展, 2017, 38(5): 148-155] |
Krantz GE, Colwell RR, Lovelace E. Vibrio parahaemolyticus from the blue crab Callinectes sapidus in Chesapeake Bay. Science, 1969, 164(3885): 1286 DOI:10.1126/science.164.3885.1286 |
Li C, Yu S, Zhao J, et al. Cloning and characterization of a sialic acid binding lectins (SABL) from Manila clam Venerupis philippinarum. Fish & Shellfish Immunology, 2011a, 30(4-5): 1202-1206 |
Li M, Zhou SM, Liu L, et al. Molecular clone and expression of C-type lectin in Meretrix Meretrix. Oceanologia et Limnologia Sinica, 2015, 46(5): 1186-1192 [ 李猛, 周素明, 刘璐, 等. 文蛤(Meretrix meretrix)C-型凝集素基因的分子克隆及表达分析. 海洋与湖沼, 2015, 46(5): 1186-1192] |
Li YW, Luo XC, Dan XM, et al. Orange-spotted grouper (Epinephelus coioides) TLR2, MyD88 and IL-1β involved in anti-Cryptocaryon irritans, response. Fish & Shellfish Immunology, 2011b, 30(6): 1230-1240 |
Lin Q, Li NQ, Fu XZ, et al. The relationship of Vibrio parahaemolyticus densities and water quality factor during oyster culture. Journal of Fisheries of China, 2012, 36(3): 415-421 [ 林强, 李宁求, 付小哲, 等. 牡蛎养殖过程中副溶血弧菌与水质因子间的关系. 水产学报, 2012, 36(3): 415-421] |
Liu L, Li D, Xiao Q. Effect of beta glucan on the related immune function of fish. Feed Research, 2017(1): 13-18 [ 刘露, 李代宗, 肖勤. β-葡聚糖对鱼类相关免疫功能的影响. 饲料研究, 2017(1): 13-18] |
Liu Q, Xie S, Zhao L, et al. Antimicrobial activity of hydrolysates from Ruditapes philippinarum. Progress in Fishery Sciences, 2013, 34(2): 109-113 [ 刘淇, 谢沙, 赵玲, 等. 菲律宾蛤仔酶解产物的抑菌活性. 渔业科学进展, 2013, 34(2): 109-113 DOI:10.3969/j.issn.1000-7075.2013.02.015] |
Means TK, Wang S, Lien E, et al. Human toll-like receptors mediate cellular activation by Mycobacterium tuberculosis. Journal of Imnlunology, 1999, 163(7): 3920-3927 |
Moreira R, Balseiro P, Planas JV, et al. Transcriptomics of in vitro immune-stimulated hemocytes from the Manila clam Ruditapes philippinarum using high-throughput sequencing. PLoS One, 2012, 7(4): e35009 DOI:10.1371/journal.pone.0035009 |
Qiu L, Song L, Xu W, et al. Molecular cloning and expression of a Toll receptor gene homologue from Zhikong Scallop, Chlamys farreri. Fish & Shellfish Immunology, 2007, 22(5): 451-466 |
Robertsen B, Rørstad G, Engstad R, et al. Enhancement of non-specific disease resistance in Atlantic salmon, Salmo salar L. by a glucan from Saccharomyces cerevisiae cell walls. Journal of Fish Diseases, 1990, 13(5): 391-400 DOI:10.1111/jfd.1990.13.issue-5 |
Rørstad G, Aasjord PM, Robertsen B. Adjuvant effect of a yeast glucan in vaccines against furunculosis in Atlantic salmon (Salmo salar L.). Fish & Shellfish Immunology, 1993, 3(3): 179-190 |
Samanta M, Swain B, Basu M, et al. Molecular characterization of toll-like receptor 2 (TLR2), analysis of its inductive expression and associated down-stream signaling molecules following ligands exposure and bacterial infection in the Indian major carp, rohu (Labeo rohita). Fish & Shellfish Immunology, 2012, 32(3): 411-425 |
Shen YL, Yu YS. Pathogenicity of Vibrio parahaemolyticus to healthy clam Meretrix meretrix and the prevention and treatment of Vibrio infections. Journal of Fisheries of China, 1993, 17(3): 249-252 [ 沈亚林, 于业绍. 副溶血弧菌对文蛤的致病性及其防治. 水产学报, 1993, 17(3): 249-252] |
Tan YM. Agglutination activities of haemolymph and tissue extracts in scallop Chlamys farreri and development and characterization of monoclonal antibody of a C-type lectin. Doctoral Dissertation of Ocean University of China, 2013 [谈艳苗.栉孔扇贝(Chlamys farreri)组织凝集活性分析及一种C-型凝集素单克隆抗体的研制和特性研究.中国海洋大学博士研究生学位论文, 2013] http://cdmd.cnki.com.cn/Article/CDMD-10423-1013354604.htm
|
Tang S, Leng J. The research progress of TLR family and its function. Progress in Microbiology and Immunology, 2004, 32(2): 42-45 [ 唐深, 冷静. TLR家族及其功能研究进展. 微生物学免疫学进展, 2004, 32(2): 42-45 DOI:10.3969/j.issn.1005-5673.2004.02.013] |
Wan HY. Study on the preparation of antibacterial hydrolysates of Ruditapes philippinarum and its antimicrobial mechanism. Master's Thesis of Qingdao University, 2012 [万慧一.菲律宾蛤仔(Ruditapes philippinarum)抑菌酶解物的制备与作用机理研究.青岛大学硕士研究生学位论文, 2012] http://cdmd.cnki.com.cn/article/cdmd-11906-1012346480.htm
|
Wang H. Study on Lectin gene family of scallop Chlamys farreri. Master's Thesis of Graduate School of Chinese Academy of Sciences, 2006 [王昊.栉孔扇贝凝集素家族基因的研究.中国科学院研究生院硕士研究生学位论文, 2006] http://cdmd.cnki.com.cn/Article/CDMD-80068-2006087657.htm
|
Wang M, Yang J, Zhou Z, et al. A primitive Toll-like receptor signaling pathway in mollusk Zhikong scallop Chlamys farreri. Developmental & Comparative Immunology, 2011, 35(4): 511-520 |
Wang XY, Yu DH, Huang GJ, et al. Preliminary study on the virulence of Vibrio parahaemolyticus to Penaeus vannamei and the antibacterial activity of flavonoids. Reservoir Fisheries, 2006, 26(3): 89-91 [ 王小玉, 喻达辉, 黄桂菊, 等. 副溶血弧菌对南美白对虾致病力及黄酮抗菌作用初步研究. 水利渔业, 2006, 26(3): 89-91 DOI:10.3969/j.issn.1003-1278.2006.03.038] |
Wang J. Effects of several immunostimulants on the yield, activities of phenoloxidase and the number, ultrastructure of hemocytes in clam Ruditapes philippinarum. Masterxs Thesis of Ocean University of China, 2007 [王晶.几种免疫促进剂对菲律宾蛤仔(Ruditapes philippinarum)酚氧化酶的产量和活性以及血细胞的数量和超微结构的影响.中国海洋大学硕士研究生学位论文, 2007] http://cdmd.cnki.com.cn/Article/CDMD-10423-2008012661.htm
|
Williams DL, Pretus HA, McNamee RB, et al. Development, physicochemical characterization and preclinical efficacy evaluation of a water soluble glucan sulfate derived from Saccharomyces cerevisiae. Immunopharmacology, 1991, 22(3): 139-156 DOI:10.1016/0162-3109(91)90039-2 |
Wu B, Chi CF, Yang AG, et al. A preliminary study on the maternal transfer and bacteriostasis of a C-type lectin in scallop (Patinopecten yessoensis). Journal of Fisheries of China, 2013, 37(5): 777-783 [ 吴彪, 迟长凤, 杨爱国, 等. 虾夷扇贝C-型凝集素母源传递与抑菌作用的初步研究. 水产学报, 2013, 37(5): 777-783] |
Zhang GF, Yan XW. Clam aquaculture study. Beijing: Science Press, 2010: 113-135 [ 张国范, 闫喜武. 蛤仔养殖学. 北京: 科学出版社, 2010: 113-135]
|
Zhang H, Hu G, Liu Q, et al. Cloning and expression study of a Toll-like receptor 2 (tlr2) gene from turbot, Scophthalmus maximus. Fish & Shellfish Immunology, 2016, 59: 137-148 |
Zhu Y. The function and application of agglutinin. Fisheries Science, 2005, 24(12): 48–49 [朱月.凝集素的作用与应用. 2005, 24(12): 48–49] http://kns.cnki.net/KCMS/detail/detail.aspx?filename=CHAN200512015&dbname=CJFD&dbcode=CJFQ
|




