2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
蛋白酶是水解蛋白质肽链的一类酶的总称,在动植物、微生物中均有分布。产蛋白酶的微生物种类主要包括细菌、霉菌和放线菌等(史翠娟等, 2015)。蛋白酶在医学领域主要用于治疗心血管病等疾病,同时在治疗脓毒症、消化系统疾病、炎症、囊性纤维化、视网膜疾病和牛皮癣等疾病方面也有所应用(Gomis-Ruth et al, 2003)。目前,在食品、洗涤剂、化妆品及抗肿瘤药物等和疾病的机理研究等方面也有诸多应用(荆谷等, 2002)。迄今为止,有关抗肿瘤活性蛋白酶只有少量报道(Weildle et al, 2014; 纪明开等, 2017)。
芽孢杆菌(Bacillus sp.)N11-8由南极表层海水中分离获得(Zheng et al, 2016),其所产蛋白酶PBN11-8具有较好的应用潜力(郑兰红等, 2015)。为获得更高的产酶量,对芽孢杆菌N11-8的培养基与培养条件进行优化。优化实验采用正交实验或响应面实验,其中,正交实验是一种高效处理多因素优化问题的方法,采取部分实验代替全面实验(何磊等, 2011; 李洪康等, 2016)。响应面法是采用拟合因素响应值之间的函数关系,精确分析因子与响应值关系以优化工艺参数的方法,适用性强(刘志祥等, 2009)。响应面法明显优于正交实验,具有实验次数少、周期短、精度高等特点,可快速有效确定多因子系统最佳条件(刘志祥等, 2009; 王茜等, 2015)。本研究通过单因素法进行前期优化,再运用响应面法建立模型,分析处理验证,确定培养基与培养条件,从而提高蛋白酶活力。
1 材料与方法 1.1 材料 1.1.1 菌株与培养芽孢杆菌N11-8由南极表层海水分离获得(Zheng et al, 2016)。ND培养基(牛肉膏0.3%,蛋白胨1%,NaCl 0.5%,pH 7);固体ND培养基(牛肉膏0.3%,蛋白胨1%,NaCl 0.5%,琼脂2%,pH 7)。
1.1.2 实验试剂葡萄糖、Folin-酚、干酪素等(国药集团化学试剂有限公司),蛋白胨(北京双旋),可溶性淀粉(汕头市西陇化工),酵母浸粉(英国Oxoid公司)。
1.2 方法 1.2.1 蛋白酶活力测定采用Folin-酚法测定蛋白酶活力,具体方法参考国家标准GB/T 23527-2009。每毫升酶液在30℃、pH 8条件下水解酪蛋白,每分钟释放1 μg酪氨酸所需的酶量定义为1个酶活单位(杨娟等, 2017)。
1.2.2 单因素实验在发酵培养基的基础上,其他条件不变,依次测定不同碳源、不同氮源、碳源浓度、氮源浓度、磷酸盐浓度、NaCl浓度、不同金属离子、金属离子浓度、接种量、装液量、转速、温度和初始pH对菌株产酶的酶活影响(马子宾等, 2015; 张丹等, 2011; 张增祥等, 2010)。
1.2.3 响应面优化实验Plackett-Burman(PB)实验参照王东等(2016)和梁昌聪等(2014),在单因素实验结果基础上,选出7个对产酶量有较大影响的因子(可溶性淀粉、蛋白胨、酵母浸粉、NaCl、FeCl3·6H2O、KH2PO4),设计PB实验(表 1、表 2),进一步筛选出3个显著影响因子。最陡爬坡实验根据PB实验的结果,以蛋白胨、酵母浸粉、温度为主要影响因素设计本实验,培养基中其他因素分别为可溶性淀粉(3 g/L)、NaCl (5 g/L)、FeCl3·6H2O (2 mmol/L)、KH2PO4 (1 g/L)、装液量(50 ml),转速(200 r/min),培养时间(60 h)(表 4)。中心组合实验分别以蛋白胨添加量、酵母浸粉添加量和温度为自变量,以蛋白酶的酶活为指标进行液体发酵条件优化(表 5、表 6)。
|
|
表 1 Plackett-Burman实验因子水平 Tab.1 The level of factors in Plackett-Burman assay |
|
|
表 2 Plackett-Burman实验筛选主要影响因素 Tab.2 Screening of main influence factors in Plackett-Burman |
|
|
表 3 Plackett-Burman实验统计分析 Tab.3 Statistical analysis of the Plackett-Burman assay |
|
|
表 4 最陡爬坡路径设计方法及实验结果 Tab.4 Experimental design and results of steepest ascent and corresponding results |
|
|
表 5 中心组合因素与水平 Tab.5 Factors and coded values of central composite test design |
|
|
表 6 中心组合实验设计及结果 Tab.6 Experimental design and the results of central composite test |
|
|
表 7 响应面模型方差分析 Tab.7 Variance analysis of the response surface model |
采用Design-Expert软件(Version 7.0 Stat-Ease Inc., USA)对响应面实验得到的数据进行线性回归和方差分析。模型及因素的显著性均通过F值考察(P < 0.05),所有实验重复3次,结果以蛋白酶酶活力表示。
2 结果与分析 2.1 单因素实验 2.1.1 不同碳、氮源对芽孢杆菌N11-8液体发酵的影响从图 1a可以发现,当可溶性淀粉为碳源时,产酶量最高。因此,培养基最适碳源为可溶性淀粉。酶的合成往往受到分解代谢阻遏的控制。葡萄糖等易代谢的碳水化合物对细菌的蛋白酶产量都有阻遏作用,在实践中往往采用代谢缓慢的碳源,或者降低糖浓度并采用连续流加法(郭军等, 2003)。图 1b显示,在实验选取的7种氮源中,蛋白胨具有最强的竞争力(产酶量最高)。

|
图 1 不同碳、氮源对芽孢杆菌N11-8产蛋白酶的影响 Fig.1 Effects of different carbon and nitrogen source on the production of protease by Bacillus sp. N11-8 |
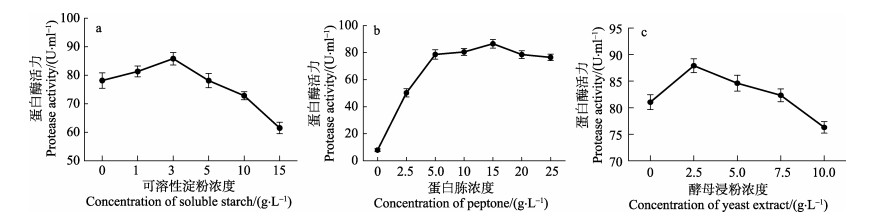
图 2a显示,随着可溶性淀粉浓度的不断增加,产酶量逐渐上升;可溶性淀粉浓度达到3 g/L时,产酶量达到最高。因此,可溶性淀粉浓度宜取3 g/L。从图 2b可以发现,随着蛋白胨浓度的增加,产酶量不断增加,在蛋白胨浓度达到15 g/L时,产酶量达到最高。因此,蛋白胨浓度宜取15 g/L。从图 2c可知,在酵母浸粉浓度达到2.5 g/L时,产酶量达到最高。因此,酵母浸粉浓度宜取2.5 g/L。
|
图 2 不同浓度可溶性淀粉、蛋白胨或酵母浸粉对芽孢杆菌N11-8产蛋白酶的影响 Fig.2 Effects of different concentrations of soluble starch, peptone and yeast extract on the production of protease by Bacillus sp. N11-8 |
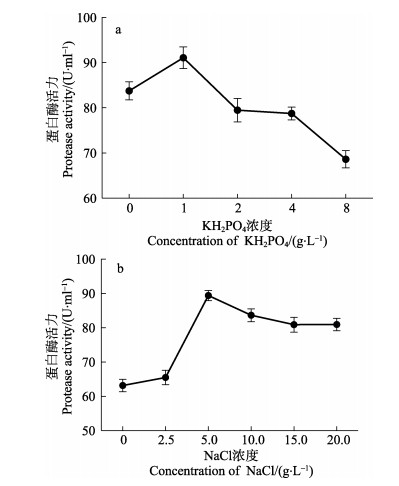
图 3a显示,磷酸盐浓度在1 g/L时,产酶量达到最高。因此,磷酸盐浓度宜取1 g/L。由图 3b可以看出,NaCl浓度在5 g/L时,产酶量达到最高。因此,NaCl浓度宜取5 g/L。
|
图 3 不同盐浓度对芽孢杆菌N11-8产蛋白酶的影响 Fig.3 Effects of different concentration of KH2PO4 or NaCl on the production of protease by Bacillus sp. N11-8 |
图 4a显示,当加入FeCl3·6H2O时,产酶量最高,即Fe3+对酶活促进作用最强。Fe2+对酶活促进作用略低于Fe3+,Ca2+、Al3+、Mn2+对酶活也有一定的促进作用,而Mg2+、Cu2+、Zn2+对酶活都有不同程度的抑制作用,尤其Zn2+几乎可使蛋白酶完全失活。随着样品中Fe3+浓度的增加,产酶量不断增加,当达到2 mmol/L时,产酶量最高(图 4b),故培养基中宜添加终浓度为2 mmol/L的FeCl3·6H2O。

|
图 4 金属离子对芽孢杆菌N11-8产蛋白酶的影响 Fig.4 Effects of metal ion on the production of protease by Bacillus sp. N11-8 |
图 5a显示,接种量在4%时,产酶量达到最高。因此,接种量宜为4%。从图 5b可以看出,装液量在50 ml时,产酶量达最高。因此,装液量宜为50 ml。在较高的装液量水平时,产酶量减少,可能主要是由于溶氧较低、供氧不足造成的(陈世建等, 2014)。

|
图 5 接种量与装液量对芽孢杆菌N11-8产蛋白酶的影响 Fig.5 Effects of initial inoculum and culture volume on the production of protease by Bacillus sp. N11-8 |
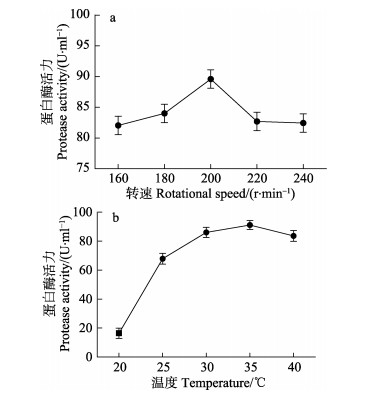
图 6a显示,转速在200 r/min时,产酶量达到最高。因此,转速宜为200 r/min。图 6b显示,温度在35℃时,产酶量达到最高。因此,温度宜为35℃。
|
图 6 不同转速与温度对芽孢杆菌N11-8产蛋白酶的影响 Fig.6 Effects of rotational speed and temperature on the production of protease by Bacillus sp. N11-8 |
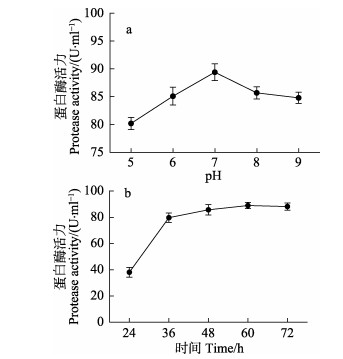
图 7a显示,初始pH=7时,产酶量达到最高。因此,初始pH宜为7。然而,随着时间增加,产酶量不断增加,并在60 h后趋于稳定,产酶量达到最高。因此,时间宜为60 h (图 7b)。
|
图 7 初始pH与时间对芽孢杆菌N11-8产蛋白酶的影响 Fig.7 Effects of initial pH and time on the production of protease by Bacillus sp. N11-8 |
如表 1所示,从单因素实验中选取7个因素:可溶性淀粉浓度、蛋白胨浓度、酵母浸粉浓度、NaCl浓度、FeCl3·6H2O浓度、KH2PO4浓度、温度,选择高低2个水平,设计实验,通过PB实验为响应面优化条件筛选出主要影响因子。12组实验的实验结果如表 2所示。由表 3可知,发酵条件的显著影响因子依次为蛋白胨浓度、温度和酵母浸粉浓度。
2.2.2 最陡爬坡实验根据PB实验统计分析结果,以蛋白胨、酵母浸粉、温度为主要影响因素设计本实验,具体设计方法及实验结果如表 4所示。显然,第4组实验的单位酶活最高,这说明产酶最优点在第4组附近。
2.2.3 中心组实验确定显著因素最优水平以最陡爬坡实验的最优组第4组为中心,采用二次回归旋转中心组合设计,进一步确定蛋白胨、酵母浸粉、温度对菌株产酶的影响。具体设计和实验结果见表 5和表 6。
用Design-Expert V 8.0.6对实验数据进行多项式回归分析,P < 0.0001表明该模型是显著的,同时,失拟项P=0.0970 > 0.05表示该模型失拟不显著,因此,该模型是合适的。另外,此模型R2=0.9714,表明该模型能较好地的解释菌株产酶量的变化。以单位酶活(Y)为因变量,蛋白胨(A)、酵母浸粉(B)和温度(C)为自变量,建立回归方程式如下:
酶活Y=89.56‒2.98A+2.34B‒2.96C‒5.14AB+1.06AC+ 0.51BC‒6.71A2‒5.88B2‒7.98C2
根据上面的方程绘制响应面分析图、等高线图(图 8),直接反映了各因素对酶活的影响。
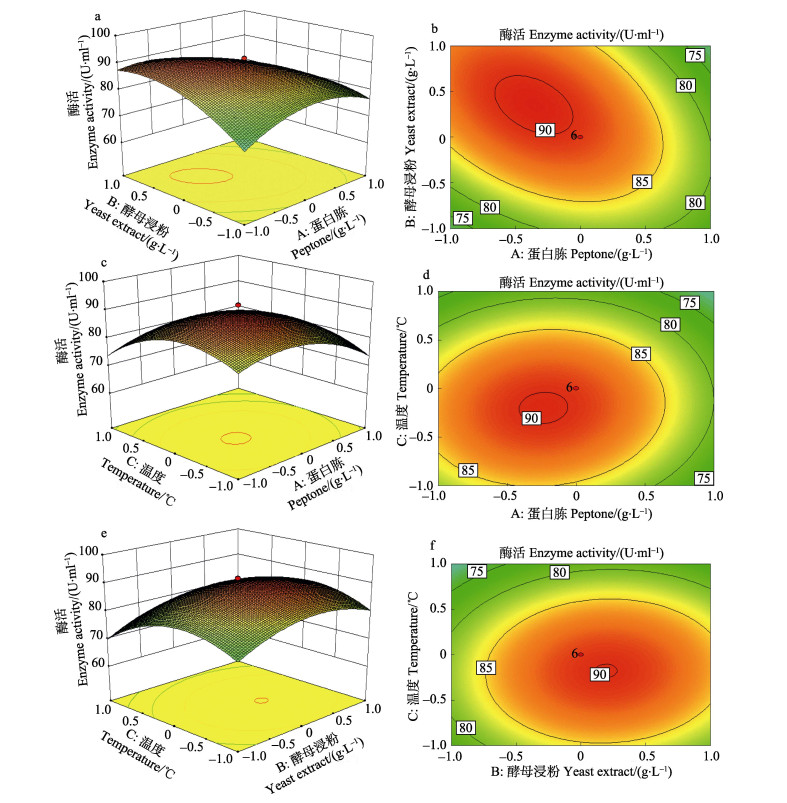
|
图 8 不同因素对酶活响应值的影响 Fig.8 The influence of three factors on the response value of enzyme activity |
用Design-Expert V8.0.6计算,对回归方程求一阶偏导数,得出模型极值点。即当蛋白胨浓度为13.1 g/L、酵母浸粉浓度为2.9 g/L、温度为34℃时,酶活力最大,理论最大值为90.8 U/ml。
2.2.4 验证实验以上述响应面分析得到的最佳培养基成分与培养条件下,进行3次实验,实际测定平均酶活为90.5 U/ml,和理论值90.8 U/ml基本一致,表明方程拟合度很好,验证了模型的正确性。
3 结论本研究通过单因素法和响应面法对来自南极表层海水的一株海洋芽孢杆菌N11-8产蛋白酶PBN11-8的培养基成分和培养条件进行了优化,利用实验设计软件Design-Expert建立相应数学模型,经检验证明该模型合理可靠,能够较好地预测并用于优化该菌产蛋白酶发酵条件。对影响产酶量的关键因素及其相互作用进行探讨后,最终确定了以可溶性淀粉(3 g/L)为碳源,蛋白胨(13.1 g/L)和酵母浸粉(2.9 g/L)为复合氮源,Fe3+(2 mmol/L)为金属离子,初始pH值为7.0,用NaCl(5 g/L)调节盐度,250 ml三角瓶装液50 ml,接种量为4%,34℃、200 r/min发酵培养60 h,最终优化后的酶活达到90.5 U/ml,比初始酶活73.2 U/ml提高了23.6%。
Brown GT, Murray GI. Current mechanistic insights into the roles of matrix metalloproteinases in tumour invasion and metastasis. Journal of Pathology, 2015, 237(3): 273-281 |
Chen SJ, Wang W, Sun M. Identification of a marine bacterium producing high-level catalase and optimization of its fermentation conditions. Progress in Fishery Sciences, 2014, 35(4): 103-109 [ 陈世建, 王伟, 孙谧. 一株海洋过氧化氢酶高产菌的鉴定及产酶条件优化. 渔业科学进展, 2014, 35(4): 103-109] |
Gomis-Rüth FX. Structural aspects of the metzincin clan of metalloendopeptidases. Molecular Biotechnology, 2003, 24(2): 157-202 DOI:10.1385/MB:24:2 |
Guo J, Yang YP, Renqinkaorile. Ascertaining the medium ingredients for a fibrinolytic enzyme secreting Bacillus subtilis strain. Journal of Inner Mongolia Agricultural University, 2003, 24(1): 51-55 [ 郭军, 杨雨平, 仁庆考日乐. 枯草杆菌溶血纤维蛋白酶发酵培养基配方的确定. 内蒙古农业大学学报, 2003, 24(1): 51-55] |
He L, Liu JZ, Qin SL, et al. Identification of an astaxanthin- producing marine yeast strain YS-185 and optimization of its fermentation conditions. Progress in Fishery Sciences, 2011, 32(4): 93-101 [ 何磊, 刘均忠, 秦胜利, 等. 产虾青素海洋酵母菌YS-185的鉴定及发酵条件优化. 渔业科学进展, 2011, 32(4): 93-101 DOI:10.3969/j.issn.1000-7075.2011.04.015] |
Ji KM, Chen LH, Cheng B, et al. The inhibition effects and mechanism of recombinant snake venom metalloproteinase inhibitor on tumor angiogenesis. Chinese Pharmacological Bulletin, 2017, 33(3): 394-400 [ 纪明开, 陈丽红, 程波, 等. 蛇毒金属蛋白酶抑制剂重组蛋白抗肿瘤血管生成作用及其机制. 中国药理学通报, 2017, 33(3): 394-400 DOI:10.3969/j.issn.1001-1978.2017.03.020] |
Jing G, Feng J, Kong J, et al. Research progress on metalloproteinases from microorganism. Progress in Biotechnology, 2002, 22(1): 61-63 [ 荆谷, 冯静, 孔健, 等. 微生物金属蛋白酶的研究进展. 生物工程进展, 2002, 22(1): 61-63 DOI:10.3969/j.issn.1671-8135.2002.01.014] |
Li HK, Li YR, Li Y, et al. Optimization of fermentation conditions for the production of neutral protease by Bacillus subtillis. Food and Fermentation Industries, 2016, 42(5): 102-107 [ 李洪康, 李由然, 李赢, 等. 枯草芽孢杆菌产中性蛋白酶发酵条件优化. 食品与发酵工业, 2016, 42(5): 102-107] |
Liang CC, Liu L, Zhang JH, et al. Optimization of medium components for sporulation quantity by trichoderma viride strain H06 using response surface methodology. Chinese Journal of Tropical Crops, 2014, 35(2): 333-338 [ 梁昌聪, 刘磊, 张建华, 等. 响应面法优化绿色木霉H06产孢发酵培养基. 热带作物学报, 2014, 35(2): 333-338 DOI:10.3969/j.issn.1000-2561.2014.02.021] |
Liu ZX, Zeng CZ. The application of response surface method in optimization of fermentation medium. Northern Horticulture, 2009(2): 127-129 [ 刘志祥, 曾超珍. 响应面法在发酵培养基优化中的应用. 北方园艺, 2009(2): 127-129] |
Ma ZB, Zheng HF, Liu JZ, et al. Identification of a marine bacterium S-3685 with high neutral protease and optimization of its fermentation conditions. Progress in Fishery Sciences, 2015, 36(5): 131-137 [ 马子宾, 郑鸿飞, 刘均忠, 等. 一株海洋中性蛋白酶高产菌S-3685的鉴定及产酶条件. 渔业科学进展, 2015, 36(5): 131-137] |
Shi CJ, Yan PS, Zhao RX, et al. Advances on enzymes from marine microorganisms. Current Biotechnology, 2015, 5(3): 185-190 [ 史翠娟, 闫培生, 赵瑞希, 等. 海洋微生物酶研究进展. 生物技术进展, 2015, 5(3): 185-190 DOI:10.3969/j.issn.2095-2341.2015.03.06] |
Wang D, Rong JP, Tang ZZ, et al. Response surface method optimization of fermentation conditions for Bacillus subtilis producing neutral protease. Genomics and Applied Biology, 2016, 35(1): 143-151 [ 王东, 荣家萍, 唐自钟, 等. 响应面法优化枯草芽孢杆菌产中性蛋白酶的发酵条件. 基因组学与应用生物学, 2016, 35(1): 143-151] |
Wu EX, Wang FF, NormanMcKIE. Matrix metalloproteinase. Life Science Research, 1999(3): 175-194 [ 吴二喜, 王凤飞, NormanMcKIE. 基质金属蛋白酶(英文). 生命科学研究, 1999(3): 175-194 DOI:10.3969/j.issn.1007-7847.1999.03.001] |
Yang J, Li SY, Ma ZB, et al. Optimization of the purification protocol of biomimetic affinity material for marine metalloprotease MP. Science and Technology of Food Industry, 2017, 38(15): 146-152 [ 杨娟, 李尚勇, 马子宾, 等. 海洋金属蛋白酶MP仿生亲和材料纯化条件的优化. 食品工业科技, 2017, 38(15): 146-152] |
Zhang D, Min WH, Liu JS, et al. Response surface optimization of fermentation conditions for protease production by Pichia kudriavzevii yeast. Food Science, 2011, 32(13): 248-253 [ 张丹, 闵伟红, 刘景圣, 等. 响应面法优化蛋白酶菌株发酵条件. 食品科学, 2011, 32(13): 248-253] |
Zhang ZX, Wang W, Wang F, et al. Optimization of fermentation conditions for the catalase production by Aeromonas sp. CE-2-A. Progress in Fishery Sciences, 2010, 31(6): 95-103 [ 张增祥, 王伟, 王芳, 等. 过氧化氢酶高产菌株CE-2-A的发酵条件优化. 渔业科学进展, 2010, 31(6): 95-103 DOI:10.3969/j.issn.1000-7075.2010.06.014] |
Zheng LH, Yang KL, Liu J, et al. Screening of microorganisms from Antarctic surface water and cytotoxicity metabolites from Antarctic microorganisms. Food Science and Nutrition, 2016, 4(2): 198-206 DOI:10.1002/fsn3.2016.4.issue-2 |
Zheng LH, Yang KL, Sun M, et al. The preparation and application of a marine bacillus polypeptide. China, 151008745.8[P]. 2015-02-13 [郑兰红, 杨康利, 孙谧, 等.一种海洋芽孢杆菌多肽及其制备和应用.中国, 151008745.8[P]. 2015-02-13]
|



