2. 中国水产科学研究院 南海水产研究所 广东省渔业生态环境重点实验室 农业农村部南海渔业资源开发利用重点实验室 广州 510300;
3. 南海生物资源开发与利用协同创新中心 广州 510275
2. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Fishery Ecology and Environment, Guangdong Province; Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture and Rural Affairs, Guangzhou 510300;
3. South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center, Guangzhou 510275
半集约化、集约化养殖日益受到关注(曹煜成等, 2006),该模式下水体环境主要依赖人工调控,水体生物多样性复杂程度低(殷汝新等, 2015; 王善龙等, 2016; 郗建云等, 2016; 李莎莎等, 2017),有害物质容易大量积累(李卓佳等, 2010),控制不当容易引起水质恶化。其中,氨氮的过量积累对鱼、虾等水产动物具有严重的毒害作用(董玉波等, 2011; 周平, 2013),其脂溶性强,可透过细胞膜扰乱水产动物正常代谢活动,抑制其生长发育,损伤机体的抗病或抗逆机能,甚至导致死亡(何玉英等, 2016)。目前,对养殖水体氨氮的去除方法主要有物理、化学和生物3种,相比而言,生物方法利用微生物的生理代谢机制去除水体中的氨氮,具有环境友好,不易产生二次污染等优点(张峰峰等, 2014; 王磊等, 2016)。研究表明,对氨氮具有去除功效的微生物有芽孢杆菌(Bacillus)(匡群等, 2013)、粪产碱杆菌(Alcaligenes faecalis)(刘芳芳等, 2010)、变形杆菌(Proteus)(张庆华等, 2007)和假单胞菌(Pseudomonas)(张峰峰等, 2014)等。
红球菌(Rhodococcus)作为水体环境中的常见微生物,具有代谢多样性的特点,能有效去除多种化合物(孙艳等, 2004)。当前,对红球菌功能的研究主要集中在生物脱硫(Kirkwood et al, 2007),石油污染修复(杨智等, 2015),污水处理(Jorge et al, 2001),降解有机农药、有机腈、霉菌毒素(许育新等, 2004; Coady et al, 2015; Cserháti et al, 2013)等方面。同时,红球菌可以作为某些水产养殖动物的益生菌(Sharifuzzaman et al, 2018; Boutin et al, 2013; 邝金媚等, 2010),提供水产养殖动物必须的类胡萝卜素(郑晓冬等, 2000)。近年来研究表明,红球菌对氨氮也有一定的去除效果,这些红球菌主要由油田外排污水(李沛霖, 2006)、土壤(张光亚等, 2003)、养猪厂的废水(张智超等, 2017)、污水处理厂的活性污泥(白志辉等, 2013)等非养殖水体中筛出。目前,具有氨氮去除功能的红球菌在水产养殖池塘中的筛选、氨氮去除机理、环境适应性及应用方面还少有报道。
本研究采用了前期从虾池养殖中后期(50 d)水体环境中筛选获得的1株土著菌株XH2,已初步证实具有氨氮去除功效,经鉴定为玫瑰红红球菌(Rhodococcus rhodochrous),并对其在不同盐度、pH、温度、通气量条件下的生长和氨氮去除效果进行实验,以期了解上述4种因子对菌株XH2生长及氨氮去除效果的影响,确定其适宜生长并有较好氨氮去除效果的条件,为养殖水体氨氮去除的实际应用提供有效菌源和技术方法。
1 材料与方法 1.1 材料 1.1.1 菌株红球菌XH2由中国水产科学研究院南海水产研究所提供,该菌株从对虾集约化养殖中后期(50 d)水体中分离获得,该水体环境的盐度为23~25,pH为7.3~8.5,温度为28℃~30℃。该菌株已于中国典型培养物保藏中心进行了菌种保藏,保藏编号为CCTCCM2017437。
1.1.2 培养基光合菌改良液体培养基(杨启霞等, 2009; 杨莺莺等, 2003、2009):NH4Cl 1 g,三水合乙酸钠3 g,酵母膏1 g,MgSO4 0.2 g,KH2PO4 0.5 g,生长因子1 ml,蒸馏水1000 ml。其中,生长因子:CaCl2 5 g,MnSO4 0.25 g,FeSO4 0.5 g,谷氨酸0.02 g,蒸馏水100 ml。光合菌改良固体培养基平板:在上述培养基的基础上添加琼脂粉20 g/L。菌株活化种子液:在光合菌改良液体培养基的基础上,将NH4Cl的添加量改为0.068 g/L。分析培养液:在光合菌改良液体培养基的基础上额外添加NaNO2 0.134 g/L,同时,将NH4Cl的添加量改为0.068 g/L,使该培养液初始氨氮和亚硝酸盐氮浓度分别达到约24和20 mg/L。
1.2 菌株鉴定 1.2.1 16S rDNA序列分析细菌总DNA提取采用TIANGEN公司的TIANamp Bacteria DNA Kit产品。依照产品说明书提取菌株XH2的DNA后,对其16S rDNA片段进行PCR扩增。16S rDNA扩增采用的细菌通用引物为:8F(5' -AGAGTTTGATCCTGGCTCAG-3' ),1492R(5' -GGTTACCTT GTTACGACTT-3' )。PCR反应体系采用50 μl体系,其中加入2 μl模板DNA。PCR反应条件:95℃ 4 min;95℃ 1 min,48℃ 1 min,72℃ 2 min,30个循环;72℃ 10 min。扩增产物通过1.0%的琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司测序。测序结果用DNAStar软件包中的Editseq软件拼接,在NCBI数据库BLAST检索中进行核酸序列同源性比较,确定菌株的种属。
1.2.2 Biolog系统细菌鉴定采用Biolog微生物全自动分析仪Microlog 3 (Microstation)及Biolog MicroLog 4.2软件进行菌株的生化反应特性鉴定,选用Biolog GP2微孔鉴定板,按照Biolog自动微生物分析系统的说明书操作,将所获结果与数据库进行比对,确定菌株的种属。
1.3 不同因子对菌株XH2生长及其氨氮去除效果的影响将保存的菌株XH2于光合菌固体培养基平板上活化,于实验开始前挑取单菌落,接入100 ml菌株活化种子液中(装于250 ml锥形瓶内)。设不同梯度的盐度、pH、温度和通气量实验组,各实验组均使用1000 ml锥形瓶,并向其内添加600 ml分析培养液。实验开始时,将等体积的菌株活化种子液接入各实验组的分析培养液中,各实验组初始接菌量均为106 cells/ml,每组设3个平行。各实验组初始氨氮浓度约为24 mg/L,亚硝酸盐氮浓度约为20 mg/L,依照《海洋监测规范》第4部分:海水分析(GB 17378.4- 2007)的方法,以靛酚蓝分光光度法和萘乙二胺分光光度法分别测定实验过程中氨氮和亚硝酸盐氮的浓度变化。用血球计数板在光学显微镜下计数,测定菌量变化。
1.3.1 盐度实验系统的盐度梯度为5、15、25、35、45,对照组(盐度为25)不加菌株XH2,通过添加不同剂量的NaCl对盐度进行调节。接菌后放入摇床,pH为6.0,30℃,200 r/min振荡至实验结束,每天用NaOH、HCl调节分析培养液的pH值,保持在6.0左右。于第0、1、2、3、4、5、9天取样检测其氨氮、亚硝酸盐氮含量,同时测定菌量。
1.3.2 pH实验系统的pH梯度为4.5、6.0、7.5、9.0、10.5,对照组(pH为6.0)不加菌株XH2。盐度为25,接菌后放入摇床,30℃,200 r/min振荡至实验结束,每天测定分析培养液pH并进行调节,使各实验组pH维持在初始水平。取样时间以及测定指标同1.3.1。
1.3.3 温度实验系统的温度梯度为5℃、15℃、25℃、35℃、45℃,对照组(温度为30℃)不加菌株XH2。盐度和pH分别设为25和7.5。接菌后放入摇床,30℃,200 r/min振荡至实验结束。取样时间以及测定指标同1.3.1。
1.3.4 通气量以2 L发酵罐(Biostat B型自控通气发酵罐)实验系统为测试平台,将通气量设为高、低2组(2和1 L/min),实验前,需矫正发酵罐溶氧电极和pH电极,该实验系统可自动记录发酵罐中溶氧量的变化以及自动调节罐内分析培养液的温度和pH值。实验过程中的pH为7.5、盐度为25、温度为30℃,转子转速为200 r/min,在第0、1、2、3、4、5天进行取样,测定指标同1.3.1。
1.4 数据分析采用SPSS 20.0软件对实验数据进行单因素方差分析(One-way ANOVA),使用Duncan检验方法,显著水平设为P < 0.05。氨氮去除率的计算:氨氮去除率=(氨氮初始浓度-培养后氨氮剩余浓度)/氨氮初始浓度×100%。
2 结果 2.1 菌株XH2的鉴定以16S rDNA序列在NCBI数据库中进行核酸数据比对,结果显示,XH2与红球菌属相似度为100%,初步判定菌株XH2为红球菌属。在Biolog细菌鉴定系统中,与XH2相似度最高的菌株为玫瑰红红球菌,其PROB为98%、SIM为0.617、DIST为5.93。综合以上鉴定结果,菌株XH2定为玫瑰红红球菌。
2.2 盐度对菌株XH2生长及其氨氮去除效果的影响除盐度为45实验组外,其他各组菌株均在第1天后进入对数生长期,第3天后,菌量均达到108 cells/ml水平,最高为3.02×108 cells/ml(图 1A)。实验过程中,对照组氨氮浓度无明显变化(P > 0.05),第2天时,盐度为5、15和25实验组的氨氮浓度大幅降低,氨氮去除率分别达到79.2%、79.5%和90.3%,显著优于其他各组(P < 0.01),而后,此3组的氨氮浓度始终稳定保持在较低水平;第3天时,盐度为35和45实验组的氨氮浓度亦明显降低(P < 0.05),到第4天,其氨氮去除率达到100.0%(图 1B)。然而,菌株XH2不能有效去除环境中的亚硝酸盐氮(图 1C),在9 d的监测过程中,各实验组和对照组分析培养液中的亚硝酸盐氮浓度均无显著变化(P > 0.05)。
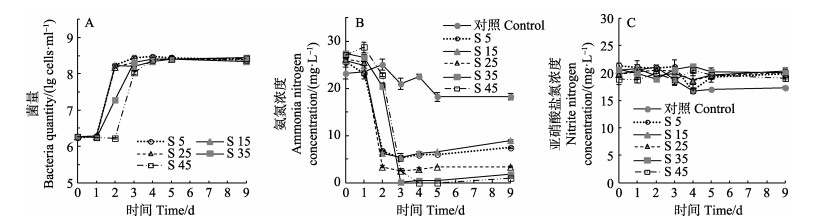
|
图 1 不同盐度条件下XH2的菌量(A)、分析培养液中氨氮(B)、亚硝酸盐氮(C)的含量变化
Fig.1 Variations of strain XH2 amount (A), ammonia nitrogen (B) and nitrite nitrogen (C) concentrations in the medium of different salinities
S:盐度;对照:盐度25,不加菌株XH2; 氨氮初始浓度:24 mg/L;亚硝酸盐氮初始浓度:20 mg/L,下同 S: Salinity; Control: Salinity 25 without strain XH2; Initial ammonia nitrogen concentration: 24 mg/L; Initial nitrite nitrogen concentration: 20 mg/L, the same as below |
菌株XH2在pH为6.0~9.0条件下均能良好生长,于2 d内菌量即可从106 cells/ml增长至108 cells/ml,其中,pH为7.5时,菌株生长最快;当初始pH为4.5或10.5时,菌株生长受到明显抑制(图 2A)。实验过程中,对照组和pH为4.5实验组的氨氮浓度始终无明显变化(P > 0.05);pH为6.0、7.5和9.0实验组的氨氮浓度总体呈明显下降趋势,pH为10.5实验组的氨氮浓度略有降低,其中,pH为6.0和7.5实验组的氨氮浓度在第2天分别大幅降低至0.26和0 mg/L,此后,pH为6.0、7.5、9.0实验组的氨氮浓度稳定在较低水平(图 2B)。就亚硝酸盐氮的浓度而言,对照组和各实验组均未呈现下降趋势,在14.97~24.31 mg/L的范围内小幅波动(图 2C)。

|
图 2 不同pH条件下XH2的菌量(A)、分析培养液中氨氮(B)、亚硝酸盐氮(C)的含量变化 Fig.2 Variations of strain XH2 amount (A), ammonia nitrogen (B) and nitrite nitrogen (C) concentrations in the medium of different pH 对照:pH 6.0,不加菌株XH2 Control: pH 6.0 without strain XH2 |
菌株XH2在温度为5℃时,生长受到明显抑制,在温度为15℃~45℃时,均能良好生长,2~3 d时,其菌量可从初始的106 cells/ml增长至108 cells/ml,并一直维持在该水平(图 3A)。对照组和温度为5℃实验组的氨氮浓度无明显变化(P > 0.05),其他各实验组的氨氮浓度总体呈下降趋势。其中,温度为30℃、35℃和45℃实验组的氨氮浓度在第2天时降至最低,其氨氮去除率分别为100.0%、93.8%和70.1%;温度为15℃、25℃实验组则在第3天降至最低,其氨氮去除率为99.6%、97.7%;其后,实验组的氨氮浓度均略有升高,但仍远低于对照组(图 3B)。就亚硝酸盐氮的浓度而言,对照组和各实验组在15.97~22.57 mg/L的范围内小幅波动(图 3C)。
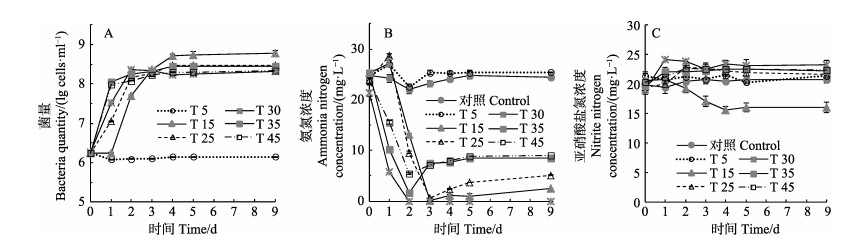
|
图 3 不同温度条件下XH2的菌量(A)、分析培养液中氨氮(B)和亚硝酸盐氮(C)的含量变化 Fig.3 Variations of strain XH2 amount (A), ammonia nitrogen (B) and nitrite nitrogen (C) concentrations in the medium at different temperatures T:温度;对照:温度30℃,不加菌株XH2 T: Temperature; Control: Temperature 30℃ without strain XH2 |
通气量为1 L/min时,菌株在24 h内进入对数生长期,并于36 h后进入稳定期,菌量最高可达1.03× 109 cells/ml,而培养液中的溶氧含量也相应在2 h时达到最低值,随后不断升高并稳定在90.0%左右;通气量为2 L/min时,菌株12~36 h进入对数生长期,60 h后进入稳定期,稍迟于上述实验组,菌量最高可达6.78×108 cells/ml (图 4A、图 4B)。菌株在2实验组中均表现出对氨氮良好的去除效果,低通气量组在第1天氨氮去除率可达98.6%,高通气量组第2天的氨氮去除率为98.2%,此后,培养液中的氨氮浓度始终维持在较低水平(图 4C)。但2个实验组的亚硝酸盐氮浓度一直维持在13.63 mg/L以上的较高水平(图 4D)。
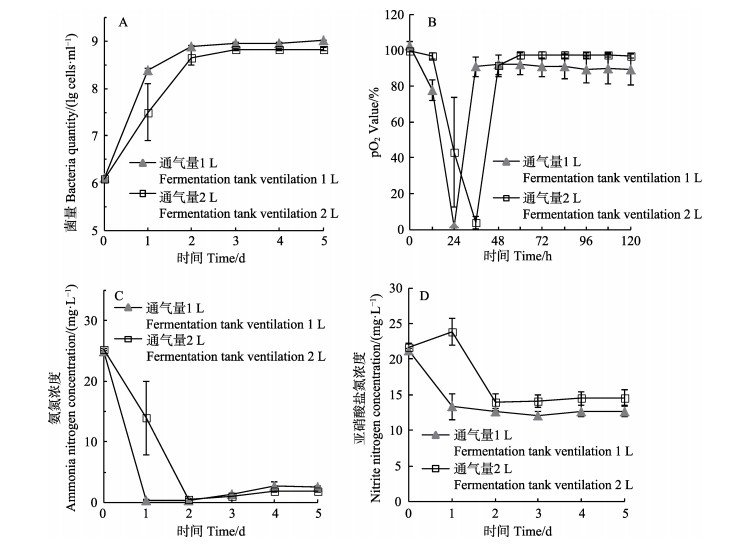
|
图 4 不同通气量条件下XH2的菌量(A)和分析培养液中溶氧(B)、氨氮(C)、亚硝酸盐氮(D)的含量变化 Fig.4 Variations of strain XH2 amount (A), dissolved oxygen (B), ammonia nitrogen (C) and nitrite nitrogen (D) concentrations in the medium with different ventilations |
现有报道的红球菌多筛选自土壤、工业废水、畜禽养殖废弃物等非水产养殖水体环境。黄钧等(2010)和张智超等(2017)从活性污泥及畜禽养殖排出物中分离出红球菌菌株,它们6 d内的氨氮去除率分别达到68.9%和94.4%;司文攻等(2011)从土壤获得的1株红球菌,其3 d内氨氮去除率为65.0%。相较上述红球菌,菌株XH2为养殖池塘土著菌,其在原有环境中的适应性和竞争力更强,且对原有生态环境相对更为安全(何沅滨等, 2015)。在养殖水体环境中筛选具备生态适应性强、生长性能好、水质净化效率高的菌株,并结合水产养殖与渔业微生物制剂的生产实际开展针对性研究,以此研发的微生物制剂方能更切合水产养殖产业的实际需求,才能更有效地促进其在养殖水体原位净化技术的规模化应用,助力零换水生态型养殖业的发展。本研究选择以虾池养殖中后期(50 d)水体环境为基础,从中筛选具有高效氨氮去除功能的土著菌株,进而获得玫瑰红红球菌XH2。故从目的性、产业应用预期目标等方面而言,该研究所获菌株较以往研究定位更明确,更易满足水产养殖水体净化所需。
盐度、温度、pH和通气量是水产养殖中的几个重要指标。本研究通过检测分析培养液中菌量、氨氮及亚硝酸盐氮浓度的变化,进而了解了上述4个因子对菌株生长和氨氮去除效果的影响。菌株XH2在盐度为5~45,pH为6.0~9.0,温度为15℃~45℃及通气量为1~2 L/min的条件下均能生长良好,在较低盐度(5~25)和较高温度(25℃~45℃)下生长更优。另一方面,菌株XH2在盐度为5~15时,最高氨氮去除率约为79.0%,而盐度为25~45时,最高氨氮去除率在90.0%以上,说明菌株XH2对较高盐度水体环境的氨氮去除效果更佳。在pH为6.0~9.0、温度为15℃~ 35℃时,菌株XH2对氨氮的最高去除率在93.0%以上;当pH为4.5和10.5、温度为5℃时,氨氮去除效果不明显,温度为45℃时,最高氨氮去除率仅为77.1%,表明其在中性偏碱的条件下有较好的氨氮去除效果,而温度过高或过低均会弱化其氨氮去除效果。在通气量为1和2 L/min的条件下,菌株XH2的最高氨氮去除率均在98.0%以上,但其在低通气量组时进入对数生长期以及氨氮浓度大幅下降的时间均早于高通气量组。因此,在实际生产中可采用低通气量来扩培菌株XH2,在节约资源的同时不会影响其生长和氨氮去除效果。
在水产养殖生产中,适宜的水体盐度、pH、温度的覆盖区间分别为0~38.1、6.9~8.7和15℃~35℃,在不同的养殖品种和养殖模式之间会存在一定的差异(李卓佳等, 2007)。可见,菌株XH2对盐度、pH、温度的适应范围与大部分水产养殖池塘水体的变化区间相吻合。通常具有氨氮去除功能的菌株环境适应范围为盐度0~35、pH 6.0~9.0和温度15℃~40℃,该条件下菌株对氨氮的去除率为40.0%~98.0%(李存玉等, 2017; 胡修贵等, 2013)。综合来看,菌株XH2与上述报道相比大体一致,而其对氨氮的去除效果更优。
微生物转化氨氮为多种形态的氮的形式大体分为3类。其一,氨氮被氧化为亚硝酸盐氮、硝酸盐氮等;其二,氨氮被微生物同化吸收以合成其生长所需含氮物质;其三,氨氮被转化为含氮气体,如NOX、N2等(王弘宇等, 2009)。黄雪娇等(2016)发现了一株具有氨氮去除功效的光合菌,培养过程中并未发现亚硝酸盐氮及硝酸盐氮积累,其认为该菌通过同化吸收来去除氨氮。刘志云等(2016)筛选出一株能去除氨氮的粉状毕赤酵母菌(Pichia pastoris),其氨氮去除途径为同化吸收及转化为硝酸盐氮。当前,鲜有关于红球菌氨氮去除机制的报道(张智超等, 2017)。本研究对各实验组中菌株XH2的分析培养液进行了菌量、氨氮和亚硝酸盐氮的检测。各实验组中菌株XH2菌量的增加与氨氮去除同步,且氨氮浓度大幅下降与菌株对数生长期吻合,同时,亚硝酸盐氮的浓度没有明显变化,推测氨氮去除过程主要发生在菌株对数生长时期,大部分氨氮被菌株同化,用于其自身生长繁殖(陈昢圳等, 2009; 张培玉等, 2010)。后期氨氮的小幅回升,可能是由于分析培养液中营养不足,菌株进入衰亡期,菌体自溶释放出的氨氮比菌株去除的氨氮多(李泳洪等, 2016)。由于只检测了氨氮和亚硝酸盐氮,未检测其他氮元素指标,并不能明确菌株XH2是否能转化成其他形式的氮,有待进一步的实验来证实。
总体而言,本研究从虾池养殖水体环境中获得的土著玫瑰红红球菌XH2对盐度、pH、温度的适应性良好,且能有效去除水体环境中的氨氮,可作为养殖池塘水体氨氮防控菌剂产品研发的备选菌株。当前,已明确了实验室条件下4种因子对菌株XH2氨氮去除效果的影响,之后将会对该菌株的氨氮去除机制及其对养殖池塘水体其他生物群落的影响、菌剂规模化生产工艺、在养殖生产中的应用技术优化等做进一步的研究。
Bai ZH, Chen YY, Zhao ZR, et al. Production method and application of Rhodococcus with denitrification function. CN104140935A, 2013-05-08 [白志辉, 陈月月, 赵志瑞, 等.一株具有脱氮功能的红球菌及其菌剂的生产方法和应用. CN104140935A, 2013-05-08]
|
Boutin S, Audet C, Derome N. Probiotic treatment by indigenous bacteria decreases mortality without disturbing the natural microbiota of Salvelinus fontinalis. Canadian Journal of Microbiology, 2013, 59(10): 662-670 DOI:10.1139/cjm-2013-0443 |
Cao YC, Li ZJ, Jia XP, et al. System configuration of industrial shrimp farming. South China Fisheries Science, 2006, 2(3): 72-76 [ 曹煜成, 李卓佳, 贾晓平, 等. 对虾工厂化养殖的系统结构. 南方水产, 2006, 2(3): 72-76 DOI:10.3969/j.issn.2095-0780.2006.03.013] |
Chen PZ, Wang LG, Wang YC, et al. Screening and denitrification characteristics of a heterotrophic nitrification- aerobic denitrifier bacteria. Environmental Science, 2009, 30(12): 3614-3618 [ 陈昢圳, 王立刚, 王迎春, 等. 异养硝化-好氧反硝化菌的筛选及脱氮性能的实验研究. 环境科学, 2009, 30(12): 3614-3618 DOI:10.3321/j.issn:0250-3301.2009.12.028] |
Coady TM, Coffey LV, O'Reilly C, et al. Substrate evaluation of Rhodococcus erythropolis SET1, a nitrile hydrolyzing bacterium, demonstrating dual activity strongly dependent on nitrile sub-structure. European Journal of Organic Chemistry, 2015(5): 1108-1116 |
Cserháti M, Kriszt B, Krifaton Cs, et al. Mycotoxin-degradation profile of Rhodococcus strains. International Journal of Food Microbiology, 2013, 166(1): 176-185 DOI:10.1016/j.ijfoodmicro.2013.06.002 |
Dong YB, Dai YY. Research survey of toxic effects of nitrite to aquatic animals. Journal of Aquaculture, 2011, 32(4): 28-32 [ 董玉波, 戴媛媛. 亚硝酸盐氮对水产经济动物毒性影响的研究概况. 水产养殖, 2011, 32(4): 28-32 DOI:10.3969/j.issn.1004-2091.2011.04.008] |
He YB, Li Y, Chen YJ, et al. Screening Bacillus subtilis to use for improving water quality in loach (Misgurnus anguillicaudatus) culture ponds. Journal of Hydroecology, 2015, 36(4): 86-91 [ 何沅滨, 李义, 陈亚军, 等. 泥鳅养殖水体中一株芽孢杆菌的筛选及其净水效果研究. 水生态学杂志, 2015, 36(4): 86-91] |
He YY, Li SF, Wang QY, et al. cDNA cloning and expression analysis of glutamate dehydrogenase in Chinese shrimp (Fenneropenaeus chinensis) exposed to ambient ammonia. Progress in Fishery Sciences, 2016, 37(5): 83-91 [ 何玉英, 李少飞, 王清印, 等. 氨氮胁迫下中国明对虾(Fenneropenaeus chinensis)谷氨酸脱氢酶基因的表达分析. 渔业科学进展, 2016, 37(5): 83-91] |
Hu XG, Zhao P, Li YH, et al. Isolation and identification of heterotrophic nitrosobacteria from bio-flocs and analysis of their characteristics. Progress in Fishery Sciences, 2013, 34(5): 97-103 [ 胡修贵, 赵培, 李玉宏, 等. 生物絮团中异养亚硝化菌的分离鉴定及其特性. 渔业科学进展, 2013, 34(5): 97-103 DOI:10.3969/j.issn.1000-7075.2013.05.015] |
Huang J, Mou LP, Zhao YG. A heterotrophic nitrifying aerobic denitrifying bacterium and its culture method and application. CN101875909A, 2010-11-03 [黄钧, 牟丽娉, 赵永贵.一种异养硝化好氧反硝化细菌及其培养方法和用途. CN101875909A, 2010-11-03] http://www.cqvip.com/Main/Detail.aspx?id=30023186
|
Huang XJ, Yang C, Ni JP, et al. Isolation, identification and characteristics of a Rhodopseudomonas with high ammonia- nitrogen removal efficiency. Environmental Science, 2016, 37(6): 2276-2283 [ 黄雪娇, 杨冲, 倪九派, 等. 1株高效去除氨氮的红假单胞菌的分离鉴定及特性. 环境科学, 2016, 37(6): 2276-2283] |
Jorge LM, Olga VM, Tamara VT, et al. Development of a Rhodococcus recombinant strain for degradation of products from anaerobic dechlorination of PCBs. Environmental Science & Technology, , 2001, 35(4): 663-668 |
Kirkwood KM, Andersson JT, Fedorak PM, et al. Sulfur from benzothiophene and alkylbenzothiophenes supports growth of Rhodococcus sp. strain JVH1. Biodegradation, 2007, 18(5): 541-549 DOI:10.1007/s10532-006-9085-3 |
Kuang JM, Wu XL, Zhao DH. Research and application on colorants in aquaculture. Guangdong Feed, 2010, 19(4): 22-25 [ 邝金媚, 吴秀丽, 赵典惠. 着色剂在水产养殖中的研究与应用. 广东饲料, 2010, 19(4): 22-25 DOI:10.3969/j.issn.1005-8613.2010.04.011] |
Kuang Q, Sun M, Zhang WN, et al. Biological characteristics of Bacillus megaterium JSSW-JD and its effect on nitrogen and phosphorus in aquaculture water. Jiangsu Agricultural Sciences, 2013, 41(4): 222-225 [ 匡群, 孙梅, 张维娜, 等. 巨大芽孢杆菌JSSW-JD的生物学特性及对养殖水体氮磷的影响. 江苏农业科学, 2013, 41(4): 222-225 DOI:10.3969/j.issn.1002-1302.2013.04.086] |
Li CY, Liu XZ, Xu YJ, et al. Isolation, culture, and identification of two strains of probiotics and their effects on water quality control. Progress in Fishery Sciences, 2017, 38(1): 120-127 [ 李存玉, 柳学周, 徐永江, 等. 两株有益菌的分离、培养、鉴定及其水质调控效果评价. 渔业科学进展, 2017, 38(1): 120-127] |
Li PL. Preliminary research on the ammonia-oxidization and the phenomenon of aerobic denitrification of Chemoautotrophic biofilm. Masterxs Thesis of Sichuan University, 2006, 8-49 [李沛霖.自养生物膜氨氧化及其反硝化现象初探.四川大学硕士研究生学位论文, 2006, 8-49] http://cdmd.cnki.com.cn/Article/CDMD-10610-2006188093.htm
|
Li SS, Cao YC, Hu XJ, et al. Optimization for cultivation parameters of Bacillus sp. A4 using response surface methodology. South China Fisheries Science, 2017, 13(5): 85-93 [ 李莎莎, 曹煜成, 胡晓娟, 等. 响应面法优化芽孢杆菌(Bacillus sp.)A4的培养参数. 南方水产科学, 2017, 13(5): 85-93 DOI:10.3969/j.issn.2095-0780.2017.05.012] |
Li YH, Chen XL, Xu XP. Isolation and identification of heterotrophic nitrification-aerobic denitrification strain Bacillus sp. JB4. Journal of Green Science and Technology, 2016(16): 23-25 [ 李泳洪, 陈小岚, 许旭萍. 异养硝化-好氧反硝化菌Bacillus sp. JB4的分离鉴定试验. 绿色科技, 2016(16): 23-25 DOI:10.3969/j.issn.1674-9944.2016.16.007] |
Li ZJ, Jia XP, Yang YY, et al. Microbiological technology and healthy shrimp culture. Beijing: Marine Press, 2007: 68-77 [ 李卓佳, 贾晓平, 杨莺莺, 等. 微生物技术与对虾健康养殖. 北京: 海洋出版社, 2007: 68-77]
|
Li ZJ, Li YW, Cao YC, et al. Analysis of physical-chemical factors variation and nutritional status of Litopenaeus vannamei high level seawater ponds. Journal of Agro-Environment Science, 2010, 29(10): 2025-2032 [ 李卓佳, 李奕雯, 曹煜成, 等. 凡纳滨对虾海水高位池养殖水体理化因子变化与营养状况分析. 农业环境科学学报, 2010, 29(10): 2025-2032] |
Liu FF, Zhou DP, Wu SH, et al. Isolation and identification of heterotrophic nitrifiers from cultivation wastewater. Journal of Agro-Environment Science, 2010, 29(11): 2232-2237 [ 刘芳芳, 周德平, 吴淑杭, 等. 养殖废水中异养硝化细菌的分离筛选和鉴定. 农业环境科学学报, 2010, 29(11): 2232-2237] |
Liu ZY, Liu GH, Xie Q, et al. Isolation and characterization of an NH4+-N degrading bacterium Pichia farinosa NGH for NH3 reduction from chicken manure. Acta Ecologiae Animalis Domastici, 2016, 37(3): 43-49 [ 刘志云, 刘国华, 谢庆, 等. 粉状毕赤酵母NGH的氨氮降解特性及除氨效果研究. 家畜生态学报, 2016, 37(3): 43-49 DOI:10.3969/j.issn.1673-1182.2016.03.008] |
Sharifuzzaman SM, Rahman H, Austin DA, et al. Properties of probiotics Kocuria SM1 and Rhodococcus SM2 isolated from fish guts. Probiotics & Antimicrobial Proteins, 2018, 10(3): 534-542 |
Si WG, Lv ZG, Xu C. Isolation of heterotrophic nitrifiers which can tolerate high concentration of ammonia-nitrogen and the optimization of their nitrogen removal efficiency in wastewater. Chinese Journal of Environmental Science, 2011, 32(11): 3448-3454 [ 司文攻, 吕志刚, 许超. 耐受高浓度氨氮异养硝化菌的筛选及其脱氮条件优化. 环境科学, 2011, 32(11): 3448-3454] |
Sun Y, Yang XQ, Qian SJ. Cloning and expression of polychlorobiphenyl/biphenyl degrading gene from Rhodococcus pyridinovorans. China Environmental Science, 2004, 24(6): 734-737 [ 孙艳, 杨秀清, 钱世钧. 嗜吡啶红球菌多氯联苯降解基因的克隆与表达. 中国环境科学, 2004, 24(6): 734-737 DOI:10.3321/j.issn:1000-6923.2004.06.022] |
Wang HY, Ma F, Yang K, et al. Ammonia removal by two strains of heterotrophic nitrifying bacteria. China Environmental Science, 2009, 29(1): 47-52 [ 王弘宇, 马放, 杨开, 等. 两株异养硝化细菌的氨氮去除特性. 中国环境科学, 2009, 29(1): 47-52 DOI:10.3321/j.issn:1000-6923.2009.01.010] |
Wang L, Wang ZJ, Gao G, et al. Identification and application of a probiotic strain functioning in both ammonia nitrogen removal and Vibrio parahaemolyticus antagonism. Progress in Fishery Sciences, 2016, 37(3): 78-84 [ 王磊, 王志杰, 高戈, 等. 一株兼具氨氮去除能力和对副溶血弧菌拮抗作用的有益菌的筛选及其初步应用. 渔业科学进展, 2016, 37(3): 78-84] |
Wang SL, Cao YC, Xu Y, et al. Regulation of Bacillus cereus to microalgae community in shrimp aquaculture water. South China Fisheries Science, 2016, 12(1): 9-16 [ 王善龙, 曹煜成, 徐煜, 等. 蜡样芽孢杆菌对对虾养殖水体微藻群落的调控研究. 南方水产科学, 2016, 12(1): 9-16 DOI:10.3969/j.issn.2095-0780.2016.01.002] |
Xi JY, Cao YC, Li ZJ, et al. Specificity of algicidal activity against four species of microalgae by algicidal bacterium A2. South China Fisheries Science, 2016, 12(5): 34-42 [ 郗建云, 曹煜成, 李卓佳, 等. 溶藻菌A2对4种微藻的溶藻效果分析. 南方水产科学, 2016, 12(5): 34-42 DOI:10.3969/j.issn.2095-0780.2016.05.005] |
Xu YX, Dai QH, Li XH, et al. Isolation and identification of cypermethrin degrading-bacterium CDT3 and its degradation characters. Journal of Agro-Environment Science, 2004, 23(5): 958-963 [ 许育新, 戴青华, 李晓慧, 等. 氯氰菊酯降解菌株CDT3的分离鉴定及生理特性研究. 农业环境科学学报, 2004, 23(5): 958-963 DOI:10.3321/j.issn:1672-2043.2004.05.027] |
Yang QX, Chang XB, Liu YX. Problem of photosynthetic bacteria culture in seawater and optimization of culture conditions. Journal of Anhui Agricultural Sciences, 2009, 37(5): 1901-1902 [ 杨启霞, 常显波, 刘英霞. 海水培养光合细菌存在的问题及其优化研究. 安徽农业科学, 2009, 37(5): 1901-1902 DOI:10.3969/j.issn.0517-6611.2009.05.017] |
Yang YY, Cao YC, Li ZJ, et al. The application of Rhodopseudomonas palustris PS1 on purifying waste water from intensive shrimp culture. Chinese Journal of Microecology, 2009, 21(1): 4-6 [ 杨莺莺, 曹煜成, 李卓佳, 等. PS1沼泽红假单胞菌对集约化对虾养殖废水的净化作用. 中国微生态学杂志, 2009, 21(1): 4-6] |
Yang YY, Li ZJ, Jia XP, et al. Effect of biochemical characteristics and environmental factor of water purification photosynthetic bacteria PS2 on its growth. Journal of Shanghai Fisheries University, 2003, 12(4): 293-297 [ 杨莺莺, 李卓佳, 贾晓平, 等. 水质净化作用菌光合细菌PS2的生物学特性及环境因子对其生长的影响. 上海海洋大学学报, 2003, 12(4): 293-297 DOI:10.3969/j.issn.1004-7271.2003.04.002] |
Yang Z, Chen JX, Qin B, et al. Characterization and catabolic genes detection of three oil-degrading Rhodococcus spp. Chinese Journal of Applied and Environmental Biology, 2015, 21(5): 805-812 [ 杨智, 陈吉祥, 秦波, 等. 3株石油降解红球菌(Rhodococcus spp.)特性及相关基因分析. 应用与环境生物学报, 2015, 21(5): 805-812] |
Yin RX, Yin SR. Study on regulation of eutrophication of aquaculture water by microecological technology. China Fisheries, 2015(6): 76-78 [ 殷汝新, 殷守仁. 微生态技术对养殖水体富营养化的调控研究. 中国水产, 2015(6): 76-78 DOI:10.3969/j.issn.1002-6681.2015.06.036] |
Zhang FF, Xie FX, Zhou K, et al. Isolation and identification of one bacterium species with high effective ability of removing ammonia-nitrogen. Acta Agriculturae Boreali- Sinica, 2014, 29(4): 221-225 [ 张峰峰, 谢凤行, 周可, 等. 一株高氨氮去除能力菌株的分离筛选及鉴定. 华北农学报, 2014, 29(4): 221-225] |
Zhang GY, Chen MC, Han RY, et al. Isolation, identification and phylogenetic analysis of a heterotrophic nitrifier. Acta Microbiologica Sinica, 2003, 43(2): 156-161 [ 张光亚, 陈美慈, 韩如旸, 等. 一株异养硝化细菌的分离及系统发育分析. 微生物学报, 2003, 43(2): 156-161 DOI:10.3321/j.issn:0001-6209.2003.02.002] |
Zhang PY, Qu Y, Yu DS, et al. Comparison of heterotrophic nitrification and aerobic denitrification system by strain qy37 and its accelerating removal characteristic of NH4+-N. Environmental Science, 2010, 31(8): 1819-1826 [ 张培玉, 曲洋, 于德爽, 等. 菌株qy37的异养硝化/好氧反硝化机制比较及氨氮加速降解特性研究. 环境科学, 2010, 31(8): 1819-1826] |
Zhang QH, Dai XL, Li Y, et al. Identification and phylogenesis of ammonifying bacteria from pond water of Litopenaeus vannamei. Journal of Fisheries of China, 2007, 31(5): 692-698 [ 张庆华, 戴习林, 李怡, 等. 凡纳滨对虾养殖池水中氨化细菌的鉴定及系统发育分析. 水产学报, 2007, 31(5): 692-698] |
Zhang ZC, Sun H, Wu YF, et al. PCR-DGGE assisted selection of ammonia degrading bacteria. Acta Agriculture Zhejiangensis, 2017, 29(2): 286-291 [ 张智超, 孙宏, 吴逸飞, 等. 基于PCR-DGGE技术辅助筛选氨氮降解菌株. 浙江农业学报, 2017, 29(2): 286-291 DOI:10.3969/j.issn.1004-1524.2017.02.15] |
Zheng XD, Wang YY. Study on producing carotenoid with Rhodoccus. Journal of Zhejiang University (Agriculture & Life Sciences), 2000, 26(5): 516-520 [ 郑晓冬, 王友永. 用红球菌生产类胡萝卜素的研究. 浙江大学学报(农业与生命科学版), 2000, 26(5): 516-520 DOI:10.3321/j.issn:1008-9209.2000.05.013] |
Zhou P. Harm of ammonia nitrogen to aquaculture and its control measures. China Fisheries, 2013(8): 63-64 [ 周平. 氨氮对水产养殖的危害及防治措施. 中国水产, 2013(8): 63-64 DOI:10.3969/j.issn.1002-6681.2013.08.025] |



