2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
中国明对虾(Fenneropenaeus chinensis)是中国传统养殖品种,其肉质鲜美,营养价值高。中国明对虾自然群体主要分布于中国的黄海、渤海海域以及朝鲜半岛的西海岸附近(孟宪红, 2010)。白斑综合征(White spot syndrome, WSS)是目前对虾养殖业中主要病害之一,该病发病后对虾死亡速度快、死亡率高,10 d内死亡率接近100%。该病的病原是白斑综合征病毒(White spot syndrome virus, WSSV),该病毒属于线形病毒科(Nimaviridae),是一种双链DNA病毒(Huang et al, 2002; van Hulten et al, 2001; Yang et al, 2001)。WSSV对中国明对虾的致死率高,对虾死亡速度快,人工感染实验中的中国明对虾平均存活时间约为5~ 7 d(冯亚萍等, 2017)。microRNA (miRNA)是一类长度约为21~25 bp的小分子非编码RNA,参与转录后调控过程,能够与目标靶基因的mRNA结合来调控目的基因的翻译过程,从而起到对基因表达水平的调控。研究表明,miRNA能够参与宿主与病原的互作过程。前期研究发现,半滑舌鳎(Cynoglossus semilaevis) miR-223参与免疫应答过程,在鳗弧菌(Vibrio anguillarum)感染后的免疫组织中呈现差异表达趋势(颜慧等, 2015)。感染WSSV后的斑节对虾(Penaeus monodon)体内11种miRNA呈现差异表达趋势(Kaewkascholkul et al, 2016),日本囊对虾(Marsupenaeus japonicus)中发现,miR-965和miR-100可能与对虾和病毒间的互作相关(Le et al, 2016; Yang et al, 2014)。这些研究提示,特殊miRNA在对虾和病毒间互作过程中可能发挥调控作用,但是,哪些miRNA发挥了具体调控作用目前还不清楚。Bantam是一种miRNA,研究表明,bantam能够参与调控生物生长(Hipfner et al, 2002)、细胞增殖与凋亡(Nolo et al, 2006)。在感染苜蓿银纹夜蛾核型多角体病毒(Autographa californica multicapsid nucleopolyhedrovirus, AcMNPV)后的斜纹夜蛾(Spodoptera litura)中,bantam表达水平呈上调趋势,提示其在宿主-病毒互作中发挥调控作用(Shi et al, 2016)。作者对感染WSSV后的中国明对虾bantam及其靶基因特征进行研究,期望能在miRNA水平为中国明对虾抗WSSV研究提供一些参考。
1 材料与方法 1.1 实验动物实验所用中国明对虾为中国水产科学研究院黄海水产研究所遗传育种中心培育的“黄海2号”新品种。对虾养殖水经砂滤、紫外线消毒、5 mg/L有效氯等方法进行处理。
1.2 病毒悬液制备和浓度测定取感染WSSV后死亡的中国明对虾肌肉组织,在冰浴中剪碎,按照1 g肌肉组织加入10 ml PBS,使用Precellys 24组织破碎仪(Bertin,法国)进行破碎,对匀浆液使用Centrifuge 5804R离心机(Eppendorf,德国) 12000 r/min离心后,取上清液,作为WSSV病毒悬液。使用ABI 7500荧光定量PCR仪和Premix Ex TaqTM (Probe qPCR)(TaKaRa)试剂盒,利用探针法qRT-PCR技术对病毒悬液中的WSSV含量进行检测。引物和探针序列见表 1。PCR反应体系:10 μl Premix Ex Taq (Probe qPCR)(2×),0.4 μl ROX Reference Dye Ⅱ,0.4 μl WSSV forward primer (10 μmol/L),0.4 μl WSSV reverse primer (10 μmol/L),0.8 μl WSSV probe (10 μmol/L),2 μl病毒悬液,dH2O补足20 μl。反应程序:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。根据WSSV标准品浓度和Ct值进行线性回归分析,根据待检测病毒悬液的Ct值,计算其中的病毒浓度,平行实验重复3次。
|
|
表 1 引物和探针信息 Tab.1 Primers and probes information |
使用注射器从中国明对虾第5腹节处注射10 μl病毒悬液。每尾对虾的WSSV注射量为1×105 copies。分别在注射病毒悬液后的6、12、24、48 h,取对虾肝胰腺和鳃组织。取正常对虾作为对照。每组实验取3个生物学重复,肝胰腺和鳃组织经过液氮速冻后,放入-80℃保存,用于后期RNA提取。
1.4 miRNA提取及qRT-PCR使用miRcute miRNA提取分离试剂盒(天根),按照说明书进行miRNA的提取。提取后的miRNA保存在-80℃,用于后期qRT-PCR实验。采用Mir-XTM miRNA First Strand Synthesis Kit(Clontech,美国)进行miRNA加A尾反转录,合成cDNA模板。根据bantam序列(5'-UGAGAUCAUUGUGAAAGCUGAUU-3')设计qRT-PCR引物(表 1)。使用qRT-PCR技术,对感染WSSV后不同时间段的中国明对虾肝胰腺和鳃组织中的bantam表达水平进行检测。使用SYBR® Premix Ex TaqTM (Tli RNaseH Plus)(TaKaRa)试剂盒。内参检测选用试剂盒自带的U6引物。反应体系:cDNA模板2 μl、SYBR Premix Ex Taq (Tli RNaseH Plus)(2×) 10 μl、ROX Reference Dye Ⅱ (50×) 0.4 μl、RT primer (10 μmol/L) 0.4 μl、mRQ 3' Primer 0.4 μl、ddH2O 6.8 μl。反应程序:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;熔解曲线分析。所有实验设置3个平行,使用2-ΔΔCt法对结果进行处理,实验中所涉及的数据均为平均值±标准差(Mean±SD),使用SPSS软件t检验进行显著性分析,P < 0.05为差异显著,P < 0.01为差异极显著。
1.5 靶基因分析使用miRanda软件(http://www.microrna.org/microrna/home.do)和本实验室已有的中国明对虾高通量转录组测序数据中的3'UTR序列,对bantam靶基因进行预测。取评分最高靶基因作为研究对象。使用SMARTer® RACE 5′/3′ Kit (Clontech)试剂盒,利用RACE技术获得靶基因cDNA序列。利用NCBI数据库中的Search for Conserved Domains within a protein or coding nucleotide sequence功能(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对靶基因序列进行功能域分析。从NCBI数据库(http://www.ncbi.nlm.nih.gov/)查找其他物种的靶基因氨基酸序列,利用MEGA 5软件(http://www.megas-oftware.net)进行进化树分析,用DNAMAN(version 6) (Lynnon Biosoft,加拿大)软件进行多序列对比分析。
提取感染6、12、24、48 h后的中国明对虾肝胰腺和鳃组织总RNA,按照RNAsimple总RNA提取试剂盒(天根)说明书操作。利用qRT-PCR技术对靶基因表达水平进行检测。内参选择18S rRNA,引物序列见表 1。反应体系和程序同bantam表达水平检测实验。
2 结果 2.1 bantam表达水平研究结果显示,感染WSSV的中国明对虾肝胰腺中的bantam表达水平呈现下调趋势。在感染WSSV后的6、12、24和48 h,中国明对虾肝胰腺中的bantam表达水平分别是对照组的(0.16±0.03)(P < 0.05)、(0.63± 0.26)、(0.32±0.06)(P < 0.05)和(0.41±0.13)倍。感染WSSV的中国明对虾鳃中的bantam表达水平呈现波动趋势。在感染WSSV后的6、12、24和48 h,中国明对虾鳃中的bantam表达水平分别是对照组的(0.30±0.17)(P < 0.05)、(1.88±0.26)(P < 0.01)、(0.84±0.36)和(0.51±0.25)倍。
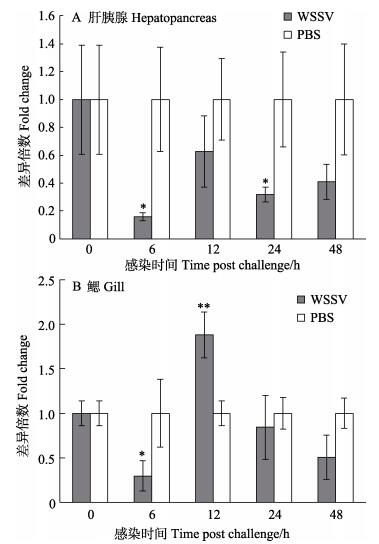
|
图 1 感染WSSV后中国明对虾肝胰腺和鳃中bantam表达水平 Fig.1 Expression level of bantam in the hepatopancreas and gill of WSSV-infected Chinese shrimp *为差异显著(P < 0.05);**为差异极显著(P < 0.01)。下同 * denoted significant difference (P < 0.05); ** denoted highly significant difference (P < 0.01). The same as below |
miRanda软件预测评分最高的中国明对虾bantam候选靶基因是泛素缀合酶E2(Ubiquitin-conjugating enzyme E2),miRanda评分为183,预测bantam与靶基因泛素缀合酶E2结合位点的自由结合能是-27.89 kcal/mol。
中国明对虾泛素缀合酶E2基因编码区共540 bp,起始密码子ATG,终止密码子TAG,共编码179个氨基酸。功能域预测结果显示,第33~80氨基酸残基构成Ubiquitin-conjugating enzyme E2的catalytic (UBCc)功能域(图 2)。由来自5种脊椎动物、5种无脊椎动物、3种真菌和2种植物的泛素缀合酶E2氨基酸序列进化树分析结果显示,中国明对虾的泛素缀合酶E2蛋白首先与甲壳动物端足虫(Hyalella azteca)聚为一支,其他无脊椎动物赤拟谷盗(Tribolium castaneum)、果蝇(Drosophila serrata)、地中海实蝇(Ceratitis capitata)泛素缀合酶E2聚为一支。5种脊椎动物分别是小鼠(Mus musculus)、大鼠(Rattus norvegicus)、人类(Homo sapiens)、珍珠鸡(Numida meleagris)、大山雀(Parus major)泛素缀合酶E2聚为一支。3种子囊菌(Umbilicaria pustulata、Diplocarpon rosae、Madurella mycetomatis)泛素缀合酶E2聚为一支。2种植物分别是可可(Theobroma cacao)和菠萝(Ananas comosus)泛素缀合酶E2聚为一支(图 3)。多序列比对结果显示,泛素缀合酶E2蛋白的UBCc功能域氨基酸残基序列在不同物种间保守性较高。其中,5种脊椎动物的泛素缀合酶E2氨基酸序列均以MASQN氨基酸残基序列开始,4种无脊椎动物的泛素缀合酶E2氨基酸序列均以MAQN氨基酸残基开始。分类学地位较远的物种间的泛素缀合酶E2蛋白N端氨基酸序列变化较大,保守性总体略低于C端氨基酸序列(图 4)。

|
图 2 泛素缀合酶E2核酸以及预测氨基酸序列 Fig.2 Nucleotide and deduced amino acid sequence of the ubiquitin-conjugating enzyme E2 起始密码子和终止密码子用方框标出。UBCc功能域用下划线标出 The initiation and termination codons are boxed. The UBCc domain is underlined |
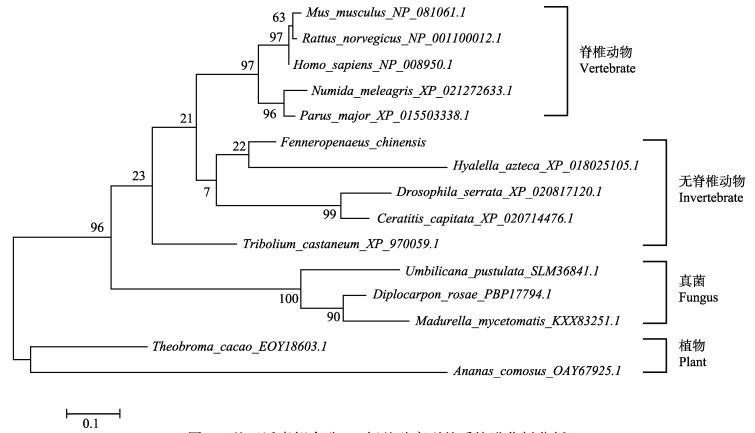
|
图 3 基于泛素缀合酶E2氨基酸序列的系统进化树分析 Fig.3 Phylogenetic analysis based on the deduced amino acid sequences of the ubiquitin-conjugating enzyme E2 |

|
图 4 泛素缀合酶E2氨基酸多序列比对 Fig.4 Multiple alignments of deduced amino acid sequences of the ubiquitin-conjugating enzyme E2 多序列比对所用序列与图 3中所用序列一致 The sequences used in the multiple alignments are the same sequences shown in Fig. 3 |
qRT-PCR结果显示,在感染WSSV后6、12、24和48 h的中国明对虾肝胰腺中,泛素缀合酶E2的表达水平分别是对照组的(0.54±0.10)、(1.19±0.62)、(3.69±0.51)(P < 0.01)和(1.94±0.07)(P < 0.05)倍。在感染WSSV后6、12、24和48 h的中国明对虾鳃中,泛素缀合酶E2表达水平是对照组的(0.22±0.05)、(1.34± 0.38)、(4.29±0.52)(P < 0.01)和(1.28±0.79)倍(图 5)。
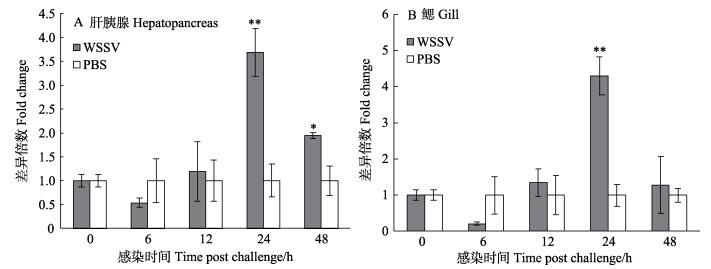
|
图 5 感染WSSV后中国明对虾肝胰腺和鳃内泛素缀合酶E2基因表达水平 Fig.5 Gene expression level of ubiquitin-conjugating enzyme E2 in the hepatopancreas and gill of WSSV-infected Chinese shrimp |
高致死率的WSSV对中国明对虾产业发展带来巨大的影响。目前,在中国明对虾抗WSSV研究领域,miRNA方面的研究相对较少。针对凡纳滨对虾(Litopenaeus vannamei)的研究表明,8种miRNA在感染WSSV后的对虾体内呈现差异表达(Zeng et al, 2015)。在桃拉病毒感染的凡纳滨对虾体内,22种miRNA发生差异表达,其中,有8种miRNA上调表达,14种下调表达(马宁等, 2015)。这些研究提示,miRNA在对虾与病毒互作中可能发挥重要调控作用。
本研究表明,bantam在感染WSSV后的中国明对虾体内呈现显著的表达变化。研究表明,bantam主要参与调控细胞增殖、细胞凋亡过程(Brennecke et al, 2003; Lam et al, 2014; Huang et al, 2014)。同时,有关于bantam参与免疫过程的报道。在感染桃拉病毒后的凡纳滨对虾肝胰腺内,bantam的表达量下降到正常水平的0.34倍(马宁等, 2015)。感染WSSV的凡纳滨对虾肝胰腺内bantam的表达水平显著下调至正常对虾的0.3倍(Zeng et al, 2015)。上述研究结果与本研究类似。bantam在感染WSSV初期的对虾肝胰腺中呈现下调表达趋势,提示bantam可能与对虾和病毒间的互作过程相关。但是,本研究发现感染WSSV后的中国明对虾鳃中bantam表达呈现出先下调后上调的波动变化。肝胰腺是发挥免疫作用的组织,鳃是WSSV侵染的主要靶器官,WSSV的侵染对这2种组织内bantam表达水平的影响不同,提示不同组织应答病毒侵染的机制不同。考虑到bantam主要参与调控细胞增殖和细胞凋亡过程,这可能提示,通过bantam的转录后调控过程,病毒侵染影响了宿主的细胞凋亡过程。
泛素缀合酶E2是参与蛋白泛素化反应的酶,蛋白的泛素化通过泛素活化酶E1、泛素缀合酶E2、泛素蛋白连接酶E3将泛素与蛋白酶连接,泛素化蛋白酶发挥水解作用。因此,该酶在生物细胞周期调控、细胞增殖、细胞凋亡过程中发挥重要作用(Chang et al, 2015; Jiang et al, 2010; Maeda et al, 2009)。陈学昭等(2015)研究报道,泛素缀合酶E2在鳗弧菌感染后的松江鲈(Trachidermus fasciatus)肝脏、脾脏内表达水平迅速上升,提示该基因与鱼类的免疫功能可能相关。Jeena等(2012)在斑节对虾抗WSSV研究中发现,感染WSSV后24 h,对虾体内的泛素缀合酶E2表达水平显著升高,随后表达水平开始下降,泛素缀合酶E2表达特征与本研究十分相似,进一步提示,泛素缀合酶E2可能与对虾和WSSV互作过程相关。bantam和泛素缀合酶E2都是与细胞增殖、细胞凋亡过程相关的调控因子。研究表明,在感染WSSV后的中国明对虾体内bantam和泛素缀合酶E2呈现显著表达变化(P < 0.05),提示中国明对虾在感染WSSV后可能通过泛素-蛋白酶体途径(Ubiquitin-proteasome pathway, UPP)对某些特殊靶蛋白进行选择性降解,影响细胞的凋亡过程。但是,这种变化是中国明对虾对WSSV侵染过程的免疫应答,还是宿主基因被WSSV挟持为病毒侵染过程服务,需要进一步研究来证实。
Brennecke J, Hipfner DR, Stark A, et al. bantam, encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila. Cell, 2003, 113(1): 25-36 DOI:10.1016/S0092-8674(03)00231-9 |
Chang R, Wei L, Lu Y, et al. Upregulated expression of ubiquitin-conjugating enzyme E2Q1 (UBE2Q1) is associated with enhanced cell proliferation and poor prognosis in human hapatocellular carcinoma. Journal of Molecular Histology, 2015, 46(1): 45-56 DOI:10.1007/s10735-014-9596-x |
Chen XZ, Zhang L, Yu SS, et al. Molecular cloning and expression analysis of ubiquitin-conjugating enzyme E2-D2 in roughskin sculpin, Trachidermus Fasciatus. Haiyang Xuebao, 2015, 37(10): 133-140 [ 陈学昭, 张雷, 于珊珊, 等. 松江鲈(Trachidermus fasciatus)泛素结合酶E2-D2基因的分子克隆及组织表达分析. 海洋学报, 2015, 37(10): 133-140 DOI:10.3969/j.issn.0253-4193.2015.10.013] |
Feng YP, Kong J, Luo K, et al. The comparison of the sensitivity to the white spot syndrome virus between Fenneropenaeus chinensis and Litopenaeus vannamei. Progress in Fishery Sciences, 2017, 38(6): 78-84 [ 冯亚萍, 孔杰, 罗坤, 等. 中国对虾(Fenneropenaeus chinensis)和凡纳滨对虾(Litopenaeus vannamei)对白斑综合征病毒的敏感性比较. 渔业科学进展, 2017, 38(6): 78-84] |
Hipfner DR, Weigmann K, Cohen SM. The bantam gene regulates Drosophila growth. Genetics, 2002, 161(4): 1527-1537 |
Huang C, Zhang X, Lin Q, et al. Proteomic analysis of shrimp white spot syndrome viral proteins and characterization of a novel envelope protein VP466. Molecular and Cellular Proteomics, 2002, 1(3): 223-231 DOI:10.1074/mcp.M100035-MCP200 |
Huang H, Li J, Hu L, et al. Bantam is essential for Drosophila intestinal stem cell proliferation in response to Hippo signaling. Developmental Biology, 2014, 385(2): 211-217 DOI:10.1016/j.ydbio.2013.11.008 |
Jeena K, Prasad KP, Pathan MK, et al. Expression profiling of WSSV ORF 199 and shrimp ubiquitin conjugating enzyme in WSSV infected Penaeus monodon. Asian-Australasian Journal of Animal Sciences, 2012, 25(8): 1184-1189 DOI:10.5713/ajas.2011.11473 |
Jiang L, Bao Y, Luo C, et al. Knockdown of ubiquitin-conjugating enzyme E2C/UbcH10 expression by RNA interference inhibits glioma cell proliferation and enhances cell apoptosis in vitro. Journal of Cancer Research and Clinical Oncology, 2010, 136(2): 211-217 DOI:10.1007/s00432-009-0651-z |
Kaewkascholkul N, Somboonviwat K, Asakawa S, et al. Shrimp miRNAs regulate innate immune response against white spot syndrome virus infection. Developmental and Comparative Immunology, 2016, 60: 191-201 DOI:10.1016/j.dci.2016.03.002 |
Lam V, Tokusumi T, Tokusumi Y, et al. bantam miRNA is important for Drosophila blood cell homeostasis and a regulator of proliferation in the hematopoietic progenitor niche. Biochemical and Biophysical Research Communica-tions, 2014, 453(3): 467-472 DOI:10.1016/j.bbrc.2014.09.109 |
Le S, Li C, Zhang X. The role of shrimp miR-965 in virus infection. Fish and Shellfish Immunology, 2016, 54: 427-434 DOI:10.1016/j.fsi.2016.04.129 |
Ma N, Zeng DG, Li M, et al. Study on differential expression of microRNAs in Litopenaeus vannamei induced by Taura syndrome virus infection. Southwest China Journal of Agricultural Sciences, 2015, 28(5): 2310-2315 [ 马宁, 曾地刚, 黎铭, 等. 桃拉综合症病毒感染诱导的凡纳滨对虾microRNA表达差异的研究. 西南农业学报, 2015, 28(5): 2310-2315] |
Maeda H, Miyajima N, Kano S, et al. Ubiquitin-conjugating enzyme UBE2Q2 suppresses cell proliferation and is down-regulated in recurrent head and neck cancer. Molecular Cancer Research, 2009, 7(9): 1553-1562 DOI:10.1158/1541-7786.MCR-08-0543 |
Meng XH. The analysis of WSSV resistance of Fenneropenaeus chinensis "Huanghai No.2". Doctoral Dissertation of Ocean University of China, 2010 [孟宪红.中国对虾"黄海2号"对WSSV的抗病性分析.中国海洋大学博士研究生学位论文, 2010] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1828712
|
Nolo R, Morrison CM, Tao C, et al. The bantam microRNA is a target of the hippo tumor-suppressor pathway. Current Biology, 2006, 16(19): 1895-1904 DOI:10.1016/j.cub.2006.08.057 |
Shi X, Ran Z, Li S, et al. The effect of microRNA bantam on Baculovirus AcMNPV infection in vitro and in vivo. Viruses, 2016, 8(5): 136 DOI:10.3390/v8050136 |
van Hulten MCW, Witteveldt J, Peters S, et al. The white spot syndrome virus DNA genome sequence. Virology, 2001, 286(1): 7-22 DOI:10.1006/viro.2001.1002 |
Yang F, He J, Lin X, et al. Complete genome sequence of the shrimp white spot bacilliform virus. Journal of Virology, 2001, 75(23): 11811-11820 DOI:10.1128/JVI.75.23.11811-11820.2001 |
Yan H, Zeng Y, Gong GY, et al. The expression pattern of miR-223 in different tissues of Cynoglossus semilaevis and the regulation of expression in response to infections. Progress in Fishery Sciences, 2015, 36(2): 37-44 [ 颜慧, 曾艳, 公光业, 等. 半滑舌鳎(Cynoglossus semilaevis) miR-223的表达特征及免疫应答分析. 渔业科学进展, 2015, 36(2): 37-44] |
Yang L, Yang G, Zhang X. The mir-100-mediated pathway regulates apoptosis against virus infection in shrimp. Fish and Shellfish Immunology, 2014, 40(1): 146-153 DOI:10.1016/j.fsi.2014.06.019 |
Zeng DG, Chen XL, Xie DX, et al. Identification of highly expressed host microRNAs that respond to white spot syndrome virus infection in the Pacific white shrimp Litopenaeus vannamei (Penaeidae). Genetic and Molecular Research, 2015, 14(2): 4818-4828 DOI:10.4238/2015.May.11.14 |



