2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与 食物产出过程功能实验室 青岛 266071;
3. 农业农村部大洋渔业开发重点实验室 上海 201306;
4. 国家远洋渔业工程技术研究中心 上海 201306;
5. 大洋渔业资源可持续开发教育部重点实验室 上海 201306;
6. 上海海洋大学海洋生态与环境学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306;
5. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306;
6. College of Marine Ecology and Environment, Shanghai Ocean University, Shanghai 201306
茎柔鱼(Dosidicus gigas)是重要的大洋经济性头足类,广泛分布于东太平洋,资源量丰富(陈新军等, 2012a)。据FAO (2016)统计,茎柔鱼年产量已达到经济性头足类总产量的24%,超过100万t,其作业海区包括加利福利亚湾、哥斯达黎加外海以及秘鲁与智利的沿岸和外海。除这些传统的渔场,自2012年开始,中东太平洋赤道海域被开发为新的茎柔鱼渔场(陈新军等, 2012b)。茎柔鱼肉质鲜美、营养丰富,可被制作成鱼类饵料和鱼粉等产品,随着食品加工技术的发展,其胴体和腕足被加工为多种即食休闲食品(Uriarte-Montoya et al, 2010; Arias-Moscoso et al, 2011; 杨宪时等, 2013)。但是,茎柔鱼产量易受到海洋环境变化的影响,而不同海域受影响的程度不同,这使得各海区茎柔鱼产品价格存在波动(Markaida, 2006; Medellín-Ortiz et al, 2016)。随着南太平洋区域性渔业管理组织(SPRFMO)成立,茎柔鱼被纳入监管范围。这迫切需要我国全面了解各海区茎柔鱼的特点,从而对其资源合理利用,在国际谈判管理中掌握话语权。
脂肪酸是海产品的主要营养成分之一,因其具有调节免疫力和降低心血管疾病风险等作用而受到人们的重视(Simopoulos, 2006; 李忠清等, 2016; 柳学周等, 2017)。同时,脂肪酸作为茎柔鱼生命活动主要的能量来源之一,与其生命过程中的生理机能具有密切的关系(Phillips et al, 2001; Pethybridge et al, 2013)。海洋生物脂肪酸组成会受到多种因素的影响,其中,摄食活动和栖息地的环境条件被认为是影响其组成的最主要因素(Iverson et al, 2004; 许强等, 2011)。这使得脂肪酸成为一种具有示踪海洋生物间营养关系和溯源海产品的生物标志物。目前,国内对茎柔鱼脂肪酸的研究主要集中在对秘鲁外海茎柔鱼肌肉和腕足的营养成分分析(杨宪时等, 2013)和食品加工领域(王丽丽等, 2014),国外仅Saito等(2014)对秘鲁沿海茎柔鱼不同组织和胃含物的脂肪酸组成进行了研究,未见针对不同海区茎柔鱼脂肪酸组成进行详细分析报道。因此,本研究以在中东太平洋赤道海域、秘鲁外海和智利外海捕获的茎柔鱼为研究对象,对其肌肉脂肪酸组成进行测定和比较。分析各海区茎柔鱼所含脂肪酸种类和组成的潜在差异,并分析可能造成空间差异的主要脂肪酸种类和原因。
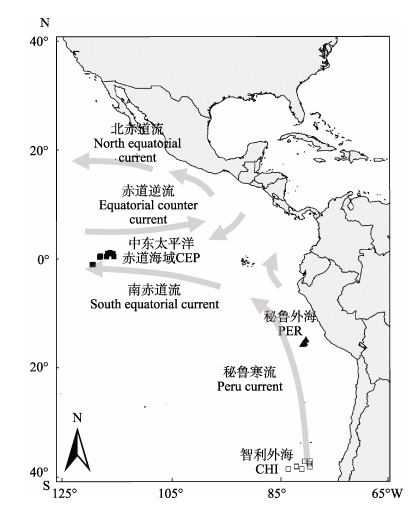
1 材料与方法 1.1 实验材料实验样品由鱿钓船在中东太平洋赤道海域(CEP)、秘鲁外海(PER)和智利外海(CHI)3个茎柔鱼生产海区采集(图 1),样品经冷冻保存运回实验室,于-20℃冰箱冷冻保藏(Phillips et al, 2002)。为了解不同海区茎柔鱼脂肪酸组成差异,本研究仅选取个体大小相近的样品进行研究。共采集了44尾样品,样品的具体情况见表 1。实验室解冻后,测定其胴长,精确至0.1 cm。取茎柔鱼胴体漏斗锁软骨处的肌肉2 cm×2 cm,去除表皮,使用超纯水漂洗后放入冷冻干燥机(Christ Alpha 1-4) -55℃干燥24 h,干燥后,用冷冻混合球磨仪(Mixer mill MM440)磨碎成粉末(直径5 µm)。
|
图 1 茎柔鱼采样点和主要表层海流(Anderson et al, 2001) Fig.1 Sampling locations of Dosidicus gigas and major surface currents |
|
|
表 1 茎柔鱼采样点、基础生物学参数和脂肪含量 Tab.1 Sampling locations, biological parameters, and total lipids of D. gigas |
称取样品粉末200 mg加入15 ml三氯甲烷-甲醇溶液(2:1,v/v),浸泡24 h。离心后取上清液,加入0.9%的氯化钠溶液洗涤,静置至溶液明显分层。取三氯甲烷层于圆底烧瓶中,用氮气吹干后,重量法测定干样中总脂肪含量。加入4 ml氢氧化钠-甲醇溶液(0.5 mol/L),混合后连接水浴回流装置,60℃水浴加热30 min。之后,加入4 ml三氯化硼-甲醇溶液(14%,w/v),水浴加热30 min。冷却至室温,加入4 ml正己烷,震荡2 min。再加入10 ml氯化钠溶液,静置分层。正己烷层移入配有聚四氟乙烯瓶盖的厚壁玻璃管。
1.2.2 脂肪酸分析脂肪酸采用气相色谱/质谱联用仪(7890B/5977A,Agilent)进行分析。色谱条件:毛细管柱型号为Agilent HP-88(60 m×0.25 nm×0.20 μm),载气为高纯氦气,分流比为10︰1,进样口温度为250℃。升温程序:初始温度为125℃,以8℃/min升温至145℃并保持26 min,然后以2℃/min升温至220℃并保持1 min,最后以1℃/min升温至227℃并保持1 min。
1.3 数据统计脂肪酸组成采用内标法(GLC 37,Nu-Chek Prep Inc,Elysian)进行定量分析。每种脂肪酸以占各脂肪酸总含量的百分比表示。使用SPSS19.0和Past3软件对数据进行统计分析。利用主成分分析检验不同海区茎柔鱼肌肉脂肪酸组成的空间差异。采用Bray-Curtis相似性系数,以相似性分析(ANOSIM)对比海区间空间差异的大小,并通过分析相似性百分比(SIMPER)检验造成茎柔鱼肌肉脂肪酸组成空间差异的主要脂肪酸种类。
2 结果与分析 2.1 茎柔鱼肌肉脂肪含量和脂肪酸组成本研究中,各海区茎柔鱼的胴长(P=0.11)和脂肪含量(P=0.06)无显著差异(表 1)。对脂肪酸测定结果分析发现,3个海区茎柔鱼肌肉中所含脂肪酸种类不同,分别检测出24~28种脂肪酸(表 2)。捕获自秘鲁外海(PER)的样品所含的种类最多(28种),包括10种饱和脂肪酸(SAT)、8种单不饱和脂肪酸(MUFA)和10种多不饱和脂肪酸(PUFA)。而中东太平洋赤道海域(CEP)的个体未检出C20:3n6 (PUFA)。智利外海(CHI)样品中的脂肪酸种类最少(24种),C14:0、C15:0、C14:1n5和C20:3n3均未检出。
|
|
表 2 茎柔鱼肌肉脂肪酸组成(平均值±标准误差) Tab.2 Fatty acid profiles of D. gigas muscle tissues (Mean±SE)(%) |
PUFA是茎柔鱼肌肉脂肪酸含量最高的一类。CHI样品的PUFA总含量最高(69.3%),PER样品的最低,但也高达59.7%,且与CEP样品(61.2%)无显著差异(图 2)。C22:6n3(DHA)是PUFA的主要存在形式(> 61.2%),其含量以CHI样品最高,CEP和PER样品次之,但二者差异不显著。茎柔鱼肌肉SAT含量为20.7%~27.3%,CHI个体的SAT含量显著低于其他2个海区(图 2)。在3个海区检测出的SAT中,只有C16:0和C18:0含量较高,其他种类的百分含量均较低(表 2)。C16:0是含量最高的SAT,占55.03%~ 63.11%。茎柔鱼肌肉中MUFA的含量低于SAT和PUFA,仅10.01%~13.04%。CEP和PER个体的MUFA高于CHI,而二者差异不显著(图 2)。在全部海区含量均高于1%的脂肪酸有10种,即C16:0、C18:0、C16:1n7、C17:1n7、C18:1n9、C20:1n9、C18:2n6、C20:4n6、C20:5n3(EPA)和DHA(表 2)。其中,含量排在前6位的是C16:0、C18:0、C20:1n9、C18:2n6、EPA和DHA,这6种脂肪酸的总含量在3个海区均高达81.1%以上。

|
图 2 不同海区茎柔鱼肌肉饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸比较(平均值±标准误差) Fig.2 Comparison of the saturated, monounsaturated, and polyunsaturated fatty acid profiles of D. gigas muscle tissue in three areas (Mean±SE) CEP:中东太平洋赤道海域;PER:秘鲁外海;CHI:智利外海。不同字母表示数值存在显著差异(P < 0.05) CEP: Equatorial central eastern Pacific; PER: Off Peru; CHI: Off Chile. Values with different letters were statistically different (P < 0.05) |
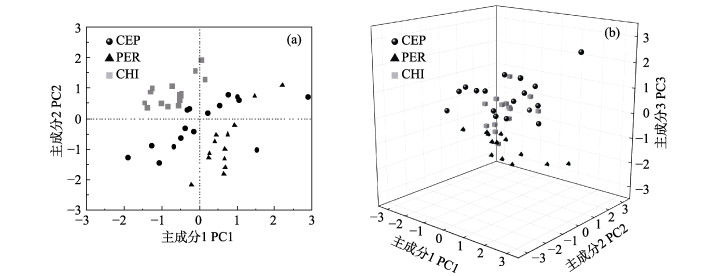
以3个海区茎柔鱼样品为样本单元,仅选择在全部海区含量均高于1%的脂肪酸为参数进行主成分分析。有3个主成分初始特征值> 1,方差贡献率依次为34.69%、25.11%和14.46%,累计74.26%,表明本结果可以反映茎柔鱼肌肉脂肪酸含量的信息。
由主成分散点图可以看出(图 3),3个海区基本散布在不同的区域,说明茎柔鱼脂肪酸组成在海区间存在差异。主成分1和2能较好地区分秘鲁和智利外海样品,但在增加主成分3后仍较难区分CEP和其他2个海区。结合成分矩阵结果(表 3),对主成分1和2贡献较大的特征向量为C18:0、C16:1n7、C17:1n7、C18:1n9、C20:1n9、C18:2n6、C20:4n6和C22:6n3,说明这些脂肪酸可以体现秘鲁和智利外海样品的空间差异。
|
图 3 不同海区茎柔鱼肌肉脂肪酸组成主成分分析 Fig.3 Principal component analysis of the fatty acid compositions of D. gigas from three areas CEP:中东太平洋赤道海域;PER:秘鲁外海;CHI:智利外海 CEP: Equatorial central eastern Pacific; PER: Off Peru; CHI: Off Chile |
|
|
表 3 主成分矩阵组成 Tab.3 Component matrix of principal components |
ANOSIM显示,各海区间茎柔鱼脂肪酸组成均存在显著差异(P < 0.05)。由于R值可指示各组海区间差异的大小,PER与CHI的差异(R=0.87)明显大于其他2组海区的差异(CEP与PER:R=0.18;CEP与CHI:R=0.33)。根据SIMPER分析结果,图 4列出了茎柔鱼肌肉主要脂肪酸种类对空间非相似性的贡献率。对CEP和PER差异贡献较大的是C22:6n3、C16:0和C18:2n6,总贡献率为70.45%。而CEP与CHI和PER与CHI的差异主要是来自C22:6n3、C20:4n6和C16:0,总贡献率分别为71.20%和68.18%。

|
图 4 茎柔鱼肌肉各脂肪酸种类对脂肪酸组成空间差异的贡献率 Fig.4 Contribution of fatty acids in D. gigas muscle tissue that caused the spatial differences in SIMPER analysis |
本研究对东太平洋3个海区茎柔鱼肌肉脂肪酸组成分析发现,不同海区茎柔鱼所含的脂肪酸种类存在差异(表 2)。捕获自PER的样品共检测到28种,而CHI的个体只有24种。尽管如此,各海区茎柔鱼脂肪酸均以PUFA为主,含量占比达到59.68%~ 69.28%,其次是SFA(20.71%~27.28%)和MUFA (10.01%~13.04%)。该结果与杨宪时等(2013)和Saito等(2014)对秘鲁沿岸和外海茎柔鱼胴体肌肉脂肪酸组成的研究结果相似。类似的不同饱和度脂肪酸的相对含量也出现在其他头足类中。Stowasser等(2006)对大西洋短鳍鱿鱼(Lolliguncula brevis)肌肉和消化腺脂肪酸组成研究发现,含量由高到低分别为PUFA、SFA和MUFA。南极褶柔鱼(Todarodes filippovae)肌肉脂肪酸组成也存在这种关系,但其消化腺的脂肪酸主要以MUFA为主(Pethybridge et al, 2013)。与近海种类大西洋短鳍鱿鱼相比,大洋性头足类运动能力强、生长速率快,新陈代谢速率和转化率的差别可能造成了消化腺脂肪酸组成的差异(陈新军等, 2012a; Every et al, 2016)。茎柔鱼消化腺是否具有该特点还有待进一步研究。此外,各海区茎柔鱼肌肉较高的PUFA含量显示出其极高的营养价值,特别是含量排在前6位的EPA和DHA,被证实具有防治心血管疾病、改善神经和视觉系统等功效(Simopoulos, 2006; 李忠清等, 2016; 柳学周等, 2017)。
根据SIMPER分析结果,对脂肪酸组成的空间异质性贡献较高的脂肪酸包括C16:0、C18:2n6、C20:4n6和C22:6n3,这些脂肪酸可能直接反映了各海区食物来源的差异。虽然对茎柔鱼必需脂肪酸种类的研究还未见报道,但在大西洋短鳍鱿鱼室内投喂实验中,Stowasser等(2006)发现,其肌肉中C18:2n6和C22:6n3含量与饵料中对应脂肪酸含量的关系最为密切。这2种脂肪酸可能是茎柔鱼的必需脂肪酸,并能体现出食物来源的空间差异(Sargent et al, 1995),与茎柔鱼的食性分析结果一致。Alegre等(2014)对秘鲁海域(PER)茎柔鱼胃含物研究后发现,其主要摄食其他头足类和灯笼鱼(Vinciguerria lucetia)。而智利外海(CHI)采集的茎柔鱼胃含物中鱼类的比重超过80%,头足类极少(Pardo-Gandarillas et al, 2014)。虽然有关中东太平洋赤道海域(CEP)茎柔鱼食物组成的研究还未见报道,但CEP样品的特异性脂肪酸组成反映出其与其他2个海区食物来源的潜在差异。本研究表明,不同海区茎柔鱼食物来源的复杂性以及脂肪酸分析方法在其食性研究中的潜在价值。
脂肪酸组成的空间异质性也可能与各海区环境条件有关。本研究中,秘鲁和智利外海主要受秘鲁寒流和上升补偿流影响,海域的水温较低。由于智利所处纬度较高,其外海水温相对更低(图 1)。而CEP同时受南赤道流和赤道逆流影响,且光照强度高,具有较高的水温(Anderson et al, 2001)。研究发现,在水温降低时,海洋生物会通过提高PUFA含量以保持细胞膜活性(Ruyter et al, 2003; Tocher et al, 2004)。水温的这种影响也出现在茎柔鱼中,栖息在最低水温环境的CHI个体具有最高含量的PUFA,特别是C18:2n6、C20:4n6和C22:6n3。此外,在秘鲁和智利外海,上升补偿流会将海底大量的营养盐输送到海洋真光层,而CEP靠近大洋中部,营养盐相对贫瘠。各海区水温、光照强度和营养盐的差异很可能造成了浮游植物种类和丰度的空间差异(杨东方等, 2007)。而某些浮游植物含有特异性脂肪酸种类,并可通过摄食活动反映到高营养级动物脂肪酸组成中(Iverson et al, 2004)。例如,对茎柔鱼脂肪酸组成空间差异贡献较高的C18:2n6和C20:4n6是大型藻类、红藻或褐藻的特征脂肪酸标志物(Napolitano et al, 1997; Kharlamenko et al, 2001; 李宪璀等, 2002),而C22:6n3可以指示鞭毛藻类(Pond et al, 1998; Parrish et al, 2000)。
另一方面,脂肪是生物体重要的能量储存单元,其中的SFA是茎柔鱼重要的储能和供能脂肪酸(Turchini et al, 2003)。茎柔鱼肌肉中含量最高的SFA是C16:0,其空间异质性在一定程度上反映出各海区茎柔鱼对生长和繁殖的能量需求的潜在差异。在茎柔鱼生物学研究中已得到验证,栖息于不同海域的茎柔鱼个体生长速率和初次性成熟胴长均存在显著差异(Chen et al, 2011; 陈新军等, 2012b; Liu et al, 2013)。
4 结论本研究通过测定捕获自东太平洋3个作业海区的茎柔鱼肌肉脂肪酸,分析了各海区茎柔鱼肌肉脂肪酸组成的特点和差异。结果显示,茎柔鱼肌肉脂肪酸组成存在空间差异,但均以多不饱和脂肪酸为主,该差异主要体现在各海区C16:0、C18:2n6、C20:4n6和C22:6n3的含量不同。脂肪酸组成的空间异质性可能是由各海区海洋环境、食物来源和个体能量需求差异造成的。本研究结果说明了脂肪酸标志物在追溯茎柔鱼来源、分析群体结构等方面的潜力。但本研究只选取了中型个体样品,今后需要进一步探讨分析这些特征脂肪酸对茎柔鱼来源海区的判别情况。
Alegre A, Ménard F, Tafur R, et al. Comprehensive model of jumbo squid Dosidicus gigas trophic ecology in the Northern Humboldt Current System. PLoS One, 2014, 9(1): e85919 DOI:10.1371/journal.pone.0085919 |
Anderson CI, Rodhouse PG. Life cycles, oceanography and variability: Ommastrephid squid in variable oceanographic environments. Fisheries Research, 2001, 54(1): 133-143 DOI:10.1016/S0165-7836(01)00378-2 |
Arias-Moscoso JL, Soto-Valdez H, Plascencia-Jatomea M, et al. Composites of chitosan with acid soluble collagen from jumbo squid (Dosidicus gigas) by-products. Polymer International, 2011, 60(6): 924-931 DOI:10.1002/pi.v60.6 |
Chen XJ, Li JH, Liu BL, et al. Comparison of fishery biology for Dosidicus gigas from three different areas in the eastern Pacific Ocean. Journal of Shanghai Ocean University, 2012a, 21(2): 280-287 [ 陈新军, 李建华, 刘必林, 等. 东太平洋不同海区茎柔鱼渔业生物学的初步研究. 上海海洋大学学报, 2012a, 21(2): 280-287] |
Chen XJ, Li JH, Yi Q, et al. Preliminary study on fisheries biology of Dosidicus gigas in the waters near the equator of eastern Pacific Ocean. Oceanologia et Limnologia Sinica, 2012b, 43(6): 1233-1238 [ 陈新军, 李建华, 易倩, 等. 东太平洋赤道附近海域茎柔鱼(Dosidicus gigas)渔业生物学的初步研究. 海洋与湖沼, 2012b, 43(6): 1233-1238] |
Chen XJ, Lu HJ, Liu BL, et al. Age, growth and population structure of jumbo flying squid, Dosidicus gigas, based on statolith microstructure off the Exclusive Economic Zone of Chilean waters. Journal of the Marine Biological Association of the United Kingdom, 2011, 91(1): 229-235 DOI:10.1017/S0025315410001438 |
Every SL, Pethybridge HR, Crook DA, et al. Comparison of fin and muscle tissues for analysis of signature fatty acids in tropical euryhaline sharks. Journal of Experimental Marine Biology and Ecology, 2016, 479: 46-53 DOI:10.1016/j.jembe.2016.02.011 |
FAO. Fishery and aquaculture statistics. FAO yearbook 2014, Rome: FAO, 2016
|
Iverson SJ, Field C, Don Bowen W, et al. Quantitative fatty acid signature analysis: A new method of estimating predator diets. Ecological Monographs, 2004, 74(2): 211-235 DOI:10.1890/02-4105 |
Kharlamenko VI, Kiyashko SI, Imbs AB, et al. Identification of food sources of invertebrates from the seagrass Zostera marina community using carbon and sulfur stable isotope ratio and fatty acid analyses. Marine Ecology Progress Series, 2001, 220: 103-117 DOI:10.3354/meps220103 |
Li XC, Fan X, Han LJ, et al. Fatty acids of common marine macrophytes from the Yellow and Bohai seas. Oceanologia et Limnologia Sinica, 2002, 33(2): 215-224 [ 李宪璀, 范晓, 韩丽君, 等. 中国黄、渤海常见大型海藻的脂肪酸组成. 海洋与湖沼, 2002, 33(2): 215-224 DOI:10.3321/j.issn:0029-814X.2002.02.015] |
Li ZQ, Xia B, Wang JY, et al. Comparative study on nutrient composition of body walls of green and white sea cucumbers (Apostichopus japonicus). Progress in Fishery Sciences, 2016, 37(3): 101-107 [ 李忠清, 夏斌, 王际英, 等. 青、白刺参(Apostichopus japonicus)体壁营养成分的比较分析. 渔业科学进展, 2016, 37(3): 101-107] |
Liu BL, Chen XJ, Chen Y, et al. Age, maturation, and population structure of the Humboldt squid Dosidicus gigas off the Peruvian Exclusive Economic Zones. Chinese Journal of Oceanology and Limnology, 2013, 31(1): 81-91 DOI:10.1007/s00343-013-2036-z |
Liu XZ, Xu YJ, Li R, et al. Analysis and evaluation of nutritional composition of the muscle of yellowtail kingfish (Seriola aureovittata). Progress in Fishery Sciences, 2017, 38(1): 128-135 [ 柳学周, 徐永江, 李荣, 等. 黄条  (Seriola aureovittata)肌肉营养组成分析与评价. 渔业科学进展, 2017, 38(1): 128-135] (Seriola aureovittata)肌肉营养组成分析与评价. 渔业科学进展, 2017, 38(1): 128-135] |
Markaida U. Population structure and reproductive biology of jumbo squid Dosidicus gigas from the Gulf of California after the 1997-1998 El Niño event. Fisheries Research, 2006, 79(1-2): 28-37 DOI:10.1016/j.fishres.2006.02.009 |
Medellín-Ortiz A, Cadena-Cárdenas L, Santana-Morales O. Environmental effects on the jumbo squid fishery along Baja California's west coast. Fisheries Science, 2016, 82(6): 851-861 DOI:10.1007/s12562-016-1026-4 |
Napolitano GE, Pollero RJ, Gayoso AM, et al. Fatty acids as trophic markers of phytoplankton blooms in the Bahía Blanca estuary (Buenos Aires, Argentina) and in Trinity Bay (Newfoundland, Canada). Biochemical Systematics and Ecology, 1997, 25(8): 739-755 DOI:10.1016/S0305-1978(97)00053-7 |
Pardo-Gandarillas MC, Lohrmann KB, George-Nascimento, et al. Diet and parasites of the jumbo squid Dosidicus gigas in the Humboldt Current System. Molluscan Research, 2014, 34(1): 10-19 DOI:10.1080/13235818.2013.860870 |
Parrish CC, Abrajano TA, Budge SM, et al. Lipid and phenolic biomarkers in marine ecosystems: Analysis and applications. In: Wangersky PJ (eds). Marine chemistry. The handbook of environmental chemistry (Vol. 5 Series: Water pollution), vol 5D. Springer, Berlin: Heidelberg, 2000
|
Pethybridge HR, Nichols PD, Virtue P, et al. The foraging ecology of an oceanic squid, Todarodes filippovae: The use of signature lipid profiling to monitor ecosystem change. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2013, 95(15): 119-128 |
Phillips KL, Jackson GD, Nichols PD. Predation on myctophids by the squid Moroteuthis ingens around Macquarie and Heard Islands: Stomach contents and fatty acid analyses. Marine Ecology Progress Series, 2001, 215(1): 179-189 |
Phillips KL, Nichols PD, Jackson GD. Lipid and fatty acid composition of the mantle and digestive gland of four Southern Ocean squid species: Implications for food-web studies. Antarctic Science, 2002, 14(3): 212-220 |
Pond DW, Bell MV, Harris RP, et al. Microplanktonic polyunsaturated fatty acid markers: A mesocosm trial. Estuarine, Coastal and Shelf Science, 1998, 46(2): 61-67 DOI:10.1006/ecss.1998.0334 |
Ruyter B, Røjø C, Grisdale-Helland B, et al. Influence of temperature and high dietary linoleic acid content on esterification, elongation, and desaturation of PUFA in Atlantic salmon hepatocytes. Lipids, 2003, 38(8): 833-840 DOI:10.1007/s11745-003-1133-6 |
Saito H, Sakai M, Wakabayashi T. Characteristics of the lipid and fatty acid compositions of the Humboldt squid, Dosidicus gigas: The trophic relationship between the squid and its prey. European Journal of Lipid Science and Technology, 2014, 116(3): 360-366 DOI:10.1002/ejlt.v116.3 |
Sargent JR, Bell JG, Bell MV, et al. Requirement criteria for essential fatty acids. Journal of Applied Ichthyology, 1995, 11(3-4): 183-198 DOI:10.1111/jai.1995.11.issue-3-4 |
Simopoulos AP. Evolutionary aspects of diet, the omega-6/ omega-3 ratio and genetic variation: Nutritional implications for chronic diseases. Biomedicine & Pharmacotherapy, 2006, 60(9): 502-507 |
Stowasser G, Pierce GJ, Moffat CF, et al. Experimental study on the effect of diet on fatty acid and stable isotope profiles of the squid Lolliguncula brevis. Journal of Experimental Marine Biology and Ecology, 2006, 333(1): 97-114 DOI:10.1016/j.jembe.2005.12.008 |
Tocher DR, Fonseca-Madrigal J, Dick JR, et al. Effects of water temperature and diets containing palm oil on fatty acid desaturation and oxidation in hepatocytes and intestinal enterocytes of rainbow trout (Oncorhynchus mykiss). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2004, 137(1): 49-63 DOI:10.1016/j.cbpc.2003.10.002 |
Turchini GM, Mentasti T, Frøyland L, et al. Effects of alternative dietary lipid sources on performance, tissue chemical composition, mitochondrial fatty acid oxidation capabilities and sensory characteristics in brown trout (Salmo trutta L.). Aquaculture, 2003, 225(1): 251-267 |
Uriarte-Montoya MH, Arias-Moscoso JL, Plascencia-Jatomea M, et al. Jumbo squid (Dosidicus gigas) mantle collagen: Extraction, characterization, and potential application in the preparation of chitosan-collagen biofilms. Bioresource Technology, 2010, 101(11): 4212-4219 DOI:10.1016/j.biortech.2010.01.008 |
Wang LL, Yiang XS, Li XY, et al. The effect of moisture content on the texture and color of light baked squid tentacles. Food and Fermentation Industries, 2014, 40(2): 47-50 [ 王丽丽, 杨宪时, 李学英, 等. 水分含量对软烤鱿鱼足片质构和色泽的影响. 食品与发酵工业, 2014, 40(2): 47-50] |
Xu Q, Yang HS. Fatty acid biomarker and its application in marine trophic relation studies. Acta Oceanologica Sinica, 2011, 33(1): 1-6 [ 许强, 杨红生. 脂肪酸标志物在海洋生态系统营养关系研究中的应用. 海洋学报, 2011, 33(1): 1-6 DOI:10.3969/j.issn.1009-5470.2011.01.001] |
Yang DF, Chen ST, Hu J, et al. Magnitude order of the effect of light, water temperature and nutrients on phytoplankton growth. Marine Environmental Science, 2007, 26(3): 201-207 [ 杨东方, 陈生涛, 胡均, 等. 光照、水温和营养盐对浮游植物生长重要影响大小的顺序. 海洋环境科学, 2007, 26(3): 201-207 DOI:10.3969/j.issn.1007-6336.2007.03.001] |
Yang XS, Wang LL, Li XY, et al. Analysis and evaluation of nutritional compositions of Dosidicus gigas and Onychoteuthis borealijaponicus okad. Modern Food Science and Technology, 2013, 29(9): 2247-2251, 2293 [ 杨宪时, 王丽丽, 李学英, 等. 秘鲁鱿鱼和日本海鱿鱼营养成分分析与评价. 现代食品科技, 2013, 29(9): 2247-2251, 2293] |



