2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
视黄酸(Retinoic acid, RA)是一种脂溶性小分子物质,又称维甲酸,是维生素A(VA)在机体内经过一系列水解和酶催化作用生成的最终代谢产物。视黄酸合成进入细胞后先与重组人胞内维甲酸结合蛋白-1 (CRABP1)和CRΑBP2蛋白结合,转运进入细胞核,形成核受体二聚体,调节相关基因的表达(Budhu et al, 2002)。RA的作用是通过定位在靶细胞核内的特异性受体介导的。目前,已发现两类视黄酸受体:视黄酸受体(RAR)和视黄酸X受体(RXR),作为配体激活的转录因子(Chambon, 1996)。RAR是一类细胞核受体,属于类固醇和甲状腺激素受体超家族,其通过与RXR形成异源二聚体(RAR/RXR),增加与视黄素应答元件的亲和力,由此加强本身的转录活性和对配体的敏感性(Kliewer et al, 1992; Hallenbeck et al, 1992)。哺乳动物RAR有3种亚型:RARα、RARβ和RARγ,配体为顺式视黄酸(9-cis-RA)和反式视黄酸(ATRA)(Brand et al, 1988),但鱼类中目前没有发现RARβ亚型的存在(Jones et al, 1995)。研究发现,RA/RAR系统具有抑制肿瘤生长、保护上皮组织、促进胚胎骨骼心脏功能和视觉发育功能(De Luca, 1991; Zhou et al, 2017; Isojima et al, 2014),并且在抑制细胞凋亡(Herget et al, 1998)和免疫调节(Erkelens et al, 2017)也有重要生理作用,是机体维持稳态的重要因子。
RA及其受体RAR系统在鱼类中的研究较少(Faehnrich, 2016; Zhang et al, 2013; 冷向军, 2017)。在鲆鲽类中,RA/RAR系统对牙鲆(Paralichthys olivaceus)骨骼发育和眼睛位移等变态发育过程(Haga et al, 2002; Martinez et al, 2007),对塞内加尔鳎(Solea senegalensis)(Ignacio et al, 2009)和大西洋庸鲽(Hippoglossus hippoglossus)(Lewis-McCrea et al, 2010)骨骼发育畸形都具有重要的生理调控作用。对牙鲆的研究表明,利用9-cis-RA或者ATRA处理变态前仔鱼,可以通过RA/RAR信号通路的介导作用抑制鱼苗眼睛完成位移。同时发现,牙鲆和半滑舌鳎(Cynoglossus semilaevis)皮肤的RA浓度在有眼侧皮肤高于无眼侧皮肤,且光照可通过RA/RAR信号通路诱导牙鲆无眼侧色素过度沉着(黑化),表明RA/RAR信号通路在半滑舌鳎、牙鲆的体色左右不对称发育模式中起重要调控功能(Shao et al, 2017),但RA/RAR系统对半滑舌鳎体色调控的具体机制仍待进一步研究。
半滑舌鳎属鲽形目、舌鳎科、舌鳎属,为我国近海自然分布的重要经济鱼类,自人工繁育技术取得突破以来,其养殖产业得到快速发展,已成为鲆鲽类三大主导养殖品种之一(邓景耀等, 1988; 柳学周等, 2006、2014)。养殖生产中发现,半滑舌鳎无眼侧黑化(色素沉积过多)问题日益凸显,而无眼侧发生黑化的商品鱼市场价格较无眼侧正常鱼价格低20%以上,成为制约半滑舌鳎养殖产业经济效益的瓶颈之一。目前,国内外对半滑舌鳎无眼侧黑化发生的相关机制鲜有报道,本实验室前期研究了半滑舌鳎体色相关功能基因POMC、MCHR与MCH等的克隆、表达调控及其与体色的关系(史学营等, 2015、2017; 朱学武等, 2016; 徐永江等, 2017),为认识半滑舌鳎无眼侧体色调控机制积累了资料。本研究拟开展半滑舌鳎RAR结构及其表达特性研究,以期为探究RA/RAR系统在养殖半滑舌鳎无眼侧黑化调控中的作用机制提供基础资料。
1 材料与方法 1.1 实验用鱼及样品处理实验用半滑舌鳎于2017年6~8月取自山东省海阳市黄海水产有限公司。取样实验鱼3尾(都存在一定程度无眼侧黑化),体长为(33±3) cm,体重为(237±30) g,用于RAR基因克隆与组织表达特性分析。实验鱼以MS-222 (280 mg/L)麻醉后,快速取性腺、肝脏、心脏、胃、肠、脾、肾、垂体、脑、鳃、肌肉、有眼侧正常皮肤、无眼侧黑化皮肤和无眼侧正常皮肤组织投入液氮速冻后,转入–80℃保存,用于总RNA的提取。
1.2 总RNA提取和cDNA第1链合成利用RNAiso Plus (TaKaRa,日本)试剂盒并按照操作说明提取各组织样品总RNA,通过1%琼脂糖凝胶电泳检测RNA质量,NanoDrop 2000 (Thermo,美国)测定RNA浓度。取适量鳃组织总RNA,以PrimeScriptTM Ⅱ1st strand cDNA Synthesis Kit (TaKaRa,日本)合成cDNA第1链。以SMARTerTM RACE cDNA Amplification Kit(Clontech,美国)合成5'-RACE及3'-RACE cDNA第1链,用于RAR基因RACE全长克隆。取等量各组织样品的总RNA,用PrimeScript RT Reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa,日本)合成cDNA第1链,用于RAR mRNA组织表达特性及分析。各操作步骤均严格按照使用说明书进行。
1.3 总RNA提取和中间片段扩增根据GenBank登记的XM_017034299.1、XM_ 008318896.2预测半滑舌鳎RARs序列保守区设计特异引物(表 1),以肝脏组织为模板,扩增RARα基因的核心序列,PCR反应体系(25 μl):0.2 μl Taq酶、2.5 μl 10×PCR Buffer、2 μl dNTP Mixture、0.5 μl模板、1 μl RARα-F、1 μl RARα-R、17.8 μl ddH2O。反应条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 2 min,38个循环;72℃延伸10 min。扩增RARγ基因的模板为脾脏,PCR反应体系和条件同RARα;PCR产物经1.2%琼脂糖凝胶电泳分离后,切胶回收目的条带并纯化。回收PCR产物与pEASY-T1载体(北京全式金生物公司)连接,转化至Trans1-T1感受态细胞(全式金),LB固体培养基37℃培养过夜,挑取阳性克隆送至生工生物工程(上海)股份有限公司测序;RAR的中间序列已上传NCBI数据库(RARα登录号:MG596268;RARγ登录号:MG596269)。
|
|
表 1 半滑舌鳎RAR基因克隆使用的PCR扩增引物 Tab.1 Primers used for PCR amplification of RAR of C. semilaevis |
根据克隆验证的中心片段设计RACE引物。用Smart RACE Advantage 2 PCR试剂盒(Clontech,美国)进行梯度PCR扩增。第1次PCR,反应体系:17 μl ddH2O、2.5 μl Buffer、2 μl 50×dNTP Mix、0.5 μl 50×Advantage 2 Polymerase Mix、1 μl cDNA、引物RARα1 1 μl和1 μl UPM,共计25 μl。设计Touchdown PCR,反应条件为94℃ 30 s,66℃ 30 s,72℃ 2 min,15个循环,Tm值每5个循环降低2℃;94℃ 30 s,55℃ 30 s,72℃ 2 min,20个循环;最后72℃延伸5 min。以第1次PCR产物稀释10倍为模板,进行巢式PCR,反应体系:17 μl ddH2O、2.5 μl Buffer、2 μl 50×dNTP Mix、0.5 μl 50×Advantage 2 Polymerase Mix、1 μl cDNA、1 μl NPM和1 μl RARα2引物,共计25 μl。PCR反应条件同第1次PCR。PCR产物于1.2%琼脂糖凝胶电泳检测后,对目的条带进行胶回收、载体连接、转化、筛选阳性克隆并测序。RARγ反应体系与条件同RARα。
1.5 RAR mRNA定量表达分析根据获得的半滑舌鳎RARα和RARγ的cDNA序列设计定量PCR引物qRARα和qRARγ(表 1),以18S为内参。利用Mastercycler ep realplex real-time PCR仪(Eppendorf,德国),使用SYBR Premix Ex TaqTMⅡ试剂盒(TaKaRa)进行定量扩增,PCR体系(20 μl):1 μl cDNA模板、上下游引物各0.8 μl (10 μmol/L)、10 μl SYBR Premix Ex TaqTM Ⅱ和7.4 μl dd H2O.。PCR反应条件:95℃预变性30 s,95℃ 5 s,58℃ 20 s、共40个循环。每个样品测试设置3个重复。RAR mRNA的表达量以18S mRNA表达量为基础,利用2-ΔΔCT方法计算获得(Livak et al, 2001)。
1.6 序列分析及数据处理半滑舌鳎RAR基因的结构、分子量预测、等电点预测使用ExPASy在线数据库预测(www.expasy.org/tools/protparam.html);氨基酸序列推导、序列拼接和氨基酸同源性分析均使用软件DNAMAN 6.0,信号肽预测使用SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/)。亚细胞定位使用PSORT Ⅱ软件(https://psort.hgc.jp/form2.html)。结构域预测使用NCBI数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),氨基酸序列比对和系统进化分析使用ClustalW在线软件(http://www.genome.jp/tools-bin/clustalw)和MEGA 7软件。通过SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白质二级结构,通过SWISS-MODEL在线软件(http://www.swissmodel.expasy.org/)分析预测蛋白质三级结构。
实验数据均以平均值±标准差(Mean±SD)表示,多组数据间比较采用SPSS 19.0统计软件进行单因素方差分析(One-way ANOVA)、Duncan和SNK多重比较分析,当P < 0.05时表示差异显著。
2 结果 2.1 RAR cDNA序列结构半滑舌鳎RARα cDNA序列全长为1823 bp (图 1),包括17 bp的5'非编码区(UTR)、1332 bp的开放阅读框(ORF)和474 bp的3'非编码区(UTR),编码443个氨基酸,预测编码蛋白分子量为49 kb,等电点为8.47。半滑舌鳎RARγ cDNA序列全长为1959 bp (图 2),包括305 bp的5'(UTR)、1497 bp的ORF和98 bp的3' (UTR),编码498个氨基酸,预测编码蛋白的分子量为55.8 kb,等电点为4.99。预测2种RAR基因的亚细胞定位均位于细胞核。

|
图 1 半滑舌鳎RARα基因cDNA全长序列及推导的氨基酸序列 Fig.1 The full-length cDNA sequence of C. semilaevis RARα gene and its deduced amino acid sequence 推导的氨基酸序列用单字母表示,从阴影显示的起始甲硫氨酸开始计数。终止密码子用*表示。下同 The deduced amino acid residues were represented as single letter abbreviations and numbered from the initiating methionine which was shadowed. Termination codon was marked with *. The same as below |

|
图 2 半滑舌鳎RARγ基因cDNA全长序列及推导的氨基酸序列 Fig.2 The full-length cDNA sequence of C. semilaevis RARγ gene and its deduced amino acid sequence |
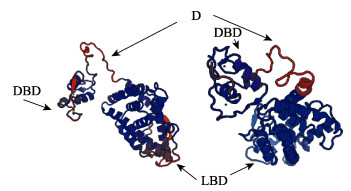
通过SOPMA软件分析RAR编码蛋白的空间二级结构:在RARα成熟蛋白的二级结构中,α-螺旋占34.31%,β-转角占8.35%,无规则卷曲占43.12%,延伸链占14.22%。在RARγ成熟蛋白的二级结构中,α-螺旋占36.75%,β-转角占9.44%,无规则卷曲占40.36%,延伸链占13.45%。通过SWISS-MODEL网站同源建模方法构建了半滑舌鳎RAR编码的蛋白质可能的三级结构,以同源建模的方法与各自的50个RA核受体家族模板构建预测可能的蛋白质三级结构,RARα获得6种三级结构模型,选取GMQE评价值0.55、QMEAN稳定系数-2.79(负值越大越稳定)构建模型;RARγ有5种,选取GMQE评价值0.61,QMEAN稳定系数-2.13构建模型。三级结构模型显示(图 3),RAR蛋白质分为3部分,蓝色的DBD区和LBD区通过橘黄色的D区铰链区相连。
|
图 3 SWISS-MODEL预测的半滑舌鳎RARα(左)和RARγ(右)蛋白质三级结构 Fig.3 Tertiary structure of C. semilaevis RARα (left) and RARγ (right) proteins predicted by SWISS-MODEL |
同源性分析显示,半滑舌鳎RARα的氨基酸序列与同属鲽形目的牙鲆的同源性最高,为97.0%,其次为银大麻哈鱼(Oncorhynchus kisutch)92.2%、鲈鱼(Lateolabrax japonicas) 87.9%、斑马鱼(Danio rerio)86.8%、红鳍东方鲀(Takifugu rubripes)64.6%,且与两栖类、爬行类、啮齿类、鸟类和人(Homo sapiens)的相似度分别为79.6%、82.2%、80.5%、81.5%和80.7%。半滑舌鳎RARγ的氨基酸序列同样与牙鲆同源性最高,达97%,与其他鱼类的同源性均达90.5%以上,与两栖类、啮齿类和人的相似度分别为71.4%、84.5%和80.7%。另外,半滑舌鳎RARα和RARγ的氨基酸序列相似度为60.8% (表 2)。
|
|
表 2 半滑舌鳎RAR氨基酸序列与其他脊椎动物的同源性比较 Tab.2 Comparison of homology of the precursor peptide sequences of RAR gene between C. semilaevis and other vertebrates |
通过结构域预测发现,半滑舌鳎与鲈鱼、人、斑马鱼具有相似的功能结构域,都具有DNA结合区(DBD区)和配体结合区(LBD)区。利用ClustalW对半滑舌鳎RAR的氨基酸序列与其他物种的RAR氨基酸序列进行了比较(图 4)。结果发现,半滑舌鳎与其他鱼类RAR的氨基酸序列整体保守性较强,除在N端的A/B区和C端的F区末尾保守型较差外,中间的DNA与配体结合区保守度较高。

|
图 4 半滑舌鳎与其他物种的RAR氨基酸序列比较
Fig.4 Comparison of the amino acid sequences of C. semilaevis RAR and other species
“*”表示一致的氨基酸;“:”表示高度保守度的氨基酸;“.”表示低保守度的氨基酸;阴影部分表示DBD和LBD功能结构域;RAR氨基酸序列号见表 2;CS:半滑舌鳎;DR:斑马鱼LJ:鲈鱼;HS:人
Asterisks (*) indicated identical amino acid sequences; Dot (:) indicated highly conserved amino acid sequences; Dot (.) indicated amino acid sequences of low degree conserved; GenBank accession numbers were shown in Tab. 2. The shadow part represents the DBD and LBD functional domains CS: Cynoglossus semilaevis; DR: Danio-rerio; LJ: Lateolabrax-japonicus; HS: Homo sapiens |
利用NJ法构建了基于氨基酸序列的半滑舌鳎RARα、RARγ和其他脊椎动物的系统进化树(图 5),半滑舌鳎RARα和RARγ都分别与鲽形目、鲈形目、鲤形目等其他鱼类形成独立的分支,而两栖类、哺乳类和爬行类形成独立的分支。

|
图 5 基于RAR氨基酸序列的NJ系统进化树 Fig.5 NJ phylogenetic tree based on RAR amino acid sequences |
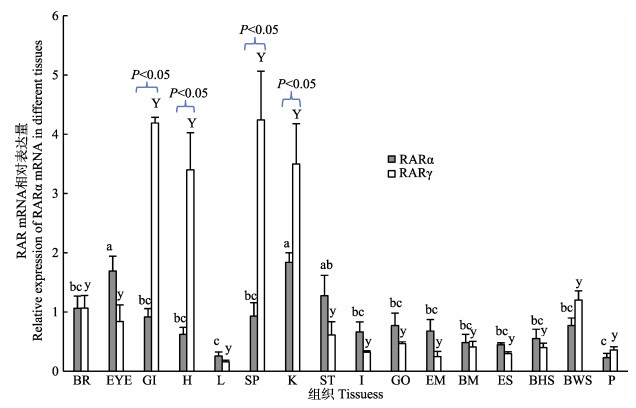
半滑舌鳎2种RAR基因在所有检测组织中都有表达。RARα mRNA在肾脏和眼中表达量最高,与除胃的其他组织差异显著,在胃中的表达也较高,在脑、脾脏、鳃、无眼侧白皮肤、性腺、有眼侧肌肉、肠、心脏、无眼侧黑化皮肤、无眼侧肌肉、有眼侧皮肤等其他组织中也检测到一定的表达量。半滑舌鳎RARγ mRNA在脾脏和鳃中表达量最高,在心脏和肾脏表达量也较高,与其他组织差异显著;而在无眼侧白皮肤、脑、眼、胃、性腺、无眼侧黑化皮肤、无眼侧肌肉、垂体等其他组织表达量相对较低。在肾脏中,2种RAR mRNA表达水平都很高。脾脏、心脏、鳃、肾脏、无眼侧白皮肤等组织中RARγ mRNA表达量高于RARα,而在眼、胃、肠、性腺、肌肉、肝脏、有眼侧皮肤、无眼侧黑化皮肤等组织中,RARα mRNA表达量高于RARγ,脾脏、心脏、鳃和肾脏组织中RARγ与RARα表达差异显著,而其他组织中RARγ与RARα表达差异不显著。脑中2种RAR mRNA表达量基本一致,表明这2种RAR基因在不同组织中的生理功能可能存在差异,即使在同一组织中其生理功能也多存在一定的差异(图 6)。
|
图 6 半滑舌鳎RAR mRNA在不同组织中的相对表达量 Fig.6 Relative expression of RAR mRNA in different tissues of Cynoglossus semilaevis BR:脑;EYE:眼;GI:鳃;H:心脏;L:肝脏;SP:脾脏;K:肾脏;ST:胃;I:肠;GO:性腺;EM:有眼侧肌肉;BM:无眼侧肌肉;ES:有眼侧皮肤;BHS:无眼侧黑化皮肤;BWS:无眼侧白皮肤;P:垂体。不同组织表达差异分析中Y和y字母代表单独分析RARγ的2个显著差异集合,RARα单独分析使用a、b、c,代表 3个显著差异集合,同一组织2种基因表达显著差异(P < 0.05)用大括号表示,下同 B: Brain; EYE: Eye; GI: Gill; H: Heart; L: Liver; SP: Spleen; K: Kindey; ST: Stomach; I: Intestine; GO: Gonad; EM: Eye-side muscle; BM: Blind-side muscle; ES: Eye-side skin; BHS: Blind-side hypermelanosis skin; BWS: Blind-side white skin; P: Pituitary. In different tissue expression analysis, Y and y letters represent two distinct different sets of RARγ analysis separately, RARα analysis alone, a, b and c represent three significant different sets. The significant difference in the expression of two genes in the same tissue is expressed in braces (P < 0.05), the same as below |
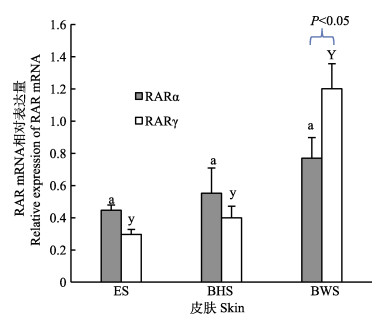
分析有眼侧皮肤、无眼侧黑化皮肤和无眼侧白皮肤中2种RAR基因mRNA的表达情况(图 7),发现无眼侧白皮肤的2种RAR mRNA的表达量最高,其次为无眼侧黑化皮肤,最低的为有眼侧皮肤,其中,RARγ表达差异显著。RARγ在无眼侧未黑化皮肤中的表达显著高于RARα (P < 0.05),而在正常有眼侧皮肤和无眼侧黑化皮肤中,RARα的表达高于RARγ,表明可能RARα和RARγ对皮肤组织中色素的调控作用具有不同的调控机制。
|
图 7 半滑舌鳎RAR mRNA在皮肤组织中的相对表达量 Fig.7 Relative expression of RAR mRNA in the skin of Cynoglossus semilaevis ES:有眼侧皮肤;BHS:无眼侧黑化皮肤;BWS:无眼侧白皮肤 ES: Eye-side skin; BHS: Blind-side hypermelanosis skin; BWS: Blind-side white skin |
本研究获得了半滑舌鳎RAR的2个亚型RARα和RARγ cDNA序列全长,并研究了其组织表达特性,为研究RA/RAR系统对体色异常调控提供了基础材料。本研究获得了半滑舌鳎2个RAR亚型的结构,预测未发现跨膜结构和信号肽(Napoli, 1996)。同其他脊椎动物一致,半滑舌鳎RAR具备A~F共6个功能域,在进化过程中高度保守,其中,C区最为保守,具有锌指结构功能的为DBD区。E区在配体结合中起辅助作用,形成疏水氨基酸残基。D区作为铰链连接DBD和LBD (Leid et al, 1992)。同源性分析表明,半滑舌鳎RARα和RARγ的氨基酸序列与牙鲆的同源性最高,达97%,与其他鱼类、两栖类、爬行类、啮齿类和人的氨基酸同源性也处于较高水平,表明其在进化过程中保守性较强。同时,本研究显示,半滑舌鳎RARα和RARγ的氨基酸同源性达60.8%,但在进化树上属于2个不同的进化分支,表明在进化过程中2种RAR受体基因出现了进化差异。
本研究发现,半滑舌鳎2种RAR基因mRNA在所有检测组织中均有表达,表明其均具有广泛的生理作用。RARα mRNA在肾脏中表达量最高,表明肾脏可能为其主要靶器官,而同时在眼、脑和胃中的表达量高于其他组织,表明RARα在这些组织器官的生理功能中都可能起重要的调控作用,这种组织表达分布特征与斑马鱼(Joore et al, 1994)、鲈鱼(钱云霞等, 2012)以及哺乳动物(Meng et al, 2011) RARα的组织表达特性相似。另外,半滑舌鳎RARγ mRNA的主要靶器官为脾脏和鳃,同时,在心脏和肾脏中均有高表达量,表明RARγ主要在这些器官中起重要的表达调控作用。2种RAR受体mRNA都在肾脏中具有高表达,推测肾脏可能是RA/RAR信号通路的重要作用靶点,具体作用方式有待于下一步深入研究。对虹鳟(Oncorhynchus mykiss)的研究结果表明,鳃是RAR的主要表达器官,推测与其较高的新陈代谢速率有关,也可能与RAR调节细胞生长与凋亡功能相关(Alsop et al, 2001)。本研究也发现,鳃中2种RAR受体基因的表达量较高,但其具体的生理功能有待于进一步研究。在对鸡(Gallus gallus)的RARγ研究中,发现鸡与哺乳动物有相似的表达特异性,即RARγ表达高度限制在皮肤中(Michaille et al, 1994),然而,半滑舌鳎RAR表达在皮肤和肌肉相对其他组织较少,这种组织分布的差异主要可能是由种的差异引起的。
本研究中,比较了有眼侧皮肤、无眼侧白皮肤和无眼侧黑化皮肤中2种RAR基因mRNA的表达情况和两者的相互关系,发现在正常有眼侧皮肤中和在无眼侧黑化皮肤中RARα的表达略高于RARγ,而在无眼侧未发生黑化的皮肤中,RARγ的表达却显著高于RARα。先前对半滑舌鳎色素细胞的研究表明,黑色素与虹彩细胞等的数量分布以有眼侧皮肤中最多,无眼侧黑化皮肤中其次,而无眼侧白皮肤中无黑色素细胞分布(史学营等, 2015)。这种不同状态的皮肤组织中RAR转录产物表达与黑色素细胞分布的关系表明,RARγ与RARα均参与了半滑舌鳎皮肤组织中黑色素细胞的生长发育与分布调控过程,但其在皮肤组织中黑色素细胞的形成方面具有差异表达调控作用。与RARγ相比,RARα与皮肤中黑色素细胞的生长及数量分布调控可能具有更为密切的关系。今后应结合鲆鲽类黑色素相关基因(如MCH、MCHR、POMC等)的表达和作用机理进行深入研究,探讨它们之间的相互作用关系。
在牙鲆研究中,RARs与配体ATRA结合作用于苗种骨骼变态和体色沉着(Haga et al, 2003)。Shao等(2017)通过转录组研究发现,牙鲆和半滑舌鳎有眼侧皮肤ATRA和9-cis-RA浓度均高于无眼侧皮肤,但两侧皮肤中RAR和RXR的基因表达没有明显差异。本研究未能测定不同类型皮肤中的RAR配体浓度,是否是配体浓度梯度的差异导致受体基因表达量的差异有待于今后深入研究。结合本研究RAR在皮肤中的分布,推测半滑舌鳎RAR可能与黑色素细胞的发育及分布具有不同的关系。已有研究证明,在斑马鱼中存在RARα-a和RARα-b亚型(Hale et al, 1993),而半滑舌鳎基因组预测其具有RARα、RARβ和RARγ三种亚型,同时,每一种亚型又有数种不同的分子形式(Chen et al, 2014),开展RAR基因在不同组织器官中的表达特征和可能的生理功能研究有助于阐明RA/RAR系统在无眼侧黑化发生的机理。本研究中,还发现半滑舌鳎RARα和RARγ mRNA在肾脏、脾脏、脑、眼、胃、无眼侧白皮肤、性腺等组织中同时具有高表达,且在不同的组织中2种受体基因表达量不同,表明半滑舌鳎2种RAR基因在不同的组织中生理功能不同。Shao等(2017)在成年牙鲆两侧皮肤中发现,感光视蛋白对光照刺激有应答反应,在光刺激下会影响配体RA在体两侧的浓度差,作用于RA/RAR系统导致无眼侧发生黑化。工厂化养殖环境中发现,幼鱼通过补充RAR的配体RA控制了鲆鲽类有眼侧无黑色素沉着现象(白化),而过量的RA补充却会导致无眼侧黑色素沉着过多(黑化)(Miwa et al, 1999)。研究发现,改变光照(Shao et al, 2017)、铺沙(Estevez et al, 2001)、栖息环境颜色(Takahashi et al, 2004)和养殖密度(Bolker et al, 2000)等也会影响无眼侧黑色素沉着,且这些外源刺激都与摄食RA或通过眼和皮肤的感光视蛋白接收刺激产生RA,从而调控RAR表达,并最终作用于鲆鲽类的体色沉着有一定关系。Isojima等(2014)研究表明,鲆鲽类体色发生与分布受到多种基因表达调控。深入开展RA/RAR系统对体色的调控作用及其信号通路的系统研究将有助于揭示半滑舌鳎无眼侧黑化的分子调控机制。
Alsop D, Brown S, Kraak GVD. Development of a retinoic acid receptor-binding assay with rainbow trout tissue: Characterization of retinoic acid binding, receptor tissue distribution, and developmental changes. General and Comparative Endocrinology, 2001, 123(3): 254-267 DOI:10.1006/gcen.2001.7659 |
Bolker JA, Hill CR. Pigmentation development in hatchery- reared flatfishes. Journal of Fish Biology, 2000, 56(5): 1029-1052 DOI:10.1111/jfb.2000.56.issue-5 |
Brand N, Petkovich M, Krust A, et al. Identification of a 2nd human retinoic acid receptor. Nature, 1988, 332(6167): 850-853 DOI:10.1038/332850a0 |
Budhu AS, Noy N. Direct channeling of retinoic acid between cellular retinoic acid-binding protein Ⅱ and retinoic acid receptor sensitizes mammary carcinoma cells to retinoic acid-induced growth arrest. Molecular & Cellular Biology, 2002, 22(8): 2632-2641 |
Chambon P. A decade of molecular biology of retinoic acid receptors. FASEB Journal, 1996, 10(9): 940-954 DOI:10.1096/fasebj.10.9.8801176 |
Chen SL, Zhang GJ, Shao CW, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle. Nature Genetics, 2014, 46(3): 253-260 DOI:10.1038/ng.2890 |
De Luca LM. Retinoids and their receptors in differentiation, embryogenesis, and neoplasia. FASEB Journal, 1991, 5(14): 2924-2933 DOI:10.1096/fasebj.5.14.1661245 |
Deng JY, Meng TX, Ren SM, et al. Composition and quantity distribution of the Bohai Sea fish species. Marine Fisheries Research, 1988(9): 11-89 [ 邓景耀, 孟田湘, 任胜民, 等. 渤海鱼类种类组成及数量分布. 海洋水产研究, 1988(9): 11-89] |
Erkelens MN, Mebius RE. Retinoic acid and immune homeostasis: A balancing act. Trends in Immunology, 2017, 38(3): 168-180 DOI:10.1016/j.it.2016.12.006 |
Estevez A, Kaneko T, Seikai T, et al. Ontogeny of ACTH and MSH cells in Japanese flounder (Paralichthys olivaceus) in relation to albinism. Aquaculture, 2001, 202(1): 131-143 |
Faehnrich B, Lukas B, Humer E, et al. Phytogenic pigments in animal nutrition: Potentials and risks. Journal of the Science of Food and Agriculture, 2016, 96(5): 1420-1430 DOI:10.1002/jsfa.2016.96.issue-5 |
Haga Y, Suzuki T, Takeuchi T, et al. A retinoic acid receptor- selective agonist causes jaw deformity in the Japanese flounder, Paralichthys olivaceus. Aquaculture, 2003, 221(1): 381-392 |
Haga Y, Suzuki T, Takeuchi T, et al. Retinoic acid isomers produce malformations in postembryonic development of the Japanese flounder, Paralichthys olivaceus. Zoological Science, 2002, 19(10): 1105-1112 DOI:10.2108/zsj.19.1105 |
Hale LA, Tallafuss A, Yan YL, et al. Characterization of the retinoic acid receptor genes RARaa, RARab and RARg during zebrafish development. Gene Expression Patterns, 2006, 6(5): 546-555 DOI:10.1016/j.modgep.2005.10.007 |
Hallenbeck PL, Marks MS, Lippoldt RE, et al. Heterodimerization of thyroid hormone (TH) receptor with H-2RIIBP (RXR beta) enhances DNA binding and TH-dependent transcriptional activation. Proceedings of the National Academy of Science of the United States of America, 1992, 89(12): 5572-5576 DOI:10.1073/pnas.89.12.5572 |
Herget T, Specht H, Esdar C, et al. Retinoic acid induces apoptosis-associated neural differentiation of a murine teratocarcinoma cell line. Journal of Neurochemistry, 1998, 70(1): 47-58 |
Ignacio F, Matas P, Juanb OD, et al. Effect of dietary vitamin A on Senegalese sole (Solea senegalensis) skeletogenesis and larval quality. Aquaculture, 2009, 295(3-4): 250-265 DOI:10.1016/j.aquaculture.2009.06.046 |
Isojima T, Tagawa M. Transplantation of pigmented and non-pigmented scales into the ocular and blind sides of the Japanese flounder Paralichthys olivaceus, suggesting the presence of ocular-side characteristic inducer in pigmented scales. Fisheries Science, 2014, 80(5): 1027-1035 DOI:10.1007/s12562-014-0784-0 |
Jones BB, Ohno CK, Allenby G, et al. New retinoid X receptor subtypes in zebra fish (Danio rerio) differentially modulate transcription and do not bind 9-cis retinoic acid. Molecular and Cellular Biology, 1995, 15(10): 5226-5234 DOI:10.1128/MCB.15.10.5226 |
Joore J, van der Lans GB, Lanser PH, et al. Effects of retinoic acid on the expression of retinoic acid receptors during zebrafish embryogenesis. Mechanisms of Development, 1994, 46(2): 137-150 |
Kliewer SA, Umesono K, Noonnan DJ, et al. Convergence of 9-cis retinoic acid and peroxisome proliferator signalling pathways through heterodimer formation of their receptors. Nature, 1992, 358(6389): 771-774 DOI:10.1038/358771a0 |
Leid M, Kastner P, Chambon P, et al. Multiplicity generates diversity in the retinoic acid signalling pathways. Trends in Biochemical Sciences, 1992, 17(10): 427-460 DOI:10.1016/0968-0004(92)90014-Z |
Leng XJ. Research advance in vitamin nutrition of aquatic animals. Feed Industry, 2017, 38(16): 1-6 [ 冷向军. 水产动物维生素营养研究进展. 饲料工业, 2017, 38(16): 1-6] |
Lewis-McCrea LM, Lall SP. Effects of phosphorus and vitamin C deficiency, vitamin A toxicity, and lipid peroxidation on skeletal abnormalities in Atlantic halibut (Hippoglossus hippoglossus). Journal of Applied Ichthyology, 2010, 26(2): 334-343 DOI:10.1111/jai.2010.26.issue-2 |
Liu XZ, Zhuang ZM, Ma AJ, et al. Operative technologies for seedling rearing of Cynoglossus semilaevis Günther. Marine Fisheries Research, 2006, 27(2): 17-24 [ 柳学周, 庄志猛, 马爱军, 等. 半滑舌鳎苗种生产技术的开发研究. 海洋水产研究, 2006, 27(2): 17-24] |
Liu XZ, Zhuang ZM. Reproduction biology and culture technology of half-smooth tongue sole Cynoglossus semilaevis. Beijing: China Agriculture Press, 2014: 1-10 [ 柳学周, 庄志猛. 半滑舌鳎繁育理论与养殖技术. 北京: 中国农业出版社, 2014: 1-10]
|
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method. Methods, 2001, 25(4): 402-408 DOI:10.1006/meth.2001.1262 |
Martinez GM, Baron MP, Bolker JA. Skeletal and pigmentation defects following retinoic acid exposure in larval summer flounder, Paralichthys dentatus. Journal of the World Aquaculture Society, 2007, 38(3): 353-366 DOI:10.1111/jwas.2007.38.issue-3 |
Meng QY, Chen XN, Zhao J, et al. Distribution of retinoic acid receptor-α immunoreactivity in the human hypothalamus. Neuroscience, 2011, 174: 132-142 DOI:10.1016/j.neuroscience.2010.11.058 |
Michaille JJ, Blanchet S, Kanzler B, et al. Characterization of cDNAs encoding the chick retinoic acid receptor gamma 2 and preferential distribution of retinoic acid receptor gamma transcripts during chick skin development. Developmental Dynamics, 1994, 201(4): 334-343 DOI:10.1002/aja.1002010405 |
Miwa S, Yamano K. Retinoic acid stimulates development of adult-type chormatophores in the flounder. Journal of Experimental Zoology Part A, 1999, 284(3): 317-324 DOI:10.1002/(ISSN)1097-010X |
Napoli JL. Biochemical pathways of retinoid transport, metabolism, and signal transduction. Clinical Immunology and Immunopathology, 1996, 80(3): 52-62 DOI:10.1006/clin.1996.0142 |
Qian YX, Han L, Tong CH, et al. Retinoic acid receptor α and retinoic acid receptor γ in Lateolabrax japonicas: cDNA clonging and gene expression analysis. Acta Nutrimenta Sinica, 2012, 24(4): 712-721 [ 钱云霞, 韩柳, 童彩环, 等. 鲈鱼视黄酸受体α和视黄酸受体γ cDNA克隆和基因表达分析. 动物营养学报, 2012, 24(4): 712-721] |
Shao CW, Chen SL, Bao BL, et al. The genome and transcriptome of Japanese flounder provide insights into flatfish asymmetry. Nature Genetics, 2017, 49(1): 119-124 DOI:10.1038/ng.3732 |
Shi XY, Liu XZ, Shi Y, et al. Molecular characterization of MCHR and its corelation with blind-side hypermelanosis in Cynoglossus semilaevis. Progress in Fishery Sciences, 2017, 38(1): 91-102 [ 史学营, 柳学周, 石莹, 等. 半滑舌鳎(Cynoglossus semilaevis)黑色素聚集素受体(MCHR)表达特性及其与无眼侧黑化的关系. 渔业科学进展, 2017, 38(1): 91-102] |
Shi XY, Liu XZ, Xu YJ, et al. Preliminary studies on blind-side hypermelanosis of Cynoglossus semilaevis: Chromatophores observation and expression of proopiomelanocortin. Progress in Fishery Sciences, 2015, 36(2): 45-54 [ 史学营, 柳学周, 徐永江, 等. 半滑舌鳎(Cynoglossus semilaevis)体表色素细胞观察及POMC表达特性分析. 渔业科学进展, 2015, 36(2): 45-54] |
Takahashi A, Tsuchiya K, Yamanome T, et al. Possible involvement of melanin concentrating hormone in food intake in a teleost fish, barfin flounder. Peptides, 2004, 25(10): 1613-1622 DOI:10.1016/j.peptides.2004.02.022 |
Xu YJ, Zhu XW, Liu XZ, et al. Cloning and expression of melanin-concentrating hormone in half-smooth tongue sole (Cynoglossus semilaevis). Progress in Fishery Sciences, 2017, 38(1): 81-90 [ 徐永江, 朱学武, 柳学周, 等. 半滑舌鳎(Cynoglossus semilaevis)黑色素富集激素基因的克隆和表达. 渔业科学进展, 2017, 38(1): 81-90] |
Zhang JL, Zuo ZH, Zhu WW, et al. Sex-different effects of tributyltin on brain aromatase, estrogen receptor and retinoid X receptor gene expression in rockfish (Sebastiscus marmoratus). Marine Environmental Research, 2013, 90(3): 113-118 |
Zhou WD, Wang LL, Zhou LB, et al. All-trans retinoic acid upregulates the expression of ciliary neurotrophic factor in retinal pigment epithelial cells. Cell Biochemistry and Function, 2017, 35(4): 202-208 DOI:10.1002/cbf.v35.4 |
Zhu XW, Xu YJ, Liu XY, et al. In vitro expression and bioactivity analysis of melanin concentration hormone from Cynoglossus semilaevis. Journal of Fisheries of China, 2016, 40(10): 1595-1605 [ 朱学武, 徐永江, 柳学周, 等. 半滑舌鳎黑色素聚集激素重组制备与生物活性分析. 水产学报, 2016, 40(10): 1595-1605] |



