2. 青岛大学公共卫生学院 青岛 266021;
3. 青岛市食品药品检验研究院 青岛 266071
2. School of Public Health, Qingdao University, Qingdao 266021;
3. Qingdao Institute for Food and Drug Control, Qingdao 266071
南极磷虾(Euphausia superba)是一种生活在南极海域的小型海洋浮游甲壳类动物,现已成为世界远洋捕捞业最重要的渔业资源(刘勤等, 2014、2015)。南极磷虾油以南极磷虾为原料经提取精制而得,因其富含ω-3 (EPA、DHA)系列多不饱和脂肪酸、磷脂以及虾青素等功能脂类(Lu et al, 2014;刘建君等, 2014;聂玉晨等, 2016),具有调节血脂、抗氧化、改善脑细胞功能等多种生理活性(He et al, 2013; Wang et al, 2011; Zhou et al, 2016)而受到广泛关注。2013年我国卫生计生委第16号公告已批准南极磷虾油为新食品原料,但由于南极磷虾油中具有较高的总砷含量,使人们对其食用安全性产生一定疑虑,同时也限制了其在食品、功能食品和医药制品领域的应用推广。
受原料及加工工艺影响,南极磷虾油中总砷含量约为2.5~8.0 mg/kg,研究表明,其中主要砷形态是无毒的砷甜菜碱,含量为87.9%,而毒性较高的AsⅢ及AsⅤ仅约占南极磷虾油中总砷含量的0.27% (王松等, 2016)。本研究以南极磷虾油中砷的主要形态—砷甜菜碱为重点研究对象,观察灌胃添加高剂量砷甜菜碱的磷虾油之后,大鼠脏器中总砷的吸收、蓄积、排泄及长期灌胃后的蓄积情况,为科学解释南极磷虾油中砷的毒性提供数据支持,同时也为南极磷虾油在食品、功能食品和医药制品领域的应用提供理论支持。
1 材料与方法 1.1 材料砷甜菜碱:含量≥95%,购于日本Wako公司,货号:321-34911
南极磷虾油:红棕色透明油状,贮存于干燥、密封处,总砷含量为3.92 mg/kg
大豆油:金龙鱼大豆油,嘉里粮油(天津)有限公司,总砷含量为0.037 mg/kg
1.2 实验动物SPF级雄性Wistar大鼠,体重180~220 g,购于青岛市实验动物和动物实验中心,实验动物生产许可证号为SCXK(鲁)20140001。饲养环境:温度20~25℃,湿度40%~70%,基础饲料喂养,自由饮食、饮水。
1.3 主要试剂与仪器砷标准品:1000 μg/ml,GBW08611-15031(国家标准物质中心) 7500CX型电感耦合等离子体质谱仪(ICP-MS,美国Agilent公司),MARS EXPRESS微波消解仪(美国CEM公司),BSA 224S-CW型分析天平(德国SartoriUS公司),Milli-Q超纯水系统(美国Millipore公司)。
1.4 方法 1.4.1 24 h吸收代谢实验SPF级雄性Wistar大鼠54只,随机分为3组:大豆油对照组(对照组)、磷虾油组、添加100 mg/kg砷甜菜碱的磷虾油组(砷甜菜碱磷虾油组),每组18只。实验前禁食不禁水12 h,灌胃剂量2.625 g油/kg·bw,于灌胃后1、2、4、6、12、24 h经戊巴比妥钠麻醉,腹主动脉取血处死大鼠,收集血浆,剥离肝脏、肾脏、脾脏,收集12 h及24 h尿液。血浆、脏器和尿液均贮存于–80℃备用。
1.4.2 7 d、30 d连续灌胃实验SPF级雄性Wistar大鼠45只,随机将动物分为3组:对照组、磷虾油组、砷甜菜碱磷虾油组,每组5只。连续灌胃7 d,实验前禁食不禁水12 h,灌胃剂量2.625 g油/kg·bw,于末次灌胃后24 h,经戊巴比妥钠麻醉,剥离肝脏、肾脏。相同的分组,每组10只,连续灌胃同等剂量的油脂30 d,末次灌胃后24 h,经戊巴比妥钠麻醉,腹主动脉取血处死大鼠,剥离肝脏、肾脏,贮存于–80℃备用。
1.5 总砷的测定血浆、脏器及尿液中总砷含量检测分析按GB5009.11-2014标准规定执行。
1.6 数据处理计量数据以x±s表示,采用SPSS 17.0统计软件对数据进行统计分析,采用One-way ANOVA (Tukey t’ test)进行分析比较,以P < 0.05为具有统计学意义上的显著差异。
2 结果南极磷虾油具有相对较高的总砷含量,但其所含的砷化合物绝大部分为砷甜菜碱,约占总砷含量的87.9% (王松等, 2016)。所以本研究采用总砷含量表征砷甜菜碱的代谢。
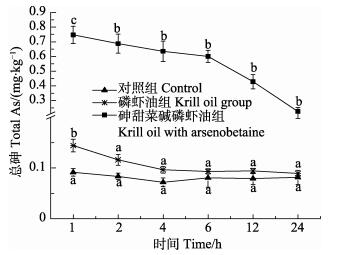
2.1 南极磷虾油中砷甜菜碱24 h消化吸收代谢 2.1.1 不同时间点大鼠血浆中总砷含量变化不同实验组大鼠血浆中总砷含量变化情况如图 1所示。灌胃后,磷虾油组和砷甜菜碱磷虾油组血浆中总砷在1 h时含量最高,随时间延长而降低。各时间节点下,砷甜菜碱磷虾油组总砷含量高于对照组,但随着代谢的进行,大鼠血浆中总砷含量逐渐降低,24 h降至最高值的30%以下。磷虾油组较对照组血浆总砷含量略有升高,但在24 h之内即降低至正常水平。
|
图 1 不同时间节点大鼠血浆中总砷含量 Fig.1 Total arsenic content in rat plasma at different time points 不同字母标识代表各时间节点下不同实验组间具有显著性差异(P < 0.05),下同 Different letters represent significant differences between different experimental groups at each time point (P < 0.05). The same as below |
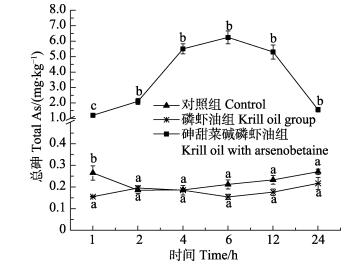
不同实验组大鼠肝脏中总砷含量变化情况见图 2。灌胃后,砷甜菜碱磷虾油组大鼠肝脏中总砷含量随时间延长而增加,于6 h达到最高,最高含量为6.24 mg/kg,而后逐渐降低,24 h含量降至最高值25%以下,趋近于初始水平。与对照组相比,磷虾油组大鼠肝脏总砷含量除1 h时间节点外,均无显著差异,且无随时间变化的趋势。
|
图 2 不同时间节点大鼠肝脏总砷含量 Fig.2 Total arsenic content in liver of rat at different time |
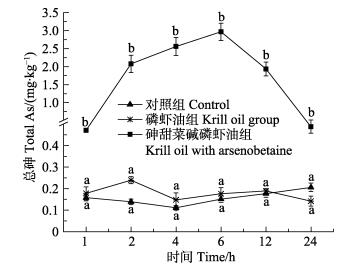
不同实验组大鼠肾脏中总砷含量变化情况见图 3。灌胃后,砷甜菜碱磷虾油组大鼠肾脏中总砷含量随时间延长而增加,于6 h达到最高,最高含量为2.97 mg/kg,而后逐渐降低,24 h含量降至最高值16%以下,恢复至初始水平。磷虾油组相比于对照组,总砷含量没有显著性差异,且无随时间变化的趋势。
|
图 3 不同时间的大鼠肾脏中总砷含量 Fig.3 Total arsenic content in kidney of rat at different time |
不同实验组大鼠灌胃12 h和24 h后尿液中总砷含量如表 1所示。砷甜菜碱磷虾油组和磷虾油组大鼠12 h和24 h尿液中总砷含量明显高于对照组(P < 0.05)。根据灌胃剂量2.625 g磷虾油/kg·bw折算成砷甜菜碱含量,砷甜菜碱磷虾油组每只大鼠平均分别给予0.0525 mg砷甜菜碱,磷虾油组每只大鼠平均分别给予0.00525 mg砷甜菜碱。根据12 h和24 h尿液量及总砷含量,计算得出砷甜菜碱的尿液排泄率。在24 h之内,磷虾油组中的砷85%随尿液排出体外; 砷甜菜碱磷虾油组12 h尿液排泄率为36%,24 h尿液排泄率为80%。
|
|
表 1 大鼠尿液总砷含量(x±s, n=5) Tab.1 Total arsenic contents in the urine of the experimental rats (x±s, n=5) |
不同实验组大鼠脾中总砷含量变化情况如图 4所示。灌胃后,砷甜菜碱磷虾油组脾中总砷含量随时间延长而增高,于6 h达到最高,最高含量为1.23 mg/kg,而后逐渐降低,24 h含量降至最高值30%,趋近于初始水平。与对照组相比,磷虾油组大鼠脾脏总砷含量除2 h和24 h时间点外均无显著差异,且无随时间变化的趋势。

|
图 4 不同时间节点的大鼠脾脏中的总砷含量 Fig.4 Total arsenic content in spleen of rat at different time |
连续灌胃7 d和30 d后,不同实验组大鼠肝脏和肾脏中总砷含量见表 2。与对照组相比,连续灌胃7 d和30 d,磷虾油组和砷甜菜碱磷虾油组大鼠肝脏和肾脏中总砷含量均无显著变化(P > 0.05),且二者间也无显著差异(P > 0.05)。由此可见,随着给予砷甜菜碱时间的延长,大鼠肝脏和肾脏中总砷含量并没有随之增加。以上实验结果证明,磷虾油中的砷甜菜碱在体内并不会产生蓄积作用。
|
|
表 2 7 d、30 d喂养大鼠脏器中总砷含量(x±s) Tab.2 Total arsenic contents in the organs of the experimental rats fed for 7 or 30 days (x±s) |
砷为有毒有害元素,砷毒性很大程度上取决于它的化学形态和氧化态(Nearing et al, 2014),无机砷的毒性远大于有机砷(Khairul et al, 2017; Sadee et al, 2015),有机砷中砷甜菜碱和砷胆碱被认为是没有毒性的。海产品中虽然砷含量较高,但多数是以有机砷的形态存在(Taylor et al, 2016),且绝大部分为砷甜菜碱(Molin et al, 2015)。GB2762-2012《食品安全国家标准食品中污染物限量》规定水产动物及其制品无机砷限量为0.5 mg/kg,南极磷虾油符合这一标准要求。GB16740-2014《食品安全国家标准保健食品》规定液态产品总砷限量为0.3 mg/kg。南极磷虾油相对较高的总砷含量使其在保健品领域的应用受到了限制,因此,本研究针对摄食磷虾油及其砷甜菜碱后大鼠血浆及脏器中总砷的代谢和蓄积情况进行了考察。
本研究为考察南极磷虾油中砷的安全性,实验设计时将中国营养学会膳食指南中规定的成人每日摄入25 g油脂均更换为南极磷虾油,考察最大限度摄入南极磷虾油时,其所含的砷是否会带来安全风险。根据成人和大鼠之间的剂量换算系数,计算得到大鼠灌胃剂量为2.625 g/kg·bw。肝脏是动物和人体最重要的代谢器官,并且砷代谢主要在肝脏中进行(刘洋等, 2009),而肾脏则是砷排泄的主要器官(李伟等, 2016),脾是机体最重要的免疫和造血器官,研究证实砷暴露人群免疫功能受损(周勇等, 2010)。因此,本研究着重观察了肝脏、肾脏和脾中砷甜菜碱的代谢情况。24 h消化吸收代谢实验结果显示,灌胃南极磷虾油后,大鼠血浆中总砷含量在1 h达到最高,而后逐渐降低,24 h之内可降低至对照组水平。各时间节点下,磷虾油组大鼠血浆、肝脏、肾脏中总砷含量较对照组均无显著变化,脾中总砷含量较对照组略有升高,这与杨瑞瑛等(2005)的研究结果一致。砷甜菜碱磷虾油组大鼠肝脏、肾脏和脾中总砷含量均随时间的延长而增加,到6 h达到最高,之后逐渐降低,24 h后均下降至最高值的30%以下,提示大剂量的砷甜菜碱不会在肝、肾、脾等脏器中被蓄积。尿液中总砷分析结果显示,南极磷虾油中85%的砷会在24 h之内随尿液排出体外,而其余小部分砷会随胆汁等其他途径排出体外(Dopp et al, 2010)。Kaise等(1992)报道指出,砷甜菜碱具有低毒、不代谢的特点。检测人摄食砷甜菜碱后的尿液发现,尿液中无机砷、一甲基砷酸和二甲基砷酸的浓度没有出现升高现象,同样证实了砷甜菜碱不会在人体内转化为其他代谢产物(陈甫华等, 1993)。
7 d和30 d连续灌胃实验结果显示,与对照组相比,磷虾油组和砷甜菜碱磷虾油组大鼠肝脏和肾脏中总砷含量均无明显差异,证明磷虾油乃至超出正常磷虾油中砷甜菜碱10倍的供试物并不会随着摄入时间的增加而在脏器中产生积累。这与陈甫华等(1993)的研究结果一致。砷甜菜碱在人体没有产生明显毒副作用的靶器官,不在体内产生蓄积作用。另外,分别连续灌胃7 d和30 d,各实验组大鼠肝脏和肾脏中总砷含量并未随摄食时间的延长而出现显著变化,表明短期和长期服用南极磷虾油,其所含有的砷甜菜碱不会出现代谢蓄积现象。
综上所述,摄食南极磷虾油后,85%的砷会于24 h内随尿液排出体外,而短期及长期摄食南极磷虾油,体内也不会产生砷蓄积现象。本研究系统解释了南极磷虾油中所含的砷在大鼠体内的消化吸收代谢和蓄积情况,对于指导南极磷虾油及其相关产品的科学消费和拓展应用具有重要意义。
Chen FH, Zhang XR. Arsenobetaine in marine animals. Marine Environmental Science, 1993, 12(2): 58-67 [ 陈甫华, 张相如. 海洋动物中的砷甜菜碱. 海洋环境科学, 1993, 12(2): 58-67] |
Dopp E, Kligerman AD, Diazbone RA. Organoarsenicals. Uptake, metabolism, and toxicity. Metal Ions in Life Sciences, 2010, 7: 231 |
He RK, Luo HJ, et al. Health benefits of Antarctic krill oil. Food Research and Development, 2013, 34(20): 130-133 |
Kaise T, Horiguchi Y, Fukui S, et al. Acute toxicity and metabolism of arsenocholine in mice. Applied Organometallic Chemistry, 1992, 6(4): 369-373 |
Khairul I, Wang QQ, Jiang YH, et al. Metabolism, toxicity and anticancer activities of arsenic compounds. Oncotarget, 2017, 8(14): 23905-23926 |
Liu JJ, Feng DN, Su XF, et al. Optimization of formula for Antartic krill oil soft capsules shell. Progress in Fishery Sciences, 2014, 35(4): 141-144 [ 刘建君, 冯迪娜, 苏学锋, 等. 南极磷虾油软胶囊囊皮配方的设计与优化. 渔业科学进展, 2014, 35(4): 141-144] |
Liu Q, Huang HL, Li LN, et al. Strategic thinking behind the commercial development of Antarctic krill. Chinese Journal of Polar Research, 2015(1): 31-37 [ 刘勤, 黄洪亮, 李励年, 等. 南极磷虾商业化开发的战略性思考. 极地研究, 2015(1): 31-37] |
Liu Q, Liu ZD, Lu YN, et al. On Antarctic krill products and development trends. Morden Fisheries Information, 2014, 29(2): 115-21 [ 刘勤, 刘志东, 陆亚男, 等. 南极磷虾产品研究及发展趋势. 渔业信息与战略, 2014, 29(2): 115-121 DOI:10.3969/j.issn.1004-8340.2014.02.007] |
Liu Y, Wu J. Advances in research on the metabolism of arsenic in the liver and its effects on hepatic biochemical parameters. World Chinese Journal of Digestology, 2009, 17(34): 3524-3529 [ 刘洋, 吴君. 砷在肝脏中的代谢及对其生化指标影响的研究进展. 世界华人消化杂志, 2009, 17(34): 3524-3529 DOI:10.3969/j.issn.1009-3079.2009.34.010] |
Li W, Li B. Health effects of long-time arsenic exposure: A review of recent studies. Journal of Environment and Health, 2016, 33(9): 836-841 [ 李伟, 李冰. 环境砷暴露对机体损伤的研究进展. 环境与健康杂志, 2016, 33(9): 836-841] |
Lu HFS, Bruheim I, Jacobsen C, et al. Oxidative stability and non-enzymatic browning reactions in Antarctic krill oil (Euphausia superba). Lipid Technology, 2014, 26(5): 111-114 DOI:10.1002/lite.201400027 |
Molin M, Ulven SM, Meltzer HM, et al. Arsenic in the human food chain, biotransformation and toxicology-Review focusing on seafood arsenic. Journal of Trace Elements in Medicine and Biology Organ of the Society for Minerals & Trace Elements, 2015, 31: 249 |
Nearing MM, Koch I, Reimer KJ. Complementary arsenic speciation methods: A review. Spectrochimica Acta Part B Atomic Spectroscopy, 2014, 99(9): 150-162 |
Nie YC, Zhang B, Zhao XY, et al. Seasonal variation in lipids and protein content of Antarctic krill (Euphausia superba). Progress in Fishery Sciences, 2016, 37(3): 1-8 [ 聂玉晨, 张波, 赵宪勇, 等. 南极磷虾(Euphausia superba)脂肪与蛋白含量的季节变化. 渔业科学进展, 2016, 37(3): 1-8] |
Sadee B, Foulkes ME, Hill SJ. Coupled techniques for arsenic speciation in food and drinking water: A review. Journal of Analytical Atomic Spectrometry, 2015, 30(1): 102-118 DOI:10.1039/C4JA00269E |
Taylor V, Goodale B, Raab A, et al. Human exposure to organic arsenic species from seafood. Science of the Total Environment, 2016, 580: 266-282 |
Wang S, Li K, Cui H, et al. Quantitative analysis of total and different species of arsenic in oil of Antarctic krill (Euphausia superba). Chinese Journal of Analytical Chemistry, 2016, 44(5): 767-772 [ 王松, Li K, 崔鹤, 等. 南极磷虾油中总砷含量及砷形态分析. 分析化学, 2016, 44(5): 767-772] |
Wang YE, Jiang GL, Xu K, et al. Effects of the Antarctic krill oil on the serum lipids and antioxidation ability in hyperlipidemia rats. Chinese Journal of Marine Drugs, 2011, 30(3): 56-59 |
Yang RY, Li ZJ, Lin Q, et al. Distribution of arsenic in arsenic-poisoning rat organs. Chinese Journal of Control of Endemic Diseases, 2005, 20(5): 260-262 [ 杨瑞瑛, 李子杰, 林勤, 等. 砷中毒大鼠体内各脏器、组织中砷的分布. 中国地方病防治杂志, 2005, 20(5): 260-262] |
Zhou DY. Effects of long-term intake of Antarctic krill oils on artery blood pressure in spontaneously hypertensive rats. Journal of the Science of Food & Agriculture, 2016, 97(4) |
Zhou Y, He LP, Huang X, et al. Immunological function among people exposed to lead, cadmium, and arsenic pollution. Chinese Journal of Public Health, 2010, 26(2): 243-244 [ 周勇, 贺莉萍, 黄晓, 等. 铅、镉、砷污染地区人群免疫功能检测分析. 中国公共卫生, 2010, 26(2): 243-244] |



