2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家试验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
海水酸化是由全球气候变化导致的一种海洋环境变化,已成为一个世界性的环境问题和当今的研究热点(Riebesell et al, 2007)。关于海水酸化对浮游植物的生长、光合作用、叶绿素荧光动力学参数的影响已有报道(高坤山, 2011; 毛雪微等, 2016; 徐金涛等, 2016; Hong et al, 2017),但由于海洋藻类对大气CO2浓度升高的响应存在明显的种间异质性,不同种类浮游植物,甚至同一种类在不同培养条件下对酸化的响应均不同。同时,浮游植物作为滤食性贝类的主要饵料,其营养价值取决于被摄食的难易程度(粒径的大小)和生化组成等(陈自强等, 2013),而生物体发育过程中大分子的组成及其化学计量的变化都会反映到元素比率上(Laspoumaderes et al, 2010; 陈蕾等, 2014),浮游植物的元素组成会影响其营养物质(如蛋白质、脂肪酸等)的含量(Sterner et al, 2002),进而影响其作为食物的营养价值。关于海水酸化对不同种类浮游植物生物组成的研究较少(Rossoll et al, 2012; Schoo et al, 2013),因此,开展CO2浓度升高对不同类别饵料藻细胞数量(生长、光合)和质量(营养元素含量比值)影响的比较研究是非常必要的。本研究采用室内可控实验方法,以不同粒径、不同种类的4种饵料藻:叉鞭金藻(Dicrateria sp.)、三角褐指藻(Phaeodactylum tricornutum)、小球藻(Chlorella vulgaris)和亚心形扁藻(Platymonas subcordiformis)为研究对象,测定了CO2浓度升高对其生长、单位细胞叶绿素a含量、叶绿素荧光动力学参数及营养质量的影响,以期为进一步从食物链角度研究海水酸化对滤食性贝类及海洋生态系统的影响提供理论基础。
1 材料与方法 1.1 藻种培养实验所用藻种叉鞭金藻、三角褐指藻、小球藻和亚心形扁藻,均由中国水产科学研究院黄海水产研究所海水养殖生态与技术研究室提供。
实验设定低CO2浓度组(403×10-6)和高CO2浓度组(1600×10-6),相当于当前和2300年大气平均CO2浓度预测水平(Caldeira et al, 2003; Stocker et al, 2013; Dlugokencky et al, 2017)。CO2浓度采用植物培养箱(HP1000G-D, 武汉瑞华仪器设备有限责任公司)来控制(毛雪微等, 2016)。实验所用容器为3 L锥形瓶,加入2 L f/2培养液,接入指数生长期的微藻,初始浓度为5~10×104 cells/ml。每个实验组分别设置3个平行,初始pH为8.2和7.6。光暗比(L/D)为12 h: 12 h,温度为(20.0±0.5)℃,光照为80 μmol/(m2·s),每天定时摇动4~6次。实验持续13 d,每隔1 d测定藻细胞浓度和藻体的叶绿素荧光参数,培养7 d后测定藻体的C、N和P含量。叶绿素a含量按照海洋监测规范GB 17378.7-2007进行。
1.2 藻细胞浓度计数及比生长速率计算取样10 ml,用Beckman Coulter Multisizer Ⅲ颗粒计数器测定藻细胞浓度。根据以下公式计算比生长速率(μ):
| $ \mu = \ln ({N_2}/{N_1})/({t_2} - {t_1}) $ |
式中,N1为第t1天藻细胞密度(cell/ml);N2为第t2天藻细胞密度。
1.3 叶绿素荧光参数测定利用Imaging-PAM调制叶绿素荧光成像系统对藻进行叶绿素荧光动力学参数的测定。测量前将浮游植物样品暗适应20 min,每个平行重复2次。采用Platt等(1980)提出的双指数衰减函数对快速光曲线(RLC)进行拟合:
| $ P = {P_m} \times [1 - \exp (- \alpha \times {\rm{PAR}}/{P_m})] \times \exp (- \beta \times {\rm{PAR}}/{P_m}) $ |
其中,P为相对电子传递速率,Pm为无光抑制时的最大潜在相对电子传递速率rETRmax,PAR为光照强度,α为快速光曲线的初始斜率,β为光抑制参数。
1.4 C、N和P含量测定取一定体积的藻液,离心收集(3000 r/min 10 min),烘干至恒重。将样品研磨成粉状混合均匀,取2 mg用元素分析仪(Elemental Analyzer Vario EL cube, 德国Elementar)测定藻体C、N含量;按照周毅等(2003)方法测定藻体P含量。
1.5 数据分析采用SPSS 21.0进行单因素方差分析(One-way ANOVA),检验组间组内差异,P < 0.05视为差异显著,P < 0.01视为差异极显著。
2 结果 2.1 4种浮游植物细胞生长及比生长速率不同CO2浓度下亚心形扁藻、小球藻、叉鞭金藻和三角褐指藻的生长曲线以及比生长速率如图 1所示。总体来讲,CO2浓度升高可显著提高4种藻的生长及比生长速率(P < 0.05),但不同种类的变化幅度不同。从比生长速率来看,亚心形扁藻的反应最为迅速,与对照组相比,差异达到极显著(P < 0.01),其最大比生长速率为0.590/d,整个实验期间平均比生长速率(0.233/d)比对照组(0.205/d)高出13.5%;同时,高CO2浓度组的藻体细胞浓度显著高于低CO2浓度组(图 1a)(P < 0.05)。其次是小球藻,在培养的第3天,藻细胞浓度显著高于对照组(P < 0.05),平均比生长速率相比低CO2浓度组提高了5.9%(图 1b)。叉鞭金藻和三角褐指藻在培养的第9天,高CO2浓度组的藻细胞浓度显著高于低CO2浓度组(P < 0.05,图 1c、图 1d)。从藻体细胞浓度来看,亚心形扁藻和三角褐指藻分别在第11天和第9天达到峰值,之后增长减缓;小球藻和叉鞭金藻在实验结束的第13天尚处于指数增长期。

|
图 1 不同CO2浓度下4种藻的生长曲线和比生长速率
Fig.1 Growth curves and the specific growth rate of four microalgae cultured in different CO2 concentrations
a:亚心形扁藻; b:小球藻; c:叉鞭金藻; d:三角褐指藻 *:差异显著P < 0.05; **:差异极显著P < 0.01。下同 a: Platymonas subcordiformis; b: Chlorella vulgaris; c: Dicrateria sp.; d: Phaeodactylum tricornutum *: Significant difference, P < 0.05; **: Highly Significant difference, P < 0.01. The same as below |
不同CO2浓度下4种藻体的C、N、P含量及其比值见表 1。总体趋势是,CO2浓度升高提高了4种藻藻体的C含量,其中小球藻达到了显著水平(P < 0.05);高CO2浓度下,4种藻藻细胞N含量均出现降低趋势,其中,仅亚心形扁藻的N含量显著降低(P < 0.05),其他3种藻N含量变化不显著(P > 0.05);不同藻藻体的P含量变化趋势不同,亚心形扁藻和小球藻高CO2浓度组显著低于低CO2浓度组(P < 0.05),但叉鞭金藻和三角褐指藻P含量变化不显著(P > 0.05)。
|
|
表 1 4种藻在不同CO2浓度下培养7 d后藻体C、N、P含量及其比值 Tab.1 C, N and P contents and mole ratios in microalgae cultured with different CO2 concentrations in 7 days |
CO2浓度升高使藻体的C/N升高,其中,亚心形扁藻和三角褐指藻C/N值显著提高(P < 0.05),分别从8.16增加至9.89,从10.29增加至13.83;C/P的种间差异较大,亚心形扁藻和小球藻高CO2浓度组显著高于低CO2浓度组(P < 0.05),叉鞭金藻和三角褐指藻与低CO2浓度组无显著差异(P > 0.05)。
2.3 CO2浓度升高对4种藻类光合作用参数的影响 2.3.1 单位细胞叶绿素a含量的变化4种藻的单位细胞叶绿素a含量随时间变化情况见图 2。在整个培养期间(13 d),除小球藻外,其他3种藻高CO2浓度组的单位细胞叶绿素a含量均呈现降低趋势。亚心形扁藻和叉鞭金藻分别在培养的第3天和第7天显著低于低CO2浓度组,其中,亚心形扁藻在实验后期又逐渐升高,与低CO2浓度组相比差异达到显著程度(P < 0.05);小球藻单位细胞叶绿素a含量在第3天显著提高;而CO2浓度升高对三角褐指藻无显著影响(P > 0.05)。
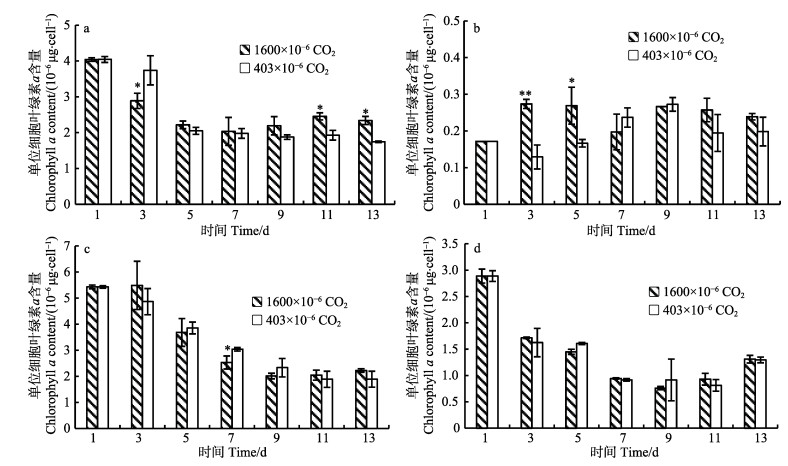
|
图 2 不同CO2浓度下4种藻单位细胞叶绿素a含量 Fig.2 The chlorophyll a contents of four microalgae cultured in different CO2 concentrations a:亚心形扁藻; b:小球藻; c:叉鞭金藻; d:三角褐指藻 a: Platymonas subcordiformis; b: Chlorella vulgaris; c: Dicrateria sp.; d: Phaeodactylum tricornutum |
4种藻叶绿素荧光参数随时间变化情况见图 3。亚心形扁藻Fv/Fm的变化范围为0.581~0.703(图 3a),前11 d高CO2浓度组与低CO2浓度组无显著差异,之后显著下降(P < 0.05);非光化学淬灭系数(NPQ)在第11天,高CO2浓度组显著低于低CO2浓度组(P < 0.05);光化学淬灭(qP)无显著变化(P > 0.05)。CO2浓度升高对小球藻NPQ和qP均无显著影响(图 3b);Fv/Fm在第7天显著高于对照组(P < 0.05),其变化范围在0.552~0.656之间。对于叉鞭金藻,高CO2浓度条件下的Fv/Fm和qP与低CO2浓度组无显著差异;NPQ显著低于低CO2浓度组(P < 0.05)(图 3c)。三角褐指藻Fv/Fm变化趋势与叉鞭金藻一致,数值变化范围在0.482~0.662之间,高CO2浓度组在第3、5、13天显著高于低CO2浓度组(P < 0.05);高CO2浓度组NPQ在第11天显著升高(P < 0.05);qP先缓慢降低后趋于平稳,在第7天和第13天高CO2浓度组qP显著高于低CO2浓度组(P < 0.05) (图 3d)。

|
图 3 不同CO2浓度下4种微藻不同荧光参数的变化
Fig.3 Changes of different fluorescence parameters of four microalgae cultured in different CO2 concentrations
Fv/Fm:最大光量子产量;NPQ:非光化学猝灭;qP:光化学猝灭 a:亚心形扁藻; b:小球藻; c:叉鞭金藻; d:三角褐指藻 a: Platymonas subcordiformis; b: Chlorella vulgaris; c: Dicrateria sp.; d: Phaeodactylum tricornutum |
4种藻的潜在最大相对电子传递效率(rETRmax)、快速光曲线初始斜率(α)见图 4。高CO2浓度条件下,亚心形扁藻和三角褐指藻的rETRmax显著提高(P < 0.05),小球藻、叉鞭金藻无显著差异(P > 0.05);CO2浓度升高对亚心形扁藻、小球藻、三角褐指藻的快速光曲线初始斜率(α)无显著影响(P > 0.05),叉鞭金藻的α显著高于低CO2浓度组(P < 0.05)。
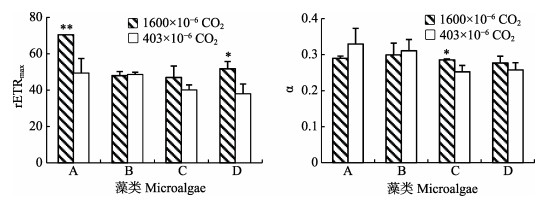
|
图 4 4种藻快速光曲线拟合参数rETRmax和α随培养时间的变化 Fig.4 Variations of rETRmax and α of the four microalgae with culturing time A:亚心形扁藻;B:小球藻;C:叉鞭金藻;D:三角褐指藻 A: Platymonas subcordiformis; B: Chlorella vulgaris; C: Dicrateria sp.; D: Phaeodactylum tricornutum |
不同种类浮游植物对CO2浓度升高的响应存在较大差异。本研究中,CO2浓度升高显著促进了叉鞭金藻、三角褐指藻、亚心形扁藻和小球藻种群的生长。毛雪微等(2016)的研究显示,酸化会促进浮游植物的生长,CO2浓度升高(1000 μatm CO2)使三角褐指藻实验组的平均比生长速率比对照组高出33.1%,高于本研究的结果。导致这种差异的原因可能是酸化程度和光照等实验条件不同。已有的研究结果显示,三角褐指藻的最适光照强度为144 μmol/(m2·s),在一定范围内,藻体的生长速率随光照强度的增加而增加(臧正蓉等, 2015),而毛雪微等(2016)的报道中光照强度为(139±20) μmol/(m2·s),本研究光照强度为80 μmol/m2·s。可见不同浮游植物对CO2浓度升高的响应程度不同。哪种浮游植物会在高CO2浓度下成为竞争优势种,还与自然海域的其他环境条件有关。因此,仅凭室内的单种培养结果,不足以预测自然海域浮游植物种群及群落结构对CO2浓度升高的响应。
叶绿素荧光技术是一种研究和探测植物光合生理状况及各种外界因子对其细微影响的新型植物活体测定技术,是快速、无损伤地研究植物光合作用的理想方法。叶绿素荧光参数与光合作用中光系统对光能的吸收、传递、耗散和分配等反应紧密相连(姜恒等, 2012)。Fv/Fm是藻类生理状态的重要指标,当浮游植物受到光照、温度、盐度、营养盐等环境因子胁迫时,Fv/Fm通常会显著降低(梁英等, 2007; 高坤山, 2014)。本研究中,4种藻的Fv/Fm值在CO2浓度升高条件下(培养的前7 d内)并未显著降低,且小球藻和三角褐指藻分别在第7天和第3天、第5天显著增加,说明高CO2浓度并未造成胁迫,同时提高了小球藻和三角褐指藻的最大光和效率。NPQ为非光化学淬灭系数,反映PSⅡ天线色素吸收的光能以热的形式耗散的那部分能量,目的是缓解过剩的激发能对PSⅡ反应中心的破坏,是一种自我保护机制(梁英等, 2007)。本研究中,亚心形扁藻高CO2浓度组的NPQ在第3天显著降低,叉鞭金藻高CO2浓度组NPQ除第5天外均显著低于低CO2浓度组,类似情况在其他研究中也有发现:在高pCO2水平(101.3 Pa)下,三角褐指藻NPQ与对照(39.3Pa)相比显著降低(Wu et al, 2010),这可能是由于当前海洋环境下存在叉鞭金藻的碳源供应限制(王东升, 2015)。qP是光化学淬灭,反映PSⅡ天线色素吸收的光能用于光化学电子传递的份额。三角褐指藻高CO2浓度组qP在第7天、第13天显著增加,PSⅡ的电子传递活性增强,光合活性升高。α表示藻类对光能的利用效率,CO2浓度升高显著提高了指数生长期叉鞭金藻α值,与徐金涛等(2016)研究的塔玛亚历山大藻的结果不一致。分析原因,可能与藻体的种间差异、实验条件不同等有关。徐金涛等(2016)实验培养温度为(20±1)℃,光照强度为120 μmol/(m2·s),pH为8.0±0.1,与本实验条件略有差异。可见,不同藻的叶绿素荧光参数对CO2浓度升高的响应不同,其中除了小球藻叶绿素荧光参数没有显著差异外,CO2浓度升高引起的酸化环境对其他3种藻的叶绿素荧光参数均有不同程度的影响,敏感程度各不一致。
浮游植物光合作用的强弱是影响其种群生长速率的主要因素。色素含量高低与藻细胞光合作用强弱有直接的关系,也间接影响细胞的生长繁殖(梁英等, 2007),其中叶绿素a是海洋浮游植物中除蓝藻以外均含有的特征色素(徐金涛等, 2016),因此,CO2浓度升高对藻体叶绿素荧光参数及叶绿素a含量产生的影响,最终表现为对浮游植物细胞生长的影响。高CO2浓度条件下,亚心形扁藻和小球藻分别通过增强rETRmax和升高单位细胞叶绿素a含量来促进细胞数量的增加。同时,CO2浓度升高加快了叉鞭金藻的电子传递速率,增强了对光能的吸收能力,并提高了三角褐指藻的潜在最大光合作用能力,促进了细胞生长。浮游植物的光合作用是一系列复杂代谢反应的总和,CO2浓度升高对其光合作用过程及生长的具体影响机制还有待今后进一步研究。
3.2 CO2浓度升高引起的海水酸化对不同藻类质量的影响自然环境中海洋浮游植物C、N、P比值趋近于106 : 16 : 1(Redfield, 1934),但由于浮游植物可有效利用的N、P浓度存在很大差异,加之光强、温度和CO2浓度等变化,导致很多藻类的C、N、P比不同于Redfield比值(Fu et al, 2007; Finkel et al, 2010)。本研究结果显示,CO2浓度的增加提高了亚心形扁藻的C/N、C/P值、小球藻的C/P值和三角褐指藻的C/N值,藻体中N、P含量相对减少,偏离了Redfield比值,使其作为食物的营养价值降低。蓝细菌聚球藻(Synechococcus)是海洋浮游植物群落的优势组分,是全球碳循环的主要参与者和初级生产力的主要贡献者,在海洋生态系统的光合作用、碳循环及食物链中扮演着举足轻重的角色(马英等, 2004)。Fu等(2007)对蓝细菌聚球藻的研究显示,在CO2浓度升高(750× 10-6)的条件下,C、N含量、C/P值均升高,与本研究结果一致。Urabe等(2003)研究发现,CO2浓度增加提高了浮游植物C/P值,使其作为食物的质量下降,进而对水溞的生长产生抑制作用。在N、P限制条件下培养的饵料微藻C/N、C/P比值升高,营养价值发生了变化,使安氏伪镖水蚤(Pseudodiaptomus annandalei)各时期个体的N、P含量显著降低,对其生长发育和摄食均产生了抑制作用(石琛等, 2011; 何学佳等, 2012)。CO2浓度升高对浮游植物C、N、P比值的影响会沿食物链向上传递,使得植食性动物,如浮游动物、滤食性贝类等的食物品质下降,对浮游动物、滤食性贝类等次级生产者的生长发育、生殖等产生一系列影响,进而影响整个食物网(Rossoll et al, 2012; 陈蕾等, 2014)。由于种间异质性,不同藻类对CO2浓度升高的响应不同,今后应该加强对不同种类的研究,并结合现场实验等(高坤山, 2011; 陈蕾等, 2014),综合探讨气候变化对食物链及海洋生态系统的影响。
Caldeira K, Wickett ME. Oceanography: Anthropogenic carbon and ocean pH. Nature, 2003, 425(6956): 365 DOI:10.1038/425365a |
Chen L, Li CL. Research advances in ecological stoichiometry of marine plankton. Chinese Journal of Applied Ecology, 2014, 25(10): 3047-3055 [ 陈蕾, 李超伦. 海洋浮游生物的生态化学计量学研究进展. 应用生态学报, 2014, 25(10): 3047-3055] |
Chen ZQ, Shou L, Liao YB, et al. Advance in the effect of microalgal diets and nutritional value on the growth of early life stages of bivalves. Bulletin of Science and Technology, 2013, 29(7): 46-55 [ 陈自强, 寿鹿, 廖一波, 等. 微藻饵料对双壳贝类幼体生长影响的研究进展. 科技通报, 2013, 29(7): 46-55 DOI:10.3969/j.issn.1001-7119.2013.07.009] |
Dlugokencky E, Tans P. NOAA/ESRL (www.esrl.noaa.gov/gmd/ccgg/trends/)
|
Finkel ZV, Beardall J, Flynn KJ, et al. Phytoplankton in a changing world: Cell size and elemental stoichiometry. Journal of Plankton Research, 2010, 32(1): 119-137 DOI:10.1093/plankt/fbp098 |
Fu FX, Marke W, Zhang Y, et al. Effects of increased temperature and CO2 on photosynthesis, growth, and elemental ratios in marine Synechococcus and Prochlorococcus (Cyanobacteria). Journal of Phycology, 2007, 43(3): 485-496 DOI:10.1111/jpy.2007.43.issue-3 |
Gao KS. Positive and negative effects of ocean acidification: Physiological responses of algae. Journal of Xiamen University (Natural Science), 2011, 50(2): 411-417 [ 高坤山. 海洋酸化正负效应:藻类的生理学响应. 厦门大学学报(自然科学版), 2011, 50(2): 411-417] |
Gao KS. Algal carbon fixation-basis, advances and methods. Beijing: Science Press, 2014 [ 高坤山. 藻类固碳—理论, 进展与方法. 北京: 科学出版社, 2014]
|
He XJ, Zhang JG, Shi C, et al. Growth and ingestion of Pseudodiaptomus annandalei under different nitrogen conditions. Oceanologia et Limnologia Sinica, 2012, 43(3): 609-614 [ 何学佳, 张君纲, 石琛, 等. 不同氮条件下安氏伪镖水蚤(Pseudodiaptomus annandalei)的生长及摄食. 海洋与湖沼, 2012, 43(3): 609-614] |
Hong H, Shen R, Zhang F, et al. The complex effects of ocean acidification on the prominent N2-fixing cyanobacterium Trichodesmium. Science, 2017, 356(6337): 527-531 DOI:10.1126/science.aal2981 |
Jiang H, Wu B, Yan B, et al. Application of microalgae chlorophyll fluorescence technique in environment monitoring. Journal of Environmental Engineering Technology, 2012, 2(2): 172-178 [ 姜恒, 吴斌, 阎冰, 等. 微藻叶绿素荧光技术在环境监测中的应用. 环境工程技术学报, 2012, 2(2): 172-178 DOI:10.3969/j.issn.1674-991X.2012.02.026] |
Laspoumaderes C, Modenutti B, Balseiro E. Herbivory versus omnivory: Linking homeostasis and elemental imbalance in copepod development. Journal of Plankton Research, 2010, 32(32): 1573-1582 |
Liang Y, Feng LX, Yin CL, et al. Current status and prospect of chlorophyll fluorescence technique in the study of responses of microalgae to environmental stress. Marine Sciences, 2007, 31(1): 71-76 [ 梁英, 冯力霞, 尹翠玲, 等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景. 海洋科学, 2007, 31(1): 71-76 DOI:10.3969/j.issn.1000-3096.2007.01.013] |
Ma Y, Jiao NZ. Advances in molecular ecology of Synechococcus. Progress in Natural Science, 2004, 14(9): 967-972 [ 马英, 焦念志. 聚球藻(Synechococcus)分子生态学研究进展. 自然科学进展, 2004, 14(9): 967-972 DOI:10.3321/j.issn:1002-008X.2004.09.002] |
Mao XW, Liu GX, Wang WM, et al. Effects of elevated CO2 on the population growth of Phaeodactylum tricornutum and Chaetoceros curvisetus. Periodical of Ocean University of China (Natural Science), 2016, 46(3): 60-66 [ 毛雪微, 刘光兴, 王为民, 等. CO2浓度升高对三角褐指藻和旋链角毛藻种群生长的影响. 中国海洋大学学报(自然科学版), 2016, 46(3): 60-66] |
Redfield AC. On the proportions of organic derivatives in sea water and their relation to the composition of plankton. James Johnstone Memorial Volume., 1934, 177-192 |
Riebesell U, Schulz KG, Bellerby RG, et al. Enhanced biological carbon consumption in a high CO2 ocean. Nature, 2007, 450(7169): 545-548 DOI:10.1038/nature06267 |
Rossoll D, Bermúdez R, Hauss H, et al. Ocean acidification- induced food quality deterioration constrains trophic transfer. PLoS One, 2012, 7(4): e34737 DOI:10.1371/journal.pone.0034737 |
Schoo KL, Malzahn AM, Krause E, et al. Increased carbon dioxide availability alters phytoplankton stoichiometry and affects carbon cycling and growth of a marine planktonic herbivore. Marine Biology, 2013, 160(8): 2145-2155 DOI:10.1007/s00227-012-2121-4 |
Shi C, Lü SH, He XJ. Effect of phosphorus condition on growth and ingestion in Pseudodiaptomus annandalei. Acta Hydrobiologica Sinica, 2011, 35(3): 460-466 [ 石琛, 吕颂辉, 何学佳. 不同磷条件对安氏伪镖水蚤(Pseudodiaptomus annandalei)的生长及摄食的影响. 水生生物学报, 2011, 35(3): 460-466] |
Sterner RW, Elser JJ. Ecological stoichiometry: The biology of elements from molecules to the biosphere. Princeton, NJ: Princeton University Press, 2002
|
Stocker TF, Qin D, Plattner GK, et al. IPCC, 2013: Climate Change 2013: The physical science basis. Contribution of Working Group Ⅰ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Computational Geometry, 2013, 18(2): 95-123 |
Urabe J, Togari J, Elser JJ. Stoichiometric impacts of increased carbon dioxide on a planktonic herbivore. Global Change Biology, 2003, 9(6): 818-825 DOI:10.1046/j.1365-2486.2003.00634.x |
Wang D. Inter- and intra-specific responses of coccolithophores to CO2-induced ocean acidification and preliminary study on photoprotection mechanisms. Master's Thesis of Qingdao Agricultural University, 2015 [ 王东升. 海洋酸化条件下颗石藻种内及种间的特异性生理响应及其NPQ机制的初步探究. 青岛农业大学硕士研究生学位论文, 2015]
|
Wu Y, Gao K, Riebesell U. CO2-induced seawater acidification affects physiological performance of the marine diatom Phaeodactylum tricornutum. Biogeosciences Discussions, 2010, 7(9): 2915-2923 DOI:10.5194/bg-7-2915-2010 |
Xu JT, Pang M, Ma X, et al. Carbon dioxide enrichment affects chlorophyll fluorescence and toxin production of Alexandrium tamarense. Oceanologia et Limnologia Sinica, 2016, 47(3): 557-563 [ 徐金涛, 庞敏, 马新, 等. CO2加富对塔玛亚历山大藻叶绿素荧光参数及产毒的影响. 海洋与湖沼, 2016, 47(3): 557-563] |
Zang ZR, Xie XJ, Zhao PP, et al. Effect of different temperatures and light conditions on the growth and fucoxanthin content of Phaeodactylum tricornutum. Marine Sciences, 2015, 39(7): 1-6 [ 臧正蓉, 解修俊, 赵佩佩, 等. 温度和光照对三角褐指藻的生长及岩藻黄素含量的影响. 海洋科学, 2015, 39(7): 1-6] |
Zhou Y, Zhang FS, Yang HS, et al. Comparison of effectiveness of different ashing auxiliaries for determination of phosphorus in natural waters, aquatic organisms and sediments by ignition method. Water Research, 2003, 37(16): 3875-3882 DOI:10.1016/S0043-1354(03)00267-7 |



