2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 水产科学国家级实验教学示范中心 上海海洋大学 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306
血红蛋白(Hemoglobin)为呼吸蛋白中的一员,广泛存在于脊椎动物、部分无脊椎动物以及一些高等植物、少数真菌和细菌中(汪青等, 2011)。血红蛋白的主要功能是参与运输和存储O2,但随着研究的不断深入,发现不同物种血红蛋白的结构存在一定差异,尤其是在无脊椎动物中其保守性较低,这为其新功能的获得提供了基础(叶水英等, 2008)。报道显示,血红蛋白是一种多功能蛋白,除携氧功能外,还具有储存能量、维持渗透压、维持血压和抗菌等多种功能(Brittain, 2002; Kato et al, 2017; Wang et al, 2013; 齐小琼等, 2014)。例如,人血红蛋白可以吸收肺中的NO,释放到血液中,从而调节NO浓度(Datta et al, 2004),海洋蠕虫(Arenicola marina)的血红蛋白能参与体液酸碱平衡的调节(Toulmond, 1973)。软体动物血红蛋白的免疫活性也受到重视,王素芳等(2014)纯化得到了泥蚶(Tegillarca granosa)的血红蛋白,进一步研究发现,其具有过氧化物酶活性,还具有抗恶臭假单胞杆菌(Pseudomonas putida)活性;荆昭(2011)研究发现,毛蚶(Scapharca kagoshimensis)的血红蛋白能杀灭金黄色葡萄球菌(Staphylococcus aureus)、枯草杆菌(Bacillus subtilis)和四联微球菌(Micrococcus tetragenus)等多种细菌。
魁蚶(Scapharca broughtonii)是我国重要的大型经济蚶类,生活于潮间带至数十米的浅海区,以软泥和泥沙质海底常见,在我国主要分布于黄、渤海,东海少见(张素萍, 2008)。魁蚶抗逆性较强,对低盐、鳗弧菌(Vibrio anguillarum)等胁迫都具有一定的耐受能力(张广明等, 2017; Zheng et al, 2015),可能与其血淋巴成分有关,但相关方面的研究报道十分有限。与其他多数双壳贝类不同,魁蚶血液呈鲜红色。周丽青等(2013、2014)将魁蚶血细胞划分为三类,即红细胞、白细胞和血栓细胞,并发现红细胞对病原体有被动吞噬和免疫吸附作用。蚶科贝类的血红蛋白基因已经在泥蚶(Bao et al, 2013)和毛蚶(荆昭, 2011)中克隆获得,相关功能方面的初步研究也已开展。
为更好地了解魁蚶血红蛋白基因结构、时空分布特征以及在胁迫后的表达变化,本研究拟克隆获得魁蚶血红蛋白基因,并分别研究该基因在mRNA水平上的变化特征,以期为魁蚶血红蛋白相关功能的研究积累数据。
1 材料与方法 1.1 实验材料与来源实验魁蚶采自山东省莱州海区,选取壳长为40 mm左右的活力强的个体,将其表面的泥沙洗刷干净,低温运至实验室,于20℃充气海水中暂养7 d,每天换水2次,每次换水1/2,每4 h投喂小新月菱形藻(Nitzschia clostertum)等单胞藻1次;实验幼虫取自山东省莱州育苗场。
1.2 实验处理及实验组织获得鳗弧菌刺激实验:将魁蚶随机分为鳗弧菌处理组、PBS组和对照组3组,每组40个体。鳗弧菌为本实验室保存的菌种,用2216E培养基复苏,离心弃上清液,用PBS稀释至OD600 nm=0.4 (1 OD=5×108cells/ml)。鳗弧菌处理组是向魁蚶闭壳肌中注射50 μl菌悬液,PBS组注射50 μl灭菌PBS,对照组不进行任何处理。分别于0、2、4、8、16、24、32和64 h随机选取3个个体抽取血淋巴,离心(4℃, 800 r/min, 15 min)收集血细胞,用于总RNA提取。
低氧胁迫处理:通过调节氮气和空气的充气速度控制海水溶解氧(DO)浓度,实验共设4个DO浓度梯度,分别为0.5、2.5、4.5和7.5 mg/L (对照组),处理0、2、4、8、16、24、32和64 h后,在每组中随机取3个魁蚶血淋巴,离心收集血细胞。
取对照组魁蚶的外套膜、闭壳肌、鳃、肝胰腺、血淋巴和斧足等组织存于液氮中,用于基因克隆和组织表达分析。为获得发育同步性高的魁蚶幼虫,在魁蚶育苗场构建5个魁蚶家系,利用筛绢分别富集0、1、2、3、12、16、18、28 h及2、3、5、6、8、9、10、11、12、13、23 d的幼虫,保存于液氮中。
1.3 基因克隆与序列分析 1.3.1 总RNA提取与cDNA合成RNA提取参照孙杰等(2010)的方法进行。主要步骤:将组织样品在液氮中研磨,Trizol处理10 min,加入氯仿抽提蛋白质,然后再利用异丙醇沉淀RNA,用75%乙醇洗净异丙醇后,室温干燥,DEPC水溶解RNA。采用分光光度计(A260 nm/A280 nm)和琼脂糖凝胶电泳检测RNA的质量、纯度和完整性。采用PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit试剂盒(TaKaRa),按照说明书操作步骤合成cDNA第一链,PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)合成cDNA,用于实时荧光定量PCR(qRT-PCR),置于-20℃中备用。
1.3.2 SbHbⅠ基因克隆根据本实验室转录组数据库中的已知序列,利用Primer Premier 5设计特异性引物SbHbⅠ-F和SbHbⅠ-R,扩增验证SbHbⅠcDNA的中间片段。使用RACE试剂盒(Clontech)进行RACE扩增,拼接扩增序列获得基因cDNA全长。根据扩增出的中间片段设计5'RACE(5Hb-R1和5Hb-R2)和3'RACE(3Hb-F1和3Hb-F2)引物,进行巢式扩增。第一轮使用试剂盒中的UPM和5Hb-R1与3Hb-F1进行扩增,以第一轮的扩增产物稀释30倍为模板,以NUP和5Hb-R2与3Hb-F2进行第二轮扩增。PCR反应程序:94℃ 30 s,72℃ 1 min,5个循环;94℃ 30 s,70℃ 30 s,72℃ 1 min,5个循环;94℃ 30 s,68℃ 30 s,72℃ 1 min,25个循环;4℃保存。所用引物见表 1。
|
|
表 1 实验所用引物序列 Tab.1 The primers used in this experiment |
2%琼脂糖凝胶电泳检测PCR产物,切胶回收目的条带,连接T载体并转化至克隆菌,挑取阳性单克隆菌株,测序验证。
1.3.3 序列分析用DNAstar软件对测序序列进行拼接,获得完整cDNA序列,查找ORF并翻译成氨基酸,预测蛋白分子量及等电点;利用Interproscan和Smart在线软件(http://www.ebi.ac.uk/interpro/和http://smart.embl-heidelberg.de/)预测编码蛋白的功能域;用TMHMM、SingalP3.0Server (http://www.cbs.dtu.dk/services/TMHMM/和http://www.cbs.dtu.dk/services/SignalP-3.0/)等在线软件分析蛋白的跨膜结构,预测信号肽。经Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)查找同源序列,利用ClustalX和DNAman软件进行多序列同源比对,利用Mega 6.0软件采用邻接法(Neighbor-Joining, NJ)中的Poisson model模型构建系统进化树。
1.4 qRT-PCR分析设计特异性引物qHb-F和qHb-R,以稀释15倍的cDNA为模板进行定量扩增,实验用β-actin作为内参基因(引物序列见表 1)。反应体系:Taq酶10 μl,正反向引物各0.8 μl,ROX Reference DyeⅡ0.4 μl,模板2 μl,ddH2O 6 μl。反应程序:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。每个样品设置3个重复,采用2-ΔΔCt法计算基因的相对表达量。使用SPSS 17.0软件进行单因素方差分析(One-way ANOVA)和Duncan多重比较(P < 0.05)。利用GraphPad prism软件作图。
2 结果 2.1 基因cDNA序列分析将测序结果进行拼接、比对,最终得到血红蛋白基因的cDNA全长序列(命名为SbHbⅠ,GenBank登录号为MF370202),序列信息如图 1所示。基因cDNA全长为867 bp,包括177 bp的5'-UTR、206 bp的3'-UTR和483 bp的ORF,ORF编码160个氨基酸残基,预测蛋白分子量为17.5 kDa,理论等电点为9.68。3'-UTR近poly A附近具有加尾信号序列(AATAAA)。软件预测SbHbⅠ编码的蛋白不存在跨膜结构和信号肽,但存在血红素结合位点,位点分别在第61、62、80、83、84、108、111、112、117、121、122和125氨基酸处。

|
图 1 SbHbⅠ核苷酸序列及编码氨基酸序列 Fig.1 Nucleotide and deduced amino acid sequence of SbHbⅠ 双下划线分别代表起始密码子(ATG)和终止密码子(TAA),单下划线的为加尾信号(aataaa),加粗的氨基酸为血红素结合位点 The start codon (ATG) and stop codon (TAA) are underlined with double underscore, polyadenylation signals and poly A plus tail signal (aataaa) is underlined, and the bold amino acid show the heme binding site |
NCBI在线比对结果显示,SbHbⅠ编码的氨基酸序列与其他物种血红蛋白编码氨基酸序列具有不同程度的相似度,其中,与毛蚶相似度为93%,与泥蚶的相似度为84%,与人血红蛋白的相似度为70%,氨基酸序列比对信息如图 2所示。
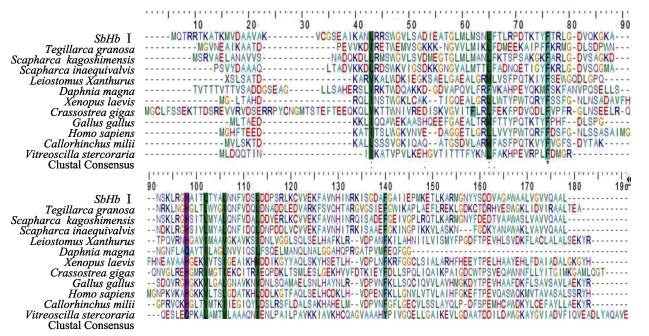
|
图 2 不同物种血红蛋白氨基酸序列比对 Fig.2 Multiple sequence alignment of SbHbⅠ with other hemoglobin amino acid sequences 氨基酸序列GenBank号:泥蚶(HQ149306.1);毛蚶(FJ797701.1);不等壳毛蚶(6HBI_A);黄尾平口石首鱼(P56250.1);大型溞(AAF66070.1);光滑爪蟾(NM_001088028.2);长牡蛎(XP_011416055.1);原鸡(NM_205489.2);人(DQ659148.1);叶吻银鲛(NM_001292784.1);透明颤菌(M30794.1) The GenBank accession numbers of protein sequences used for analysis are as follows: T. granosa(HQ149306.1); S. kagoshimensis(FJ797701.1); S. inaequivalvis(6HBI_A); Leiostomus xanthurus (P56250.1); Daphnia magna(AAF66070.1); Xenopus laevis(NM_001088028.2); Crassostrea gigas (XP_011416055.1); Gallus gallus (NM_205489.2); Homo sapiens(DQ659148.1); Callorhinchus milii (NM_001292784.1); Vitreoscilla stercoraria(M30794.1) |
在GenBank上搜索选取了具有代表性物种的血红蛋白序列,使用Mega 6.0构建的NJ进化树见图 3。结果显示,属于古菌域的产气荚膜梭菌(Halophilic archaeon)、植物中的马铃薯(Rattus norvegicus)和棘皮动物中的近辐蛇尾(Ophiactis simplex)产生分支,与其他物种距离较远。之后主要分为两大支,脊索动物聚为一支,无脊索动物、真菌和细菌聚为一支。本研究中的魁蚶先与毛蚶聚为一支,再依次与不等壳毛蚶(S. inaequivalvis)、泥蚶聚在一起。
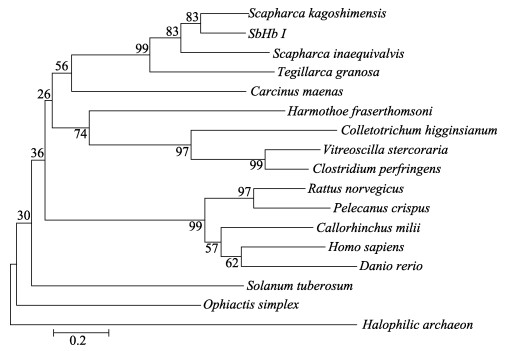
|
图 3 NJ法构建的血红蛋白家族系统进化树 Fig.3 The phylogenetic tree based on the sequences of different hemoglobin family members 进化树中所用蛋白的氨基酸序列的GenBank号:透明颤菌(AAA27584.1);嗜盐古菌(ATW86944.1);产气荚膜梭菌(EIA16494.1);近辐蛇尾(AHN50408.1);岸蟹(CBN88274.1);马铃薯(NP001275068.1);卷羽鹈鹕(NP001289298.1);人(ABG47031.1);鳞沙蚕(AJP75042.1);叶吻银鲛(NP_001279713.1);褐家鼠(NP_037228.1);斑马鱼(NP_932339.1);十字花科蔬菜炭疽菌(XP_018156679.1);泥蚶(HQ149306.1);毛蚶(FJ797701.1);不等壳毛蚶(X71387.1) The GenBank accession numbers of protein sequences used for phylogenetic analysis are as follows: V. stercoraria(AAA27584.1); H. archaeon(ATW86944.1); Clostridium perfringens (EIA16494.1); O. simplex(AHN50408.1); Carcinus maenas(CBN88274.1); Solanum tuberosum(NP001275068.1); Pelecanus crispus(NP001289298.1); H. sapiens(ABG47031.1); Harmothoe fraserthomsoni(AJP75042.1); C.milii(NP_001279713.1); R. norvegicus(NP_037228.1); Danio rerio(NP_932339.1); Colletotrichum higginsianum(XP_018156679.1); T. granosa(HQ149306.1); S. kagoshimensis(FJ797701.1); S. inaequivalvis (X71387.1) |
通过qRT-PCR检测SbHbⅠ基因在鳃、血淋巴、外套膜、斧足、闭壳肌和肝胰腺等6个组织中的表达情况(图 4)。从图 4可以看出,在6个组织中均能检测到SbHbⅠ基因的转录本表达。SbHbⅠ在血淋巴中的表达量最高,与其他5个组织存在显著差异(P < 0.05),而这5个组织中SbHbⅠ的表达量差异不显著(P > 0.05)。
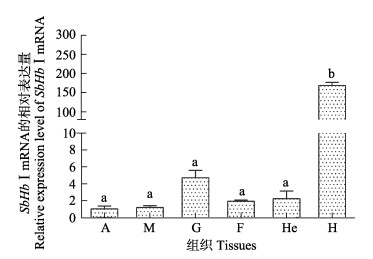
|
图 4 SbHbⅠmRNA在不同组织中的表达水平 Fig.4 Relative expression level of SbHbⅠ mRNA in different tissues of S. broughtonii A:闭壳肌;M:外套膜;G:鳃;F:斧足;He:肝胰腺;H:血淋巴。不同字母间表示差异显著(P < 0.05),相同字母间表示差异不显著(P > 0.05),下同 A: Adductor muscle; M: Mantle; G: Gill; F: Foot; He: Hepatopancreas; H: Haemocyte. Different letters indicate significant difference (P < 0.05), and the same letters indicate no significant difference(P > 0.05).The same as below |
SbHbⅠ在幼虫不同发育阶段的表达特征见图 5。从图 5可知,卵细胞至发育11 d时,幼虫的SbHbⅠ表达量虽有变化,但差异不显著;幼虫发育2 d以后,SbHbⅠ有上调趋势,幼虫发育至12 d时,其表达量显著高于1/2 d时的参照值(P < 0.05),同时也达到了所有检测阶段的最高值,为对照组的200多倍。12~13 d时,SbHbⅠ表达量没有显著差异。相对于12~13 d时的表达量,22 d幼虫体内SbHbⅠ的表达量显著下降,约为参照值的161倍(P < 0.05)。在整个检测阶段中,SbHbⅠ的表达量呈先升高再降低的趋势。
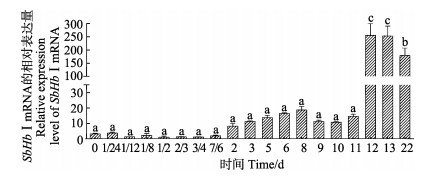
|
图 5 SbHbⅠmRNA在幼虫不同发育时间的表达水平 Fig.5 Relative expression level of SbHbⅠmRNA in different developmental time of larvae |
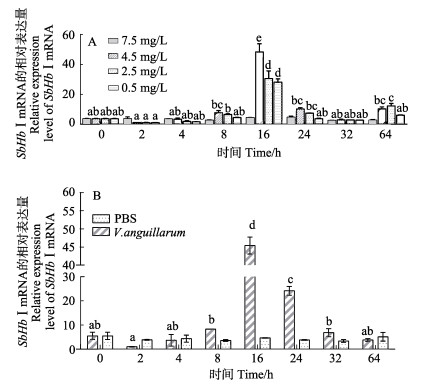
低氧胁迫和鳗弧菌刺激后,SbHbⅠ的表达变化见图 6。图 6A显示,在DO值为7.5 mg/L的对照组中,SbHbⅠ的表达比较稳定,没有显著变化。低氧胁迫使各处理组SbHbⅠ具有相似的变化趋势,基本表现为先下降后上升的趋势。低氧胁迫2 h时,4.5、2.5和0.5 mg/L 3个处理组血淋巴中的SbHbⅠ出现下降,均低于0 h的表达量,但未到达显著水平。低氧胁迫8 h时,3个处理组SbHbⅠ表达量显著高于2 h。低氧胁迫16 h时,各组均急剧升高达到峰值,4.5、2.5和0.5 mg/L组的表达量分别是7.5 mg/L组的11.1倍、7倍和6.45倍,且与其他相同处理组所有时间点的表达量存在显著差异(P < 0.05)。低氧胁迫24 h时,SbHbⅠ表达量开始下降,至32 h时基本恢复至对照组水平。鳗弧菌刺激后,SbHbⅠ在血细胞中的表达变化趋势基本与低氧胁迫一致,也是在16 h时急剧上升,之后显著下降(图 6B)。
|
图 6 SbHbⅠmRNA在低氧胁迫和鳗弧菌刺激后的表达水平 Fig.6 Relative expression level of SbHbⅠmRNA in haemocytes after hypoxia stress and V. anguillarum stimulation |
魁蚶血液呈红色是一种十分有趣的现象,其原因是血细胞中含有红细胞。Zhou等(2017)报道,魁蚶红细胞具有被动吞噬作用和免疫吸附作用,在魁蚶免疫防御系统中发挥重要作用。这对于主要依靠非特异性免疫进行机体免疫保护的魁蚶来说有重要意义,这也可能是魁蚶具有较强抗逆能力的原因之一。而在红细胞中,其主要的功能蛋白是血红蛋白。在泥蚶、毛蚶等蚶类中已克隆获得血红蛋白基因,且在同一物种中通常具有多个类型,同时,免疫相关的功能研究也已经开展(Bao et al, 2013)。本研究通过PCR和RACE技术克隆获得了全长为867 bp的cDNA序列,序列分析和同源比对发现,编码160个氨基酸残基,存在多个血红素结合位点,具有血红蛋白的特征序列;且与其他物种,尤其毛蚶、泥蚶等近缘物种的血红蛋白序列具有较高相似度,从而在分子水平上证实魁蚶中也含有血红蛋白基因。Bao等(2013)报道泥蚶血红蛋白的3个亚基的基因Tg-HbⅠ、Tg-HbⅡA和Tg-HbⅡB,魁蚶血红蛋白基因多态性有待进一步研究。
本研究中,在所收集的鳃、肝胰腺、斧足、外套膜、闭壳肌和血淋巴6个组织中均检测到了血红蛋白的转录本,但血淋巴中的表达量显著高于其他5个组织,是闭壳肌中的160多倍,且其他5个组织之间表达量没有显著差异。汪青等(2012)发现,泥蚶血红蛋白基因Tg-HbⅡ也在血液中表达量最高,其他组织相对较低。所以,在5个表达量较低的组织中检测到的血红蛋白,或许是由于魁蚶开放式循环方式而导致的血淋巴“污染”。在幼虫不同发育阶段的表达结果表明,SbHbⅠ在mRNA水平上具有母源传递特性,而且可能在担轮幼虫期开始自身合成,在壳顶幼虫期(本研究中12 d时)其合成系统相对完善,合成能力显著提升。这与吴彪等(2017)、岳峰(2013)分别报道的魁蚶大防御素和扇贝的几种免疫分子的母源传递及免疫因子合成规律相似。
本研究中,低氧胁迫后,3个处理水平组的血淋巴中SbHbⅠ的表达模式基本一致,呈先上升后下降再上升的趋势,16 h表达量最高。在机体缺氧时,血红蛋白能够释放所结合的氧气供组织生命活动所需,而缺氧时,机体对氧气的需求有赖于红细胞数量的增加。这说明在机体感受低氧环境后,SbHbⅠ的上调表达可能是红细胞需求增加的体现。而在多数的同一时间点,4.5 mg/L组SbHbⅠ的响应要比其他2个处理组更灵敏,这可能是因为过低的溶氧已对魁蚶的正常生理活动产生较大影响。结合鳗弧菌刺激后SbHbⅠ的表达看,发现SbHbⅠ的表达变化趋势与郑利兵等(2015)、黄永欢等(2016)和沈淑芳等(2018)报道的半乳糖凝集素、过氧化氢酶和C型凝集素免疫因子经鳗弧菌刺激后的变化趋势相近。因此,推断SbHbⅠ在免疫反应过程中也发挥作用,为一种免疫相关因子。
目前,魁蚶免疫因子基因克隆及功能的相关研究已经有大防御素(Li et al, 2012)、锰超氧化物歧化酶(Zheng et al, 2015)和铁蛋白(Zheng et al, 2016)等多个报道。而血红蛋白作为魁蚶血淋巴中极为重要的成分,在机体的生命活动中发挥重要生物学功能,仍需深入研究。本研究初步揭示了魁蚶血红蛋白Ⅰ基因的结构特征和表达模式,为魁蚶血红蛋白后续的功能研究提供了参考资料。
Bao YB, Li PF, Dong YH, et al. Polymorphism of the multiple hemoglobins in blood clam Tegillarca granosa and its association with disease resistance to Vibrio parahaemolyticus. Fish and Shellfish Immunology, 2013, 34(5): 1320-1324 DOI:10.1016/j.fsi.2013.02.022 |
Brittain T. Molecular aspects of embryonic hemoglobin function. Molecular Aspects of Medicine, 2002, 23(4): 293-342 DOI:10.1016/S0098-2997(02)00004-3 |
Datta S, Machaal A, Thekkudan J, et al. Inhaled nitric oxide as rescue therapy for right ventricular insufficiency after orthotopic heart transplantation. Journal of Heart and Lung Transplantation, 2004, 23(2): 158 |
Hang YH, Liu ZH, Wu B, et al. Gene cloning and expression analysis of catalase in Scapharca broughtonii. Journal of Fisheries of China, 2016, 40(6): 856-866 [ 黄永欢, 刘志鸿, 吴彪, 等. 魁蚶过氧化氢酶基因克隆及表达分析. 水产学报, 2016, 40(6): 856-866] |
Jin Z. Study on phenoloxidase-like properties and antibacterial activity of hemoglobin from blood clam Scapharca kagoshimensis. Doctoral Dissertation of Ocean University of China, 2011 [ 荆昭. 毛蚶(Scapharca kagoshimensis)血红蛋白的类酚氧化酶性质及其抗菌活性研究. 中国海洋大学博士研究生学位论文, 2011]
|
Kato Y, Shoji Y, Morita K, et al. Evaluation of changes in oxyhemoglobin during Shiritori task in elderly subjects including those with Alzheimers disease. Psychogeriatrics, 2017, 17(4): 238-246 DOI:10.1111/psyg.2017.17.issue-4 |
Li M, Zhu L, Zhou CY, et al. Molecular characterization and expression of a novel big defensin (Sb-BDef1) from ark shell, Scapharca broughtonii. Fish and Shellfish Immunology, 2012, 33(5): 1167-1173 DOI:10.1016/j.fsi.2012.09.008 |
Qi XQ, Wang T. Molecular evolution of hemoglobin families. Hubei Agricultural Sciences, 2014, 53(18): 4447-4456 [ 齐小琼, 王艇. 植物血红蛋白基因家族的分子进化研究. 湖北农业科学, 2014, 53(18): 4447-4456] |
Shen SF, Zhu L, Li JQ, et al. Molecular cloning and expression analysis of C-type lectin from Scapharca broughtonii. Progress in Fishery Sciences, 2018, 39(1): 128-136 [ 沈淑芳, 朱玲, 李加琦, 等. 魁蚶C型凝集素基因cDNA的克隆及表达分析. 渔业科学进展, 2018, 39(1): 128-136] |
Sun J, Wang BJ, Sun SJ, et al. cDNA cloning and sequence analysis of hemocyaninin Fenneropenaeus chinensis. Progress in Fishery Sciences, 2010, 31(1): 80-88 [ 孙杰, 王宝杰, 孙姝娟, 等. 中国对虾血蓝蛋白基因cDNA的克隆与序列分析. 渔业科学进展, 2010, 31(1): 80-88 DOI:10.3969/j.issn.1000-7075.2010.01.013] |
Toulmond A. Tide-related changes of blood respiratory variables in the lugworm Arenicola marina. Respiration Physiology, 1973, 19(2): 130-144 DOI:10.1016/0034-5687(73)90072-8 |
Wang SF, Bao YB, Shi NJ, et al. Purification and antibacterial activity of hemoglobin from Tegillarca granosa. Acta Oceanologica Sinica, 2014, 36(12): 67-73 [ 王素芳, 包永波, 施淼江, 等. 泥蚶血红蛋白的制备及其抗菌活性研究. 海洋学报, 2014, 36(12): 67-73 DOI:10.3969/j.issn.0253-4193.2014.12.006] |
Wang Q, Jiang C, Fang S, et al. Antihyperglycemic, antihyperlipidemic and antioxidant effects of ethanol and aqueous extracts of Cyclocarya paliurus leaves in type 2 diabetic rats. Journal of Ethnopharmacology, 2013, 150(3): 1119-1127 DOI:10.1016/j.jep.2013.10.040 |
Wang Q, Xiang RH, Bao YB, et al. Research progress in animal hemoglobin. Journal of Ningbo University (NSEE), 2011, 24(2): 20-24 [ 汪青, 项荣花, 包永波, 等. 动物血红蛋白研究进展. 宁波大学学报(理工版), 2011, 24(2): 20-24 DOI:10.3969/j.issn.1001-5132.2011.02.004] |
Wang Q, Lin ZH, Bao YB, et al. Clone and analysis of hemoglobin gene (Tg-HbⅡA) and immune expression research in Tegillarca granosa. Oceanologia et Limnologia Sinica, 2012, 43(1): 88-94 [ 汪青, 林志华, 包永波, 等. 泥蚶(Tegillarca granosa)血红蛋白基因(Tg-HbⅡA)克隆、分析及免疫表达研究. 海洋与湖沼, 2012, 43(1): 88-94] |
Wu B, Liu ZH, Zhou LQ, et al. Dynamic expression of big-defensin in different developmental stages of early-larcva of Scapharca broughtonii. Oceanologia et Limnologia Sinica, 2017, 48(2): 351-357 [ 吴彪, 刘志鸿, 周丽青, 等. 魁蚶母源大防御素在子代发育早期的动态变化. 海洋与湖沼, 2017, 48(2): 351-357] |
Ye SY, Chen SZ. The type and function of plant hemoglobin. Anhui Agricultural Science Bulletin, 2008, 14(17): 82-83, 98 [ 叶水英, 陈素珍. 植物血红蛋白的类型及其功能. 安徽农学通报, 2008, 14(17): 82-83, 98 DOI:10.3969/j.issn.1007-7731.2008.17.031] |
Yue F. Study on the ontogenesis of immune system in scallop Chlamys farreri and the maternal immunity at its early life. Doctoral Dissertation of University of Chinese Academy of Science, 2013 [ 岳峰. 栉孔扇贝免疫系统发生及母源免疫的初步研究. 中国科学院大学博士研究生学位论文, 2013]
|
Zhang GM, Wu B, Yang AG, et al. Influence of low salinity challenge on survival and enzyme activities in Scapharca broughtonii. Journal of Ludong University (Natural Science Edition), 2017, 33(2): 159-163 [ 张广明, 吴彪, 杨爱国, 等. 盐度胁迫对魁蚶耐受性及体内酶活性的影响. 鲁东大学学报(自然科学版), 2017, 33(2): 159-163 DOI:10.3969/j.issn.1673-8020.2017.02.012] |
Zhang SP. Illustrated handbook of of marine Mollusks in China. Beijing: China Ocean Press, 2008: 268-269 [ 张素萍. 中国海洋贝类图鉴. 北京: 海洋出版社, 2008: 268-269]
|
Zheng LB, Wu B, Liu ZH, et al. Cloning and expression analysis of galectin from Scapharca broughtonii (SbGal). Oceanolo- gia et Limnologia Sinica, 2015, 46(5): 1061-1070 [ 郑利兵, 吴彪, 刘志鸿, 等. 魁蚶(Scapharca broughtonii)半乳糖凝集素(SbGal)基因cDNA的克隆及表达分析. 海洋与湖沼, 2015, 46(5): 1061-1070] |
Zheng LB, Wu B, Liu ZH, et al. A manganese superoxide dismutase (MnSOD) from ark shell, Scapharca broughtonii: Molecular characterization, expression and immune activity analysis. Fish and Shellfish Immunology, 2015, 45(2): 656-665 DOI:10.1016/j.fsi.2015.05.003 |
Zheng LB, Liu ZH, Wu B, et al. Ferritin has an important immune function in the ark shell Scapharca broughtonii. Developmental and Comparative Immunology, 2016, 59(1): 15-24 |
Zhou LQ, Yang AG, Wang QY, et al. Studies on the hemocytes types and their immunological functions inbloody clam (Scapharca broughtonii). Journal of Fisheries of China, 2013, 37(4): 599-606 [ 周丽青, 杨爱国, 王清印, 等. 魁蚶血细胞分类及其免疫功能的初步分析. 水产学报, 2013, 37(4): 599-606] |
Zhou LQ, Yang AG, Wang QY, et al. Effect of Vibrio anguillarum on morphology and immunological function of blood cells in Scapharca broughtonii. Oceanologia et Limnologia Sinica, 2014, 45(3): 536-541 [ 周丽青, 杨爱国, 王清印, 等. 鳗弧菌对魁蚶血细胞形态及免疫功能的影响. 海洋与湖沼, 2014, 45(3): 536-541] |
Zhou LQ, Yang AG, Liu ZH, et al. Changes in hemolymph characteristics of ark shell Scapharaca broughtonii dealt with Vibrio anguillarum challenge in vivo and various of anticoagulants in vitro. Fish and Shellfish Immunology, 2017, 61(10): 9-15 |



