2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
中国对虾(Fenneropenaeus chinensis)是我国重要的土著海水养殖种类之一,近十几年来,其养殖产业饱受病害困扰。在诸多病原当中,白斑综合征病毒(White spot syndrome virus, WSSV)是对对虾养殖生产毒害最大的病毒之一(Lightner, 1996),它导致的疾病传播快、破坏性强,且防治困难,已给我国乃至全球的对虾养殖业造成了极大危害,严重制约了对虾养殖业的健康发展。国内外学者展开了大量研究工作,如消除传染源、切断传播途径、控制水质量、提高对虾抵抗力等以降低其危害,但至今效果不显著(Yang et al, 2001; He et al, 2012; Yang et al, 2012; 曹家旺等, 2017)。研究对虾对病原感染的免疫应答机制,可以为有效进行对虾的病害防治提供重要的理论指导。
甘氨酸脱羧酶(Glycine Decarboxylase, GLDC)是由P-蛋白、H-蛋白、T-蛋白和L-蛋白4个亚基构成的多酶复合体系(Tada et al, 1987)。它作为天冬门氨酸氨基转移酶超家族(Aspartateamino transferase superfamily, AAT_I)的成员,是一种磷酸吡哆醛依赖酶。在人类中的研究表明,甘氨酸脱羧酶的突变是非酮性高甘胺酸血症(Nonketotic Hyperglycinemia, NKH)的病因,该疾病是由先天基因缺陷导致大量甘氨酸在体液中积累而引起的严重的神经功能障碍,如脑病、肌张力减退、呼吸暂停、顽固性癫痫和可能的死亡(Kanekar et al, 2013)。也有学者指出,GLDC是非小细胞肺癌(Non-small cell lung cancer, NSCLC)发生的关键酶,NSCLC初期肿瘤的TICs中检测到高表达量的LIN28B干细胞因子和GLDC(Zhang et al, 2012)。GLDC在糖酵解和甘氨酸/丝氨酸代谢中引起巨大变化,导致嘧啶代谢发生变化,从而影响肿瘤细胞的增殖(信波等, 2007)。迄今为止,水产动物中尚未见该基因相关的研究报道。
在中国对虾感染WSSV后的表达谱芯片研究中,发现甘氨酸脱羧酶基因出现显著差异表达,此外,该基因内部出现与抗病性状呈显著关联的SNP位点(本实验室未发表数据)。故此,本研究采用RACE技术克隆中国对虾的甘氨酸脱羧酶基因(以下称FcGLDC基因),并研究其在WSSV侵染后的时空表达特点;利用直接测序法筛选基因内部的SNP位点,并利用飞行时间质谱法对SNP位点进行分型及其与抗WSSV性状的关联分析。研究结果将有助于为中国对虾抗WSSV育种提供理论依据和实践资料。
1 材料与方法 1.1 实验材料及人工WSSV感染实验中国对虾实验群体取自中国水产科学研究院黄海水产研究所遗传育种中心[体重(1.01±0.21) g],实验前暂养7 d。实验用水为砂滤海水,养殖期间水温为24.8~25.4℃,盐度为28,持续充氧,每天换水,并投喂配合饲料。利用单尾、等量、口饲法对1500尾左右的对虾进行WSSV感染,感染方法参见逄锦菲等(2013),选取WSSV感染实验中早期死亡的48尾和后期死亡的48尾对虾分别作为敏感群体和抗性群体,将2个群体的肌肉组织保存于液氮中,用于后续DNA的提取及关联分析。
随机挑选暂养的健康中国对虾180尾,平均分为2组(WSSV感染组和对照组),每组3个平行。WSSV感染组从第五腹节处注射病毒含量103 copies/μl的病毒悬液10 μl,对照组从第五腹节处注射PBS 10 μl,各组分别在实验开始后的0、6、12、24、48和72 h取鳃、肝胰腺和肌肉组织,每个时间点各取3尾存于液氮中,用于后续RNA的提取及荧光定量验证。
1.2 基因组DNA和总RNA的提取及cDNA合成使用Trizol法提取中国对虾肝胰腺组织的总RNA,具体操作方法参照说明书(Invitrogen, 美国)。采用紫外分光光度计与琼脂糖凝胶电泳检测所提取RNA的质量及完整性。利用SMARTTM RACE Amplification Kit (Clontech, 美国)反转录合成cDNA第一条链。按照TIANGEN基因组DNA提取试剂盒的方法进行基因组DNA的提取。采用紫外分光光度计与琼脂糖凝胶电泳检测所提取DNA的质量及完整性。
1.3 中国对虾FcGLDC基因全长cDNA的克隆及测序根据本实验室的中国对虾454转录组测序获得的甘氨酸脱羧酶基因的部分EST序列,使用Primer Premier 5.0软件设计5'RACE和3'RACE引物(表 1),利用Advantage 2 Polymerase (AD酶)进行扩增,扩增产物经1.2%琼脂糖凝胶电泳检测后,利用胶回收试剂盒回收目的片段,连接到pMD18-T simple载体上,转化入Top 10感受态细胞。使用M13引物对克隆进行菌落PCR鉴定,阳性克隆经确定后送青岛擎科测序公司进行测序。
|
|
表 1 引物序列及信息 Tab.1 Primer sequences in RACE, qRT-PCR and DNA amplification |
以对虾的基因组DNA为模板,根据FcGLDC基因的cDNA序列设计引物(表 1)。利用TaKaRa的LA Taq DNA聚合酶进行扩增,反应体系:DNA模板2 μl,正反向引物各5 μl,dNTP mixture (2.5 mmol/L each) 8 μl,Buffer 5 μl,LA Taq 0.5 μl,加水补足到50 μl。PCR反应程序:94℃变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸3 min,35个循环,72℃延伸5 min。扩增产物测序由青岛擎科测序公司进行。
1.5 基因生物信息学分析测序结果通过NCBI网站上的BLASTX进行序列同源性比对分析,利用DNASTAR软件进行全长序列拼接,在线生物学软件ExPASY对全长序列编码的氨基酸序列进行生物信息学分析,使用MEGA 5.0软件的邻接法(NJ)构建系统进化树。
1.6 基因的时空表达分析以18S rRNA作为Real-time PCR反应的内参基因,采用TaKaRa的荧光定量PCR试剂盒对基因进行荧光定量qRT-PCR检测。所用仪器为ABI 7500型荧光定量PCR仪,各个基因引物序列见表 1。20 μl反应体系包含:2×SYBR Green PCR Master Mix 10 μl,正向和反向引物各1 μl (2 μmol/L),稀释后的cDNA模板1 μl (1:10稀释),循环参数按照说明书。实验重复3次,以平均值进行后续数据分析。根据2-∆∆Ct方法计算每个基因的相对表达量(Livak et al, 2001),所得数据用SPSS 18.0进行单因素方差分析(One-way ANOVA),比较均值的差异显著性,P < 0.05为差异显著,P > 0.05为差异不显著。
1.7 中国对虾FcGLDC基因的SNP位点筛查及其与抗WSSV性状的关联分析取中国对虾5个个体的DNA进行混合,进行PCR扩增反应,扩增产物用1.2%琼脂糖凝胶电泳检测后将产物送青岛擎科测序公司测序。在测序结果中寻找有明显双峰的位点,将其定为SNP位点。之后利用飞行时间质谱法对SNP位点进行分型,并在敏感群体和抗性群体中对分型结果进行关联分析。
2 结果与分析 2.1 中国对虾FcGLDC基因cDNA全长序列的克隆利用Trizol法获得中国对虾肝胰腺组织的RNA,经1.2%琼脂糖凝胶电泳检测后发现,18S和28S rRNA条带清晰,说明其完整性较好,紫外分光光度计检测其OD260 nm/OD280 nm为1.86,表明其纯度较高,可用于后续实验。
中国对虾FcGLDC cDNA序列全长3481 bp,其中,5'UTR长17 bp,3'UTR长86 bp,ORF为2829 bp,编码942个氨基酸,包含94个碱性氨基酸(K和R),108个酸性氨基酸(D和E),322个疏水氨基酸(A、I、L、F、W和V),233个亲水氨基酸(N、C、Q、S、T和Y),222个带电荷氨基酸(K、R、D和E),预测蛋白分子量为104.66 kDa,理论等电点为6.51(图 1)。
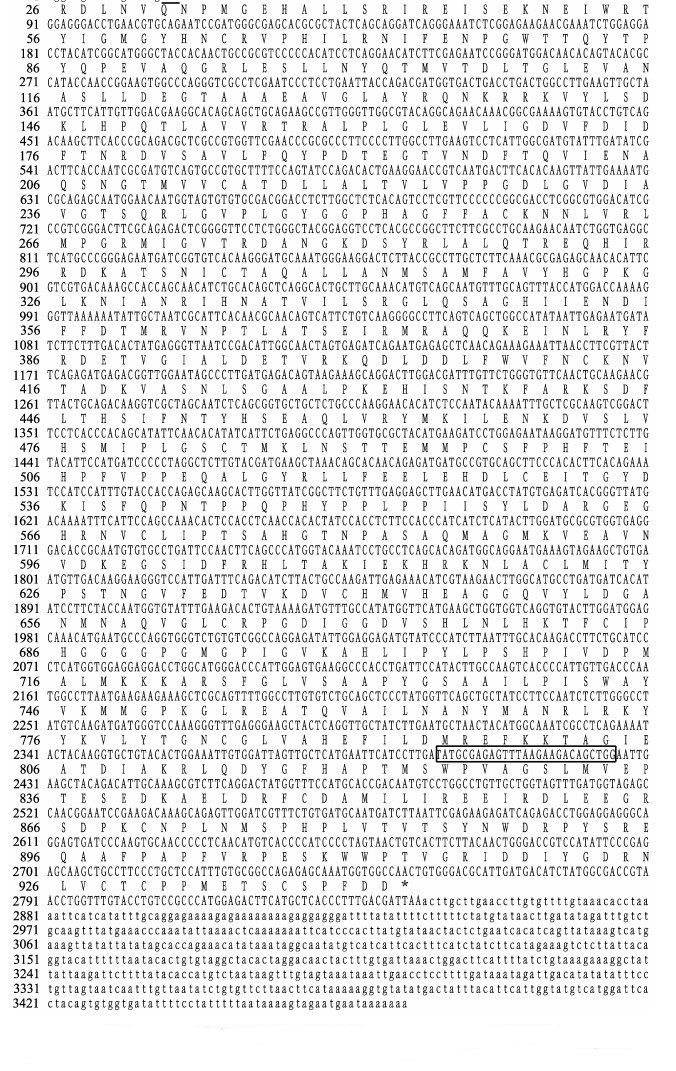
|
图 1 中国对虾GLDC基因cDNA全长序列及其编码的氨基酸序列 Fig.1 The full-length cDNA sequence and deduced amino acid sequence of the FcGLDC gene 全长起始密码子ATG由下划线标出;终止密码子TAA由*标出;黑色方框内为保守序列 Start codon (ATG) was underlined; Stop codon (TAA) marked with asterisk; Conserved sequence marked with black box |
经PCR扩增得到中国对虾GLDC基因DNA序列全长,共4964 bp,包含12个外显子和11个内含子。所有内含子均由GT开头,以AG结尾,符合GT-AG法则。所有内含子都在开放阅读框内部(图 2)。

|
图 2 FcGLDC基因的DNA结构 Fig.2 The DNA structure of FcGLDC 红色框表示外显子,黑色线表示内含子 Red box represents exon, black line represents intron |
氨基酸序列分析显示,FcGLDC蛋白含有天冬氨酸氨基转移酶超家族的典型保守序列SAAILPISW(A也可为S),定位于第736~744氨基酸(图 3)。氨基酸序列比对发现,FcGLDC的蛋白序列与节肢动物的相似度最高,与内华达白蚁(Zootermopsis nevadensis)、体虱(Pediculus humanus corporis)和白纹伊蚊(Aedes albopictus)的相似度分别是71%、68%和68%,而与哺乳动物如非洲象(Loxodonta africana)和草原鹿鼠(Peromyscus maniculatus bairie)的相似度分别为67%和67%。

|
图 3 中国对虾与其他物种GLDC氨基酸的序列比对 Fig.3 Alignment analysis of amino acid sequence of FcGLDC from various species 黑色方框内为保守序列。 Conserved sequence marked with black box |
系统进化分析表明,GLDC基因在进化过程中分为了脊椎动物(哺乳动物、爬行动物等)和无脊椎动物(主要为节肢动物)两个大的分支,在无脊椎动物分支中,中国对虾所属的甲壳亚门和家蝇(Musca domestica)、埃及伊蚊(Aedes aegypti)等六足亚门的物种之间也体现了差异性(图 4)。
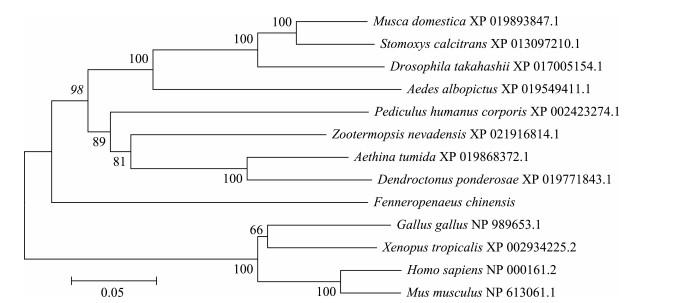
|
图 4 中国对虾与其他物种GLDC的系统进化分析 Fig.4 The phylogenetic tree analysis of FcGLDC from various species |
FcGLDC基因在中国对虾各组织中的相对表达量分析结果显示,该基因在鳃、肝胰腺和肌肉中均有表达,其中,肌肉中的表达量最高,肝胰腺中次之,鳃中的表达量最少,但三者间无显著差异(P > 0.05) (图 5A)。
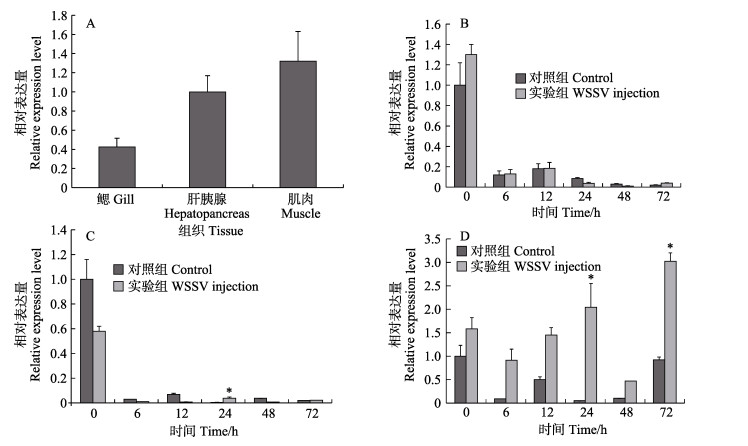
|
图 5 FcGLDC mRNA的组织表达及其在感染后的组织表达(n=3) Fig.5 The expression profiles of FcGLDC in hepatopancreas, gill, and muscle (n=3) A:正常组织;B:感染后的肝胰腺;C:感染后的鳃;D:感染后的肌肉。*表示显著性差异 A: Control; B: Hepatopancreas after WSSV challenge; C: Gill after WSSV challenge; D: Muscle after WSSV challenge. * represents significant difference |
FcGLDC基因在感染WSSV的对虾不同组织中的相对表达量变化分析结果显示,在鳃中,该基因的表达量在感染后的变化与对照组基本一致,均为急剧下降,在24 h时,实验组表达量有小幅上升,是对照组的4.47倍(P < 0.05)(图 5C)。在肝胰腺中,GLDC基因的表达量同样在注射后明显降低,在12 h有上升趋势,而后在48 h时表达量达到最低。肝胰腺中,各个时间点对照组与实验组的表达量差异均不显著(P > 0.05)(图 5B)。在肌肉组织中,实验组GLDC基因的表达量在24 h和72 h时表现为2次峰值,分别为对照组的19.98倍(P < 0.05)和4.21倍(P < 0.05)(图 5D)。在6个时间点中,实验组的表达量均高于对照组。
2.5 中国对虾FcGLDC基因SNP位点多态性分析及其关联分析利用直接测序法,在FcGLDC内部共发现4个可能的SNP位点,并利用质谱法对这4个位点进行了成功分型。分型结果采用PopGene软件处理,统计各位点的期望杂合度He,观测杂合度Ho,计算各位点多态信息含量PIC,并进行哈迪–温伯格平衡检验(表 2)。
|
|
表 2 SNP位点多态性分析 Tab.2 The analysis of genetic polymorphism of SNPs |
由表 2可知,FcGLDC基因内的这4个SNP标记的Ho范围为0.045~0.462,He范围为0.108~0.465。C1588-TG和C4406-CT的PIC分别为0.355和0.285,为中度多态(0.25 < PIC < 0.5),C4854-GA和C2967-AG的PIC分别为0.142和0.101,属于低度多态(PIC < 0.25)。哈温平衡分析结果显示,只有C1588-TG符合哈迪–温伯格平衡检验,且差异不显著。
使用SPSS 18.0对基因型和抗WSSV性状之间的相关性进行卡方检验,发现各位点与抗WSSV性状不相关(P > 0.05)(表 3)。
|
|
表 3 SNP位点与抗WSSV性状的关联分析 Tab.3 The correlation analysis of SNPs between WSSV-sensitive group and WSSV-resistant group |
本研究首次报道了对虾中的甘氨酸脱羧酶,克隆的FcGLDC基因ORF全长为2829 bp,编码942个氨基酸。氨基酸序列分析表明,其含有天冬氨酸氨基转移酶超家族的典型保守序列SAAILPISW(A也可为S)。蛋白的进化分析显示,该甘氨酸脱羧酶基因与其他节肢动物的甘氨酸脱羧酶基因明显聚为一类。ORF序列分析、蛋白保守位点分析及蛋白的系统进化分析均表明FcGLDC基因与其他物种的甘氨酸脱羧酶具有较高的相似性,因此,确定本研究克隆的FcGLDC基因为中国对虾的甘氨酸脱羧酶基因。
本研究分析了中国对虾感染WSSV后GLDC基因在鳃、肝胰腺及肌肉组织中的表达特征,结果显示,该基因在3种组织中均有表达,且在肌肉中的表达最高。感染后,通过分析GLDC在3种组织中的表达规律发现,肌肉对该基因最敏感,说明WSSV对该基因有相对比较大的刺激。考虑到对虾感染WSSV后出现了运动机能减退的情况(Lightner et al, 1998),推测肌肉中该基因的表达与对虾的运动不协调有关。
本研究通过直接测序法得到了中国对虾GLDC基因全长DNA序列,该DNA序列全长为5608 bp,包含11个内含子,鉴定的外显子-内含子边界都与经典的剪接供体(GT-)和受体序列(-AG)一致。开放阅读框起于第1个外显子,止于第12个外显子。众所周知,真核生物的基因在每个外显子和内含子的接头区,都有一段高度保守的共有序列,即每个内含子的5'端起始的2个核苷酸均为GT,3'端的2个核苷酸均为AG。但也有少数基因不符合GT-AG法则,如在人类135 kb的GLDC基因含有的24个内含子中,只发现有1个内含子不符合GT-AG法则(Takayanagi et al, 2000)。
本研究通过直接测序法定位了中国对虾GLDC基因DNA全长序列中4个可能的SNP位点,并进一步通过飞行时间质谱法对这4个位点进行分型检测。4个SNP位点有2个位于内含子上,2个位于外显子上。位于外显子上的突变位点均在密码子的第3位,属于同义突变,未对所编码氨基酸序列造成影响。位于内含子区域的突变在转录翻译过程中被剪切,并不参与调控过程。位点多态性分析显示,有3个位点不符合哈迪–温伯格平衡,推测这可能是杂合子数量过多或不足造成的。位点与性状的关联分析表明,获得的SNP位点均与性状不相关。关联分析研究时需要考虑群体分层的问题。由于群体存在遗传背景的差异,使得来自不同亚群的个体中等位基因频率存在差异,即存在群体分层,关联分析时这些位点会造成假阳性(Emahazion et al, 2001)。因此,加大样本量,并尽量使用遗传背景一致或相似的群体如采用基于家系的群体进行关联研究就显得尤为重要。本研究选用家系材料作为验证群体,遗传背景相近,符合关联研究所用群体的要求。水产动物中,罗非鱼(Oreochromis niloticus)、大口黑鲈(Micropterus salmoides)、栉孔扇贝(Chlamys farreri)等物种的经济性状与SNP位点的关联分析时采用的群体多小于200个个体(刘福平等, 2009; 杜芳芳等, 2011; 李纪勤, 2012),本研究采用的是感染早期死亡和后期死亡的各48尾个体进行关联分析,数量上基本达到了关联分析群体数量的要求。
本研究首次在中国对虾中获得了甘氨酸脱羧酶基因的全长cDNA序列及其DNA序列,分析了WSSV感染后该基因在不同组织中的表达特征,并进行了基因内部SNP位点多态性分析及其关联分析,研究结果将有助于为中国对虾抗WSSV育种提供理论依据和实践资料。
Cao JW, Kong J, Luo K, et al. Immune priming response induced by heat-inactivated WSSV on Fenneropenaeus chinensis at different temperature. Progress in Fishery Sciences, 2017, 38(2): 128-136 [ 曹家旺, 孔杰, 罗坤, 等. 热灭活WSSV诱导的中国明对虾(Fenneropenaeus chinensis)在不同温度下的免疫致敏反应. 渔业科学进展, 2017, 38(2): 128-136] |
Du FF, Bai JJ, Li SJ, et al. Effects of SNPs in POU1F1 promoter on growth traits in largemouth bass (Micropterus salmoides). Journal of Fisheries of China, 2011, 35(6): 793-800 [ 杜芳芳, 白俊杰, 李胜杰, 等. 大口黑鲈POU1F1启动子区域SNPs对生长的影响. 水产学报, 2011, 35(6): 793-800] |
Emahazion T, Feuk L, Jobs M, et al. SNP association studies in Alzheimer's disease highlight problems for complex disease analysis. Trends in Genetics, 2001, 17(7): 407-413 DOI:10.1016/S0168-9525(01)02342-3 |
He YD, Zhang X. Comprehensive characterization of viral miRNAs involved in white spot syndrome virus (WSSV) infection. RNA Biology, 2012, 9(7): 1019-1029 DOI:10.4161/rna.20741 |
Kanekar S, Byler D. Characteristic MRI findings in neonatal nonketotic hyperglycinemia due to sequence changes in GLDC gene encoding the enzyme glycine decarboxylase. Metabolic Brain Disease, 2013, 28(4): 717-720 DOI:10.1007/s11011-013-9415-1 |
Lightner DV. Epizootiology, distribution and the impact on international trade of two penaeid shrimp viruses in the Americas. Revue Scientifique et Technique, 1996, 15(2): 579-601 DOI:10.20506/rst.issue.15.2.2491 |
Lightner DV, Redman RM. Shrimp diseases and current diagnostic methods. Aquaculture, 1998, 164(1-4): 201-220 DOI:10.1016/S0044-8486(98)00187-2 |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real time quantitative PCR and the 2-ΔΔCT method. Methods, 2001, 25: 402-408 DOI:10.1006/meth.2001.1262 |
Liu FP, Bai JJ, Ye X, et al. Cloning of MC4R gene and study on the association between SNPs of MC4R and growth trait in tilapia (Oreochromis niloticus). Journal of Fishery Science of China, 2009, 16(6): 816-823 [ 刘福平, 白俊杰, 叶星, 等. 罗非鱼MC4R基因克隆及与其生长相关的SNPs位点. 中国水产科学, 2009, 16(6): 816-823 DOI:10.3321/j.issn:1005-8737.2009.06.002] |
Li JQ. Development, characterization and application of EST-SNP markers in Zhikong scallop (Chlamys farreri). Doctoral Dissertation of Ocean University of China, 2012 [李纪勤.栉孔扇贝(Chlamys farreri) EST-SNP的开发及其应用.中国海洋大学博士研究生学位论文, 2012] http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505821.htm
|
Tada K, Hayasaka K. Non-ketotic hyperglycinaemia: Clinical and biochemical aspects. European Journal of Pediatrics, 1987, 146(3): 221-227 DOI:10.1007/BF00716464 |
Takayanagi M, Kure S, Sakata Y, et al. Human glycine decarboxylase gene (GLDC) and its highly conserved processed pseudogene (psiGLDC): Their structure and expression, and the identification of a large deletion in a family with nonketotic hyperglycinemia. Human Genetics, 2000, 106(3): 298 |
Yang F, He J, Lin X, et al. Complete genome sequence of the shrimp white spot bacilliform virus. Journal of Virology, 2001, 75(23): 11811-11820 DOI:10.1128/JVI.75.23.11811-11820.2001 |
Yang JY, Chang CI, Liu KF, et al. Viral resistance and immune responses of the shrimp Litopenaeusvannamei vaccinated by two WSSV structural proteins. Immunology Letters, 2012, 148(1): 41-48 DOI:10.1016/j.imlet.2012.08.004 |
Zhang WC, Shyhchang N, Yang H, et al. Glycine decarboxylase activity drives non-small cell lung cancer tumor-initiating cells and tumorigenesis. Cell, 2012, 148(1-2): 259 DOI:10.1016/j.cell.2011.11.050 |
Pang JF, Kong J, Meng XH, et al. Real-time PCR assay for quantifying WSSV load in Fenneropenaeus chinensis "Huanghai No. 2". Oceanologia et Limnologia Sinica, 2013, 44(3): 782-787 [ 逄锦菲, 孔杰, 孟宪红, 等. 中国对虾(Fenneropenaeus chinensis)"黄海2号"人工感染WSSV的荧光定量分析. 海洋与湖沼, 2013, 44(3): 782-787] |
Xin B, Liu XY, Wang W, et al. Coexistence of GABA and glycine in the neurons of the oral and interpolar subnuclei of the spinal trigeminal nucleus in the GAID67-GFP transgenic mouse. Chinese Journal of Neuroanatomy, 2007, 23(1): 45-48 [ 信波, 刘翔宇, 汪伟, 等. GAD67-GFP转基因小鼠三叉神经脊束核吻侧亚核和极间亚核内GABA和甘氨酸共存神经元的观察. 神经解剖学杂志, 2007, 23(1): 45-48 DOI:10.3969/j.issn.1000-7547.2007.01.009] |



