2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
多聚免疫球蛋白受体pIgR (Polymeric immune- globulin receptor)是Ⅰ型跨膜糖蛋白,属于免疫球蛋白超家族的一员,在动物黏膜相关淋巴组织中结合并介导分泌型抗体跨过上皮细胞进行转运,经酶切后以复合物的形式分泌到黏膜表面,抑制病原微生物的粘附和入侵,在先天性免疫与获得性免疫中均具有重要作用(Phalipon et al, 2003; Kaetzel, 2005)。哺乳动物的pIgR蛋白包含5个免疫球蛋白功能域(Ig-like domains, ILD),可以与二聚体IgA或者四聚体IgM结合,两栖动物和鸟类的pIgR蛋白包含4个ILD,分别与哺乳动物的第1、3、4和5个ILD同源(Piskurich et al, 1995; Wieland et al, 2004)。
目前,在红鳍东方鲀(Takifugu rubripes)(Hamuro et al, 2007)、鲤鱼(Cyprinus carpio)(Rombout et al, 2008)、草鱼(Ctenopharynodon idellus)(张毅, 2016)、牙鲆(Paralichthy solivaceus)(Xu et al, 2013)、斜带石斑鱼(Epinephelus coioides)(Feng et al, 2009)、虹鳟(Oncorhynchus mykiss)(Zhang et al, 2010)、大菱鲆(Scophthalmus maximus)(丁冰洁等, 2013)、鲫鱼(Carassius auratus)(Wang et al, 2017)等硬骨鱼类中均克隆得到了pIgR基因。结构分析表明,硬骨鱼pIgR蛋白仅有2个ILD,分别与哺乳动物的ILD1和ILD5同源。因此,研究鱼类pIgR对于了解生物进化过程具有重要意义。鱼类pIgR也具有和哺乳动物pIgR类似的转运功能,显示了生物进化的严谨性和保守性。最新的研究发现,在硬骨鱼中存在一种新型的免疫球蛋白IgT。对虹鳟的研究发现,pIgR仅能与肠道IgT结合,而不能与血液IgT结合(Zhang et al, 2010),提示硬骨鱼pIgR的功能仍有很多未知之谜。
半滑舌鳎(Cynoglossus semilaevis)是我国重要的海水经济养殖鱼类,由于其肉质鲜美滑嫩、营养价值高、生长快速等特点而深受人们喜爱。随着养殖数量的增多,病害的威胁也日趋严重,尤其是细菌引起的溃烂症、肠炎症最为严重,给养殖业带来了巨大的经济损失。同时,半滑舌鳎是一种底栖鱼类,腹部摩擦底面,特别容易受到损伤,在水环境中黏膜包被的皮肤、鳃、肠等是病原侵袭的主要部位,黏膜不仅仅是物理屏障,其局部黏膜的免疫应答对病原体的抵御更加重要。因此,对半滑舌鳎抗病分子机制的研究将会对其病害防治提供重要的理论基础。目前关于pIgR基因在半滑舌鳎的克隆及功能研究尚未见报道。
本研究对半滑舌鳎的pIgR基因进行全长cDNA克隆并初步分析其结构特征,采用实时荧光定量PCR(qRT-PCR)技术(邢贺飞等, 2016)检测了该基因在半滑舌鳎不同组织中的表达模式和在哈维氏弧菌(Vibrio harveyi)的刺激下不同组织的表达特征,从而为探究pIgR在半滑舌鳎的免疫应答中的作用机制、开发抗病相关分子标记提供理论基础。
1 材料与方法 1.1 实验用鱼 1.1.1 正常组织本实验中所用的半滑舌鳎取自山东省海阳市黄海水产公司,18月龄健康的半滑舌鳎体重为(104.9±4.6) g,全长为(25.8±1.3) cm,体宽为(6.8±0.2) cm。麻醉后,解剖分离肝、脾、肾、头肾、鳃、肠、肌肉、心脏、皮肤等组织,将组织样品迅速放入RNA保存液中,置于–20℃冰箱保存。
1.1.2 哈维氏弧菌感染及样品采集根据半滑舌鳎的感染实验(Wei et al, 2017),将10月龄健康的半滑舌鳎经腹腔注射哈维氏弧菌感染,在感染后的12、24、48、72和96 h共5个时间点,并以感染前0 h作为对照,分别取3条半滑舌鳎。将活鱼麻醉后迅速取肝、脾、肠、肾、鳃和皮肤等6个免疫组织,放入RNA保存液中,置于–20℃冰箱中保存。
1.2 RNA提取及cDNA的合成使用Trizol法进行半滑舌鳎总RNA的提取,用琼脂糖凝胶电泳检测总RNA质量,并使用Gene Quant Pro RNA/DNA分光光度计测定RNA浓度。RNA鉴定合格后,用cDNA反转试剂盒(TaKaRa)合成cDNA。使用TaKaRa RACE试剂盒,根据其说明书合成RACE-Ready-cDNA。
1.3 pIgR基因全长cDNA的克隆 1.3.1 中间片段的验证首先根据半滑舌鳎全基因组测序结果(Chen et al, 2014),获得pIgR基因的部分cDNA序列,应用Primer Premier 5.0软件设计引物(pIgR-F/pIgR-R)(表 1),分别以肠、肾和鳃为模板进行体系为15 μl的普通PCR扩增。体系为:Mix为7.5 μl,pIgR-F为0.6 μl,pIgR-R为0.6 μl,ddH2O为5.3 μl,模板cDNA为1 μl。程序为:95℃预变性5 min;95℃ 30 s,58℃退火30 s,72℃延伸30 s,为35个循环;72℃延伸7 min;4℃保存。
|
|
表 1 本研究所用到的引物 Tab.1 Primers used in this study |
将得到的PCR产物进行琼脂糖凝胶电泳检测,利用胶回收试剂盒(康为世纪)对所需的目的片段进行收集、纯化,连接到pEASY-T1载体,转化Top10感受态细胞,涂板后经37℃培养12~16 h,挑取3个阳性克隆送到北京睿博兴科生物技术有限公司(青岛区)测序。
1.3.2 5'和3' RACE克隆根据验证得到的部分cDNA序列设计5'和3'端的RACE引物(pIgR-5'- GSP/pIgR-5'-NGSP和pIgR-3'-GSP/pIgR-3'-NGSP)。第一轮反应体系10 μl,根据TaKaRa TaqTM Hot Start Version说明书介绍的体系比例加样混合,进行Touch down PCR程序反应。
将第一轮PCR反应产物稀释50倍后作为第二轮普通PCR扩增反应的模板。反应体系为50 μl,同上按比例加样混合后,进行第二轮普通PCR反应。将得到的PCR产物根据中间片段验证的方法处理并测序。
1.4 生物学分析及进化树构建使用生物学软件DNAstar对克隆得到的pIgR全长cDNA序列进行分析,预测其开放阅读框(ORF)以及氨基酸序列,并推导出蛋白的分子量和等电点;使用SignalP4.1对翻译的氨基酸序列进行信号肽分析,利用TMpred预测氨基酸序列跨膜结构域。pIgR基因同源氨基酸序列的搜索在NCBI数据库中通过Blast完成并预测功能结构域,通过MEGA 7.0软件完成生物系统进化树构建和氨基酸多序列比对。
1.5 pIgR基因的表达模式检测通过使用qRT-PCR检测健康的半滑舌鳎不同组织中pIgR基因的表达量;经哈维氏弧菌感染刺激后6个不同时间点的肝、肾、脾、肠、鳃和皮肤的表达模式。根据得到的ORF序列设计实时荧光定量引物(pIgR-qRT-F/pIgR-qRT-R),再以β-actin基因(β-actin-F/β-actin-R)(表 1)作为内参基因,根据TaKaRa SYBR® Premix Ex TaqTM说明书的方法进行pIgR基因的定量分析。根据测得的Ct值,利用2-ΔΔCt法计算pIgR基因相对表达量,实验得到的数据均采用SPSS软件进行方差分析,设定P < 0.05为差异显著。
2 结果与分析 2.1 半滑舌鳎pIgR基因序列特征半滑舌鳎pIgR基因的cDNA全长为1419 bp,其中,ORF为1020 bp,编码339个氨基酸,5' UTR为109 bp,3' UTR为290 bp,相对分子质量为37472.76 D,理论等电点为6.870。蛋白结构预测结果显示,在1~19 aa之间存在1个信号肽序列,之后为胞外区、跨膜区和胞内区,分别由263、22和54个氨基酸组成。胞外区包括2个ILD功能结构域分别在26~111 aa和135~224 aa位置(图 1)。

|
图 1 半滑舌鳎pIgR基因cDNA序列以及推导的氨基酸序列 Fig.1 The cDNA and deduced amino acid sequences of C. semilaevis pIgR 方框表示信号肽序列为1~19号氨基酸,下划线表示26~111号和135~224号氨基酸的2个ILD功能结构域,箭头区域表示跨膜结构域 The box indicates amino acid residues 1~19 in the signal peptide sequence, two ILD functional domains in amino acids 26~111 and 135~224 are underlined, the arrowhead indicates the transmembrane domain |
将半滑舌鳎pIgR的氨基酸序列通过蛋白序列比对在NCBI数据库中下载的其他物种:大菱鲆(S. maximus, AGN54539.1)、牙鲆(P.olivaceus, ADK91435.1)、红鳍东方鲀(T. rubripes, NP_001266944.1)、大黄鱼(Larimichthys crocea, XP_010733629.2)、青鳉(Oryzias latipes, XP_004079170.1)、虹鳟(O. mykiss, ADB81776.1)、鲤鱼(C. carpio, ADB97624.1)、草鱼(C. idellus, ALX37964.1)、斑马鱼(Danio rerio, NP_001289179.1)、非洲爪蟾(Xenopus laevis, ABK62772.1)、原鸡(Gallus gallus, NP_001038109.1)、鼠(Mus musculus, NP_ 035212.2)、人(Homo sapiens, NP_002635.2)的pIgR蛋白序列进行分析。多序列氨基酸比对结果显示,半滑舌鳎pIgR与其他硬骨鱼类都只含有2个ILD区,分别对应哺乳类的ILD1和ILD5,哺乳类及鸟类在ILD1中存在3个互补决定区(Complementary determining region, CDR),而硬骨鱼类则没有相似序列(图 2)。系统进化树显示鱼类的pIgR聚为一支,其中,半滑舌鳎与大菱鲆和牙鲆聚为一个分支,3种淡水鱼(鲤鱼、草鱼和斑马鱼)聚为一个分支;两栖类、鸟类和哺乳类聚为另一支(图 3)。

|
图 2 半滑舌鳎pIgR氨基酸多重序列比对结果 Fig.2 The multiple sequence alignment of the pIgR amino acid |

|
图 3 半滑舌鳎pIgR与其他物种pIgR系统进化分析 Fig.3 Phylogenetic analysis of C. semilaevis pIgR sequence with other pIgR sequences in fish, amphibians, birds, and mammals |
健康组织表达结果显示,pIgR基因在半滑舌鳎各个组织中均有表达,在鳃中表达量最高,其次是心脏、脾脏和皮肤,在肝脏、头肾和肠中表达量较低,在肌肉中的表达量最低(图 4)。
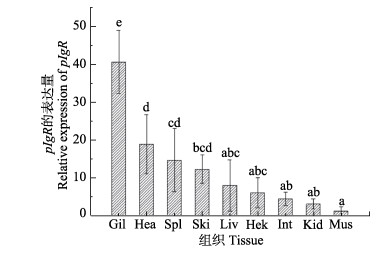
|
图 4 半滑舌鳎pIgR基因在不同组织的表达分布
Fig.4 pIgR gene of C. semilaevis expression profile in different tissues
图中“a, b, c, d, e”为SPSS软件中Duncan算法计算出的子集分组,下同 Gil:鳃; Hea:心脏; Spl:脾脏; Ski:皮肤; Liv:肝脏; Hek:头肾; Int:肠; Kid:肾脏; Mus:肌肉 The letters "a, b, c, d, e" were subsets by Duncan algorithm, the same as below Gil: Gill; Hea: Heart; Spl: Spleen; Ski: Skin; Liv: Liver; Hek: Head Kidney; Int: Intestine; Kid: Kidney; Mus: Muscle |
经哈维氏弧菌感染后,半滑舌鳎内脏和鳃组织中pIgR基因的表达模式发生变化。各组织中pIgR基因的相对表达量均呈现先增加后减少的趋势,其中,鳃和脾脏在48 h时出现峰值;肾脏、肝脏和肠在72 h时出现峰值;皮肤在96 h内一直处于上升趋势(图 5)。

|
图 5 哈维氏弧菌感染后半滑舌鳎pIgR在免疫组织中表达变化 Fig.5 The expression of C. semilaevis pIgR in immunologic tissues after V. harveyi infection |
本研究通过PCR及RACE方法成功获得半滑舌鳎pIgR基因cDNA全长序列,丰富了对半滑舌鳎免疫相关基因的认识。与硬骨鱼类pIgR基因的氨基酸序列进行同源比对分析,表明8种硬骨鱼类都只含有2个ILD,分别与哺乳动物的ILD1和ILD5同源。哺乳动物pIgR与免疫球蛋白的结合实验证明ILD1是受体结合的必要结构(Kaetzel et al, 2005)。虽然已有研究证明,硬骨鱼pIgR能够结合IgM和IgT (Feng et al, 2009; Zhang et al, 2010),但结合及转运的机制还需要进一步研究。另外,研究证明,斑马鱼存在多种pIgR-like基因,在鲤鱼肠道中也发现一种具有IgM结合活性的pIgR-like蛋白(Kortum et al, 2014),在半滑舌鳎中的研究有待继续开展。
组织表达模式分析发现,pIgR基因在半滑舌鳎各个组织中均有表达,其中,在鳃中表达最高,在心脏、脾脏和皮肤中表达稍高,在肌肉中表达最低,说明pIgR特异地在黏膜免疫相关组织中表达。心脏组织样品采集时充盈了血液,因此pIgR表达量较高。本研究结果与牙鲆(Xu et al, 2013)、大菱鲆(丁冰洁等, 2013)、斜带石斑鱼(Feng et al, 2009)和红鳍东方鲀(Hamuro et al, 2007)等基本一致。已有研究证明,硬骨鱼类pIgR基因对细菌和寄生虫的感染均有快速的响应模式。灭活鳗弧菌(Vibrio anguillarum)浸泡刺激后,大菱鲆免疫组织中pIgR的相对表达量在72 h内均呈现先上升后下降的趋势,且黏膜相关淋巴组织中的峰值出现最早(丁冰洁等, 2013)。白点虫感染泥鳅(Misgurnus anguillicaudatus)的脾脏、肾脏、皮肤和鳃中pIgR的表达量均有显著升高(Yu et al, 2018)。本研究对哈维氏弧菌感染不同时间,半滑舌鳎免疫相关组织中pIgR基因的表达变化规律进行了检测。在鳃和4种内脏组织中pIgR基因均呈现先增加后减少的趋势,其中,鳃和脾脏pIgR的表达量在48 h时出现峰值;肾脏、肝脏和肠中pIgR的表达量在72 h时出现峰值。然而,在皮肤中的pIgR的表达量在96 h内持续上升,证明皮肤一直处于应答状态,这可能是因为腹腔注射的哈维氏弧菌经血液循环及组织扩散到皮肤,导致皮肤溃烂。因此,皮肤中大量表达pIgR,发挥持久的免疫防御作用,提示pIgR在黏膜免疫防御中发挥重要作用。
综上所述,本研究对半滑舌鳎pIgR基因进行了cDNA全长克隆、进化分析及表达模式的研究,尤其是对pIgR在黏膜免疫防御中的作用进行了深入分析,为进一步研究pIgR在免疫应答中的作用机制提供了理论基础。
Chen S, Zhang G, Shao C, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle. Nature Genetics, 2014, 46(3): 253-260 DOI:10.1038/ng.2890 |
Ding BJ, Sheng XZ, Tang XC, et al. Molecular cloning and expression analysis of the pIgR gene in Scophthalmus maximus. Journal of Fishery Sciences of China, 2013, 178(4): 792-801 [ 丁冰洁, 绳秀珍, 唐小千, 等. 大菱鲆多聚免疫球蛋白受体基因的克隆及表达分析. 中国水产科学, 2013, 178(4): 792-801] |
Feng LN, Lu DQ, Bei JX, et al. Molecular cloning and functional analysis of polymeric immunoglobulin receptor gene in orange-spotted grouper (Epinephelus coioides). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2009, 154(3): 282-289 DOI:10.1016/j.cbpb.2009.07.003 |
Hamuro K, Suetake H, Saha NR, et al. A teleost polymeric Ig receptor exhibiting two Ig-like domains transports tetrameric IgM into the skin. Journal of Immunology, 2007, 178(9): 5682-5689 DOI:10.4049/jimmunol.178.9.5682 |
Kaetzel CS. The polymeric immunoglobulin receptor: Bridging innate and adaptive immune responses at mucosal surfaces. Immunological Reviews, 2005, 206(1): 83-99 DOI:10.1111/imr.2005.206.issue-1 |
Kortum AN, Rodriguez-Nunez I, Yang J, et al. Differential expression and ligand binding indicate alternative functions for zebrafish polymeric immunoglobulin receptor (pIgR) and a family of pIgR-like (PIGRL) proteins. Immunogenetics, 2014, 66(4): 267-279 DOI:10.1007/s00251-014-0759-4 |
Phalipon A, Corthésy B. Novel functions of the polymeric Ig receptor: Well beyond transport of immunoglobulins. Trends in Immunology, 2003, 24(2): 55-58 DOI:10.1016/S1471-4906(02)00031-5 |
Piskurich JF, Blanchard MH, Youngman KR, et al. Molecular cloning of the mouse polymeric Ig receptor: Functional regions of the molecule are conserved among five mammalian species. Journal of Immunology, 1995, 154(4): 1735 |
Rombout JH, Sj VDT, Yang G, et al. Expression of the polymeric immunoglobulin receptor (pIgR) in mucosal tissues of common carp (Cyprinus carpio L.). Fish & Shellfish Immunology, 2008, 24(5): 620-628 |
Wang L, Zhang J, Kong X, et al. Molecular characterization of polymeric immunoglobulin receptor and expression response to Aeromonas hydrophila challenge in Carassius auratus. Fish & Shellfish Immunology, 2017, 70: 372-380 |
Wei M, Xu WT, Li HL, et al. Molecular characterization and expression analysis of a novel r-spondin member (rspo2l) in Chinese tongue sole (Cynoglossus semilaevis). Fish & Shellfish Immunology, 2017, 72: 436-442 |
Wieland WH, Orzáez D, Lammers A, et al. A functional polymeric immunoglobulin receptor in chicken (Gallus gallus) indicates ancient role of secretory IgA in mucosal immunity. Biochemical Journal, 2004, 380(3): 669-676 DOI:10.1042/bj20040200 |
Xing HF, Gao FT, Zhang YZ, et al. Molecular cloning, expression and SNP Screening of natural resistance- associated macrophage protein (Nramp) gene cDNA from half smooth tongue sole (Cynoglossus semilaevis). Progress in Fishery Science, 2016, 37(4): 116-127 [ 邢贺飞, 高峰涛, 张永珍, 等. 半滑舌鳎(Cynoglossus semilaevis) Nramp基因克隆与表达分析及SNP筛选. 渔业科学进展, 2016, 37(4): 116-127] |
Xu G, Zhan W, Ding B, et al. Molecular cloning and expression analysis of polymeric immunoglobulin receptor in flounder (Paralichthys olivaceus). Fish & Shellfish Immunology, 2013, 35(3): 653-660 |
Yu Y, Liu Y, Li H, et al. Polymeric immunoglobulin receptor in dojo loach (Misgurnus anguillicaudatus): Molecular characterization and expression analysis in response to bacterial and parasitic challenge. Fish & Shellfish Immunology, 2018, 73: 175-184 |
Zhang Y. Polymeric immunoglobulin receptor (pIgR) in grass carp (Ctenopharyngodon idellus): Gene cloning, expression analysis and binding activity with IgM. Doctoral Dissertation of Henan Normal University, 2016 [张毅.草鱼pIgR基因克隆表达及与IgM结合活性的研究.河南师范大学博士研究生学位论文, 2016] http://cdmd.cnki.com.cn/Article/CDMD-10476-1016201115.htm
|
Zhang YA, Salinas I, Li J, et al. IgT, a primitive immunoglobulin class specialized in mucosal immunity. Nature Immunology, 2010, 11(9): 827 DOI:10.1038/ni.1913 |



