2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
副溶血弧菌(Vibrio parahaemolyticus, VP)嗜盐畏酸,广泛存在于海洋环境及海产品中,可以感染多种动物,甚至危害人类健康(如食用受其污染的海产品可能会导致急性肠胃炎)(Bakeraustin et al, 2010; Bonninjusserand et al, 2017; Ham et al, 2012; Liu et al, 2017; 黄梦诗等, 2017)。无论是从科学研究角度还是从保障食品安全等生产与生活需求方面来讲,对影响该病原菌生长的环境因子作用机理进行研究都具有重要现实意义(Young et al, 2015)。截至目前,相关研究已经获得了初步的成果,如Johnson等(2010、2012)从生态学角度研究了美国近岸海域中VP与环境温度和盐度的关系,发现无论是水体、生物体还是沉积物中,其总量与这2个参数都呈正相关;Young等(2015)研究了海产品和渔业水域中VP受温度和盐度的影响,结果显示,在一定范围内温度的升高利于该病原菌的生长,而盐度的影响则不明确;然而,Johnson等(2010)的研究表明,水体中盐度和VP总量呈负相关;孙博怿等(2015)发现,pH、电导率、盐度较其他海域偏低的长江入海口水样中VP总量较多,但多元线性回归方程分析却表明盐度和温度与该菌含量呈正相关;Kaper等(1979)和Rehnstam-Holm等(2014)的研究皆表明,水体中VP总量与pH呈负相关。此外,由于海水中营养盐等其他理化因子也对该菌的生长、分布具有重要的影响,诸如氨氮(Blackwell et al, 2008)、浊度(Johnson et al, 2012)、生物需氧量(Johnson et al, 2010)等也得到了较多的研究(Johnson, 2015)。上述研究多基于单因子效应分析,数据间关联性较差,不能充分反映交互作用,很可能是结论不能统一的主要原因。因此,具有较高契合度的综合性分析预评估方法有待建立。
响应面方法(Response surface methodology, RSM)是数学和统计方法结合的产物,常被应用于寻找多参数系统中的最佳条件(Karami et al, 2016; Kumar et al, 2012; 韩建荣等, 2017; 蒋彪等, 2017; 陈晓彤等, 2017),该方法不仅可以同时对影响生物量的各因素和各因素的相互作用进行比较和优化,还可以快速确定出各因素的最优水平,减少实验次数,节约时间,目前已被广泛应用于微生物培养基优化中(韩建荣等, 2017; 蒋彪等, 2017)。本研究采用RSM研究温度、盐度、pH、磷酸盐、硝氮和氨氮对VP的生长影响,获得具有较好准确性的响应模型,并探讨、评估了这6种理化因子的综合作用结果。
1 材料与方法 1.1 生物、化学材料与主要设备实验所用副溶血弧菌(ACTT17802)为本实验室保存。胰蛋白胨大豆肉汤(TSB)为青岛高科海博生物技术有限公司产品。NaNO3、NH4Cl、Na3PO4、NaCl和其他化学试剂皆为分析纯,其中,NaNO3和NH4Cl为上海强顺化工有限公司产品,余者皆购自于国药集团化学试剂有限公司。细菌培养采用上海知楚仪器公司生产的ZQZY-BG型振荡培养箱。细菌培养液光密度(OD600 nm)值采用TU-1901/TU-1901型紫外可见光分光光度计(北京普析通用仪器有限公司)测定。溶液酸碱度采用上海精科仪器有限公司生产的PHS-3C型pH计完成。接种实验在10000级洁净无菌室内完成。
1.2 实验方法所有培养基都选用TSB。将本实验室于–80℃冰箱中保藏的菌种接种到斜面培养基上,30℃培养24 h以活化菌种。将活化好的菌种接种到TSB液体培养基中,同时做3组平行,置于恒温培养箱中30℃培养12 h,每隔1 h取样1次, 600 nm下测定培养液吸光度(OD600 nm值)。
温度、盐度和pH对VP生长的影响实验参照刘代新等(2008),简言之:以向TSB培养液中添加NaCl的百分含量作为盐度,配制1%~10%共10个梯度;温度实验为10℃、20℃、25℃、30℃、35℃、37℃、43℃共7个梯度;采用1 mol/L的HCl和NaOH调节TSB培养液酸碱度,配制pH 5.00、6.00、7.00、7.50、8.00、8.50、9.00和10.00共8个梯度。向上述各液体培养基中各接菌1环,分别培养并测定OD值。分析结果,确定适合VP生长的最佳单因素条件范围,并依据RSM中的Box Behnken中心组合原则,采用Design-Expert软件进行分析。然后选用分析所得的最佳生长复合参数培养VP, 并测定培养18 h后培养液的OD600 nm值(n=3)以证实该方法的可靠性。
磷酸盐、硝酸盐和氨盐对VP的生长影响实验如下:在上述优化参数基础上,分别以Na3PO4、NaNO3和NH4Cl作为磷酸盐、硝氮和氨氮的代表种类,分别配制含有0.2%~1%共9个梯度的TSB培养液。然后按照上述方法培养8 h后测定VP的生长情况。为了保证合适的盐度,如非特殊说明,实验所用的培养液含3% NaCl。
1.3 数据处理RSM是通过一系列确定性实验,用多项式函数来近似隐式极限状态函数。通过合理地选取试验点和迭代策略,来保证多项式函数能够在失效概率上收敛于真实的隐式极限状态函数的失效概率。实验采用Design expert 8.0软件进行数据处理,对温度、盐度等环境理化因子与VP生长响应值进行二次方程回归拟合,建立数学模型,用决定系数和回归方程的校正系数来判断数学模型的拟合程度,多变量方差分析决定方程的意义(Karami et al, 2016)。优化得到的实验条件重复3次,以验证模型的准确性。
2 结果与分析 2.1 温度、盐度和pH对VP生长的单因子影响如图 1A所示,环境温度为10℃时,VP基本上没有增殖;在20℃~35℃范围内,随着温度的增加,8 h后VP培养液的OD值持续增加,最高值可达约1.5;而超过35℃时,OD值则明显下降,说明35℃左右的环境温度最有利于VP的生长。由图 1B可见,在1%~3%范围内,随着盐度的增加,8 h后VP培养液的OD值持续增加,最高值可达1.8;盐度高于3%情况下,8 h后VP培养液的OD值随之增加而降低;盐度为10%时,VP则几乎不能生长。同样,由图 1C可知,在pH5.0~8.0范围内,其值的增加有利于VP的生长,而超过pH8.0后,酸碱度值与OD值呈负相关。这些结果和前人的报道(Beuchat et al, 1973; 刘代新等, 2008)吻合良好。
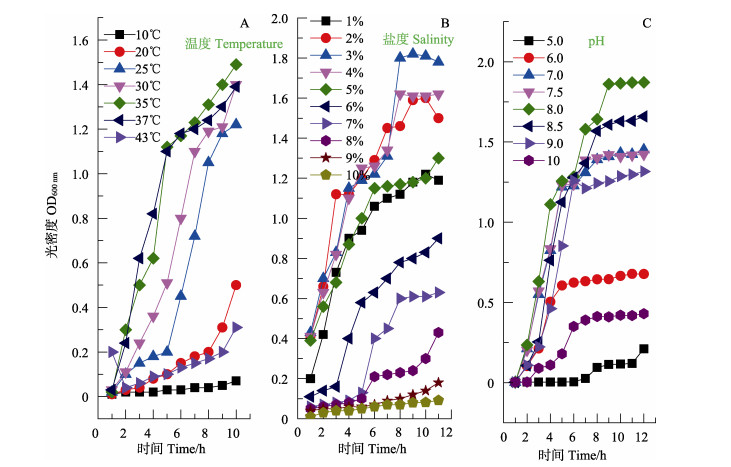
|
图 1 温度(A)、盐度(B)和pH(C)对VP生长的影响 Fig.1 Effects of the temperature (A), salinity (B) and pH (C) on the growth of VP |
根据单因子影响结果,我们选择合适的参数范围进行三因素三水平RSM设计与实验,其方案与结果见表 1。利用Design expert 8.0统计软件对实验数据进行多元回归拟合,得到VP培养8 h后的OD600 nm值与x(温度)、x1(盐度)、x2(pH)之间的二元多项回归方程为:
| $ \begin{array}{l} {\rm{O}}{{\rm{D}}_{600}} = - 33.01 + 6.88{x_2} + 0.32x + 1.40{x_1} - 0.011x{x_2} - \\ 0.07{x_1}{x_2} + 6.42E - 0.03x{x_1} - 0.40{x_2}^2 - 3.61E - 003{x^2} - 0.16{x_1}^2 \end{array} $ |
|
|
表 1 温度、盐度、pH响应面分析方案与实验结果 Tab.1 Experimental results and RSM scheme of temperature, salinity and pH |
对该模型进行方差分析见表 2。表 2结果显示出,基于OD值所建立的回归模型是显著的(P<0.01),但是失拟检测结果也十分显著(P=0.0014<0.01),所以这个方程由于失拟检测很小,表明拟合方程可能会无效。但是实验中的纯误差均方较小(MS=0.005),决定系数R2=0.9649,校正系数R=0.9198,所以综合考虑所有因素在内,拟合方程满足有效要求。
|
|
表 2 温度、盐度和pH对VP生长情况的回归模型方差分析 Tab.2 Analysis of variance for effects of temperature, salinity and pH on the growth of VP |
表 3为回归模型系数显著性检验结果。由表 3可以看出,pH的一次效应对VP的生长影响达到显著水平(P < 0.05),但温度和盐度的一次效应对其生长影响不显著(P > 0.05);温度和盐度的二次效应对VP的生长影响达到显著水平(P < 0.01);但温度、盐度和pH三者之间的交互作用对特定生长率的影响都不显著(P > 0.05)。
|
|
表 3 温度、盐度和pH回归方程系数显著性检测 Tab.3 The significance test for coefficients of established regression equation for temperature, salinity and pH |
利用Design-Expert软件对表 1的数据进行二次多元回归拟合, 所得到的二次回归方程的响应面及其等高线见图 2。等高线的形状反映交互效应的强弱大小, 圆形表示2个因素交互作用不显著, 椭圆形表示2个因素交互作用显著(Karami et al, 2016; 刘代新等, 2008)。由图 2可见,温度和盐度对OD值的影响都是随着数值的增大先升高后降低,所以可以找到一个极值点;等高线图接近椭圆形,表明温度、盐度交互作用对VP的生长影响显著。利用Design-Expert软件对代表培养液中菌体浓度的OD值的二次多项式数学模型解逆矩阵,得知pH为8.00时,温度和盐度的最优实验条件分别为:34.5℃和3%。
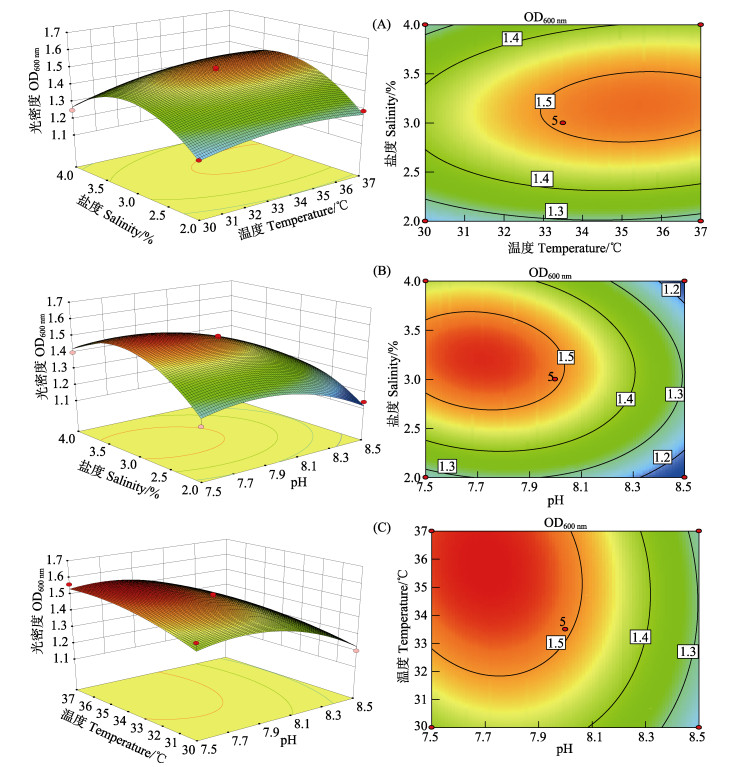
|
图 2 温度和盐度(A)、pH和盐度(B)、pH和温度(C)交互作用对VP生长影响的响应曲面和等高线 Fig.2 Response surface plots and contour plots of the temperature & salinity (A), pH & salinity (B) and pH & temperature (C) and their mutual interactions on the growth of VP |
选用最优的温度、盐度和pH参数,实验继续探讨了磷酸盐、硝酸盐和氨盐对VP生长的单因子影响。如图 3A所示,当浓度超过0.2%后,培养液中Na3PO4与OD值呈明显的负相关,当其值≥0.6%时几乎彻底抑制了VP的生长。图 3B显示在加入0.2%~0.4% NaNO3时,OD值随培养时间的增加快速增大(12 h范围内),但是加入浓度在0.6%~1%范围内时,OD值增长则明显减慢,因而呈明显的负相关。由图 3C可知,类似于NaNO3对VP生长的影响,在0.2%~1%范围内,培养液中NH4Cl浓度的增加与OD值增速也呈明显的负相关,虽然其值为1%时还不至于彻底抑制VP的生长。比较而言,同浓度的Na3PO4抑制作用明显强于硝酸盐和氨盐;NaNO3和NH4Cl的抑制作用则没有明显差别。
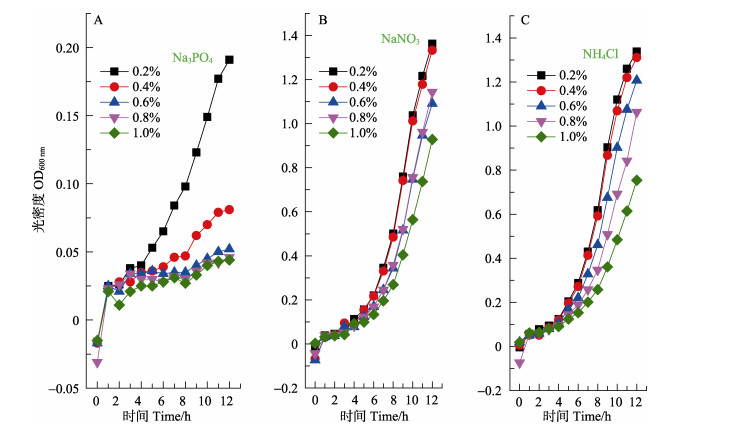
|
图 3 Na3PO4(A)、NaNO3(B)和NH4Cl(C)对VP生长的影响 Fig.3 Effects of the Na3PO4 (A), NaNO3 (B) and NH4Cl (C) on the growth of VP |
根据单因子影响结果,我们选择合适的参数范围进行三因素三水平RSM设计与实验,其方案与结果见表 4。利用Design expert 8.0统计软件对实验数据进行多元回归拟合,得到以x3(Na3PO4)、x4(NaNO3)、x5(NH4Cl)为自变量,以VP培养8 h后的OD600 nm值为因变量的二元多项回归方程为:
| $ \begin{array}{l} {\rm{O}}{{\rm{D}}_{600{\rm{ nm}}}} = 1.26 - 2.01 - 003 \times 7.85{x_4} - 0.03 \times {x_4} - 0.09{x_3} - 1.96 - \\ 0.04{x_4}{x_5} + 2.32 - 0.04{x_4}{x_3} + 3.075 - 0.04{x_3}{x_5} - 1.47 - 0.04 \times \\ {x_4}^2 - 1.12 - 005 \times {x_5}^2 + 2.42 - 0.03 \times {x_1}^2 \end{array} $ |
|
|
表 4 Na3PO4、NaNO3和NH4Cl响应面分析方案与实验结果 Tab.4 Experimental results and RSM scheme of Na3PO4, NaNO3 and NH4Cl |
对实验数据进行多元回归拟合,表 5为Na3PO4、NaNO3和NH4Cl对VP生长影响的回归模拟分析表。从表 5可知,模型非常显著(P < 0.01)。失拟误差不显著(P > 0.01),并且回归方程的决定系数R2=0.9217,校正系数R2=0.8211,这些结果说明回归模型能解释92.17% OD600 nm响应值的变化。回归模型F=9.16,P=0.004<0.01,说明Na3PO4、NaNO3和NH4Cl对VP生长的影响的模型是有效的。因此可以用上诉的回归模型来分析和预测磷酸盐、硝氮和氨氮对该菌生长的影响。
|
|
表 5 Na3PO4、NaNO3和NH4Cl对副溶血弧菌生长情况的回归模型方差分析 Tab.5 Analysis of variance for effects of Na3PO4, NaNO3 and NH4Cl on the growth of VP |
对其回归模型方差分析进行显著性检验(表 6),一次方程中Na3PO4、NaNO3和NH4Cl对VP生长的影响具有良好的线性(P < 0.01),三者之间进行正交的相互效应结果对该菌生长的影响不显著(P > 0.05),只有Na3PO4的二次方程显著(P < 0.05)。
|
|
表 6 Na3PO4、NaNO3和NH4Cl回归方程系数显著性检测 Tab.6 The significance test for coefficients of established regression equation for Na3PO4, NaNO3 and NH4Cl |
利用Design-Expert软件对表 4的数据进行二次多元回归拟合, 所得到的二次回归方程的响应面及其等高线见图 4。由图 4可知,代表VP数量的OD600 nm值随着Na3PO4、NaNO3和NH4Cl中任意一种物质浓度的增加而明显降低,意味着磷酸盐、硝氮和氨氮对该菌生长都具有显著影响;等高线近似椭圆形说明磷酸盐、硝氮和氨氮对VP的生长影响都无明显的交作效应(P > 0.05)。
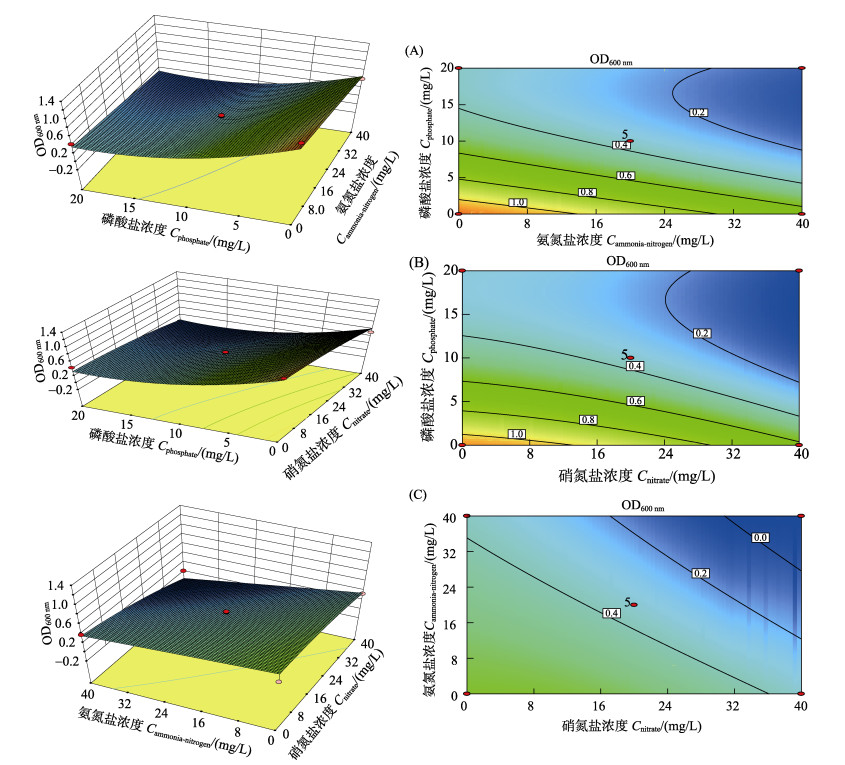
|
图 4 Na3PO4和NH4Cl(A)、Na3PO4和NaNO3(B)、NaNO3和NH4Cl(C)交互作用对VP生长影响的响应曲面和等高线 Fig.4 Response surface plots and contour plots of Na3PO4 & NH4Cl (A), Na3PO4 & NaNO3 (B) and NaNO3 & NH4Cl (C) and their mutual interactions on the growth of VP |
温度、盐度、pH及营养盐等多种理化因子对VP的生长都具有不同程度的影响,对其进行系统探讨有助于人们深入了解生态系统发展与演变规律。其中,温度、盐度和pH三种因子的作用自20世纪70年代就得到了科学界的重视(Beuchat et al, 1973; Young et al, 2015)。采用单因子分析,Beuchat等(1973)研究了温度、盐度和pH对VP生存与存活规律的影响;Randa等(2004)研究了温度和盐度对弧菌种群动力学的影响。而本实验不但分析了这3种因子的单因素作用效果,还采用RSM建立了多因素复合作用下VP的生长模型,获得了该菌的最佳培养参数,其值与前人报道吻合良好。此外,二次回归模型决定系数R2=0.9649,校正系数R2=0.9198,再次说明本实验所建RSM分析的可靠性。较之于历史上的其他研究方法,RSM最大的优点是实验次数少、灵活、方便,可以全面考虑各因素间的交互作用,并把待分析因子的实验结果函数化,从而快速得到研究对象(们)与响应值之间的关系(韩建荣等, 2017)。因此,新方法有助于人们更便捷地理解和预测环境因子变化对VP生态动力学带来的影响。
营养盐,如磷酸盐、硝氮和氨氮对VP的生长代谢也具有显著的影响(Bjk et al, 2017; Criminger et al, 2007; Oliver et al, 1983)。由于PO43+能螯合二价金属阳离子,且降低细胞壁的稳定性以及许多细胞的热稳定性,因而抑制细菌的生长(Mccarter et al, 1987 ; 尹守亮等, 2015)。氨氮参与生物体内氧化还原循环,影响细胞壁上蛋白的运转(梁艳等, 2011)。目前对其毒性的研究主要集中在鱼虾类神经元去极化(Hermenegildo et al, 2000 )及导致机体酶失活(Ching et al, 2009 ; 尹守亮等, 2015)等方面。虽然高氨氮水域中细菌的种群较少(Zhang et al, 2014),但其对细菌的具体毒理作用目前鲜有报道。目前硝氮对VP的生长也尚末得到详细的研究。本实验中,在单因素实验基础上利用RSM针对培养基中的营养盐-VP生长进行分析,建立了Na3PO4、NaNO3和NH4Cl含量变化对OD600 nm值的二次回归方程模型。通过回归模型方差分析得知,磷酸盐、硝氮和氨氮对VP生长影响都很显著(负相关)。这个结论很好地从侧面印证了前人的报道(Bjk et al, 2017;Mccarter et al, 1987 )。通过响应曲面和等高线图的直观分析可知,磷酸盐、硝氮和氨氮之间的交互作用影响不明显。
Bakeraustin C, Stockley L, Rangdale R, et al. Environmental occurrence and clinical impact of Vibrio vulnificus and Vibrio parahaemolyticus: A European perspective. Environmental Microbiology Reports, 2010, 2(1): 7-18 DOI:10.1111/j.1758-2229.2009.00096.x |
Beuchat LR. Interacting effects of pH, temperature, and salt concentration on growth and survival of Vibrio parahaemolyticus. Applied Microbiology, 1973, 25(5): 844 |
Bjk D, Jacobs JM, Davis MF, et al. Environmental determinants of Vibrio parahaemolyticus in the Chesapeake Bay. Applied & Environmental Microbiology,, 2017, 83(21): e01147-17 |
Blackwell KD, Oliver JD. The ecology of Vibrio vulnificus, Vibrio cholerae, and Vibrio parahaemolyticus in North Carolina estuaries. Journal of Microbiology, 2008, 46(2): 146-153 DOI:10.1007/s12275-007-0216-2 |
Bonninjusserand M, Copin S, Le CB, et al. Vibrio species involved in seafood-borne outbreaks (Vibrio cholerae, V. parahaemolyticus and V. vulnificus): Review of microbiological versus recent molecular detection methods in seafood products. Critical Reviews in Food Science and Nutrition, 2018, in press, DOI: 10.1080/10408398.2017.1384715
|
Chen XT, Huang LP, Sun M, et al. Optimization of conversion process of α-cyclodextrin with enzyme using response surface methodology. Progress in Fishery Sciences, 2017, 38(5): 143-151 [ 陈晓彤, 黄立萍, 孙谧, 等. 响应面分析法优化α-环糊精的酶转化工艺. 渔业科学进展, 2017, 38(5): 143-151] |
Ching B, Chew SF, Wong WP, et al. Environmental ammonia exposure induces oxidative stress in gills and brain of Boleophthalmus boddarti (mudskipper). Aquatic Toxicology, 2009, 95(3): 203-212 DOI:10.1016/j.aquatox.2009.09.004 |
Criminger JD, Hazen TH, Sobecky PA, et al. Nitrogen fixation by Vibrio parahaemolyticus and its implications for a new ecological niche. Applied & Environmental Microbiology, 2007, 73(18): 5959-5961 |
Ham H, Orth K. The role of typeⅢsecretion System 2 in Vibrio parahaemolyticus pathogenicity. Journal of Microbiology, 2012, 50(5): 719 DOI:10.1007/s12275-012-2550-2 |
Hermenegildo C, Monfort P, Felipo V. Activation of N-methyl-D- aspartate receptors in rat brain in vivo following acute ammonia intoxication: Characterization by in vivo brain microdialysis. Hepatology, 2000, 31(3): 709 DOI:10.1002/(ISSN)1527-3350 |
Han JR, Zhang FH. Optimization of submerged fermentation medium for agaricus bisporus by rseponsesurface methodology. Journal of ShanxiUniversity(Natural Science Edition), 2017, 40(3): 602-608 [ 韩建荣, 翟飞红. 响应面法优化双孢蘑菇液态发酵培养基. 山西大学学报(自然科学版), 2017, 40(3): 602-608] |
Huang MS, Yang QQ, Zhang Y, et al. Rapid detection method of Vibrio parahaemolyticus in seawater based on visual LAMP. Chinese Fishery Quality and Standards, 2017, 7(6): 58-65 [ 黄梦诗, 杨倩倩, 张艳, 等. 海水中副溶血弧菌的可视化LAMP快速检测方法. 中国渔业质量与标准, 2017, 7(6): 58-65 DOI:10.3969/j.issn.2095-1833.2017.06.009] |
Jiang B, Wang CG, Du X, et al. Optimization of fermentation medium for keratinase production from Bacillus sp. CJPE209 using reponse surfsce methodology. China Brewing, 2017, 36(5): 76-80 [ 蒋彪, 王常高, 杜馨, 等. 响应面法优化芽孢杆菌CJPE209产角蛋白酶发酵培养基的研究. 中国酿造, 2017, 36(5): 76-80] |
Johnson CN. Influence of environmental factors on Vibrio spp. in coastal ecosystems. Microbiology Spectrum, 2015, 3(3): 2008-2014 |
Johnson CN, Bowers JC, Griffitt KJ, et al. Ecology of Vibrio parahaemolyticus and Vibrio vulnificus in the coastal and estuarine waters of louisiana, Maryland, Mississippi, and Washington (United States). Applied & Environmental Microbiology, 2012, 78(20): 7249-7257 |
Johnson CN, Flowers AR, Iii NFN, et al. Relationships between environmental factors and pathogenic Vibrios in the Northern Gulf of Mexico. Applied & Environmental Microbiology, 2010, 76(21): 7076-7084 |
Kaper J, Lockman H, Colwell RR, et al. Ecology, serology, and enterotoxin production of Vibrio cholerae in Chesapeake Bay. Applied & Environmental Microbiology, 1979, 37(1): 91 |
Karami HR, Keyhani M, Mowla D. Experimental analysis of drag reduction in the pipelines with response surface methodology. Journal of Petroleum Science & Engineering, 2016, 138(2): 104-112 |
Kumar M, Jain AK, Ghosh M, et al. Statistical optimization of physical parameters for enhanced bacteriocin production by L. casei. Biotechnology & Bioprocess Engineering, 2012, 17(3): 606-616 |
Liu N, Zou D, Dong D, et al. Development of a multiplex loop-mediated isothermal amplification method for the simultaneous detection of Salmonellaspp. and Vibrio parahaemolyticus. Scientific Reports, 2017, 7: 45601 DOI:10.1038/srep45601 |
Liu DW, Ning XB, Zhang JL. Optimization of growth condition of Vibrio parahaemolyticus via response surface methodology. Microbiology China, 2008, 35(2): 306-310 [ 刘代新, 宁喜斌, 张继伦. 响应面分析法优化副溶血性弧菌生长条件. 微生物学通报, 2008, 35(2): 306-310 DOI:10.3969/j.issn.0253-2654.2008.02.029] |
Liang Y, Lu GH, Qi PD, et al. Influence of nutrients on absorption and ecotoxicological effects of contaminants in aquatic ecosystem: A review of recent researches. Journal of Environment and Health, 2011, 28(2): 181-184 [ 梁艳, 陆光华, 齐鹏德, 等. 水体中营养盐对污染物生物吸收及生物毒性的影响. 环境与健康杂志, 2011, 28(2): 181-184] |
Mccarter LL, Silverman M. Phosphate regulation of gene expression in Vibrio parahaemolyticus. Journal of Bacteriology, 1987, 169(8): 34-41 |
Oliver JD, Warner RA, Cleland DR. Distribution of Vibrio vulnificus and other lactose-fermenting vibrios in the marine environment. Applied & Environmental Microbiology, 1983, 45(3): 985-998 |
Randa MA, Polz MF, Lim E. Effects of temperature and salinity on Vibrio vulnificus population dynamics as assessed by quantitative PCR. Applied & Environmental Microbiology, 2004, 70(9): 5469-5476 |
Rehnstam-Holm AS, Atnur V, Godhe A. Defining the niche of Vibrio parahaemolyticus during pre- and post-monsoon seasons in the Coastal Arabian Sea. Microbial Ecology, 2014, 67(1): 57-65 DOI:10.1007/s00248-013-0311-3 |
Sun BY, Yang DD, Chen LM. A multivariate reciprocity analysis of Vibrio parahaemolyticus in the inshore waters along China East Coast. Journal of Microbiology, 2015, 11061106(2): 109-112 [ 孙博怿, 杨丹丹, 陈兰明. 我国东部海域近岸水体中副溶血性弧菌的多元相关性分析. 微生物学杂志, 2015, 11061106(2): 109-112 DOI:10.3969/j.issn.1005-7021.2015.02.020] |
Young I, Gropp K, Fazil A, et al. Knowledge synthesis to support risk assessment of climate change impacts on food and water safety: A case study of the effects of water temperature and salinity on Vibrio parahaemolyticus in raw oysters and harvest waters. Food Research International, 2015, 68: 86-93 DOI:10.1016/j.foodres.2014.06.035 |
Yin SL, Zhang YX, Zhang Q, et al. The Effect of inorganic phosphate on the biosynthesis of secondary metabolites in streptomyces. China Biotechnology, 2015, 35(9): 105-113 [ 尹守亮, 张玉秀, 张琪, 等. 无机磷酸盐对链霉菌合成次级代谢产物的影响. 中国生物工程杂志, 2015, 35(9): 105-113] |
Zhang C, Yuan Q, Lu Y. Inhibitory effects of ammonia on methanogen mcrA transcripts in anaerobic digester sludge. FEMS Microbiology Ecology, 2014, 87(2): 368-377 DOI:10.1111/1574-6941.12229 |



