虾壳是凡纳滨对虾(Litopenaeus vannamei)加工过程中的副产物,大部分虾壳被填埋处理,造成了资源的浪费。凡纳滨对虾虾壳可作为生产壳聚糖的原料(Al Sagheer et al, 2009)。目前,工业中以虾壳为原料采用HCl和NaOH制备壳聚糖,生产过程产生的废水中含有高浓度的Cl–和Na+,回收价值低,造成资源浪费和环境污染。随着科学技术的发展和生态文明建设的要求,人们对减少环境污染的需求越来越高,因此,壳聚糖的清洁化生产及虾壳的高值化利用成为亟待解决的问题。
壳寡糖(Chitooligosaccharides)是壳聚糖降解后的产物,具有促进种子萌发、幼苗生长和提高植物抗病性等功能(袁建平等, 2011; 张洪艳等, 2011)。壳寡糖的生物活性与脱乙酰度和分子量密切相关(Das et al, 2015)。目前,关于壳寡糖分子量对生物活性的影响已经进行了大量的研究(扈学文等, 2007),然而,壳寡糖脱乙酰度与其生物活性之间的关系却鲜有报道。
本文以凡纳滨对虾虾壳为原料,研究了不同脱乙酰度壳寡糖的绿色生产工艺,并探究了壳寡糖脱乙酰度对烟草花叶病毒(Tobacco mosaic virus, TMV)的影响,期望为实现凡纳滨对虾虾壳资源的高值化绿色应用提供科学依据。
1 材料与方法 1.1 实验材料实验原料:凡纳滨对虾虾壳。供试植物:烤烟MSK326品种,由国家农作物种质资源平台烟草种质资源子平台(National Infrastructure for Crop Germplasm Resources (Tobacco, Qingdao))提供,其保存单位为中国海洋大学食品科学与工程学院。供试毒源:烟草花叶病毒(TMV),由中国农业科学院烟草研究所提供。
1.2 实验方法 1.2.1 甲壳素的制备预处理:将凡纳滨对虾虾壳洗净、烘干和粉碎后,过100目网筛。
脱盐:称取一定量虾壳,按物料比1:6,加入3% H3PO4,室温搅拌30 min,沉淀用水洗至中性,烘干,测定样品中灰分含量,计算脱盐率。
脱蛋白:脱盐后的产物按物料比1:6,加入3% KOH,70℃搅拌30 min,沉淀用水洗至中性,烘干,测定上清液中蛋白质含量,计算脱蛋白率。
1.2.2 不同脱乙酰度壳聚糖和壳寡糖的制备不同脱乙酰度壳聚糖的制备:称取一定质量的甲壳素,置于聚四氟乙烯坩埚中,按物料比1:15,加入45% KOH溶液,微波功率为600 W,分别反应6、7、8和8.5 min,反应结束后,沉淀水洗至中性,溶于2% HAC,4800 r/min离心15 min,将上清液pH调至中性,析出的沉淀即为壳聚糖。烘干后,采用双突跃电位法测定壳聚糖脱乙酰度(贾之慎等, 2001)。
壳寡糖的制备:壳聚糖浓度2%,加入1% H2O2,170 r/min水浴摇床中50℃反应6 h,反应结束后,用1 mol/L KOH调节反应液pH至中性,于4800 r/min离心15 min,上清液旋蒸浓缩、冻干。采用高效液相色谱法测定壳寡糖分子量,色谱柱:TSK-Gel G4000 PWXL,柱温为25℃,流速为0.4 ml/min; 流动相:0.1 mol/L NaNO3+0.01 mol/L NaH2PO4缓冲溶液(pH=7.0);进样体积为20 μl。
1.2.3 脱盐率和脱蛋白率的计算脱盐率计算公式如下:
| $ 脱盐率\left(\% \right) = \frac{{({\mathit{A}_\mathit{O}} \times \mathit{O}) - \left({{\mathit{A}_\mathit{P}} \times \mathit{P}} \right)}}{{{\mathit{A}_\mathit{O}} \times \mathit{O}}} \times 100\ $ |
式中,AO为原始样品中的灰分含量(g/g),AP为脱盐处理后样品中的灰分含量(g/g),O和P分别为原始样品和磷酸处理后样品的干重(g)。
脱蛋白率计算公式如下:
| $ 脱蛋白率\left(\% \right) = \frac{{{P_S}}}{{{P_R}}} \times 100\ $ |
式中,PR为原始样品中的蛋白质含量(g),PS为脱蛋白处理后上清液中的蛋白质含量(g)。
1.2.4 不同脱乙酰度壳寡糖抗TMV效果分析 1.2.4.1 壳寡糖对TMV体外钝化的作用将带有TMV的烟草叶片中按1:40加入磷酸盐缓冲溶液(pH=7.2)进行研磨,10000 r/min离心5 min后,取上清液与浓度为100 μg/ml不同脱乙酰度壳寡糖溶液(COS1、COS2、COS3和COS4)按1:1进行混合,置于25℃水浴中反应30 min,接种于MSK326烟草叶片上,每株接种3片,重复3次,待植株呈病症后,取病叶进行Evans blue染色(刘楠等, 2011; Singh et al, 2014),观察病斑情况。
1.2.4.2 壳寡糖对病毒复制作用的影响选用长势均一、3~4片真叶期的普通烟苗供试。采用叶圆片法测定壳寡糖对病毒在寄主内复制作用的影响(申莉莉等, 2007),将TMV接种于健康烟草MSK326上6 h后,取直径为12 mm的圆片叶,分别在蒸馏水和浓度为50 μg/ml不同脱乙酰度壳寡糖溶液(COS1、COS2、COS3和COS4)中进行漂浮处理48 h,再将圆片洗净、研磨,10000 r/min离心5 min,然后接种于MSK326烟草叶片上,每株接种3片,重复3次,待植株呈病症后,取病叶进行Evans blue染色,观察病斑情况。
1.2.4.3 壳寡糖对烟草防御酶的影响选用3~4片真叶期、长势均一的普通健康烟苗,用50 μg/ml不同脱乙酰度壳寡糖溶液(COS1、COS2、COS3和COS4)和蒸馏水(CT)叶面喷雾诱导供试烟苗的下部第2片真叶,每组重复3次,壳寡糖诱导24 h后,采收处理叶的上位叶,装入自封袋中,–80℃冰箱中保存。参照文献中的方法测定过氧化氢酶(CAT)(张志良, 2003)、过氧化物酶(POD)(高俊凤, 2000)、多酚氧化酶(PPO)(谭兴杰等, 1984)和苯丙氨酸解氨酶(PAL)(薛应龙, 1985)的活性。在处理叶的上位叶片,采用常规汁液摩擦接种法接种TMV,观察烟草植株的病症表现。
1.3 数据统计与分析采用Microsoft Excel 2010和SPSS软件进行数据统计与分析,组间差异的判定选用t-检验方法,P < 0.05表示有显著性差异,P < 0.01表示差异极显著。
2 结果 2.1 不同脱乙酰壳寡糖的制备以凡纳滨对虾虾壳为原料,采用H3PO4和KOH制备甲壳素,测得其脱盐率和脱蛋白率分别为(94.04±0.52)%和(85.65±1.06)%,达到工业级甲壳素的标准。甲壳素与45% KOH混合后,于微波功率600 W条件下,反应6、7、8和8.5 min后,制得脱乙酰度分别为63.79%、72.12%、79.34%和88.15%的壳聚糖,对其氧化降解后,通过高效液相色谱法测得壳寡糖分子量分别为1502、1515、1523和1509 Da。因此,COS1、COS2、COS3和COS4分别为脱乙酰度63.79%、72.12%、79.34%和88.15%,分子量为1500 Da左右的壳寡糖。
2.2 普通烟草抗病性表现用不同脱乙酰度的壳寡糖喷施烟草叶片后接种TMV,观察普通烟的症状。结果显示,空白组(蒸馏水诱导)植株在接种5 d时出现轻花叶,接种9 d后出现重花叶,并且植株矮小,叶片狭窄,生长缓慢。不同脱乙酰度壳寡糖诱导后的植株病症表现不同,COS1诱导后病症出现时间和程度与空白组没有明显区别;COS2、COS3和COS4诱导后植株在接种7 d时出现轻花叶,接种13 d后出现重花叶,其中,COS3和COS4诱导后的植株患病程度最轻,说明这2种脱乙酰度的壳寡糖诱导烟草产生抗病性的效果最好。
2.3 不同脱乙酰度壳寡糖对TMV体外钝化的作用不同脱乙酰度的壳寡糖对TMV进行体外处理接种MSK326烟草后Evans blue染色结果如图 1所示,TMV经壳寡糖处理后病叶中蓝色染色区域较空白处理组小,随着壳寡糖脱乙酰度的升高,病叶中蓝色染色区域随之减少,说明经壳寡糖处理能减轻烟草感染TMV的程度,并且不同脱乙酰度的壳寡糖对TMV的体外钝化程度不同,COS4对TMV的体外钝化作用最好。
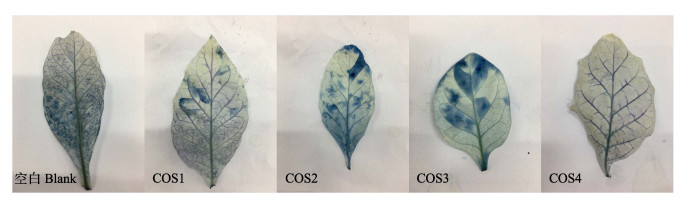
|
图 1 不同脱乙酰度壳寡糖对TMV体外钝化的作用 Fig.1 The effects on inactivating TMV in vitro by induction of chitooligosaccharides with different DDAs 空白为蒸馏水处理后的叶片 The blank refers to the leave treated with distilled water |
不同脱乙酰度壳寡糖对TMV复制的作用结果如图 2所示,COS1和COS2处理后的烟草叶与空白组病叶中蓝色染色区域没有显著差异,说明COS1和COS2对TMV在寄主内的复制没有影响;而当COS3和COS4处理后病叶中蓝色染色区域较空白组小,说明COS3和COS4能抑制TMV在寄主内的复制作用。

|
图 2 不同脱乙酰度壳寡糖对TMV复制作用的影响 Fig.2 The effects on multiplication of TMV by induction of chitooligosaccharides with different DDAs 空白为蒸馏水处理后的叶片 The blank refers to the leave treated with distilled water |
不同脱乙酰度壳寡糖对烟草诱导24 h后烟草叶片中过氧化氢酶活性结果如图 3所示。COS1诱导烟草后,烟草叶片中过氧化氢酶活性低于空白对照组(蒸馏水处理);COS2诱导后,叶片中过氧化氢酶活性略高于空白对照组,但二者之间没有显著性差异。当壳寡糖脱乙酰度大于72.12%时,诱导烟草后过氧化氢酶活性均高于空白对照组,并且COS3诱导烟草后过氧化氢酶活性最高。以上结果表明,COS3和COS4诱导烟草后能提高过氧化氢酶活性,而COS3诱导后过氧化氢酶活性最高(P < 0.01)。
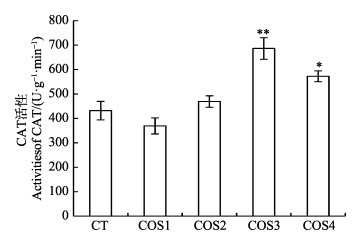
|
图 3 不同脱乙酰度壳寡糖诱导对烟草叶片中过氧化氢酶活性的影响 Fig.3 The effects on activity of CAT in tabacco leaves by induction of chitooligosaccharides with different DDAs *为差异显著(P < 0.05);**为差异极显著(P < 0.01);下同 * indicates significant difference (P < 0.05); ** indicates highly significant difference (P < 0.01). The same as below |
由图 4可以看出,COS3和COS4诱导烟草后,烟草叶片中过氧化物酶活性均高于其他处理组,COS4处理烟草后过氧化物酶活性最高。COS1诱导烟草后,过氧化物酶活性低于空白处理组,而COS2处理组的过氧化物酶活性与空白处理组没有显著性差异。以上结果表明,COS3和COS4诱导烟草能显著提高叶片中过氧化物酶的活性(P < 0.05)。
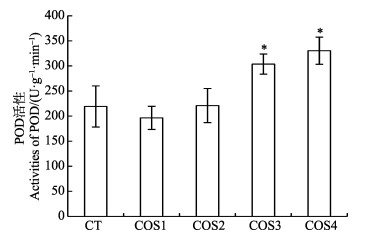
|
图 4 不同脱乙酰度壳寡糖诱导对烟草叶片中过氧化物酶活性的影响 Fig.4 The effects on activity of POD in tabacco leaves by induction of chitooligosaccharides with different DDAs |
由图 5可知,COS1和COS2处理组中多酚氧化酶的活性均低于空白对照组,而COS3和COS4处理组的多酚氧化酶活性均高于空白对照组,并且COS4诱导烟草后叶片中的多酚氧化酶活性显著高于空白对照组。以上结果表明,COS4诱导烟草能显著提高叶片中多酚氧化酶的活性(P < 0.01)。
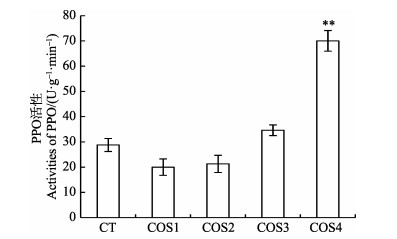
|
图 5 不同脱乙酰度壳寡糖诱导对烟草叶片中多酚氧化酶活性的影响 Fig.5 The effects on activity of PPO in tabacco leaves by induction of chitooligosaccharides with different DDAs |
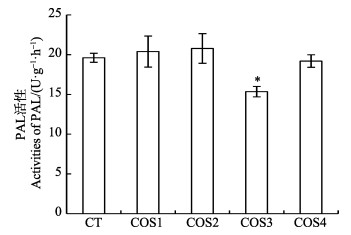
从图 6可以看出,不同脱乙酰度壳寡糖诱导烟草后,COS1和COS2处理组中苯丙氨酸解氨酶活性虽略高于空白对照组,但与空白对照组之间没有显著性差异。而COS3和COS4处理组中苯丙氨酸解氨酶的活性均低于空白对照组,这说明壳寡糖脱乙酰度与苯丙氨酸解氨酶活性可能不存在相关性。
|
图 6 不同脱乙酰度壳寡糖诱导对烟草叶片中苯丙氨酸解氨酶活性的影响 Fig.6 The effects on activity of PAL in tabacco leaves by induction of chitooligosaccharides with different DDAs |
凡纳滨对虾是目前世界养殖产量最高的三大虾种之一(李晓丽等, 2017)。虾壳中的甲壳素与蛋白质交错形成网状结构,在交错的网络中还含有以钙盐为主的矿物盐沉淀(Saito et al, 2000)。蛋白质和钙盐的存在会降低甲壳素的生物活性,需要通过脱盐和脱蛋白途径制得纯度较高的甲壳素。已有研究表明,采用0.5~1.5 mol/L HCl和1~5 mol/L NaOH处理虾壳,脱盐率达到90%以上(Younes et al, 2015),而脱蛋白率可达到80%以上(Hdde et al, 2006)。目前,工业制备壳聚糖主要为传统加热法,将甲壳素与45%~60% NaOH混合后,于105~130℃下加热反应60~180 min (Viarsagh et al, 2010; Yen et al, 2009)。以上生产过程虽然能制得达到工业级标准的壳聚糖,但HCl和NaOH的添加使生产废水中含有大量的氯元素和钠元素,易导致土壤钠质化(李小刚等, 2004),影响作物生长。本研究选用H3PO4和KOH分别对虾壳进行脱盐、脱蛋白和脱乙酰处理,其脱盐和脱蛋白效果与传统化学法效果一致。而且与传统化学方法相比,采用H3PO4和KOH处理虾壳,生产过程中产生的废水含有植物生长需要的N、P和K元素,该废水可回收后作为肥料应用于农业生产中,减少生产过程中产生的环境污染。此外,采用H2O2氧化降解壳聚糖,降解产物为壳寡糖、氧气和水,对环境无污染。可见,本研究不同脱乙酰度壳寡糖制备方法实现了壳聚糖的清洁化生产和凡纳滨对虾虾壳的高值化利用。
3.2 不同脱乙酰度壳寡糖对烟草抗TMV的影响壳寡糖作为自然界唯一的阳离子寡糖,可作为饲料添加剂和植物诱抗剂应用于动植物生长过程中(蔡胜昌等, 2015; 张洪艳等, 2011)。脱乙酰度是影响壳寡糖生物活性的因素之一,目前,已有研究报道,壳寡糖的脱乙酰度改变对种子萌发(Lan et al, 2016)和植物生长(刘启顺等, 2012)等生理过程有一定的影响。本研究表明,不同脱乙酰度的壳寡糖对烟草抗TMV的影响有所不同,脱乙酰度为63.79%的壳寡糖诱导植株患病程度与空白组没有明显区别,而脱乙酰度为79.34%和88.15%的壳寡糖诱导后的植株具有较好的抗病性,植株患病程度最轻。
3.3 不同脱乙酰度壳寡糖对TMV体外钝化和复制的作用壳寡糖对真菌类病菌具有广谱的抑制作用(Alejandrob et al, 2008),并且对植物病原真菌、细菌和病毒有体外抑制作用(赵小明等, 2006)。当病毒在植物体外受到寡糖抑制时,一定程度上会阻碍病毒侵入植株内,从而减轻植物患病程度。本研究表明,不同脱乙酰度的壳寡糖对TMV进行体外处理,接种烟草叶片后植株的患病程度不同,脱乙酰度为88.15%的壳寡糖对TMV的体外钝化作用最好,说明高脱乙酰度的壳寡糖可以通过对TMV的体外钝化阻碍病毒对寄主的侵染,从而减轻植株的患病程度。TMV在侵入植物进行复制后,将病毒运输到植物各个部位引起系统性侵染(张微, 2010)。本研究表明,脱乙酰度为79.34%和88.15%的壳寡糖能抑制TMV在寄主内的复制作用,这可能是由于以上2种脱乙酰度的壳寡糖抑制了病毒的复制,使病毒被限制在最初的侵染点,从而避免植物遭受系统性侵染。
3.4 不同脱乙酰度壳寡糖对烟草防御酶的影响植物体内防御酶活性的变化与其抗病性相关,如过氧化氢酶、过氧化物酶、多酚氧化酶和苯丙氨酸解氨酶。过氧化氢酶与植物体内活性氧清除有关,通过影响活性氧的积累而改变植物的抗病性(宋瑞芳等, 2007);过氧化物酶能有效清除植物内源性活性氧,还能促进多酚的氧化(Kushalappa et al, 2016);多酚氧化酶与植物次生代谢产物的生成有密切关系(郭红莲等, 2003);苯丙氨酸解氨酶是苯丙烷类次生代谢途径中的关键酶和限速酶,与木质素的生成和沉积有关,能有效阻止病原的扩散(马俊彦等, 2007)。本研究表明,脱乙酰度为79.34%和88.15%的壳寡糖诱导烟草后能提高过氧化氢酶、过氧化物酶和多酚氧化酶活性。因此,脱乙酰度为79.34%和88.15%的壳寡糖诱导植株产生抗病性,可能是通过对病毒的体外钝化作用、抑制病毒在寄主内的复制和提高植物体内过氧化氢酶、过氧化物酶和多酚氧化酶活性而实现的。植物抗病性的产生是一个复杂的生理过程,体外钝化、病毒复制和植物防御酶系活性的变化并不能具体说明壳寡糖脱乙酰度与烟草抗病机理的关系,所以,还需要从基因调控方面对植物抗病机理进行深入研究。
Alejandrob F, Juancarlos C, Daimy C, et al. The effect of size and acetylation degree of chitosan derivatives on tobacco plant protection against Phytophthora parasitica nicotianae. World Journal of Microbiology and Biotechnology, 2008, 24(1): 103-112 |
Al Sagheer FA, Alsughayer MA, Muslim S, et al. Extraction and characterization of chitin and chitosan from marine sources in Arabian Gulf. Carbohydrate Polymers, 2009, 77(2): 410-419 DOI:10.1016/j.carbpol.2009.01.032 |
Cai SC, Zhang LM, Zhang DR, et al. Effects of chitosan oligosaccharides and xylo-oligosaccharides on the growth, body composition and blood biochemical indexes of turbot larvae (Scophthalmus maximus). Progress in Fishery Sciences, 2015, 36(6): 29-36 [ 蔡胜昌, 张利民, 张德瑞, 等. 壳寡糖与低聚木糖对大菱鲆(Scophthalmus maximus)幼鱼生长、体组成和血液生化指标的影响. 渔业科学进展, 2015, 36(6): 29-36] |
Das SN, Madhuprakash J, Sarma PV, et al. Biotechnological approaches for field applications of chitooligosaccharides (COS) to induce innate immunity in plants. Critical Reviews in Biotechnology, 2015, 35(1): 29-43 |
Guo HL, Cheng GW, Chen J, et al. Study on the metabolism of phenolic substances in the resistance response of corn gray spot disease. Journal of Plant Pathology, 2003, 33(4): 342-346 [ 郭红莲, 程根武, 陈捷, 等. 玉米灰斑病抗性反应中酚类物质代谢作用的研究. 植物病理学报, 2003, 33(4): 342-346 DOI:10.3321/j.issn:0412-0914.2003.04.012] |
Gao JF. Experimental techniques of plant physiology. Xian: World Book Inc, 2000 [ 高俊凤. 植物生理学实验技术. 西安: 世界图书出版公司, 2000]
|
Hdde H, Netto FM. Recovery of components from shrimp (Xiphopenaeus kroyeri) processing waste by enzymatic hydrolysis. Journal of Food Science, 2006, 71(5): 298-303 DOI:10.1111/jfds.2006.71.issue-5 |
Hu XW, Xu QJ, Jin XC, et al. The effect of different molecular weight chitooligosaccharides on seed germination and seedling resistance enzyme activity of ryegrass. Chinese Agricultural Science Bulletin, 2007, 23(2): 221-225 [ 扈学文, 许秋瑾, 金相灿, 等. 不同分子量壳寡糖对黑麦草种子萌发和幼苗抗病酶活性影响的研究. 中国农学通报, 2007, 23(2): 221-225 DOI:10.3969/j.issn.1000-6850.2007.02.053] |
Jia ZS, Li QB. Determination of deacetylation degree of chitosan by double sudden jump potential titration. Chemical World, 2001, 42(5): 240-241 [ 贾之慎, 李奇彪. 双突跃电位滴定法测定壳聚糖脱乙酰度. 化学世界, 2001, 42(5): 240-241 DOI:10.3969/j.issn.0367-6358.2001.05.005] |
Kushalappa AC, Yogendra KN, Karre S. Plant innate immune response: Qualitative and quantitative resistance. Critical Reviews in Plant Sciences, 2016, 35(1): 38-55 DOI:10.1080/07352689.2016.1148980 |
Lan W, Wang W, Yu Z, et al. Enhanced germination of barley (Hordeum vulgare L. ) using chitooligosaccharide as an elicitor in seed priming to improve malt quality. Biotechnology Letters, 2016, 38(11): 1-6 |
Li XG, Cao J, Li FM. Effects of salinization and natriuretic on the physical properties of soil. Chinese Journal of Soil Science, 2004, 35(1): 64-72 [ 李小刚, 曹靖, 李凤民. 盐化及钠质化对土壤物理性质的影响. 土壤通报, 2004, 35(1): 64-72 DOI:10.3321/j.issn:0564-3945.2004.01.016] |
Liu N, Lin ZF. Cell activity staining in whole plant leaves with Evans blue. Journal of Plant Physiology, 2011, 47(6): 570-574 [ 刘楠, 林植芳. 用伊文思蓝染色法检测植物整体叶片的细胞活性. 植物生理学报, 2011, 47(6): 570-574] |
Li XL, Wang L, Song K, et al. Effects of low molecular hydrolysable fish protein added to low fish meal on non specific immunity and antioxidant capacity of Penaeus vannamei. Progress in Fishery Sciences, 2017, 38(6): 85-91 [ 李晓丽, 王玲, 宋凯, 等. 低鱼粉饲料中添加低分子水解鱼蛋白对凡纳滨对虾非特异性免疫力和抗氧化能力的影响. 渔业科学进展, 2017, 38(6): 85-91] |
Liu QS, Yin H, Li SG, et al. Application of chitosan oligosaccharides and their derivatives in plant preservation and fruit preservation: CN, CN 102771477 A. 2012 [刘启顺, 尹恒, 李曙光, 等.壳寡糖及其衍生物在植物保花保果中的应用: CN, CN 102771477 A. 2012]
|
Ma JY, Yang RD, Ao LG. Advances in biological studies of phenylalanine ammonia lyase. Modern Food Science and Technology, 2007, 23(7): 71-74 [ 马俊彦, 杨汝德, 敖利刚. 植物苯丙氨酸解氨酶的生物学研究进展. 现代食品科技, 2007, 23(7): 71-74] |
Saito Y, Okano T, Gaill F, et al. Structural data on the intra-crystalline swelling of beta-chitin. International Journal of Biological Macromolecules, 2000, 28(1): 81-88 DOI:10.1016/S0141-8130(00)00147-1 |
Shen LL, Wang FL, Qian YM, et al. Inhibitory effect of antagonistic bacteria on tobacco mosaic virus (TMV). Tobacco Science in China, 2007, 28(5): 9-11 [ 申莉莉, 王凤龙, 钱玉梅, 等. 拮抗细菌对烟草花叶病毒(TMV)的抑制作用研究. 中国烟草科学, 2007, 28(5): 9-11 DOI:10.3969/j.issn.1007-5119.2007.05.003] |
Singh VK, Upadhyay RS. Fusaric acid induced cell death and changes in oxidative metabolism of Solanum lycopersicum L. Botanical Studies, 2014, 55(1): 1-11 DOI:10.1186/1999-3110-55-1 |
Song RF, Ding YL, Gong CY, et al. Research progress on the relationship between tobacco resistance and defense enzyme activity. Chinese Agricultural Science Bulletin, 2007, 23(5): 309-314 [ 宋瑞芳, 丁永乐, 宫长荣, 等. 烟草抗病性与防御酶活性间的关系研究进展. 中国农学通报, 2007, 23(5): 309-314 DOI:10.3969/j.issn.1000-6850.2007.05.072] |
Tan XJ, Li YB. Partial purification and properties of polyphenol oxidase from pericarp of Litchi chinensis. Journal of Plant Physiology, 1984, 11061106(4): 47-54 [ 谭兴杰, 李月标. 荔枝(Litchi chinensis)果皮多酚氧化酶的部分纯化及性质. 植物生理学报, 1984, 11061106(4): 47-54] |
Viarsagh MS, Janmaleki M, Falahatpisheh HR, et al. Chitosan preparation from Persian Gulf shrimp shells and investigating the effect of time on the degree of deacetylation. Journal of Paramedical Sciences, 2010, 11061106(2): 2-6 |
Xue YL. Experimental manual of plant physiology. Shanghai: Shanghai Science and Technology Press, 1985: 191-192 [ 薛应龙. 植物生理学实验手册. 上海: 上海科技出版社, 1985: 191-192]
|
Yen MT, Yang JH, Mau JL. Physicochemical characterization of chitin and chitosan from crab shells. Carbohydrate Polymers, 2009, 75(1): 15-21 DOI:10.1016/j.carbpol.2008.06.006 |
Younes I, Hajji S, Rinaudo M, et al. Optimization of proteins and minerals removal from shrimp shells to produce highly acetylated chitin. International Journal of Biological Macromolecules, 2015, 84: 246-253 |
Yuan JP, Guo JA, Wang SF. Effects of chitosan oligosaccharides on seed germination and seedling growth of wheat. Journal of Anhui Agricultural Sciences, 2011, 39(2): 709-710 [ 袁建平, 郭军艾, 王少飞. 壳寡糖对小麦种子萌发及幼苗生长的影响. 安徽农业科学, 2011, 39(2): 709-710 DOI:10.3969/j.issn.0517-6611.2011.02.032] |
Zhang HY, Wang WX, Yin H, et al. Study on nitric oxide signal induced by chitosan oligosaccharides in plant defense response. Chinese Journal of Bioengineering, 2011, 31(2): 18-22 [ 张洪艳, 王文霞, 尹恒, 等. 壳寡糖诱导植物防御反应中一氧化氮信号的研究. 中国生物工程杂志, 2011, 31(2): 18-22] |
Zhang W. Study on the resistance and mechanism of PeaT1 induced tobacco system. Masterxs Thesis of Chinese Academy of Agricultural Sciences, 2010 [张微. PeaT1诱导烟草系统获得抗病性及其作用机理的研究.中国农业科学院硕士研究生学位论文, 2010]
|
Zhang ZL. Experimental guidance of plant physiology. Beijing: Higher Education Press, 2003 [ 张志良. 植物生理学实验指导. 北京: 高等教育出版社, 2003]
|
Zhao XM, Du YG. Progress of oligosaccharide elicitors and mechanism of plant induced resistance research. Review of China Agricultural Science and Technology, 2006, 8(6): 26-32 [ 赵小明, 杜昱光. 寡糖激发子及其诱导植物抗病性机理研究进展. 中国农业科技导报, 2006, 8(6): 26-32 DOI:10.3969/j.issn.1008-0864.2006.06.006] |



