2. 中国水产科学研究院黄海水产研究所 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
目前,我国主要养殖的经济蛸类品种有短蛸(Octopus ocellatus)、长蛸(Octopus variabilis)和真蛸(Octopus vulgaris)等,它们具有生长快速和食物转化率高的特点(林祥志等, 2006; 叶守建等, 2014)。短蛸隶属于软体动物门(Mollusca),头足纲(Cephalopoda),八腕目(Octopoda),蛸科(Octopodidae);体小腕短、生命周期短,亲体有护卵行为;为沿岸底栖种类,游泳能力较弱,有钻沙隐蔽的习性;主要以虾、蟹、贝类和底栖鱼类为食(林祥志等, 2006; Mangold et al, 1973; 叶守建等, 2014)。短蛸肉质鲜美,是我国北方的重要海产品之一。
由于对蛸类幼体的生理和生物学知识缺乏了解,我国对蛸类的繁育技术以及幼体发育阶段生物学研究还处于初期阶段,短蛸幼体阶段的培育仍受到诸多因素的限制,急需开展幼体的营养需求、适宜的开口饵料、成熟的饲养技术等研究。据报道,短蛸在孵化后的第1个月死亡率极高,尤其浮游幼体阶段是严重的瓶颈期,转入底栖生活后随着个体不断生长,存活率才逐渐提高(Iglesias et al, 2014; Raquel et al, 2017)。关于蛸类幼体人工培育及生长等的研究,国内外已有相关报道(刘兆胜, 2013; Moguel et al, 2010; Raquel et al, 2017; 郑小东等, 2011)。对于短蛸幼体的研究主要集中在影响幼体成活的因素,以及饵料和摄食方面(董根, 2014),而关于短蛸幼体早期生长发育特征的研究未见报道。
本研究通过对短蛸幼体的培育和观察,研究了从孵化至50日龄短蛸幼体的生长发育特征,旨在加深对短蛸幼体生长的了解,为短蛸人工繁育的研究提供参考依据。
1 材料与方法 1.1 实验动物与养殖条件实验于2017年6月20日至8月20日在青岛金沙滩水产开发有限公司进行。选择即将孵化且有亲体看护的短蛸卵,将亲体和卵放置在上外径为74 cm、下外径为59 cm、高为72 cm的塑料水桶内(养殖水体150 L),孵化水温为21℃~22℃,盐度为27~29,pH为7.8~8.3,光照强度1000 lx以下;连续充氧,日换水量为1/2,直到幼体孵化出膜,得到同一天的初孵短蛸400只。随后,将亲体和卵移出水桶,并将400只短蛸幼体均分至与上述规格相同的2个水桶内养殖,养殖密度控制在40只/m2以内。
1~11日龄,卤虫无节幼体与糠虾无节幼体混合投喂。底栖后减少卤虫幼体的投喂,增加糠虾无节幼体的投喂量,适当投喂蛤蜊肉进行饵料转换,并投放大小合适的海螺壳做遮蔽物。20日龄后,糠虾无节幼体和蛤蜊肉混合投喂。35日龄后,增加蛤蜊肉的投喂量,期间根据幼体的生长情况更换大小适当的遮蔽物。每日投喂前换水,日换水量为1/2。每日清晨饱食投喂,培育水温22℃~24℃,培育水体和条件与孵化阶段相同。
1.2 实验方法分别在第1、3、5、11、15、20、25、30、35、38、42、44、46、48、50天时,每次取样10只。称重前以8~10 g/L氯化镁(MgCl2·6H2O)麻醉幼体,然后用滤纸吸干幼体体表水分。分析天平称体重(Body weight, BW)(精确到0.001 g),然后测量全长(Total length, TL),腕长(Arm length, AL)及胴长(Mantle length, ML)(精确到0.01 mm)。全长(TL)为胴部底端至腕部顶端的距离;腕长(AL)为腕基部至顶端的距离;胴长(ML)为短蛸胴部底端至头部底端的距离。解剖镜(MODEL STAND SE220)下观察拍照(图 1)。
1.3 数据分析以Excel2010和SPSS20.0软件分析全长与体重、全长与腕长、腕长与胴长以及体重、全长、腕长、胴长分别与日龄的关系,做拟合曲线,选定R2值最大的函数关系式作为最佳曲线。以平均体重、全长及腕长的日均增长量、瞬时增长率来描述短蛸幼体的生长特征(李达等, 2017)。计算公式为:
日均增长量(mm)=(L2 – L1)/(t2 – t1);
日均增重量(g)=(W2 – W1)/(t2 – t1);
瞬时增长率(%/d)=[(LnL2 – LnL1)/(t2 – t1)]×100;
瞬时增重率(%/d)=[(LnW2 – LnW1)/(t2 – t1)] ×100。
式中,W1为t1时刻的体重(g);W2为t2时刻的体重(g);L1为t1时刻的全长或腕长(mm);L2为t2时刻的全长或腕长(mm)。
2 结果 2.1 短蛸幼体的阶段划分观察短蛸自孵化出膜后生活习性的变化特征,以短蛸幼体伏底比例达60%左右时为分界线,将幼体阶段划分为浮游期和底栖期。对浮游和底栖短蛸幼体进行体重与日龄模型分析与参数估计,并选取R2值最大的函数模型来描述各阶段的个体体重增长。
2.1.1 浮游期1~11日龄短蛸营浮游生活,为浮游期。平均体重与日龄的曲线参数估计结果显示,立方函数模型的R2值最大(表 1),因此选取立方函数模型来描述浮游期个体体重增长,平均体重(g)与日龄(d)的拟合方程为y = 0.0001x3 – 0.0019x2 + 0.0098x + 0.0409,结果如图 2所示。当天孵化出膜的短蛸卵黄囊吸收完全,即开口摄食。初孵短蛸平均腕长为4.04 mm,小于平均胴长(4.12 mm),腕长/胴长的值小于1(0.98);3日龄短蛸平均腕长为5.00 mm,大于平均胴长(4.27 mm),腕长/胴长的值为大于1(1.17)(图 3)。
|
|
表 1 浮游短蛸体重与日龄的模型分析与参数估计 Tab.1 The model summary and parameter estimates between body weight and age of planktonic O. ocellatus |

|
图 2 浮游短蛸幼体体重与日龄的关系 Fig.2 The relationship between body weight and age of planktonic O. ocellatus larvae |

|
图 3 短蛸幼体腕长与胴长的比值变化 Fig.3 The ratio of arm length with mantle length of O. ocellatus larvae |
11日龄底栖短蛸比例达60%,认为幼体开始进入底栖期。进入底栖期后,11~50日龄短蛸体重与日龄的曲线参数估计结果显示,复合函数、增长函数、指数函数和Logistic函数关系式的R2值相同且最大(表 2),选择其中任何一种即可,本研究选择指数函数模型来描述底栖短蛸体重增长。平均体重(g)与日龄(d)的拟合方程为y = 0.0284e0.092x。根据底栖幼体体重与日龄的关系作图,结果如图 4所示。
|
|
表 2 底栖短蛸体重与日龄的模型分析与参数估计 Tab.2 The model summary and parameter estimates of body weight and and age of benthic O. ocellatus |

|
图 4 底栖短蛸幼体体重与日龄的关系 Fig.4 The relationship between body weight and age of benthic O. ocellatus larvae |
测量并记录短蛸幼体不同生长阶段的全长、腕长与体重,计算其平均全长、腕长及体重,日增长(重)量,瞬时增长(重)率等来描述短蛸幼体养殖阶段的生长特征。本实验初孵短蛸经50 d生长期,平均全长从10.03 mm达到76.21 mm,平均日均增长量为1.50 mm,平均瞬时增长率为4.20%/d;平均腕长从4.04 mm达到54.34 mm,平均日均增长量为1.18 mm,平均瞬时增长率为5.67%/d;平均体重从0.049 g达到2.923 g,平均日均增重量为0.075 g,平均瞬时增重率为7.97%/d (表 3)。
|
|
表 3 短蛸幼体的生长情况(平均值±标准误,n=10) Tab.3 The growth of O. ocellatus larvae (mean±SE, n=10) |
初孵短蛸的平均全长为10.03 mm,平均体重为0.049 g;11日龄开始底栖生活,平均全长为16.31 mm,平均体重0.088 g;生长至50日龄时,平均全长为76.21 mm的短蛸其体重为2.923 g。通过拟合方程可知,1~50日龄短蛸平均体重(g)与全长(mm)呈立方函数关系,方程为y = –8e–07x3 + 0.001x2 – 0.011x + 0.099。根据幼体体重与全长的关系作图,结果如图 5所示。
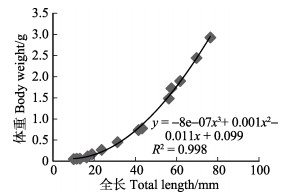
|
图 5 短蛸幼体体重与全长的关系 Fig.5 The relationship between body weight and total length of O. ocellatus larvae |
初孵短蛸的平均腕长为4.04 mm;11日龄的底栖短蛸,平均腕长达到8.91 mm;培育至50日龄,平均全长为76.21 mm的短蛸其腕长为54.34 mm。通过拟合方程可知,1~ 50日龄短蛸平均全长(mm)与腕长(mm)呈线性,方程为y = 1.314x + 4.952。根据幼体全长与腕长的关系作图,结果如图 6所示。
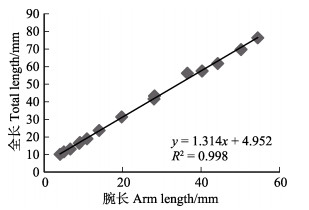
|
图 6 短蛸幼体全长与腕长的关系 Fig.6 The relationship between total length and arm length of O. ocellatus larvae |
平均体重为0.049 g的初孵短蛸,11日龄开始底栖时体重达到0.088 g,经过50 d的生长期,平均体重达到2.923 g,平均每日增重量为0.075 g(表 1)。通过拟合方程可知1~50日龄短蛸体重(g)与日龄(d)呈立方函数关系, 方程为y = 6e–05x3 – 0.003x2 + 0.036x – 0.03。根据幼体体重与日龄的关系作图, 结果如图 7所示。1~11日龄浮游期,短蛸增重较慢, 平均日增重0.003 g;进入底栖期后,增重较浮游期快, 平均日增重0.087 g(表 4)。
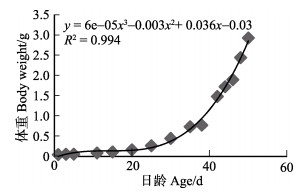
|
图 7 短蛸幼体体重与日龄的关系 Fig.7 The relationship between body weight and age of O. ocellatus larvae |
|
|
表 4 短蛸幼体不同阶段的生长情况 Tab.4 The growth of O. ocellatus larvae in different phases |
初孵短蛸生长至50日龄时, 全长达到76.21 mm左右,平均日增长量为1.5 mm。通过拟合方程可知,1~50日龄短蛸全长(mm)与日龄(d)呈立方函数增长,方程为y = 0.0004x3 + 0.002x2 + 0.307x + 10.604。根据不同阶段幼体全长与日龄的关系作图,结果如图 8所示。浮游期短蛸,全长增长较慢,平均日增长0.68 mm;11~ 50日龄底栖短蛸全长的增长较浮游期快,平均日增长1.62 mm(表 4)。
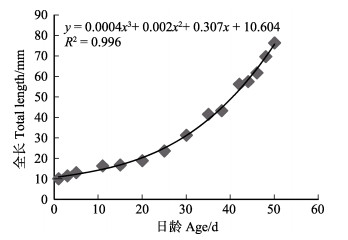
|
图 8 短蛸幼体全长与日龄的关系 Fig.8 The relationship between total length and age of O. ocellatus larvae |
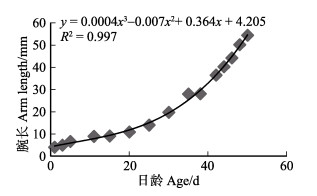
初孵短蛸平均腕长为4.04 mm,经过50 d的生长,平均腕长达到54.34 mm,平均每日增长量为1.18 mm。通过拟合方程可知,1~50日龄短蛸腕长(mm)与日龄(d)呈立方函数增长,方程为y = 0.0004x3 – 0.007x2 + 0.364x + 4.205。根据不同阶段幼体腕长与日龄的关系作图,结果如图 9所示。浮游期短蛸的腕长生长较慢,腕长平均日增长量为0.56 mm;11~50日龄短蛸的腕长增长较浮游期快, 平均日增长为1.28 mm(表 4)。
|
图 9 短蛸幼体腕长与日龄的关系 Fig.9 The relationship between arm length and age of O. ocellatus larvae |
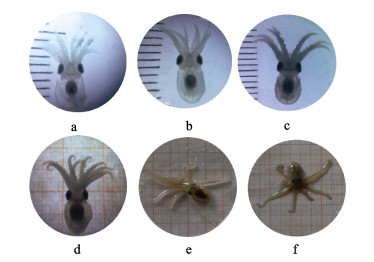
1日龄短蛸(图 10a)体色近似透明,可见内脏团呈金黄色。浮游期短蛸(图 10a和图 10b)的体色浅,底栖期体色逐渐加深(图 10c和图 10d),变为黄褐色(图 10e和图 10f)。观察并统计了浮游期短蛸的吸盘数目,初孵短蛸通常具有14~16个吸盘,随着腕的增长吸盘数目随之增加,新增吸盘从腕的末端处出现,先隆起极小的凸起,而后不断增大。8日龄短蛸吸盘个数18~20个,11日龄短蛸开始底栖,具有26~28个吸盘,进入底栖期后,吸盘数目随腕的增长继续增加。吸盘在腕上的排列方式为:从腕的基部至顶端吸盘由大到小排列;接近腕基部处前几个大吸盘呈单列分布,至腕顶端方向随吸盘逐渐变小而呈2列分布,且越至腕顶端方向吸盘越小、分布越密集。
|
图 10 短蛸幼体的生长进程 Fig.10 The growth process of O. ocellatus larvae a:1日龄;b:8日龄;c:11日龄;d:20日龄;e:35日龄;f:46日龄(每一个刻度为1 mm) a: 1-day; b: 8-day; c: 11-day; d: 20-day; e: 35-day; f: 46-day (Each calibration is 1mm) |
短蛸幼体的摄食行为不是直接吞食,是用腕上的吸盘吸附食物,而初孵短蛸腕长/胴长的值小于1,表明此阶段腕的发育相对不发达,捕捉和摄取饵料的能力较弱,即使食物充足,幼体也未能很好摄食(Raquel et al, 2017)。3日龄后腕长/胴的值大于1且呈逐渐增加趋势,由此可初步推断浮游期短蛸的能量分配主要用于完成形态上的调整,发育对生命活动起重要作用的腕和胴体等,而不是主要用于体重增长,以此增强幼体捕食和适应环境的能力,提高其存活率(何滔等, 2012; 雷舒涵等, 2014; Moguel et al, 2010; 单秀娟等, 2009; 王卫军等, 2010),这可能是浮游期短蛸体重没有快速增加的原因之一。
11日龄后短蛸进入底栖期,随着短蛸腕和胴体不断生长,幼体主动摄食能力也逐渐增强,并开始摄取蛤蜊或蟹幼体。底栖期短蛸体重增长为指数函数增长类型,体重平均日增重量比浮游期短蛸提高了0.084 g/d,全长和腕长的平均增长量分别比浮游期短蛸提高了0.94和0.72 mm/d,这可能是因为该时期短蛸的主要功能器官已逐渐发育完全, 能量主要用于体重的增加,故生长较快(雷舒涵等, 2014; Moguel et al, 2010)。
3.2 短蛸幼体的形态结构与捕食之间的关系短蛸幼体捕食行为的发生是各捕食器官共同作用的结果。漏斗、腕和吸盘等结构都在幼体的摄食过程中起着关键作用。幼体捕捉饵料时,8条腕网向食物,抓取饵料(王卫军等, 2017);短蛸腕的吸盘具有角质环但不具齿(陈道海等, 2014),吸盘具有丰富的肌纤维,是强有力的吸附器官,与猎物接触后呈漏斗状的管道边缘密封,通过肌肉收缩产生吸力效应,从而吸附食物防止挣脱(Bidder, 1966),而后用腕卷至嘴前方抱食。
短蛸在不同阶段腕和吸盘的结构都存在差异,这也体现了不同阶段的幼体在捕食能力上的差异(Kier et al, 1990; Voight, 1991)。随着幼体不断生长,腕和吸盘等结构的形态和功能逐渐完善,各器官协同完成摄食过程。初孵阶段腕长/胴长值小于1,吸盘个数少,因此,抓取和吸附食物的能力较弱;之后,腕长/胴长值不断增大,吸盘数量逐渐增多,吸附作用增强,更有利于摄食,增强了主动摄食的能力(郑小东, 2011)。11日龄的短蛸具有26~28个吸盘,进入底栖期后,腕不断增长,腕上吸盘也进一步增大增多,故而捕食能力较在浮游期更强。
Bidder AM. Feeding and digestion in cephalopods. Physiology of Mollusca, 1966, 39(3): 97-124 |
Cai RX. Zoology molluscs of Zhejiang. Hangzhou: Zhejiang Science and Technology Press, 1991 [ 蔡如星. 浙江动物志·软体动物. 杭州: 浙江科学技术出版社, 1991]
|
Chen DH, Qiu HM. Surface microstructures of suckers and their endoskeletons in cephalopods as revealed by SEM. Chinese Journal of Zoology, 2014, 49(5): 736-743 [ 陈道海, 邱海梅. 头足类腕上吸盘和内壳扫描电镜观察. 动物学杂志, 2014, 49(5): 736-743] |
Dong G. The basic biological studies on the artificial reproduction of Octopus ocellatus. Master's Thesis of Ocean University of China, 2014 [董根.短蛸人工繁育过程中的基础生物学研究.中国海洋大学硕士研究生学位论文, 2014] http://cdmd.cnki.com.cn/Article/CDMD-10423-1014368619.htm
|
He T, Xiao ZZ, Liu QH, et al. Allometric growth in rock bream larvae (Oplegnathusfasciatus Temminck et Schlegel 1844). Journal of Fisheries of China, 2012, 36(8): 1242-1248 [ 何滔, 肖志忠, 刘清华, 等. 条石鲷早期发育阶段的生长模式. 水产学报, 2012, 36(8): 1242-1248] |
Iglesias J, Fuentes L. Octopus vulgaris. paralarval culture. cephalopod culture. paralarval culture. cephalopod culture. Springer Netherlands, 2014, 11061106: 427-450 |
Kier WM, Smith AM. The morphology and mechanics of octopus suckers. Biological Bulletin, 1990, 178(2): 126-136 DOI:10.2307/1541971 |
Lei SH, Zhang XM, Zhang PD, et al. Early development of golden cuttlefish Sepia esculenta. Journal of Fishery Sciences of China, 2014, 21(1): 37-43 [ 雷舒涵, 张秀梅, 张沛东, 等. 金乌贼的早期生长发育特征. 中国水产科学, 2014, 21(1): 37-43] |
Li D, Liu CL, Li A, et al. Principal component analysis of the morphometric traits of the cuttlebone of Sepia esculenta at early developmental stages. Progress in Fishery Sciences, 2017, 38(5): 41-49 [ 李达, 刘长琳, 李昂, 等. 金乌贼(Sepia esculenta)早期发育阶段内壳形态学指标的主成分分析. 渔业科学进展, 2017, 38(5): 41-49] |
Lin XZ, Zheng XD, Su YQ, et al. The status and prospect of octopus culture biology: A review. Journal of Xiamen University (Natural Science), 2006, 45(S2): 213-218 [ 林祥志, 郑小东, 苏永全, 等. 蛸类养殖生物学研究现状及展望. 厦门大学学报(自然科学版), 2006, 45(S2): 213-218] |
Liu ZS. Studies on fundamental biology and artificial reproductive technique of Octopus vulgaris. Master's Thesis of Ocean University of China, 2013 [刘兆胜.真蛸基础生物学和繁育技术研究.中国海洋大学硕士研究生学位论文, 2013] http://cdmd.cnki.com.cn/Article/CDMD-10423-1013368720.htm
|
Mangold K, Boletzky SV. New data on reproductive biology and growth of Octopus vulgaris. Marine Biology, 1973, 19(1): 7-12 DOI:10.1007/BF00355414 |
Moguel C, Mascaró M, Avila-Poveda OH, et al. Morphological, physiological and behavioural changes during post-hatching development of Octopus maya (Mollusca: Cephalopoda) with special focus on the digestive system. Aquatic Biology, 2010, 9(1): 35-48 |
Fernández-Gago Raquel, Martin H, Heidemarie G, et al. 3D Reconstruction of the Digestive System in Octopus vulgaris Cuvier, 1797 Embryos and Paralarvae during the First Month of Life. Frontiers in Physiology, 2017, 11061106(8): 462 |
Shan XJ, Dou SZ. Allometric growth of croaker miichthys miiuy larvae and juveniles and its ecological implication. Oceanologia et Limnologia Sinica, 2009, 40(6): 714-719 [ 单秀娟, 窦硕增. 鱼(Miichthys miiuy)仔、稚鱼发育生长方式及其生态学意义. 海洋与湖沼, 2009, 40(6): 714-719 DOI:10.3321/j.issn:0029-814X.2009.06.007] |
Voight JR. Ligula length and courtship in octopus digueti: A potential mechanism of mate choice. Evolution, 1991, 45(7): 1726-1730 |
Wang WJ, Yang JM, Zhou QL, et al. Reproductive behavior and process of embryonic development of Octopus ocellatus. Journal of Fishery Sciences of China, 2010, 17(6): 1157-1162 [ 王卫军, 杨建敏, 周全利, 等. 短蛸繁殖行为及胚胎发育过程. 中国水产科学, 2010, 17(6): 1157-1162] |
Wang WJ, Dong G, Li HJ, et al. Feeding behavior of larval Amphioctopus fangsiao and the effect of different diets on its growth and survival. Progress in Fishery Sciences, 2017, 38(6): 100-106 [ 王卫军, 董根, 李焕军, 等. 短蛸(Amphioctopus fangsiao)幼体摄食行为和不同饵料对其生长、存活的影响. 渔业科学进展, 2017, 38(6): 100-106] |
Ye SJ, Zhou JW, Yang MX, et al. Exploitation of cephalopod resources in the world and development suggestion. Journal of Modern Fisheries Information, 2014, 29(1): 11-17 [ 叶守建, 周劲望, 杨铭霞, 等. 全球头足类资源开发现状分析及发展建议. 渔业信息与战略, 2014, 29(1): 11-17 DOI:10.3969/j.issn.1004-8340.2014.01.003] |
Zheng XD, Liu ZS, Zhao N, et al. Embryonic development and paralarval growth of Octopus vulgaris. Oceanologia et Limnologia Sinica, 2011, 42(2): 317-323 [ 郑小东, 刘兆胜, 赵娜, 等. 真蛸(Octopus vulgaris)胚胎发育及浮游期幼体生长研究. 海洋与湖沼, 2011, 42(2): 317-323] |




