2. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fishery, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute Chinese Academy of Fishery Sciences, Qingdao 266071
紫菜味道鲜美,营养丰富,具有较高的经济价值,是我国养殖面积最大的大型经济海藻(李晓蕾等, 2017)。近年来,随着养殖需求增加,主产区养殖海区饱和,长期密集养殖,加之全球气候变化、种质退化等原因,紫菜在主产区养殖过程中频繁出现病烂、生长迟缓、产量大幅下降等问题,我国紫菜养殖产业受到冲击。
一些学者针对紫菜养殖和育苗过程的病害问题展开了研究。杨锐等(2008)发现假交替单胞菌(Pseudoalteromonas nigrifaciens)为健康紫菜表面的优势菌,且在周围海水和病烂紫菜上未分离到该菌。王洪斌等(2011)研究表明,河豚毒素假交替单胞菌(Pseudoalteromonas tetraodonis)可能是条斑紫菜(Pyropia yezoensis)丝状体黄斑病病原菌。陈国耀等(1999)研究表明,琼脂降解菌主要附着在紫菜网绳上,可能引起紫菜脱落。闫咏等(2002)研究表明,导致条斑紫菜叶状体绿斑病的致病菌是柠檬假交替单胞菌(Pseudoalteromonas citrea)。引起紫菜病变的致病菌大多数为条件致病菌。海洋环境瞬息万变,海水环境中的微生物组成复杂多变,健康稳定的水环境中微生物群落组成处于动态平衡,当某种或某些因素突然改变打破这种平衡,某一或某些条件致病菌就会在这种失衡的状态下迅速繁殖扩增,导致病害暴发。上述研究主要采用从病烂与健康紫菜藻体上分离、鉴定致病菌或藻际微生物方法展开研究,而针对紫菜养殖海区水环境微生物物种组成及群落结构的研究几乎没有。
通过培养、分离、鉴定等传统的方法研究微生物,受培养条件等限制,检测到的微生物物种较少,尤其对一些低丰度和培养条件特殊的细菌往往难以检测到。测序技术的发展带动宏基因组学的诞生,第2代测序技术的产生彻底弥补了第1代测序技术通量低、成本高的缺点,且可实现平行测序、可定量(张丁予等, 2016)。基于第2代测序技术的微生物宏基因组研究方法,可高通量检测到样品中几乎全部微生物,包含一些新物种(盖珊珊, 2016),能更精确的检测出海洋水环境中菌群的组成和数量。
本研究采用高通量测序技术对山东长岛紫菜养殖海区表层水环境中细菌多样性进行调查,以期掌握长岛紫菜养殖区水环境中的细菌多样性分布,通过与邻近非养殖海区水环境中微生物组成的比较,探索紫菜养殖活动对水环境细菌多样性分布的影响,为紫菜养殖病害的预测及防治提供理论依据。
1 材料与方法 1.1 样品采集与处理于2016年12月从山东长岛紫菜养殖区分别采集了近岸区(CDCNS)、紫菜养殖区(CDPF)、外海区(CDCOS)的海水样品3 L,每组6个重复。现场用0.22 µm混合纤维滤膜抽滤海水样品,滤膜对折后置冻存管于干冰中保存,带回实验室,放入–80℃保存。
用塑料水桶或颠倒式采水器采集表层水样,测量指标包括温度、pH、溶解氧(DO)、盐度、氨氮(NH4+-N)、磷酸盐(PO43–-P)、硅酸盐(SiO32–-Si)、总悬浮物(TSS)等。
1.2 实验方法 1.2.1 基于16S rDNA序列的第2代测序与分析该项工作委托广州基迪奥生物科技有限公司完成。样品微生物的提取采用DNA提取试剂盒(HiPureSoil DNA Kits)(Megan,广州)。DNA的质量检测采用琼脂糖凝胶电泳法,用带有Barcode的特异引物对扩增16S rDNA V3+V4区(引物序列为F:CCTAYGGGR B GCASCAG; R:GGACTACNNGGGTATCTAAT)。PCR扩增产物切胶回收,用Qubit 3.0荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,进行Hiseq 2500 PE250 (Illumina, 美国)测序。
对测序得到的原始数据进行处理,首先过滤掉低质量的序列,得到Clean data。然后,根据PE reads之间的重叠关系,将成对双端Reads拼接为一条序列(Tag)。利用Mothur(v.1.34.0)软件包对Tag序列进行去冗余处理(Patrick et al, 2009),挑选出Unique tag序列。使用基于Naive Bayesian方法的分类器Rdp classifier工具,对Tag进行物种注释。为了更好地获得样品中物种的多样性信息,进一步对Tags进行OUT (Operating Taxonomic Unit)聚类,通过KEGG (Kyoto Encyclopedia of Genes and Genomes)数据库进行比对和OTU Pathway注释。计算Alpha多样性指数(Chao、ACE、Shannon和Simpson)与样品间Bray-Curtis系数,并根据Bray-Curtis系数的计算结果对样品进行聚类分析。
1.2.2 环境因子分析使用YSI多参数水质分析仪Proplus(美国)现场测定水温、pH、盐度、DO,使用AA3连续流动分析仪(Seal,德国)测定各项营养盐的浓度。NH4+-N的测定采用靛酚蓝法,SiO32–-Si的测定采用硅钼蓝法,PO43–-P的测定采用抗坏血酸还原磷钼蓝法(GB/T 12763.4-2007),检测限分别为0.04、0.030、0.024 µmol/L。TSS通过称量过滤前后滤膜的差值计算(GB17378.4-2007)。根据R语言的皮尔森相关系数计算环境因子与微生物的丰度之间的相关性。
2 结果 2.1 长岛海区海水中细菌组成对长岛海区海水样品测序结果通过KEGG数据库进行比对和OTU Pathway注释分析,共检测出细菌42门。变形细菌门(Proteobacteria)为整个海区优势菌,其次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、SBR1093、疣微菌门(Verrucomicrobia)、广古菌门(Euryarchaeota)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)。
长岛海区海水样品中共检测出217属。其中,丰度最高的10个属分别为噬甲基菌属(Methylophaga)、盐单胞菌属(Halomonas)、芽孢杆菌属(Bacillus)、嗜氨菌属(Ammoniphilus)、交替单胞菌属(Alteromonas)、海洋粘细菌属(Plesiocystis)、南极杆菌属(Antarctobacter)、共生菌属(Candidatus)、柠檬酸杆菌属(Citrobacter)、十八杆菌属(Octadecabacter)。
2.2 长岛海区水环境微生物多样性分析绘制不同海区样品在0.03距离下的Alpha丰富程度表,Chao、ACE和Shannon 3种指数越大,Simpson指数越接近于0,表示样品中的物种越丰富。结果显示,长岛整个海区海水微生物多样性都比较高,其中,以CDCNS的微生物物种组成最丰富,且与其他2个海区差异明显(表 1)。
|
|
表 1 样品Alpha多样性统计结果 |
根据在各个分类水平上各海区样品OUT数据,计算样品间Bray-Curtis系数,并根据Bray-Curtis系数的计算结果对样品进行聚类分析,以判断在属分类水平上各样品的相似性与特异性。CDPF明显区分于CDCNS和CDCOS区,后二者优先聚为一组(图 1)。表明CDCNS和CDCOS区微生物群落结构更为相似,CDPF区的细菌群落结构明显区别于CDCNS和CDCOS区。
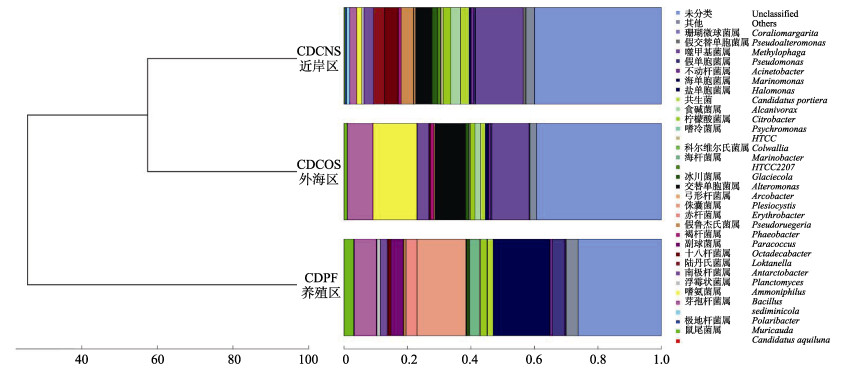
|
图 1 不同海区微生物群落结构的聚类关系 Fig.1 Cluster of microflora structure |
根据长岛海水样品细菌物种分类的OTU数据绘制热图,以展示丰度最高的前20个属/种在不同区域间的表达情况(图 2)。聚类结果与图 1类似,CDCNS与CDCOS区优先聚在一起。其中,鼠尾菌属(Muricauda)、假单胞菌属(Pseudomonas)、盐单胞菌属、赤杆菌属(Erythrobacter)、海杆菌属(Marinobacter)、海洋粘细菌、副球菌属(Paracoccus)为CDPF区特异性的优势菌。冰川菌属(Glaciecola)、共生菌、十八杆菌属、假鲁杰氏菌(Pseudoruegeria)、陆丹氏菌属(Loktanella)为CDCNS区特异性的优势菌。嗜氨菌属在CDCOS区相对丰度明显高于其他2个区域(图 2)。
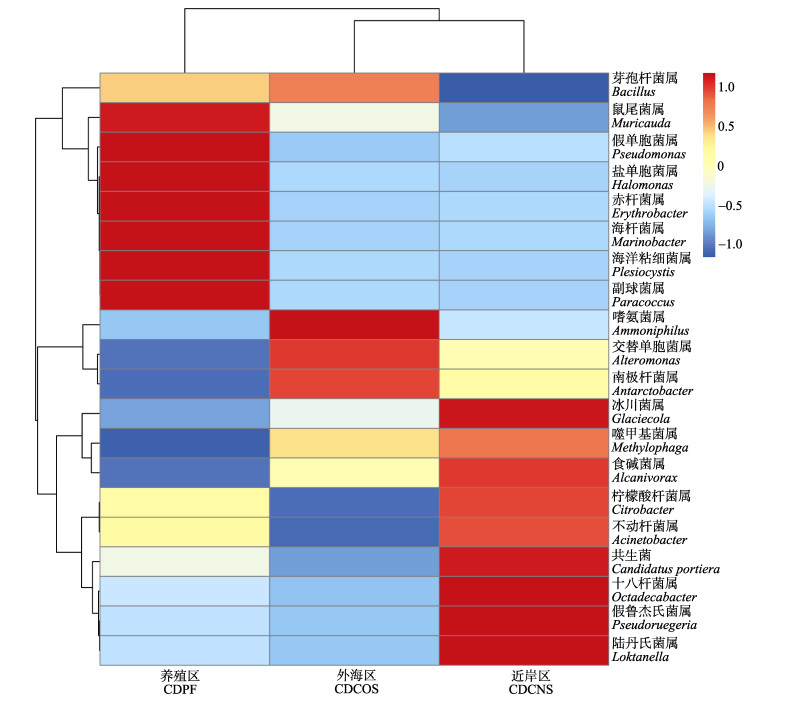
|
图 2 不同海区属分类水平的差异 Fig.2 Genus diversity among the three areas |
3个区域海水盐度、pH、DO、营养盐等环境因子结果见表 2。从表 2可以看出,CDPF区的NH4+-N含量最低,CDCOS区最高。同时,整个海区盐度较高,尤以CDPF区盐度最高。DO和pH呈现由近岸向外海逐渐降低的趋势,TSS则由近岸向外海逐渐增高。环境因子与环境微生物关联分析发现,嗜氨菌属的分布与NH4+-N和TSS的空间分布呈正相关,CDPF区的嗜氨菌属丰度最小,CDCOS区嗜氨菌属丰度最大。盐单胞菌属和海杆菌属的分布与盐度具显著相关性,CDPF区盐单胞菌属和海杆菌属含量最多,其他2个海区盐单胞菌含量较少(表 3)。
|
|
表 2 各海区环境因子分析 Tab.2 Environmental parameters of the three areas |
|
|
表 3 环境因子与部分菌属之间的相关系数 Tab.3 Correlation between environmental parameters and the abundance of some microorganisms |
紫菜富含蛋白质、维生素、矿物质和不饱和脂肪酸,具有很高的营养价值,是我国重要的大型经济海藻之一。紫菜养殖面积大,养殖区域广,其创造的经济价值占全球大型海藻年总产值的20% (陆勤勤等, 2016)。养殖紫菜还兼具修复近岸海洋环境的生态效益。条斑紫菜是我国北方地区主要养殖海藻品种,近年来,其养殖过程病烂、生长迟缓等问题日趋严重。微生物是环境重要组成,其组成和结构变化将对养殖生物的生长产生重要影响。已有研究多从温度、气候、种质与特定致病菌分离鉴定着手,而缺乏对养殖环境微生物群落结构特征的解析。
本研究发现,山东长岛海域丰度最高的细菌菌群为变形细菌门、厚壁菌门、拟杆菌门、浮霉菌门、放线菌门、SBR1093、疣微菌门等。付新华等(2017)和白洁等(2009)研究表明,环境微生物群落因海区和季节不同呈动态变化。对比不同采样时间,变形菌、拟杆菌、放线菌、浮霉菌等在渤海海洋保护区典型海域与黄海北部海域也被发现为主要优势菌,这些菌应该是海洋环境中普遍存在的细菌门类。疣微菌在秋季的渤海海域也是优势菌门(付新华等, 2017),但白洁等(2009)研究表明,在黄海北部海域水环境的优势菌组成中未包含该菌,推测疣微菌门可能为渤海海域特有的优势菌。在属分类水平上,本次调查海区发现217属,付新华等(2017)调查的渤海海区为227属,具有较好的区域一致性。然而,本次调查的长岛海域与付新华等(2017)调查的渤海保护区在蓝细菌门丰度上差异很大,这可能跟采样季节有关,本次采样时间在冬季,而付新华等(2017)采样时间在秋季,肖天等(2002)研究表明,低温不利于蓝细菌生存繁殖。
藻类和微生物群落之间相互利用、相互选择,在藻类周围形成特有的微生物群落结构(Fisher et al, 1998)。通过聚类分析发现,长岛海域紫菜CDPF的微生物群落结构明显区别于相邻的2个区域,而相距较远的CDCNS和CDCOS区的微生物群落结构反而更为接近,这说明紫菜养殖确实对环境中微生物群落结构产生了影响。条斑紫菜养殖区水环境中特有的优势菌属包括鼠尾菌属、假单胞菌属、盐单胞菌属、赤杆菌属、海杆菌属、海洋粘细菌属、副球菌属,其中,部分种属已在不同海区、不同紫菜样品的藻际微生物中被证实为优势菌。杨锐等(2008)从山东青岛的条斑紫菜叶状体表面分离得到海杆菌;武洪庆(2012)分别在射阳、连云港和大平三地的条斑紫菜表面分离得到了假单胞菌属;沈梅丽等(2013)在坛紫菜(Pyropia haitanensis)特有的共附生细菌中分离到赤杆菌属和副球菌属。在不同海区不同紫菜样品或紫菜养殖区中,海杆菌属、假单胞菌属、赤杆菌属和副球菌属作为优势菌被检测或分离到,因此,作者推测,它们是典型的紫菜外生细菌组成,应与紫菜生长息息相关,但是,彼此间的互作关系尚需进一步深入探明。
通过藻际微生物研究发现,假交替单胞菌为条斑紫菜优势附生菌,且对条斑紫菜叶状体和丝状体生长均无不良影响(杨锐等, 2008)。杨锐等(2008)没有在其紫菜样品的相应生活水体中分离到该菌,可能由于所采用的第1代测序技术通量低,难以检测到水体中的低丰度菌,而假交替单胞菌在水体中丰度较低。通过对条斑紫菜丝状体黄斑病进行培养、分离等研究发现,河豚毒素假交替单胞菌可能为重要的致病菌组成(王洪斌等, 2011)。对条斑紫菜叶状体绿斑病的研究发现,柠檬假交替单胞菌是致病的直接因素(闫咏等, 2002)。本研究对长岛紫菜养殖区与非养殖区调查发现少量假交替单胞菌,其相对丰度小于0.1%,且不同区域间假交替单胞菌的分布没有差异。调查结果未发现河豚毒素假交替单胞菌和柠檬假交替单胞菌,可能由于其丰度极低而未被检测到。
水环境中细菌多样性既与附近生物体的代谢活动、生理特征有关,又与环境因子(温度、盐度、DO、pH、营养盐等)相关(胡晓娟, 2013)。本次调查结果发现,环境因子在区域间具有较为明显的规律性,如DO、pH呈现由近岸到外海逐渐递减,TSS、Si和P呈由近岸到外海逐渐递增,NH4+-N的含量也在CDCOS区最高。由于调查海域有贝类养殖,且与CDCOS区较近,而离CDCNS区最远。贝类养殖消耗O2造成DO下降,排泄造成TSS和N、P等无机营养盐升高。而CDPF区NH4+-N大大低于CDCNS区,则是由紫菜生长消耗而致。而CDPF区的盐度也略高于其他2个区域,其原因尚未知。通过关联以上环境参数与环境微生物分析发现,二者在空间分布上具有一定的关联性,如嗜氨菌属需生长在高浓度氨离子的环境中,对氨有很强的依赖性(Zaitsev et al, 1998),因此,其分布与NH4+的空间分布呈显著正相关,成为CDCOS区典型的优势菌。盐单胞菌属为嗜盐菌,喜繁盛于盐度较高的盐场附近或海洋中(刘军华等, 2009)。本研究发现,盐单胞菌属的分布受盐度影响较大。CDPF区盐度较CDCNS和CDCOS区略高,盐单胞菌属则成为CDPF区特异性的优势菌。由于盐单胞菌属具有反硝化作用(赵贵成等, 2011),可将海水中的NO3–还原为NH4+,而紫菜在摄取氮盐的过程中,优先消耗NH4+-N(Bronk et al, 1994),因此,盐单胞菌属的富集对紫菜生长应是有利的。
Bai J, Li HY, Zhao YG. Bacterial distribution at different stations in the Northern Yellow Sea. Acta Microbiologica Sinica, 2009, 49(3): 343-350 [ 白洁, 李海艳, 赵阳国. 黄海北部不同站位海洋细菌群落分布特征. 微生物学报, 2009, 49(3): 343-350 DOI:10.3321/j.issn:0001-6209.2009.03.010] |
Bronk DA, Glibert PM, Ward BB. Nitrogen uptake disolved organic nitrogen release and new production. Science, 1994, 265(5180): 1843-1846 DOI:10.1126/science.265.5180.1843 |
Chen GY, Shen HS, Zhu MX, et al. Preliminary investigation on attaching bacteria and disease bacteria in thalli of Porphyra yezoensis. Journal of Aquaculture, 1999(1): 17-19 [ 陈国耀, 沈怀舜, 朱庙先, 等. 条斑紫菜叶状体附生菌及病原菌的初步调查. 水产养殖, 1999(1): 17-19] |
Fisher MM, Wilcox LW, Graham LE. Molecular characterization of epiphytic bacterial communities on Charophycean green algae. Applied and Environmental Microbiology, 1998, 64(11): 4384-4389 |
Fu XH, Liu GN, He JL, et al. Analysis of microbial community diversity in the Bohai Sea marine protected areas of the Shandong Province. Marine Sciences, 2017, 41(1): 39-47 [ 付新华, 刘国宁, 何健龙, 等. 山东省渤海海洋保护区典型海域表层海水微生物群落多样性分析. 海洋科学, 2017, 41(1): 39-47] |
Gai SS, Zhang WD. Microbiota of shell-boring conchocelis of Pyropia yezoensis determined by the next-generation sequencing. Oceanologia et Limnologia Sinica, 2016, 47(5): 990-996 [ 盖珊珊, 张伟东. 基于第二代测序技术的条斑紫菜(Pyropia yezoensis)贝壳丝状体附生菌群研究. 海洋与湖沼, 2016, 47(5): 990-996] |
Hu XJ. Analysis on microbial community characteristics in the typical sea areas in Guangdong Province. Master's Thesis of Jinan University, 2013, 46-49 [ 胡晓娟. 广东典型海域微生物群落特征分析. 暨南大学硕士研究生学位论文, 2013, 46-49] |
Li XL, Wang WJ, Liang ZR, et al. Antioxidant physiological characteristics of wild Pyropia yezoensis under desiccation stress. Progress in Fishery Sciences, 2017, 38(5): 156-163 [ 李晓蕾, 汪文俊, 梁洲瑞, 等. 野生条斑紫菜叶状体对干出胁迫的抗氧化生理响应特征. 渔业科学进展, 2017, 38(5): 156-163] |
Li W, Mamat O, Xu JL, et al. Comparative study of volatile components from tow strains of Pyropia haitanensis in different culture areas. Progress in Fishery Sciences, 2016, 37(5): 147-156 [ 李微, 阿曼尼萨·买买提, 徐继林, 等. 不同海域不同品种坛紫菜(Pyropia haitanensis)挥发性成分的比较分析. 渔业科学进展, 2016, 37(5): 147-156] |
Liu JH, Long C, Lu XL, et al. from the East China Sea. Chinese Journal Marine Drugs, 2009, 28(6): 5-10 [ 刘军华, 龙聪, 卢小玲, 等. 一株来源于东海的盐单胞菌的鉴定及活性筛选. 中国海洋药物杂志, 2009, 28(6): 5-10] |
Patrick DS, Sarah LW, Thomas R, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541 DOI:10.1128/AEM.01541-09 |
Shen ML, Yang R, Luo QJ, et al. Microbial diversity of Pyropia haitanensis phycosphere during cultivation. Acta Microbiologica Sinica, 2013, 53(10): 1087-1102 [ 沈梅丽, 杨锐, 骆其君, 等. 坛紫菜养殖周期中的藻际微生物多样性. 微生物学报, 2013, 53(10): 1087-1102] |
Wang HB, Li XS, Xia YM, et al. Isolation, identification and biological pathogen of yellow spot disease in conchocelis of Porphyra yezoensis. Marine Environmental Science, 2011, 30(3): 361-364 [ 王洪斌, 李信书, 夏亚明, 等. 条斑紫菜丝状体黄斑病病原体分离鉴定及生物学特性研究. 海洋环境科学, 2011, 30(3): 361-364 DOI:10.3969/j.issn.1007-6336.2011.03.013] |
Wu HQ. Epibacterial community structure of several macroalgae. Doctoral Dissertation of University of Chinese Academy of Sciences, 2012, 50-51 [ 武洪庆. 不同养殖海藻表面附着细菌多样性分析. 中国科学院大学博士研究生学位论文, 2012, 50-51] |
Xiao T, Wang R. Distribution of Synechococcus in the Bohai Sea in Autumn and Spring. Acta Ecologica Sinica, 2002, 22(12): 2071-2078 [ 肖天, 王荣. 春季与秋季渤海蓝细菌(聚球蓝细菌属)的分布特点. 生态学报, 2002, 22(12): 2071-2078 DOI:10.3321/j.issn:1000-0933.2002.12.008] |
Yan Y, Ma JH, Xu P, et al. Pseudoalteromonas citrea, the causative agent of green -spot disease of Porphyra yezoensis. Journal of Fishery Sciences of China, 2002, 9(4): 353-358 [ 闫咏, 马家海, 许璞, 等. 1株引起条斑紫菜绿斑病的柠檬假交替单胞菌. 中国水产科学, 2002, 9(4): 353-358 DOI:10.3321/j.issn:1005-8737.2002.04.014] |
Yang R, Fang WY, Shan YY, et al. Genetic diversity of epiphytic bacteria in Porphyra yezoensis. Acta Oceaologica Sinica, 2008, 30(4): 161-168 [ 杨锐, 方文雅, 单媛媛, 等. 条斑紫菜外生细菌的遗传多样性. 海洋学报, 2008, 30(4): 161-168 DOI:10.3321/j.issn:0253-4193.2008.04.020] |
Zaitsev GM, Tsitko IV, Rainey FA, et al. New aerobic ammonium-dependent obligately oxalotrophic bacteria: Description of Ammoniphilus oxalaticus gen. nov., sp. Nov. and Ammoniphilus oxalivorans gen.nov., sp. nov. International. Journal of Systematic Bacteriology, 1998, 48(1): 151-163 |
Zhang DY, Zhang TX, Wang GX. Development and application of second-generation sequencing technology. Environmental Science and Technology, 2016, 39(9): 96-102 [ 张丁予, 章婷曦, 王国祥. 第二代测序技术的发展及应用. 环境科学与技术, 2016, 39(9): 96-102] |
Zhao GC, Zhang T, Gao Y, et al. Identification and bioactivities analysis of Halomonas sp.from seawater. Academic Journal of Second Military Medical University, 2011, 32(8): 813-817 [ 赵贵成, 张韬, 高云, 等. 海洋盐单胞菌属微生物的鉴定及生物学活性分析. 第二军医大学学报, 2011, 32(8): 813-817] |



