2. 农业农村部海洋渔业可持续发展重点实验室中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 青岛瑞滋海珍品发展有限公司 青岛 266400
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. Qingdao Ruizi Seafood Development Co., Ltd, Qingdao 266400
刺参(Apostichopus japonicus),又名仿刺参,在中国主要分布于山东半岛和辽东半岛沿海,是中国北方地区重要的海珍品之一,具有很高的药用与营养价值(Bordbar et al, 2011)。随着刺参集约化养殖的发展,各种传染性疾病也频频发生,如耳状幼体时期的烂边病、烂胃病,稚参时期的化板症、肠炎病和腐皮综合征等(王印庚等, 2012、2013; 张文泽等, 2015; 逄慧娟等, 2017),给刺参养殖业造成了巨大的经济损失。
感染微生态学认为,细菌性疾病的发生与体内菌群失调密切相关。解析刺参早期发育时期体内菌群结构及其与环境菌群相关性对其健康养殖具有重要意义。近年来,对于刺参肠道菌群结构的研究已成为热点,肠道内的细菌群落组成直接受到刺参栖息环境中的菌群变化影响(李彬等, 2012),且与疾病发生密切相关。现已对刺参肠道、肠含物及养殖环境(水、底泥、附着基)菌群(Gao et al, 2014a, b ; Zhang et al, 2013 ;李彬等, 2016),以及不同季节、养殖时期和盐度下刺参肠道菌群结构开展了相关研究(关晓燕等, 2011; 李建光等, 2014; 李彬等, 2012; 王姣姣等, 2015a, b),而关于刺参早期发育各阶段体内菌群结构的研究未见报道。刺参早期发育过程包括受精卵、囊胚期、原肠期、耳状幼体、樽形幼体、五触手幼体和稚参几个时期。其中,耳状幼体摄食单胞藻等饵料,樽形幼体不摄食,五触手幼体和稚参之后阶段属沉积性食性。解析其肠道菌群的发生、发展以及变化,将为建立纠正肠道菌群失调、增强机体体质、提高抗病力的微生态学方法提供理论依据。本研究以传统培养方法,对养殖刺参早期发育各阶段幼体体内及环境(投入饵料及培育用水)菌群的组成与结构开展研究,对分离的优势细菌进行分子鉴定,在此基础上,进行了刺参幼体体内菌群结构与环境菌群结构相关性分析,以期为解析刺参消化道菌群的形成过程和演替规律以及养殖用益生菌的筛选与应用奠定基础。
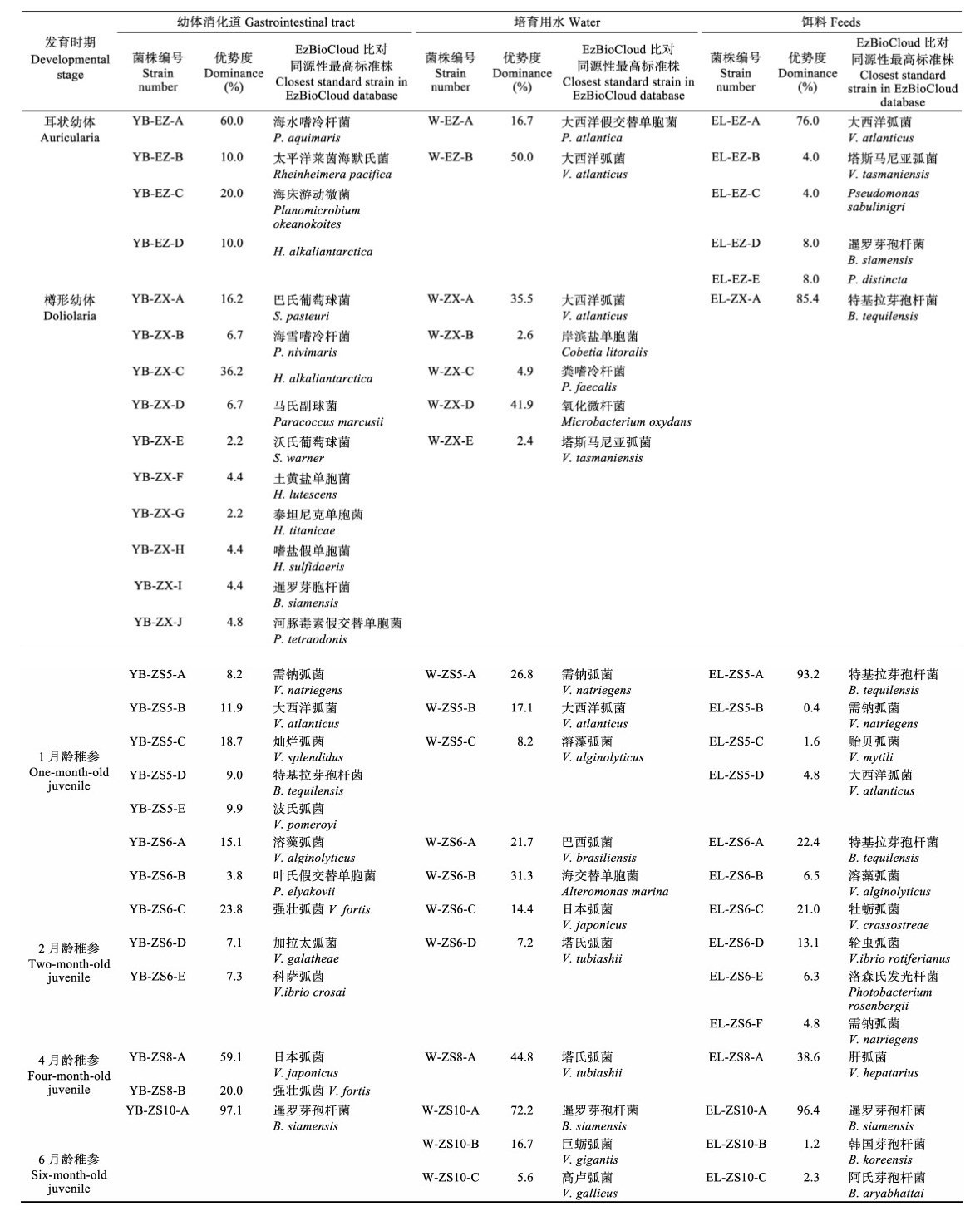
1 材料与方法 1.1 早期发育阶段养殖刺参样品的采集及处理2017年3~10月,在山东青岛瑞滋海珍品发展有限公司采集样品。亲参为升温促熟的成熟刺参,育苗用水为砂滤海水。分别采集发育成熟的雌性性腺(CX)、雄性性腺(XX)以及未受精卵(L)、受精卵(SJL)、原肠胚(YC)、耳状幼体(EZ)、樽形幼体(ZX)和附着后1月龄(ZS5)、2月龄(ZS6)、4月龄(ZS8)、6月龄(ZS10)时期的稚参,同时,采集同期培育池进水口水样(W)与饵料(EL)。
1.1.1 刺参幼体肠道的采样及处理鉴于浮游期无法区分肠道,故这几个发育期的幼体经250目灭菌筛绢收集后,用灭菌3% NaCl溶液反复冲洗数次,对幼体计数后,研磨、匀浆、梯度稀释,然后涂布于含1.5% NaCl的TSA和TCBS琼脂培养基,每梯度3个平行。对于稚参时期后的样本,采样方法为停食12 h,空胃后解剖摘取稚参肠道,用灭菌3% NaCl溶液冲洗肠道。对采集的肠道称重后研磨、匀浆、梯度稀释,然后涂布TSA和TCBS琼脂培养基,每梯度3个平行。涂布后的平板在28℃恒温培养箱中培养24 h,根据TSA和TCBS琼脂培养基上的菌落数,计算各样品中的可培养细菌总数和可培养弧菌(Vibrio)总数。
1.1.2 培育用水与饵料的采样及处理分别收集各幼体发育时期培育用进水口水样和所投喂饵料样本。初耳幼体时期的饵料主要为代用饵料(海洋红酵母、干酵母等)与螺旋藻混合而成,大耳幼体向樽形幼体转变时期的饵料又添加了EM菌、食母生片,稚参时期的饵料主要为基础配合饲料[原料为马尾藻(Scagassum)、海带(Laminaria japonica)、扇贝边]与新鲜海泥混合而成。培养及计数方法同1.1.1,计算各样本中的可培养细菌总数和弧菌总数。
1.2 菌株的分离、纯化与保藏根据菌落形态、颜色、大小等特征,对不同时期幼体、培育用水和饵料样本TSA培养基获得的可培养细菌进行分类和优势度统计,对优势菌进行分离、纯化并保种。
1.3 细菌16S rDNA序列测定采用热裂解法制备细菌DNA,采用16S rDNA序列进行细菌鉴定,所用引物:27F 5'-AGAGTTTGATC(C/A)TGGCTCAG-3',1492R 5'-TACGG(C/T)TACCTTGTTACGACTT-3。反应体系及扩增条件采用史秀清等(2015)方法。扩增产物由生工生物工程(上海)有限公司进行测序,测序结果采用Contigexpress软件拼接后与EzBioCloud数据库进行同源性比对,选出相似性最高、分类地位清楚的标准菌株,对各样品中的菌株进行汇总及分类分析。
1.4 数据分析菌落计数统计结果采用SPSS 17.0软件,用单因子方差分析(One-way ANOVA)和Duncan’s多重比较进行差异显著性检验,结果用平均值±标准差(Mean±SD)表示,P<0.05为差异性显著。根据16S rDNA鉴定结果,统计各菌株在刺参幼体不同时期、不同样本的分布情况,基于属的分类水平利用R语言软件包对各样本相关性进行主成分分析(PCA分析)。
2 结果 2.1 幼体不同发育期体内及环境可培养细菌的定量分析以TSA培养获得的菌落数对各样本可培养细菌的定量分析结果见表 1。从表 1可以看出,在幼体开口前的各发育时期(性腺、未受精卵、受精卵、原肠胚)所采集的样本均未培养出可培养细菌;当胚胎发育到耳状幼体以后,开始投喂饵料,此后的耳状幼体、樽形幼体体内可分离获得可培养细菌,但数量级较低,为101 CFU/ind.;至幼体发育到稚参以后,消化道可培养细菌总数急剧增加,数量级为105~108 CFU/g,并在4月龄时达到最大数量级(108 CFU/g)。整个育苗期用水中可培养细菌数量级较低,且维持在一个相对稳定的水平,为102 CFU/ml;鉴于不同发育期饵料种类不同,各发育时期投喂的饵料中可培养细菌数量差异显著,数量级为103~107 CFU/ml。
|
|
表 1 不同发育时期刺参幼体体内及养殖系统中可培养细菌总数(对数值) Tab.1 The total number (Logarithm) of culturable bacteria in gastrointestinal tract of sea cucumber larva at different developmental stages and its aquaculture system |
以TCBS琼脂平板培养获得的菌落数对各样本可培养弧菌的定量分析结果见表 2。从表 2可以看出,在幼体开口前的各发育时期(性腺、未受精卵、受精卵、原肠胚)及投饵后的耳状幼体、樽形幼体时期均未获得可培养弧菌;至幼体发育到稚参以后,消化道可培养弧菌急剧增加,数量级为104~107 CFU/g,并在4月龄时达到最高。在养殖系统中,虽然,整个育苗期用水中可培养弧菌数量级变化不明显,且维持在一个相对稳定的水平(102 CFU/ml),但可培养弧菌占可培养细菌的比例波动较大,幅度为14.0%~97.3%;各发育时期所投喂的饵料中,可培养弧菌数量差异显著,除了1~2月龄稚参时期中可培养弧菌数量级达到106~107 CFU/ml,且可培养弧菌占可培养细菌的比例分别为75.7%和83.7%外,其他饵料中均未检测到弧菌。
|
|
表 2 不同发育时期刺参幼体体内及养殖系统中可培养弧菌数量(对数值)及占比 Tab.2 The number (Logarithm) and proportion of culturable Vibrios in gastrointestinal tract of sea cucumber larva at different developmental stages and its aquaculture system |
根据各时期不同样品中TSA上所培养细菌的菌落形态,共获得优势细菌65株,其中,幼体、培育用水、饵料中的菌株数量分别为27株、18株和20株。将获得的16S rDNA测序结果与EzBioCloud数据库中标准菌株的16S rDNA序列进行同源性比对分析的鉴定结果见表 3和表 4。从表 3和表 4可以看出,65株细菌共鉴定到3门4纲14属43种,分属于放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria) 3个门,放线菌纲(Actinobacteria)、芽孢杆菌纲(Bacilli)、α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria) 4个纲,优势属包括弧菌属(Vibrio)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)等,其中,弧菌属种类最多,为18种。
|
|
表 3 不同发育时期刺参幼体体内及养殖系统可培养优势菌鉴定结果 Tab.3 The results of identification of culturable dominant bacteria in gastrointestinal tract of sea cucumber at different developmental stages and its aquaculture system |
|
|
表 4 不同发育时期刺参幼体体内及养殖环境可培养优势菌系统分类 Tab.4 Classification of culturable dominant bacteria in gastrointestinal tract of sea cucumber at different developmental stages and its aquaculture system |
从不同发育期刺参消化道内优势菌鉴定结果可以看出,耳状幼体期,幼体体内分离出4株优势菌,优势度最高的为海水嗜冷杆菌(Psychrobacter aquimaris),优势度占60.0%;樽形幼体时期,幼体体内菌种多样性很高(10株,6个属),各菌株的优势度为2.2%~36.2%,优势度最高的属为盐单胞菌属(Holomonas),占47.2%;发育到稚参以后,1、2、4和6月龄时期,稚参消化道中的优势菌株分别为5株、5株、2株和1株,但鉴定后集中到弧菌属、芽孢杆菌属和假交替单胞菌属(Pseudoalteromonas),6月龄时,稚参消化道中的优势属仅有芽孢杆菌属。由此可以看出,随着幼体的发育,幼体时期体内的菌群多样性较高,而发育到稚参以后,其肠道菌群相对稳定。
从各发育期培育用水分离的优势菌可以看出,尽管培育用水中可培养细菌总数较低,但水样中细菌的种类却很丰富,在耳状幼体、樽形幼体、1、2、4和6月龄稚参培育期水样中的优势菌株分别为2株、5株、3株、4株、1株和3株。根据鉴定结果可以看出,水样中弧菌种类所占优势度较高,为22.3%~52.1%。
从同期培育所用饵料中分离得到的优势菌鉴定结果可以看出,由于不同发育期所使用的饵料种类不同,各时期细菌种类和丰度差异显著,在耳状幼体时期所用饵料共分离出5株优势菌,其中,大西洋弧菌(Vibrio atlanticus)丰度最高,达到76.0%;樽形幼体时期所用饵料仅分离出1株优势菌,为特基拉芽胞杆菌(Bacillus tequilensis),优势度达到85.4%;幼体发育到底栖生活的稚参以后,其优势细菌种类较为丰富,在1、2、4和6月龄稚参培育期,饵料中的优势菌种类分别为4株、6株、1株和3株,饵料中以芽孢杆菌(Bacillus sp.)和弧菌为主要种类,优势度分别为8.0%~100.0%和6.8%~ 80.0%。
2.3 不同发育期幼体体内菌群与环境菌群相关性分析对比不同发育期幼体、培育用水和饵料的优势细菌组成可以看出,从时间轴来看,盐单胞菌(Halomonas alkaliantarctica)成为耳状幼体、樽形幼体共有优势菌;2~4月龄时,强壮弧菌(Vibrio fortis)是其消化道的共有优势菌;从养殖系统这一空间轴来看,在耳状幼体和樽形幼体时期,幼体、水和饵料中无共有优势菌;1月龄时,饵料、水中的大西洋弧菌、需纳弧菌(Vibrio natriegens)在幼体中完成了较好的定植,其次是饵料中的特基拉芽胞杆菌;2月龄时,溶藻弧菌(Vibrio alginolyticus)是消化道和饵料中的共同优势菌;6月龄时,来自饵料、水中的暹罗芽胞杆菌(Bacillus siamensis)在消化道内完成了较好的定植。相应结果显示,在幼体发育到营底栖生活以后,其体内的菌株与饵料中的优势菌株具有较好的相关性。
鉴于16S rDNA鉴定结果在属水平上的准确性高,从属水平上分析相应菌株的分类地位及在整个培育时期养殖系统的分布结果见表 4。从表 4可以看出,检出率较高的属为弧菌属(41.9%)、芽孢杆菌属(9.3%)、假交替单胞菌属(9.3%)、盐单胞菌属(9.3%)。对比幼体、培育用水和饵料中各细菌属水平上的分布可以看出,芽孢杆菌属、假交替单胞菌属和弧菌属是在3个系统中同时检出的菌属,嗜冷杆菌属(Psychrobacter)是在幼体及水中共检出的菌。进一步对比,共检出菌在系统中的分布可以看出,在幼体发育早期(樽形时期)幼体与水中的共有菌较多,而发育到底栖生活(1、2、4和6月龄)时期,幼体中与饵料中的共有菌较多。
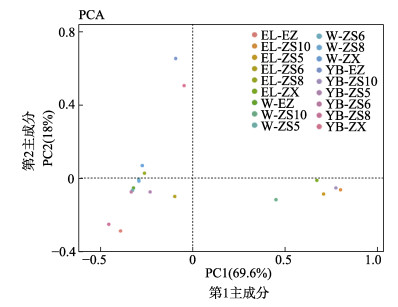
在属的水平进行各样本相关性的主成分分析(Principal Component Analysis, PCA)结果见图 1。从图 1可以看出,第1主成分PC1对样品差异的贡献值为69.6%,第2主成分PC2对样品差异的贡献值为18%。根据不同发育期各样本所处的位置可以看出,第2主成分对浮游期(耳状幼体和樽形幼体)和底栖生活期(1、2、4月龄)差异贡献较大,而发育到6月龄时,第1主成分则对样品差异贡献显著。根据相同时期幼体与水和饵料所处的位置可以看出,浮游幼体时期,幼体菌群与培育用水菌群和饵料菌群相距较远,表明二者对幼体菌群影响均不大;随着幼体的发育,当幼体发育到1月龄后,幼体菌群与培育用水菌群相距小于其与饵料菌群的距离,表明水对幼体菌群影响较大,当发育到6月龄时,其幼体体内肠道菌群与饵料距离最近,表明受饵料影响较大。
|
图 1 不同发育时期刺参幼体体内菌群与环境菌群差异的主成分分析 Fig.1 PCA of the samples among the gastrointestinal tract of sea cucumber at different developmental stages and its aquaculture system |
肠道菌群作为肠道的重要组成部分,与宿主以及所处的环境存在相互依赖和相互制约的关系,不仅影响着食物中营养物质的消化、吸收,还在宿主免疫反应中发挥重要作用(Schrijver et al, 2000; Zhao et al, 2012 )。以刺参早期发育期体内菌群结构为研究对象,解析体内菌群结构演替和变化规律以及其与环境菌群的相关性,将为刺参苗种的健康管理提供理论基础。
本研究通过传统细菌学培养方法结合优势菌鉴定,对养殖刺参早期发育各时期幼体体内可培养细菌进行了定量分析。在幼体开口摄食前,体内没有培养出可培养细菌;开口并摄食后,从浮游时期发育到底栖生活,其体内的可培养细菌总数急剧增加,表明肠道细菌是随着摄食行为的进行而使特定菌株在肠道内逐步定植的过程。通过TCBS弧菌选择性培养基对幼体体内弧菌数量进行测定,表明自刺参发育到营底栖生活后,弧菌开始检出,且一直是占据体内菌群的优势菌属。史秀清等(2015)对大菱鲆(Scophthalmus maximus)仔稚鱼发育期消化道可培养细菌的菌群特征进行分析发现,消化道中的细菌数量逐渐增加,且弧菌已成为仔稚鱼后期消化道中的优势菌群。Zhao等(2012)对杂色鲍(Haliotis diversicolor)不同发育阶段幼体消化道菌群的研究发现,幼体开始摄食后的消化道细菌数量要比未摄食时高,弧菌属的细菌成为之后3个发育阶段中消化道的优势菌。Verner-Jeffreys等(2003)研究了3个不同孵化场的大西洋庸鲽(Hippoglossus hippoglossus)仔稚鱼消化道菌群演替时发现,在仔稚鱼开口摄食后,消化道菌群的数量呈稳定增长;随着仔稚鱼的生长,弧菌属细菌逐渐取代假交替单胞菌属细菌成为消化道中的优势菌种。这些研究均表明,水产动物肠道菌群的形成是动物摄食饵料后,对饵料中特定菌株的选择性定植和扩增的过程,弧菌作为海洋细菌的重要种类,也在海水养殖动物肠道菌群中占有重要地位。
根据各优势菌株分类鉴定结果可以看出,早期发育阶段耳状幼体(含4属)、樽形幼体(含6属)的消化道菌群多样性较高,1~6月龄稚参的消化道菌群趋于单一,仅含弧菌属和芽孢杆菌属2个属,推测刺参消化系统在幼体发育完全后,才对定植的细菌具有较强的选择性,且其消化道对弧菌属和芽孢杆菌属细菌的选择性更强,与本研究结果相似。Grisez等(1997)对金头鲷(Sparus aurata)和欧洲舌齿鲈(Dicentrarchus labrax)的研究结果推测,消化系统在稚鱼和成鱼发育完全后,才对弧菌属细菌具有选择性。
本研究从分离优势菌的属水平、种水平并利用PCA方法,分析了刺参早期发育阶段幼体体内菌群与养殖系统中培育用水和饵料菌群的相关性。结果表明,在幼体发育初期,其体内菌群与培育用水的相关性较大,而随着幼体发育的进行,其体内菌群结构与饵料的相关性逐渐增加。Verner-Jeffreys等(2003)研究表明,大西洋庸鲽仔稚鱼开口摄食后,其消化道内菌群存在明显演替现象,优势菌属由未开口的卵黄囊阶段时,假交替单胞菌属变为以灿烂弧菌(Vibrio splendidus)、溶藻弧菌的弧菌属,且饵料中仅有一部分细菌能够定植于仔鱼的消化道。史秀清等(2015)对大菱鲆仔稚鱼发育期消化道的可培养细菌菌群进行分析发现,生物饵料中的细菌对仔稚鱼消化道中可培养菌群结构的形成产生的影响相对较大,而水中的细菌似乎没有对仔稚鱼的消化道菌群产生影响。Sugita等(2002)对牙鲆(Paralichthys olivaceus)仔稚鱼消化道细菌的种类和数量的研究也发现,消化道菌群会随投喂不同饵料而变化,受水体中菌群的影响较小。但也有学者认为, 水中的微生物菌群对水生动物消化道菌群影响显著,Tanasomwang等(1989)研究牙鲆仔稚鱼时发现,水中的菌群组成会明显影响仔稚鱼的消化道菌群组成。周金敏等(2010)对黄颡鱼(Pelteobagrus fulvidraco)肠道和养殖水体中的微生物菌群进行研究时发现,黄颡鱼肠道与养殖水体中的优势菌基本相同,均为肠杆菌科(Enterobacteriaceae)、气单胞菌属(Aeromonas)和不动杆菌属(Acinetobacter)细菌。本研究表明,刺参幼体发育过程中,体内的细菌菌群经历了由培育用水到发育后期与饵料密切相关的过程,可见养殖环境中水和饵料对体内菌群的建立和演替均起到重要作用。
Bordbar S, Anwar F, Saari N. High-value components and bioactives from sea cucumbers for functional foods—A review. Marine Drugs, 2011, 9(10): 1761-1805 DOI:10.3390/md9101761 |
Gao F, Li FH, Tan J, et al. Bacterial community composition in the gut content and ambient sediment of sea cucumber Apostichopus japonicus revealed by 16S rRNA gene pyrosequencing. Public Library of Science, 2014a, 9(6): 1-10 |
Gao F, Tan J, Sun HL, et al. Bacterial diversity of gut content in sea cucumber (Apostichopus japonicus) and its habitat surface sediment. Journal of Ocean University of China, 2014b, 13(2): 303-310 DOI:10.1007/s11802-014-2078-7 |
Grisez L, Reyniers J, Verdonck L, et al. Dominant intestinal microflora of sea bream and sea bass larvae, from two hatcheries, during larval development. Aquaculture, 1997, 155(1-4): 387-399 DOI:10.1016/S0044-8486(97)00113-0 |
Guan XY, Zhou ZC, Jiang B, et al. Environmental bacterial diversity in sea cucumber (Apostichopus japonicus) culture under different salinities based on DGGE fingerprint. Fisheries Science, 2011, 30(5): 276-280 [ 关晓燕, 周遵春, 姜冰, 等. DGGE分析不同盐度仿刺参养殖环境中菌群多样性. 水产科学, 2011, 30(5): 276-280 DOI:10.3969/j.issn.1003-1111.2011.05.006] |
Li B, Liao MJ, Rong XJ, et al. Correlation analysis of flora in the habitat environment and in the gut contents of sea cucumber (Apostichopus japonicus). Progress in Fishery Sciences, 2016, 37(5): 127-132 [ 李彬, 廖梅杰, 荣小军, 等. 池塘养殖仿刺参(Apostichopus japonicus)肠含物、附着基和底泥中的菌群结构及其相关性. 渔业科学进展, 2016, 37(5): 127-132] |
Li B, Rong XJ, Liao MJ, et al. Annual changes of total heterotrophic bacteria and Vibrios in the intestine of Apostichopus japonicus and its culture pond. Marine Sciences, 2012, 36(4): 63-67 [ 李彬, 荣小军, 廖梅杰, 等. 刺参肠道与养殖池塘环境中异养细菌和弧菌数量周年变化. 海洋科学, 2012, 36(4): 63-67] |
Li JG, Xu YP, Li XY, et al. Characterization of bacterial communities associated with the intestinal tracts and culture environment of sea cucumber (Apostichopus japonicus) in different culture seasons. Fisheries Science, 2014, 33(9): 562-568 [ 李建光, 徐永平, 李晓宇, 等. 不同养殖季节仿刺参肠道与养殖环境中菌群结构的特点. 水产科学, 2014, 33(9): 562-568 DOI:10.3969/j.issn.1003-1111.2014.09.005] |
Pang HJ, Liao MJ, Li B, et al. 2017. Etiology and treatment of enteritis disease in cultured junviles of Apostichopus japonicas. Progress in fishery Sciences, 2017, 38(3): 188-197 [ 逄慧娟, 廖梅杰, 李彬, 等. 刺参(Apostichopus japonicus)保苗期"肠炎病"及其治疗方法. 渔业科学进展, 2017, 38(3): 188-197] |
Schrijver RD, Ollevier F. Protein digestion in juvenile turbot (Scophthalmus maximus) and effects of dietary administration of Vibrio proteolyticus. Aquaculture, 2000, 186(1-2): 107-116 DOI:10.1016/S0044-8486(99)00372-5 |
Shi XQ, Zhang Z, Wang YG, et al. The characteristics of culturable bacterial microflora in the gastrointestinal tract of turbot (Scophthatmus maximus) larvae. Progress in Fishery Sciences, 2015, 36(4): 73-82 [ 史秀清, 张正, 王印庚, 等. 大菱鲆(Scophthalmus maximus)仔稚鱼发育期消化道可培养细菌的菌群特征分析. 渔业科学进展, 2015, 36(4): 73-82] |
Sugita H, Okano R, Suzuki Y, et al. Antibacterial abilities of intestinal bacteria from larval and juvenile Japanese flounder against fish pathogens. Fisheries Science, 2002, 68(5): 1004-1011 DOI:10.1046/j.1444-2906.2002.00525.x |
Tanasomwang V, Muroga K. Intestinal microflora of rockfish Sebastes schlegeli, tiger puffer Takifugu rubripes and red grouper Epinephelus akaara at their larval and juvenile stages. Nippon Suisan Gakkaishi, 1989, 55(8): 1371-1377 DOI:10.2331/suisan.55.1371 |
Verner-Jeffreys DW, Shields RJ, Bricknell IR, et al. Changes in the gut-associated microflora during the development of Atlantic halibut (Hippoglossus hippoglossus L. ) larvae in three British hatcheries. Aquaculture, 2003, 219(1-4): 21-42 |
Wang JJ, Li D, Song J, et al. Structural analysis of seawater bacterial community from culture pond of Apostichopus japonicus at different periods. Journal of Agricultural Science and Technology, 2015a, 17(2): 134-140 [ 王姣姣, 李丹, 宋坚, 等. 不同时期刺参养殖池塘海水菌群结构分析. 中国农业科技导报, 2015a, 17(2): 134-140] |
Wang JJ, Li D, Wang YN, et al. Bacterial flora in gut contents of sea cucumber Apostichopus japonicus at different culture periods. Journal of Dalian Ocean University, 2015b, 30(4): 345-350 [ 王姣姣, 李丹, 王轶南, 等. 不同养殖时期刺参肠道内菌群结构的分析. 大连海洋大学学报, 2015b, 30(4): 345-350] |
Wang YG, Rong XJ, Liao MJ, et al. Sea cucumber culture and disease control technology. Beijing: China Agriculture Press, 2013, 1-206 [ 王印庚, 荣小军, 廖梅杰, 等. 刺参健康养殖与病害防控技术丛解. 北京:中国农业出版社, 2013, 1-206] |
Wang YG, Guo WL, Rong XJ, et al. Isolation and identification of a pathogenic bacterium associated with off-plate syndrome from Apostichopus japonicus cultured in Liaoning Province. Progress in Fishery Sciences, 2012, 33(6): 81-86 [ 王印庚, 郭伟丽, 荣小军, 等. 养殖刺参"化板症"病原菌的分离与鉴定. 渔业科学进展, 2012, 33(6): 81-86 DOI:10.3969/j.issn.1000-7075.2012.06.012] |
Zhang WZ, Wang YG, Liao MJ, et al. Isolation and identification of the pathogenic bacteria of skin ulcerative syndrome (SUS) from Apostichopus japonicus juveniles in summer and study on its pathogenic threshold. Progress in Fishery Sciences, 2015, 36(6): 81-89 [ 张文泽, 王印庚, 廖梅杰, 等. 夏季保苗期刺参(Apostichopus japonicus)腐皮综合征病原菌的分离鉴定及其致病阈值. 渔业科学进展, 2015, 36(6): 81-89] |
Zhang XC, Nakahara T, Murase S, et al. Physiological characterization of aerobic culturable bacteria in the intestine of the sea cucumber Apostichopus japonicus. Journal of General and Applied Microbiology, 2013, 59(1): 1-10 DOI:10.2323/jgam.59.1 |
Zhao J, Shi B, Jiang QR, et al. Changes in gut-associated flora and bacterial digestive enzymes during the development stages of abalone (Haliotis diversicolor). Aquaculture, 2012, 338-341(1): 147-153 |
Zhou JM, Wu ZX, Zeng LB, et al. Microflora in digestive tract of yellow catfish (Pseudobagrus fulvidraco) and in the water. Journal of Huazhong Agricultural University, 2010, 29(5): 613-617 [ 周金敏, 吴志新, 曾令兵, 等. 黄颡鱼肠道及养殖水体中菌群的分析. 华中农业大学学报, 2010, 29(5): 613-617] |