2. 水产科学国家级实验教学示范中心 上海海洋大学 上海 201306
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306
2002~2003年,中国海南、广西等地池塘高密度养殖的凡纳滨对虾(Litopenaeus vannamei)出现“偷死”现象,并使当地对虾养殖业受到影响(章秋虎, 2004; 宋盛宪等, 2006; 徐志进等, 2009)。由于发病对虾主要在池底深水区陆续死亡,不容易被养殖者观察到,因此,被称为“偷死病”(Covert mortality disease, CMD)或“死底症”(邢华, 2004; 顾水江, 2012; Zhang et al, 2014)。患病个体表现出肝胰腺颜色变浅、萎缩,空肠空胃,生长缓慢等症状,很多时候还可见病虾腹节肌肉不透明或局部发白。患病对虾在水温较高(28℃以上)时死亡率升高,累计死亡率可达80% (Zhang et al, 2014、2017b)。
研究发现,一种新病毒——偷死野田村病毒(Covert mortality nodavirus, CMNV)是导致养殖对虾发生偷死病的病毒性病原(Zhang et al, 2014)。为了强调该疫病的病原学特征,CMD又被称为病毒性偷死病(Viral covert mortality disease, VCMD)(Zhang et al, 2017b)。CMNV可侵染多种甲壳类的肝胰腺和肌肉组织,在肝胰腺小管和淋巴器官上皮细胞,以及肌肉细胞内形成嗜酸性的包涵体,导致肝胰腺小管萎缩及肌肉纤维凝固状坏死(Zhang et al, 2014、2017b)。Liu等(2018)通过人工感染脊尾白虾(Exopalaemon carinicauda)开展了CMNV垂直传播途径研究,结果证实,CMNV能通过染病亲体的雌性或雄性生殖细胞传递至子代,实现从亲代到子代的垂直传播。Liu等(2018)研究发现,CMNV可感染虾类养殖池塘中的多种共生生物。
2013~2015年,在中国沿海地区11省市开展的CMNV流行病学调查显示,采集自辽宁、河北、天津、山东、江苏、浙江、福建、广东、广西和海南的发病虾类样品中均有CMNV阳性检出,其中,采自广东和海南的样品中的CMNV检出率最高,达52.6%和50.8%,采自辽宁、天津的样品中CMNV检出率最低,为10%和9.9%;CMNV的检出率基本呈现华南高于华东和华北的趋势(Zhang et al, 2017b)。凡纳滨对虾、中国明对虾(Fenneropenaeus chinensis)、日本囊对虾(Marsupenaeus japonicus)、斑节对虾(Penaeus monodon)和罗氏沼虾(Macrobrachium rosenbergii)等中国主要养殖虾类中均可检测到CMNV阳性,其中,日本囊对虾中CMNV检出率为60%,罗氏沼虾和中国明对虾检出率较低,分别为24%和22%(Zhang et al, 2017b)。
2015年作者实验室在来自厄瓜多尔和越南等地的发病养殖对虾样品中检出CMNV阳性,2017年在采集自马来西亚的对虾样品中检测到CMNV阳性。2016年,泰国2个实验室分别报道了当地发病凡纳滨对虾中存在CMNV高感染率的案例,利用RT- nPCR和荧光定量方法分析发现,CMNV的阳性检出率分别为30.4%和37.7% (Thitamadee et al, 2016; Pooljun et al, 2016)。上述研究中,CMNV的高流行率和广泛分布特征,揭示了CMNV具有在全球主要对虾养殖国家传播流行的较高风险。
在开展VCMD流行病学调查中发现,一些发病对虾中不存在CMNV原始株(河北株)的感染,但存在一种疑似CMNV变异株系的新型野田村病毒的感染,这种新型野田村病毒RNA依赖的RNA聚合酶基因(RdRp)序列与CMNV原始株相比存在较大程度的变异,其与CMNV原始株RdRp基因片段的相似性仅为78%,患病对虾表现出游泳性能下降、沉底的特点。由于这些样品中病原与CMNV原始分离株在核酸水平上差异明显,为了将其与CMNV原始株系区分开来,暂将其命名为“行动障碍野田村病毒(Movement disorder nodavirus, MDNV)”。
为更深入地了解2016~2017年间CMNV及新型野田村病毒——MDNV在中国主要虾类养殖地区的流行情况,本研究采用逆转录套式PCR (RT-nPCR) (Zhang et al, 2014)、逆转录环介导等温扩增技术(RT-LAMP)(Zhang et al, 2017a)和TaqMan实时荧光定量RT-PCR(TaqMan RT-qPCR) 3种方法对2016~ 2017年采集自中国沿海省市虾类样品中CMNV和MDNV的流行情况进行了系统分析,以期阐明最近2年CMNV和MDNV在沿海各省市主要虾类养殖种类中的流行和分布情况,了解新发野田村病毒对养殖虾类的危害风险。
1 材料与方法 1.1 样品来源2016年从河北、河南、山东、江苏、上海、浙江、福建、广东和海南等地共采集254份虾类样品,包括凡纳滨对虾、中国明对虾、日本囊对虾、斑节对虾、脊尾白虾、罗氏沼虾和日本沼虾(Macrobrachium nipponense)。2017年从河北、河南、山东、江苏、上海、浙江、福建和广东等地共采集387份虾类样品,种类包括凡纳滨对虾、中国明对虾、日本囊对虾、斑节对虾、脊尾白虾和罗氏沼虾。2016~2017年所采集样品的信息见表 1和表 2。所采集虾类样品的肝胰腺和肌肉等组织保存于95%乙醇溶液中备用。
|
|
表 1 样品采集省市及数量信息 Tab.1 Sampling sites and the amount of samples |
|
|
表 2 样品种类及数量信息 Tab.2 The information of sampling species and amount of samples |
将保存在95%乙醇溶液中的对虾组织取出,先用无RNA酶H2O清洗1遍,吸水纸吸去多余水分,然后采用RNAiso plus(TaKaRa)法抽提对虾总RNA,最后通过Nanodrop 2000(Thermo Scientific, 美国)测量所制备RNA的浓度和纯度。
1.3 利用RT-nPCR方法检测样品中CMNV根据Zhang等(2014)报道的RT-nPCR方法,通过逆转录和套式PCR方法检测CMNV靶基因片段。具体步骤如下:
(1) 逆转录过程
首先,配制逆转录引物预混液体系,每个反应管中含4 μl无RNA酶H2O、1 μl引物Noda-R1(10 μmol/L)、1 μl待测RNA样品(浓度在10 ng/μl~1 μg/μl),70℃预变性10 min后,立即放入冰浴中冷却2 min。
其次,配制逆转录酶预混物:2 μl 5×M-MLV逆转录酶缓冲液、0.5 μl dNTP(10 mmol/L)、0.25 μl RNase抑制剂(40 U/μl)、0.5 μl M-MLV逆转录酶(200 U/μl),无RNA酶H2O补至4 μl,混匀。42℃反应1 h,70℃变性10 min后,可获得cDNA模板。
(2) 套式PCR反应
引物序列及扩增片段信息参见表 3,参照表 4配制套式PCR反应体系。RT-nPCR第1轮PCR扩增程序:94℃变性3 min;94℃ 20 s、50℃ 20 s、72℃ 40 s,30个循环;72℃延伸7 min。第2轮PCR扩增程序:94℃变性3 min;94℃ 20 s、50℃ 20 s、72℃ 30 s,30个循环;72℃延伸7 min。电泳检测第1、2轮PCR产物,若被检样品第1轮出现619 bp、第2轮出现165 bp扩增带为CMNV强阳性,如只在第2轮出现165 bp扩增带则为弱阳性;否则为阴性。
|
|
表 3 CMNV RT-nPCR所用引物序列 Tab.3 Primers for CMNV RT-nPCR |
|
|
表 4 CMNV RT-nPCR的反应体系 Tab.4 Amounts of each ingredients used in the CMNV RT-nPCR |
根据Zhang等(2017a)建立的RT-LAMP方法对样品进行检测,引物序列见表 5,按照表 6配制反应体系。反应体系在实时荧光定量PCR仪(Bio-Rad, 美国)中63℃孵育60 min;然后根据扩增曲线有无判断样品是否为CMNV阳性。除引物不同外,MDNV的RT-LAMP方法与CMNV的RT-LAMP方法相同。
|
|
表 5 CMNV和MDNV RT-LAMP引物序列 Tab.5 Primer sequences of CMNV and MDNV RT-LAMP |
|
|
表 6 CMNV和MDNV RT-LAMP反应体系 Tab.6 Amounts of each ingredients used in the CMNV and MDNV RT-LAMP |
参照常见病毒的荧光定量方法(刘珍等, 2016; Pooljun et al, 2016; 刘宝彬等, 2017),采用One Step PrimeScriptTM RT-PCR (Perfect real time)试剂盒(TaKaRa)及表 7中的引物和探针进行TaqMan RT-qPCR,检测样品中的CMNV。
|
|
表 7 CMNV TaqMan RT-qPCR方法所用引物序列 Tab.7 Primer sequences of CMNV TaqMan RT-qPCR |
反应体系为25 μl,各组分及用量如下:2×One Step RT-PCR BufferⅢ12.5 μl,Ex Taq HS 0.4 μl,Prime Script RT enzyme MixⅡ0.4 μl,引物CMNV-TAQ-R1 (10 μmol/L) 0.5 μl、CMNV-TAQ-F2 (10 μmol/L) 0.5 μl,探针CMNV-TAQ-P1(10 μmol/L) 0.5 μl,CMNV阳性模板1 μl,其余用无RNA酶H2O补足。在冰上配置反应体系。
利用Bio-Rad实时荧光定量PCR仪进行TaqMan RT-qPCR扩增,反应程序:50.8℃保温15 min进行逆转录;94℃预变性5 min;94℃变性10 s,52.7℃退火延伸30 s,共40个循环。
1.6 样品阳性检出率计算每种方法检出CMNV/MDNV阳性的样品数除以利用该方法检测的总样品数,并以百分比表示,即为基于该方法的CMVN/MDNV阳性检出率;将呈现RT-nPCR或RT-LAMP或TaqMan RT-qPCR任一种检测方法CMNV阳性的样品数目相加(对于呈现2种或2种方法以上阳性的样品只计算1次),除以总样品数,并以百分比表示,即为CMNV的总阳性检出率(CMNV_Total)。
2 结果 2.1 CMNV在不同虾类中的阳性率分析采用RT-nPCR、RT-LAMP和TaqMan RT-qPCR 3种方法分别对2016年所采集的254份和2017年所采集的387份样品进行检测分析,结果发现,采用不同方法检测所得到的CMNV阳性率并不相同(图 1)。RT-nPCR检测结果显示,凡纳滨对虾、中国明对虾和日本囊对虾样品中可检测到CMNV,其阳性检出率分别为8.0%(44/553)、9.5%(2/21)和46.0%(17/37)。RT-LAMP检测结果显示,凡纳滨对虾、中国明对虾、日本囊对虾、斑节对虾和罗氏沼虾样品中可以检测到CMNV,其阳性检出率分别为3.8%(21/553)、4.8% (1/21)、16.2%(6/37)、22.2%(2/9)和5.9%(1/17)。TaqMan RT-qPCR检测结果显示,凡纳滨对虾、中国明对虾和日本囊对虾样品中可以检测到CMNV,CMNV的阳性检出率分别为10.3%(57/553)、57.1%(12/21)和67.6% (25/37)。上述3种方法均能检出CMNV阳性的对虾种类为凡纳滨对虾、中国明对虾和日本囊对虾。
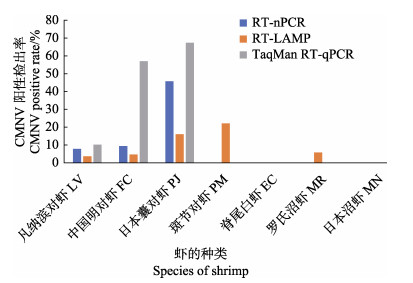
|
图 1 基于3种方法分析2016~2017年不同虾类样品中CMNV的阳性检出率 Fig.1 CMNV positive rate in different shrimp samples based on three detecting methods L. vannamei, F. chinensis, P. japonicus, P. monodon, M. rosenbergii and M. nipponense were skeletonized as LV, FC, PJ, PM, MR, and MN in the figure, respectively |
对RT-nPCR、RT-LAMP和TaqMan RT-qPCR 3种方法的检测结果按照采样年份分析(图 2)。RT-nPCR的检测结果显示,2016、2017年样品中CMNV阳性检出率分别为11.8%(30/254)和7.8%(30/ 387)。RT-LAMP的检测结果显示,2016、2017年样品中CMNV阳性检出率分别为6.7% (17/254)和3.9% (15/387)。TaqMan RT-qPCR的检测结果显示,2016、2017年样品中CMNV阳性检出率分别为17.7%(45/ 254)和12.4%(48/387)。基于上述3种方法检测结果计算得出,2016、2017年样品中CMNV总阳性检出率分别为26.8%(68/254)和16.3%(63/387)。此外,MDNV的RT-LAMP检测结果显示,2016年样品中MDNV的阳性检出率为9.4%(24/254)。
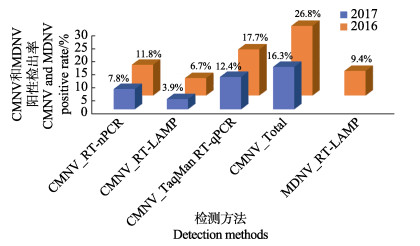
|
图 2 基于3种方法分析2016、2017年虾类样品中CMNV和MDNV的阳性检出率 Fig.2 CMNV and MDNV positive rates in shrimp samples collected in 2016 and 2017 based on three detecting methods |
对RT-nPCR、RT-LAMP和Taqman RT-qPCR 3种方法的检测结果,按照采样年份和区域分析,结果如图 3和图 4所示。2016年度的254份样品来自河北、河南、山东、江苏、上海、浙江、福建、广东和海南等省市,其中,RT-nPCR检测显示,不同省市样品中CMNV阳性检出率如下:河北为19.7%(11/56),山东为19.4%(19/98);RT-LAMP检测结果显示,不同省市样品中CMNV阳性检出率如下:河北为5.4%(3/56),山东为7.1%(7/98),浙江为3.2% (1/31),福建为15.0% (6/40);TaqMan RT-qPCR检测结果显示,不同省市样品中CMNV阳性检出率如下:河北为37.5%(21/56),山东为24.5%(24/98)。
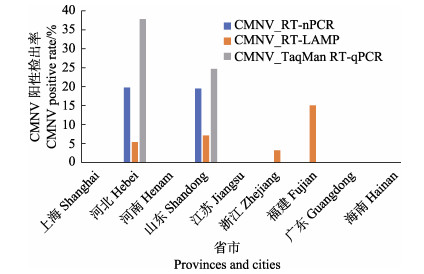
|
图 3 基于3种方法分析2016年不同省市虾类样品中CMNV的阳性检出率 Fig.3 CMNV positive rate in shrimp samples collected from different provinces and cities in 2016 based on three detecting methods |
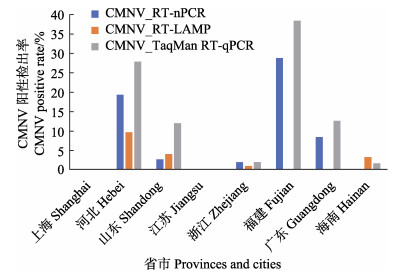
|
图 4 基于3种方法分析2017年不同省份虾类样品中CMNV的阳性检出率 Fig.4 CMNV positive rate in shrimp samples collected from different provinces and cities in 2017 based on three detecting methods |
2017年的387份样品来自河北、山东、江苏、上海、浙江、福建、广东和海南等省市。其中,RT-nPCR检测显示,不同省市样品中CMNV阳性检出率如下:河北为19.2%(18/94),山东为2.6%(2/76),浙江为1.9% (2/105),福建为28.6%(6/21),广东为8.3%(2/24);RT-LAMP检测结果显示,不同省市样品中CMNV阳性检出率如下:河北为9.6%(9/94),山东为4.0%(3/ 76),浙江为1.0%(1/105),海南为3.2%(2/63);TaqMan RT-qPCR检测结果显示,不同省市样品中CMNV阳性检出率如下:河北为27.7%(26/94),山东为11.8%(9/ 76),浙江为1.9%(2/105),福建为38.1%(8/21),广东为12.5%(3/24),海南为1.6%(1/63)。
3 讨论过去几年,VCMD的广泛发生与流行使中国养殖对虾产业遭受了严重的经济损失(Zhang et al, 2014、 2017b)。为了更深入地了解这种新发疫病的流行病学特征,2013~2015年本实验室针对中国沿海省市的主要对虾养殖地区开展了CMNV的流行病学调查研究发现,沿海各省市虾类样品中均有CMNV流行和感染;患病种类涉及中国养殖甲壳动物主要经济种类,如凡纳滨对虾、中国明对虾、日本囊对虾、斑节对虾和罗氏沼虾;患病个体大都表现出肝胰腺颜色变浅,甲壳变软,生长缓慢等VCMD的典型症状;组织病理学分析揭示,患病凡纳滨对虾、日本囊对虾和斑节对虾等腹节肌肉均呈现溶解样坏死;超微结构病理学分析显示,患病个体的肌肉、肝胰腺中均可见大量CMNV样病毒颗粒,另外,患病凡纳滨对虾体内包被肝胰腺的海绵状结缔组织鞘(Tunica propria,为结缔组织)也是病毒的富集区域。基于RT-LAMP检测的分析结果显示,2013~2015年中国沿海养殖虾类中CMNV的流行率分别为45.9%(130/283)、27.9%(84/301)和20.9%(54/259)。总体来看,CMNV呈现出流行范围广、宿主种类多和流行率高的特点(Zhang et al, 2017b)。
本研究参照朱罗罗等(2016)分子流行病学调查方法,针对2016~2017年采自中国沿海省市的641份虾类样品的分析结果显示,沿海大部分省市的养殖虾类样品中均有CMNV的阳性检出,表明CMNV仍在中国主要对虾养殖地区流行。忽略检测样本数量最少的3个省市(上海、河南和江苏),其他6个省(河北、山东、浙江、福建、广东和海南)养殖虾类样品中CMNV检出率差异很大,为1.6%~38.1%不等。研究结果也显示,CMNV在凡纳滨对虾、中国明对虾、日本囊对虾、斑节对虾和罗氏沼虾等养殖甲壳类中普遍存在,在日本囊对虾、斑节对虾和中国明对虾中检出率均较高。
为了考察CMNV不同分子生物学分析方法的可靠性和适用范围,本研究采用CMNV的RT-nPCR、RT-LAMP和TaqMan RT-qPCR 3种方法对所采集的样品进行了检测分析。结果显示,不同检测方法所得出的CMNV阳性检出率差异很大,如基于RT-nPCR、RT-LAMP和TaqMan RT-qPCR方法,641份样品中CMNV的阳性率分别为9.4%(60/641)、5.0%(32/641)和14.5%(93/641)。造成差异的原因可能是检测方法的灵敏度不同;但前期研究表明,CMNV的RT-LAMP检测方法的灵敏度高于RT-nPCR检测方法,而同一批样品基于RT-LAMP的CMNV检出率反而低于基于RT-nPCR的CMNV检出率。进一步分析检测结果发现,经RT-nPCR检测呈现CMNV阴性的样品中,部分为RT-LAMP检测的CMNV阳性;经RT-LAMP检测呈现CMNV阴性的样品中,部分为TaqMan RT-qPCR检测的CMNV阳性;经TaqMan RT-qPCR检测呈现CMNV阴性的样品中,部分为RT-LAMP和RT-nPCR检测的CMNV阳性。该结果说明,利用上述任意一种方法对CMNV样品进行检测时,均存在假阴性的结果;造成这种现象可能与所采集样品中CMNV靶基因序列发生了不同变异有关。
前期基于CMNV的RT-LAMP检测方法对2013~ 2015年中国沿海11省市养殖虾类样品的检测结果显示,CMNV的阳性检出率从2013年的45.9%(130/283)下降到2014年的27.9%(84/301)和2015年的20.9% (54/259)(Zhang et al);本研究基于RT-LAMP检测方法的分析结果也显示,2016、2017年样品中CMNV阳性检出率分别为6.7%(17/254)和3.9%(15/ 387);该结果似乎说明,CMNV在中国沿海省市养殖对虾中的流行率在不断下降。而2013~2017年在沿海省市的实际走访和调查中发现,主要虾类养殖地区VCMD的发病案例并未明显减少。考虑到CMNV作为一种单链RNA病毒,其RNA依赖的RNA聚合酶在进行基因组复制时缺乏5'~3'校正功能,会导致病毒出现较快变异。对CMNV变异情况进行持续跟踪分析发现,一些发病对虾中不存在CMNV原始株(河北株)的感染,但存在一种类似CMNV变异株系的新型野田村病毒的感染,为了与CMNV原始株系进行区分,将这种类似CMNV变异株的新型野田村病毒暂时命名为MDNV。在研究中也发现,采用目前
CMNV的RT-LAMP和TaqMan RT-qPCR检测方法,无法扩增MDNV的RdRp基因;此前,Zhang等(2014)报道的CMNV RT-nPCR方法也存在缺陷,无法检测CMNV的部分变异株系。基于RT-nPCR、RT-LAMP和TaqMan RT-qPCR方法对2016、2017年样品的分析中,CMNV阳性检出率有差异,以及基于RT-LAMP分析方法显示,2013~2017年中国沿海省市养殖对虾中CMNV流行率下降,应主要是由于上述3种方法均是基于CMNV原始株系的RdRp基因开发,而这3种方法所用引物的高特异性无法适应CMNV变异株而导致的。
基于上述3种方法的检测结果计算得出,2016年样品中CMNV总阳性检出率为26.8%(68/254),而CMNV变异株系(MDNV)的阳性检出率为9.4%(24/ 254),考虑到MDNV变异幅度较大导致CMNV上述3种检测方法与MDNV无交叉反应,以及MDNV检测方法与CMNV原始株系亦无交叉反应,而2015年样品中尚未检测到MDNV株系(数据未包括在本研究中),2016年沿海省市池塘养殖虾类中CMNV和MDNV两种新发野田村病毒的阳性检出率合计达36.2%(92/254)。由此来看,中国养殖虾类中新发野田村病毒的流行率并没有明显降低,只是流行株系发生了较大变化。
综上所述,2013~2017年针对中国沿海省市养殖虾类的流行病学调查和分子流行病学分析结果表明,CMNV作为一种新发病毒,其流行范围广、宿主种类多、流行率高,并且主要特征性基因出现了明显变异,该病毒在虾类养殖业中的危害应引起足够重视。
致谢: 中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理学研究室同事和研究生协助取样,谨致谢忱。
Gu SJ. Analysis of causes of the covert mortality disease of Pacific white shrimp and its control strategies. Scientific Fish Farming, 2012, 11061106(8): 62-63 [ 顾水江. 南美白对虾偷死病发病原因分析及防治对策. 科学养鱼, 2012, 11061106(8): 62-63] |
Liu BB, Yang B, Lü XW, et al. Detection and quantification of infectious hypodermal and hematopoietic necrosis virus (IHHNV) and Enterocytozoon hepatopenaei (EHP) of Litopenaeus vannamei by real-time PCR. Progress in Fishery Sciences, 2017, 38(2): 158-166 [ 刘宝彬, 杨冰, 吕秀旺, 等. 凡纳滨对虾(Litopenaeus vannamei)传染性皮下及造血组织坏死病毒(IHHNV)及虾肝肠胞虫(EHP)的荧光定量PCR检测. 渔业科学进展, 2017, 38(2): 158-166] |
Liu S, Li JT, Tian Y, et al. Experimental vertical transmission of covert mortality nodavirus in Exopalaemon carinicauda. Journal of General Virology, 2017, 98(4): 652-661 DOI:10.1099/jgv.0.000731 |
Liu S, Wang XH, Xu TT, et al. Vectors and reservoir hosts of covert mortality nodavirus (CMNV). Journal of Invertebrate Pathology, 2018, 154: 29-36 DOI:10.1016/j.jip.2018.03.011 |
Liu Z, Zhang QL, Wan XY, et al. Development of real-time PCR assay for detecting microsporidian Enterocytozoon hepatopenaei and the application in shrimp samples with different growth rates. Progress in Fishery Sciences, 2016, 37(2): 119-126 [ 刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测. 渔业科学进展, 2016, 37(2): 119-126] |
Pooljun C, Direkbusarakom S, Chotipuntu P, et al. Development of a TaqMan real-time RT-PCR assay for detection of covert mortality nodavirus (CMNV) in penaeid shrimp. Aquaculture, 2016, 464: 445-450 DOI:10.1016/j.aquaculture.2016.06.044 |
Song SX, Zhuang SP. Measures for control of "bottom death" of Pacific white shrimp. Fish Science and Technology, 2006, 11061106(6): 36-38 [ 宋盛宪, 庄世鹏. 防治南美白对虾"底死症"的措施. 水产科技, 2006, 11061106(6): 36-38 DOI:10.3969/j.issn.1004-6755.2006.06.020] |
Thitamadee S, Prachumwat A, Srisala J, et al. Review of current disease threats for cultivated penaeid shrimp in Asia. Aquaculture, 2016, 11061106(452): 69-87 |
Xing H. Discussion of the control measures for the "bottom death" (covert mortality disease) of Pacific white shrimp. China Fisheries, 2004, 11061106(4): 88-89 [ 邢华. 南美白对虾"死底症"(偷死病)的控制措施探讨. 中国水产, 2004, 11061106(4): 88-89 DOI:10.3969/j.issn.1002-6681.2004.04.039] |
Xu ZJ, Ji F. Comprehensive control of the covert mortality disease of Pacific white shrimp. Fishery Guide to be Rich, 2009, 11061106(1): 60-61 [ 徐志进, 纪富. 南美白对虾偷死病的综合防治. 渔业致富指南, 2009, 11061106(1): 60-61] |
Zhang QH. To be cautious of "bottom death" in the intensive farming of Pacific white shrimp. Scientific Fish Farming, 2004, 11061106(10): 48-49 [ 章秋虎. 南美白对虾高密度养殖谨防"死底症". 科学养鱼, 2004, 11061106(10): 48-49] |
Zhang QL, Liu Q, Liu S, et al. A new nodavirus is associated with covert mortality disease of shrimp. Journal of General Virology, 2014, 95(12): 2700-2709 |
Zhang QL, Liu S, Yang HL, et al. Reverse transcription loop-mediated isothermal amplification for rapid and quantitative assay of covert mortality nodavirus in shrimp. Journal of Invertebrate Pathology, 2017a, 150: 130-135 DOI:10.1016/j.jip.2015.09.001 |
Zhang QL, Xu TT, Wan XY, et al. Prevalence and distribution of covert mortality nodavirus (CMNV) in cultured crustacean. Virus Research, 2017b, 233(2): 113-119 |
Zhu LL, Zhang QL, Wan XY, et al. Molecular epidemiology of a new yellow head virus strain in China. Progress in Fishery Sciences, 2016, 37(3): 68-77 [ 朱罗罗, 张庆利, 万晓媛, 等. 我国一株新型黄头病毒的分子流行病学. 渔业科学进展, 2016, 37(3): 68-77] |



