2. 上海海洋大学 上海 201306
2. Shanghai Ocean University, Shanghai 201306
对虾偷死病(Covert mortality disease,CMD)是近年来严重危害中国对虾养殖业的一种新发疫病(章秋虎, 2004; 邢华, 2004; 徐志进等, 2009; Zhang et al, 2014)。2003年或更早的时候,海南、广西等地高密度池塘养殖的凡纳滨对虾(Litopenaeus vannamei)出现“偷死”现象,2008~2009年该病在中国南方多省市的养殖凡纳滨对虾中大规模暴发,2010年后开始传播到山东、河北和天津等地(Zhang et al, 2017)。发病对虾主要在池底深水区陆续死亡,不容易被观察到,因此,被称为“偷死病”或“死底症”(邢华, 2004; 徐志进等, 2009; Zhang et al, 2014)。患病个体表现出肝胰腺颜色变浅、萎缩,空肠空胃,生长缓慢等症状,很多时候还可见病虾腹节肌肉不透明或局部发白。患病对虾在水温较高(28℃以上)时,死亡率升高,累计死亡率可达80%(Zhang et al, 2014)。
Zhang等(2014)研究证实,CMD是由“偷死野田村病毒(Covert mortality nodavirus,CMNV)”引起的一种病毒性疾病。为了说明该疫病的病原学特征,CMD又被称为病毒性偷死病(Viral covert mortality disease, VCMD)。CMNV属于野田村病毒科α野田村病毒属(Nodaviridae, Alphanodavirus),是一种单链RNA病毒,病毒粒子为球形(二十面体),无囊膜,蔗糖密度梯度离心纯化的病毒粒子直径约为32 nm。CMNV主要感染养殖虾类,目前尚未见有感染鱼类的报道。
对2013~2015年间在中国沿海11省市145个采样点收集的发病虾类样品开展的分子流行病学研究显示,养殖凡纳滨对虾、中国明对虾(Fenneropenaeus chinensis)、日本囊对虾(Penaeus japonicus)、斑节对虾(Penaeus monodon)和罗氏沼虾(Macrobrachium rosenbergii)中均可检测到CMNV阳性,其中,日本对虾的CMNV阳性检出率高达60%,中国明对虾和罗氏沼虾的检出率较低,分别为22%和24%;2013、2014和2015年样品的CMNV阳性检出率分别为45.9%、27.9%和20.9%;来自辽宁、河北、天津、山东、江苏、浙江、福建、广东、广西和海南的虾类样品均可检测到CMNV阳性,其中,以广东和海南的检出率最高,达52.6%和50.8%,而辽宁、天津等地的检出率最低,为10%和9.9%;CMNV的检出率基本呈现华南高于华东和华北的趋势(Zhang et al, 2017)。2015年,本实验室在来自越南、厄瓜多尔和墨西哥的发病养殖对虾样品中检出CMNV。2016年,Thitamadee等(2016)利用套式RT-PCR检测技术在泰国当地发病对虾中检测到CMNV,且检出率很高;Pooljun等(2016)研究发现,泰国南部养殖池塘凡纳滨对虾中疑患VCMD个体的CMNV阳性检出率分别为30.4%和37.7%。CMNV在全球主要对虾养殖地区传播的风险已经引起广泛关注。
2017年8月山东潍坊一个养殖场的凡纳滨对虾疑患VCMD,本实验室在该养殖场的池塘内采集了发病对虾和浮游动物样品,同时也对养殖场排水渠中野生的鲫鱼(Carassius auratus)等样品进行了采集和固定保存。分子生物学分析结果显示,患病对虾、养殖池塘共生生物和鲫鱼样品均呈现CMNV阳性。
本研究采用逆转录套式PCR(RT-nPCR)、组织病理学、组织原位杂交和透射电子显微镜(TEM)技术,分析了鲫鱼脑和心肌组织中CMNV的存在、感染情况以及CMNV感染鲫鱼所导致的病理变化,以期从不同角度确认该鲫鱼是否被CMNV所感染,是否为CMNV的新宿主。
1 材料与方法 1.1 样品采集鲫鱼样品采集于山东潍坊一养殖场的排水渠中,体长为8~10 cm,取每尾个体的脑和心肌组织,将组织样品切分为1式3份,分别固定于RNA Later固定液(天根)、4%多聚甲醛固定液[配制方法参见Chen等(2014)]和戊二醛固定液[配制方法参见Graham等(2007)]中,用于后续的分子生物学、组织学和超微结构分析。保存在4%多聚甲醛中的样品固定24 h后,转移到70%乙醇中贮存。
1.2 组织总RNA提取将30 mg鲫鱼心肌及脑组织置于500 μl TRIzol中,用电动匀浆器将其快速破碎匀浆,然后,按照RNA快速提取试剂盒(百泰克)说明书,提取组织样品的总RNA,最后,用超微量分光光度计NanoDrop 2000 (Thermo Fisher Scientific,美国)测定所制备RNA的浓度和纯度。
1.3 逆转录套式PCR(RT-nPCR)检测取1 μl (100 ng/μl)鲫鱼组织总RNA,加入1 μl 10 mmol/L的Noda-R1引物[引物序列参见Zhang等(2014)]和4 μl无RNA酶水后,混匀,70℃预变性5 min,冰浴2 min,然后,依次加入2 μl 5×M-MLV逆转录酶缓冲液、0.5 μl dNTP (10 mmol/L)、0.25 μl RNA酶抑制剂(40 U/μl)、0.5 μl M-MLV逆转录酶(200 U/μl)和0.75 μl无RNA酶水后,混匀,42℃逆转录1 h,70℃变性5 min,即获得cDNA模板。
按照Zhang等(2014)报道的方法进行RT-nPCR的第一轮扩增反应;RT-nPCR的第二步PCR采用TaKaRa Premix TaqTM (Ex TaqTM 2.0)进行,25 μl反应体系:12.5 μl预混合Taq,1 μl正向引物(Noda-F1: 5′-AAATACGGCGATGACG-3′, 10 μmol/L),1 μl反向引物(Noda-R2: 5′-GGCGGTGAGATGGATTTT-3′, 10 μmol/L),1 μl第一步RT-PCR产物和9.5 μl ddH2O。第二步PCR的反应程序:94℃预变性3 min;94℃变性30 s,52℃退火30 s和72℃延伸50 s,共35个循环;72℃延伸5 min。通过第二步PCR扩增,可得到CMNV中依赖RNA的RNA聚合酶基因(RdRp) (GenBank登录号KM112247)中长度为207 bp的扩增产物。RT-nPCR检测过程中,同时对阳性对照、阴性对照RNA进行逆转录和第一轮及第二轮PCR扩增。
1.4 组织病理学分析采用Bell等(1988)和Lightner(1996)报道的方法,对保存在70%乙醇中的样品进行脱水、石蜡包埋等处理。每份样品制备4张厚度为3 μm的石蜡切片,对第1张切片进行苏木精和伊红(HE)染色,用于组织病理学观察(参考上述Lightner报道的方法),第2张切片用于地高辛(DIG)标记的RNA探针进行CMNV组织原位杂交,第3、4张切片用于随机探针和无探针的原位杂交作为阴性和空白对照。利用Nikon Eclipse E80i显微镜对组织切片进行观察和拍照。
1.5 组织原位杂交分析根据Zhang等(2017)报道的方法,利用带有限制性内切酶识别位点的引物对RdRp基因上一段长为244 bp的片段进行扩增,将扩增所得目标片段克隆到pBluescriptⅡSK(+)载体中,用限制性内切酶PstⅠ将重组后的载体线性化;以线性化的载体为模板,采用T7 RNA聚合酶转录出DIG标记的RNA探针。利用上述探针,根据前人报道的方法(Nuovo et al, 1999; Piette et al, 2008; Chen et al, 2014)对切片进行原位杂交,杂交后的切片进行核固红复染着色。利用Nikon Eclipse E80i显微镜观察原位杂交切片并拍照。
1.6 透射电子显微镜分析将保存在戊二醛固定液中、对应编号呈原位杂交检测阳性的样品,送青岛大学医院电镜中心进行固定、包埋、切片和染色,操作流程参照Graham等(2007),稍加修改后具体步骤包括:1%锇酸(0.1 mol/L甲次砷酸盐缓冲液配制,pH值为7.3)固定3 h,蒸馏水浸泡10 min;接着依次在50%、70%和90%乙醇中脱水20 min,在无水乙醇中脱水4次,10 min/次;先用1:1的树脂酒精包埋液处理30 min,再用3:1的树脂酒精包埋液处理60 min,然后用纯树脂包埋3 d,制备厚度为0.5 μm的超薄切片;切片用醋酸铀和柠檬酸铅进行染色,用透射电子显微镜(Japan Electron Optics Laboratory Co., Ltd., 日本)观察、拍照。
2 实验结果 2.1 RT-nPCR检测结果RT-nPCR扩增产物的电泳图片显示,来自鲫鱼样品的cDNA经过二轮PCR,扩增获得了与预期的207 bp大小一致的目标基因片段(图 1),并且和阳性对照的扩增片段在相同位置。根据该结果初步判断鲫鱼样品中存在或感染了CMNV。

|
图 1 鲫鱼样品的CMNV逆转录套式PCR第二轮扩增产物电泳 Fig.1 Electrophoresis of the amplification products from the second step of CMNV RT-nPCR test for the sample of C. auratus naturally infected with CMNV M: Marker DL2000; P:阳性对照; 1和2:鲫鱼样品; C:阴性对照 M: Marker DL2000; P: Positive control; 1 and 2: Samples of C. auratus; C: Negative control |
鲫鱼脑神经组织病理图显示,鲫鱼脑组织二叠体内颗粒细胞层中可见明显的神经组织空泡化,二叠体内颗粒细胞排列混乱、无序,细胞核固缩明显(图 2a和图 2b)。组织原位杂交图(图 2c和图 2d)显示,鲫鱼脑组织颗粒细胞层中有明显的蓝紫色CMNV探针杂交信号。对照组切片中无杂交信号出现(图 2e和图 2f)。

|
图 2 自然感染CMNV的鲫鱼脑神经组织病理和原位杂交图 Fig.2 Micrographs of HE staining and in situ hybridization for brain nerve tissue of the C. auratus naturally infected with CMNV (a):自然感染CMNV的鲫鱼脑组织病理学HE染色图;(b):(a)中黑框内区域的放大图,可见明显的神经组织空泡化和颗粒细胞核固缩;(c):自然感染CMNV的鲫鱼脑的组织原位杂交图;(d):(c)中黑框内区域的放大图,颗粒细胞中有明显的蓝紫色CMNV探针杂交信号;(e):无CMNV RNA探针的脑组织原位杂交图;(f):(e)中黑框内区域的放大图 (a): Micrographs of HE staining for brain of the C. auratus; (b): Magnified micrograph of the zone in the black frame in (a), visible cytoplasmic vacuolation of nerve and karyopyknosis of the granular cells; (c): Micrographs of ISH for brain of the C. auratus with the CMNV RNA probe; (d): Magnified micrograph of the zone in the black frame in (c), visible intense hybridization signal at the granular cells; (e): Micrographs of ISH for brain of the C. auratus without the CMNV RNA probe; (f): Magnified micrograph of the zone in the black frame in (e) |
鲫鱼脑皮层组织病理图显示,鲫鱼脑皮层组织空泡化严重,组成神经元的锥体细胞呈现明显空泡化,较高比例的细胞核出现固缩变形(图 3a和图 3b)。该样品的组织原位杂交图显示(图 3c和图 3d),呈现坏死部位的神经元周围存在明显浅紫色的CMNV探针杂交信号。对照组切片中无杂交信号出现(图 3e和图 3f)。
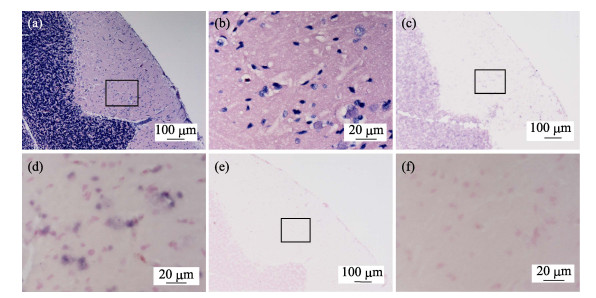
|
图 3 自然感染CMNV的鲫鱼脑皮层组织病理和原位杂交图 Fig.3 Micrographs of HE staining and in situ hybridization for brain cortical tissue of the C. auratus naturally infected with CMNV (a):自然感染CMNV鲫鱼脑组织病理学HE染色图;(b):(a)中黑框内区域的放大图,可见组成脑皮层的锥体细胞的空泡化和细胞核固缩;(c):自然感染CMNV鲫鱼脑的组织原位杂交图;(d):(c)中黑框内区域的放大图,坏死的椎体细胞中有明显的蓝紫色CMNV探针杂交信号;(e):无CMNV RNA探针的自然感染CMNV鲫鱼的脑组织原位杂交图;(f):(e)中黑框内区域的放大图 (a): Micrographs of HE staining for brain of the C. auratus; (b): Magnified micrograph of the zone in the black frame in (a), visible cytoplasmic vacuolation of pyramidal cells and karyopyknosis of pyramidal cells in cortical tissue; (c): Micrographs of ISH for brain of the C. auratus with the CMNV RNA probe; (d): Magnified micrograph of the zone in the black frame in (c), visible intense CMNV probe hybridization signal at the necrotic neuron; (e): Micrographs of ISH for brain of the C. auratus without the CMNV RNA probe; (f): Magnified micrograph of the zone in the black frame in (e) |
鲫鱼心肌组织病理图显示,心肌组织中肌纤维呈现溶解样坏死,肌细胞空泡化明显,间隙可见血细胞浸润,肌细胞的细胞核固缩明显(图 4a和图 4b)。组织原位杂交图(图 4c和图 4d)显示,心肌组织坏死部位出现浅紫色的CMNV探针杂交信号。对照组切片中无杂交信号出现(图 4e和图 4f)。

|
图 4 自然感染CMNV的鲫鱼心肌组织病理和组织原位杂交图 Fig.4 Micrographs of HE staining and in situ hybridization for cardiac muscle of the C. auratus naturally infected with CMNV (a):自然感染CMNV鲫鱼心肌组织病理学HE染色图;(b):(a)中黑框内区域的放大图;(c):自然感染CMNV鲫鱼心肌组织原位杂交图;(d):(c)中黑框内区域的放大图;(e):无CMNV RNA探针的自然感染CMNV鲫鱼的心肌组织原位杂交图;(f):(e)中黑框内区域的放大图 (a): Micrographs of HE staining for cardiac muscle of the C. auratus; (b): Magnified micrograph of the zone in the black frame in (a), visible dissolved myoneme of myocyte; (c): Micrographs of ISH for cardiac muscle of the C. auratus with the CMNV RNA probe; (d): Magnified micrograph of the zone in the black frame in (c); (e): Micrographs of ISH for cardiac muscle of the C. auratus without the CMNV RNA probe; (f): Magnified micrograph of the zone in the black frame in (e) |
鲫鱼脑组织超薄切片透射电镜分析结果显示,脑组织空泡化病变严重,神经组织坏死明显,有髓神经纤维出现脱髓鞘现象,细胞核固缩变形明显,但镜下未见明显的CMNV样病毒颗粒,也未观测到其他已知病原体(图 5a和图 5b)。
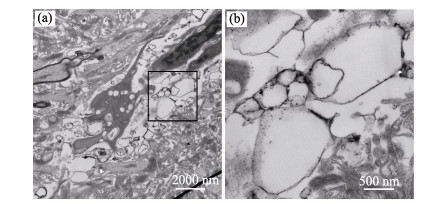
|
图 5 自然感染CMNV的鲫鱼脑组织超薄切片的透射电镜图 Fig.5 Micrographs of ultrathin section for brain of C. auratus visualized by transmission electron microscopy (TEM) (a):鲫鱼脑组织的超薄电镜图;(b):(a)中黑框内区域的放大图,可见脑组织中神经空泡化明显 (a): TEM micrographs for the brain; (b): Showed the magnified zone in the black frame in (a), visible cytoplasmic vacuolation of nerve |
鲫鱼心肌组织超薄切片透射电镜分析结果显示,心肌组织坏死严重,肌细胞中大面积区域被CMNV样病毒颗粒所占据(图 6a和图 6b);高放大倍数下可见心肌细胞内大量清晰的、直径约为30 nm的CMNV样病毒颗粒(图 6c)。

|
图 6 自然感染CMNV的鲫鱼心脏组织超薄切片的透射电镜图 Fig.6 Micrographs of ultrathin section for heart of C. auratus visualized under transmission electron microscopic (TEM) (a)~(c):心脏肌肉组织的超薄电镜图;(b)和(c):分别为(a)和(b)图中黑框内放大区域,可见心肌组织中大量散在的CMNV样病毒颗粒 (a)~(c) TEM micrographs for the cardiac muscle of the heart: (b) and (c): Showed the magnified zone in the black frame in (a), visible scattering CMNV-like particles in necrotic myocardial cell |
研究发现,CMNV的宿主范围广泛,该病毒除了感染中国主要养殖甲壳类如凡纳滨对虾、中国明对虾、日本对虾、斑节对虾和罗氏沼虾外,还可以感染对虾养殖池塘中的桡足类(Parathemisto gaudichaud)、蜾蠃蜚(Corophium sinense Zhang)、寄居蟹(Diogenes edwardsii)和细长脚虫戎(Parathemisto gaudichalldi)等种类(Zhang et al, 2017; Liu et al, 2018)。CMNV可侵染多种甲壳类的肝胰腺和肌肉组织,在肝胰腺小管和淋巴器官上皮细胞和肌肉细胞内形成嗜酸性的包涵体,导致肝胰腺小管萎缩及肌肉纤维溶解样、凝固状坏死(Zhang et al, 2014、2017)。Liu等(2017)通过人工感染实验证明,CMNV可通过脊尾白虾(Exopalaemon carinicauda)亲体的雄性生殖细胞或雌性生殖细胞传递至子代,实现从亲代到子代的垂直传播。
为了筛查CMNV可感染的水生动物种类,本研究对山东潍坊一发生VCMD对虾养殖场排水渠中野生的鲫鱼进行了采样和分析,鲫鱼心肌组织的分子生物学检测呈CMNV阳性,初步判断鲫鱼可携带或感染CMNV。进一步的组织病理学和组织原位杂交分析结果显示,鲫鱼样品脑组织出现了较为严重的病理变化,包括脑皮层和二叠体内神经组织空泡化、组织排列疏松,脑皮层锥体细胞和二叠体颗粒细胞层细胞核明显固缩等,说明CMNV在自然条件下感染鲫鱼能够导致其脑组织发生明显病变。对鲫鱼样品心肌组织的超微结构分析结果显示,CMNV可浸染鲫鱼的心脏,导致心肌组织大面积坏死;CMNV颗粒占据了心肌细胞内大部分区域,部分肌肉纤维溶解并为CMNV颗粒所取代。上述研究结果证实,CMNV在自然条件下可感染野生鲫鱼,并导致其脑和心肌发生明显的病理损伤。
由于CMNV在分类上归为α野田村病毒属,其与β野田村病毒属相关病毒的感染特征可能类似。为了排除上述鲫鱼样品中β野田村病毒共感染的可能性,本研究采用由世界动物卫生组织(Office International Des Epizooties, OIE)推荐的、针对β野田村病毒的TaqMan实时荧光定量PCR方法,检测了鲫鱼脑组织的RNA,结果显示,在本研究中鲫鱼样品中没有β野田村病毒属已知株系的阳性检出(结果未展示),从而证实本研究鲫鱼样品中不存在β野田村病毒的感染。
通常来讲,病毒具有强烈的宿主专一性和严格的物种屏障(Wang et al, 2004; Kuiken et al, 2006; Tang et al, 2006)。α野田村病毒属内除了野田村病毒(Nodamura virus, NoV)和兽棚病毒(Flock house virus, FHV)外,多数病毒的宿主范围似乎都仅限于各种昆虫(Selling et al, 1990; Stock et al, 2009)。作为野田村病毒科的代表种,NoV病毒的宿主范围较为独特,除了能够感染昆虫外,还对哺乳动物宿主具有致病性(Bailey et al, 1973、1975)。研究证实,NoV能够感染猪,可以被蚊子传播,会对乳鼠(Mus musculus)和仓鼠(Mesocricetus auratus)产生致死性(Ball et al, 1999; King et al, 2011)。FHV分离自褐新西兰肋翅鳃角金龟(Costelytra zealandica) (Scotti et al, 1983),但能够在植物中复制产生感染性病毒粒子(Selling et al, 1990)。上述研究均表明,NoV和FHV具有跨宿主传播的能力。相比之下,β野田村病毒属的宿主范围仅限于不同种的鱼类(Scotti et al, 1983; Furusawa et al, 2007; Bigarré et al, 2009; Souto et al, 2015)。迄今为止,尚未见报道表明α野田村病毒具有感染鱼类的能力。前期研究发现,发生VCMD的凡纳滨对虾养殖池塘中,CMNV除了感染养殖对虾外,也可感染池塘中共生的鲻虾虎鱼(Mugilogobius abei)(另文发表),结合本研究所揭示的CMNV能够感染野生鲫鱼,可以发现,CMNV作为一种虾类新发疫病病毒性病原,能跨越物种障碍在自然条件下感染鱼类,实现跨宿主传播。
池塘养殖系统,除了养殖池塘本身外,还包括排水渠、废水处理池等设施,池塘中养殖对虾发病后,养殖水体会经排水渠向外排放或排入废水处理池中。由于目前中国大部分对虾养殖地区对养殖废水外排管理不严格,多数养殖场一般将养殖废水就近直接外排至沟渠或近海中,造成养殖池塘中病原向外扩散的风险。本研究中的养殖场养殖用水来源为近岸河口,从发病对虾养殖池塘外排水渠的鲫鱼样品中检测到CMNV感染,证实该养殖场暴发VCMD疫情后,其池塘中CMNV可能会经排水设施向外传播扩散。同时,CMNV可在自然状态下感染淡水鱼类——鲫鱼这一事实,一方面为CMNV跨越宿主界限感染鱼类提供了更多证据,另一方考虑到鲫鱼是淡水或半咸水鱼类,加之CMNV可感染半咸水养殖的罗氏沼虾,CMNV感染其他鱼类尤其是淡水养殖动物种类的风险值得高度关注。
鲫鱼是一种淡水鱼类,分类上归属于辐鳍鱼纲、鲤形目、鲤科鲫属,主要分布于欧亚地区的淡水水域中,部分沿海近岸的淡咸水中也有少量分布。中国境内,鲫鱼分布广泛,各地水域常年均有生产,是中国一种重要的经济鱼类(谢忠明, 1999; 郁桐炳等, 2004)。本研究证实,CMNV能够在自然条件下感染鲫鱼导致其脑和心肌组织产生明显病理变化,说明CMNV对鲫鱼具有一定的致病性,因此,CMNV危害养殖鲫鱼的风险不容忽视。但对于CMNV感染鲫鱼的致死率、主要靶组织等问题,尚需深入研究。
Bailey L, Newman JFE, Porterfield JS. The multiplication of Nodamura virus in insect and mammalian cell cultures. Journal of General Virology, 1975, 26: 15-20 DOI:10.1099/0022-1317-26-1-15 |
Bailey L, Scott HA. The pathogenicity of Nodamura virus for insects. Nature, 1973, 241(5391): 545 |
Ball LA, Johnson KL. Reverse genetics of nodaviruses. Advances in Virus Research, 1999, 53: 229-244 DOI:10.1016/S0065-3527(08)60350-4 |
Bell TA, Lightner DV. A handbook of normal penaeid shrimp histology. Baton Rouge: World Aquaculture Society, 1988
|
Bigarré L, Cabon J, Baud M, et al. Outbreak of betanodavirus infection in tilapia, Oreochromis niloticus (L.), in fresh water. Journal of Fish Diseases, 2009, 32(8): 667-673 DOI:10.1111/jfd.2009.32.issue-8 |
Chen SL, Zhang GJ, Shao CW, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle. Nature Genetics, 2014, 46(3): 253-260 DOI:10.1038/ng.2890 |
Furusawa R, Okinaka Y, Uematsu K, et al. Screening of freshwater fish species for their susceptibility to a betanodavirus. Diseases of Aquatic Organisms, 2007, 77(2): 119-125 |
Graham L, Orenstein JM. Processing tissue and cells for transmission electron microscopy in diagnostic pathology and research. Nature Protocols, 2007, 2(10): 2439-2450 DOI:10.1038/nprot.2007.304 |
King AMQ, Adams MJ, Carstens EB, et al. Virus taxonomy: Ninth report of the international committee on taxonomy of viruses. London: Elsevier Academic Press, 2011
|
Kuiken T, Holmes EC, McCauley J, et al. Host species barriers to influenza virus infections. Science, 2006, 312(5772): 394-397 DOI:10.1126/science.1122818 |
Lightner DV. A handbook of pathology and diagnostic procedures for diseases of cultured penaeid shrimp. Baton Rouge: World Aquaculture Society, 1996 http://agris.fao.org/agris-search/search.do?recordID=US19970037440
|
Liu S, Li JT, Tian Y, et al. Experimental vertical transmission of covert mortality nodavirus in Exopalaemon carinicauda. Journal of General Virology, 2017, 98(4): 652-661 DOI:10.1099/jgv.0.000731 |
Liu S, Wang XH, Xu TT, et al. Vectors and reservoir hosts of covert mortality nodavirus (CMNV) in shrimp ponds. Journal of Invertebrate Pathology, 2018, 154: 29-36 DOI:10.1016/j.jip.2018.03.011 |
Nuovo GJ, Plaia TW, Belinsky SA, et al. In situ detection of the hypermethylation-induced inactivation of the p16 gene as an early event in oncogenesis. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(22): 12754-12759 DOI:10.1073/pnas.96.22.12754 |
Piette D, Hendrickx M, Willems E, et al. An optimized procedure for whole-mount in situ hybridization on mouse embryos and embryoid bodies. Nature Protocols, 2008, 3(7): 1194-1201 DOI:10.1038/nprot.2008.103 |
Pooljun C, Direkbusarakom S, Chotipuntu P, et al. Development of a TaqMan real-time RT-PCR assay for detection of covert mortality nodavirus (CMNV) in penaeid shrimp. Aquaculture, 2016, 464(1): 445-450 |
Scotti PD, Dearing S, Mossop DW. Flock house virus: A nodavirus isolated from Costelytra zealandica (White) (Coleoptera: Scarabaeida). Archives of Virology, 1983, 75(3): 181-189 DOI:10.1007/BF01315272 |
Selling BH, Allison RF, Kaesberg P. Genomic RNA of an insect virus directs synthesis of infectious virions in plants. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(1): 434-438 DOI:10.1073/pnas.87.1.434 |
Souto S, Lopez-Jimena B, Alonso MC, et al. Experimental susceptibility of European sea bass and Senegalese sole to different betanodavirus isolates. Veterinary Microbiology, 2015, 177(1-2): 53-61 DOI:10.1016/j.vetmic.2015.02.030 |
Stock SP, Vandenburg J, Glazer I, et al. Insect pathogens: Molecular approaches and techniques. Cambridge, MA: CAB International, 2009 https://www.cabdirect.org/?target=%2fcabdirect%2fabstract%2f20093093999
|
Tang Q, Maul GG. Mouse cytomegalovirus crosses the species barrier with help from a few human cytomegalovirus proteins. Journal of Virology, 2006, 80(15): 7510-7521 DOI:10.1128/JVI.00684-06 |
Thitamadee S, Prachumwat A, Srisala J, et al. Review of current disease threats for cultivated penaeid shrimp in Asia. Aquaculture, 2016, 452: 69-87 DOI:10.1016/j.aquaculture.2015.10.028 |
Wang F, Ma Y, Barrett JW, et al. Disruption of Erk-dependent type Ⅰ interferon induction breaks the myxoma virus species barrier. Nature Immunology, 2004, 5(12): 1266-1274 DOI:10.1038/ni1132 |
Xie ZM. High quality crucian carp breeding technology. Beijing: China Agriculture Press, 1999 [ 谢忠明. 优质鲫鱼养殖技术. 北京: 中国农业出版社, 1999]
|
Xing H. Discussion of the control measures for the "bottom death" (covert mortality disease) of Pacific white shrimp. China Fisheries, 2004(4): 88-89 [ 邢华. 南美白对虾"死底症"(偷死病)的控制措施探讨. 中国水产, 2004(4): 88-89 DOI:10.3969/j.issn.1002-6681.2004.04.039] |
Xu ZJ, Ji F. Comprehensive control of the covert mortality disease of Pacific white shrimp. Fishery Guide to be Rich, 2009(1): 60-61 [ 徐志进, 纪富. 南美白对虾偷死病的综合防治. 渔业致富指南, 2009(1): 60-61] |
Yu TB, Ge XP. Cultivation of high quality crucian carp. Beijing: China Agriculture Press, 2004 [ 郁桐炳, 戈贤平. 巧养名优鲫鱼. 北京: 中国农业出版社, 2004]
|
Zhang QH. To be cautious of "bottom death" in the intensive farming of Pacific white shrimp. Inland Aquatic Product, 2004, 29(10): 48-49 [ 章秋虎. 南美白对虾高密度养殖谨防"死底症"发生. 内陆水产, 2004, 29(10): 48-49] |
Zhang QL, Liu Q, Liu S, et al. A new nodavirus is associated with covert mortality disease of shrimp. Journal of General Virology, 2014, 95(12): 2700-2709 |
Zhang QL, Xu TT, Wan XY, et al. Prevalence and distribution of covert mortality nodavirus (CMNV) in cultured crustacean. Virus Research, 2017, 233(2): 113-119 |



