2. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 荣成楮岛水产有限公司 荣成 264312;
5. 挪威海洋研究所 卑尔根 5817
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. Rongcheng Chudao Aquaculture Corporation, Rongcheng 264312;
5. Institute of Marine Research in Norway, Bergen 5817
自工业革命以来,人类活动排放至大气中CO2含量快速升高,从而使海洋中CO2溶解吸收量迅速增加,最终引发了严重的海洋环境问题——海水酸化。在政府间气候变化专门委员会(IPCC)报道中发现,海洋表面的pH与工业革命前相比,在2000年已经下降0.1个单位; 据预测,到2100年将下降0.3~0.5个单位; 到2300年将会下降0.8~1.4个单位(Caldeira et al, 2005)。海洋表面pH的下降会引起海水中H+含量增多,CO32-减少,尤其碳酸盐饱和度的下降,从而对生态系统造成影响(Ferrari et al, 2011)。近年来,海水酸化是国际研究的热门领域之一,在权威期刊已经有多篇关于海水酸化对海洋生物,尤其是钙化生物影响的报道(Fabry et al, 2008; Feely et al, 2004; Doney et al, 2009)。作为海洋中主要的钙化生物,海水酸化对贝类的研究引起了科研工作者的关注,主要涉及贝类的早期发育、钙化机制、生理能量、免疫调节方面(Talmage et al, 2010; Green et al, 2004; Wang et al, 2015; Michaelidis et al, 2005)。Talmage等(2010)研究表明,海水酸化(CO2浓度为650×10-6)会导致硬壳蛤(Mercenaria mercenaria)、海湾扇贝(Argopecten irradians)、美洲牡蛎(Crassostrea virginica)幼虫的变态、生长和存活都受到一定程度的负面影响。Timmins-Schiffman等(2013)发现,海水酸化会使太平洋牡蛎(Crassostrea gigas)受精后的幼体发育延缓。
紫贻贝(Mytilus galloprovincialis)又称“淡菜”,是我国黄海、渤海重要的海水经济贝类。据中国渔业统计年鉴(2016)报道,贻贝海水养殖面积达4.5万hm2,产量为87.8万t,占贝类海水养殖总产量的6.2%,在贝类海水养殖总产量中位居第4位。海水酸化的变化将会对贻贝的矿化、生长和生理过程造成不同程度的影响。Gazeau等(2007)研究发现,海水酸化(CO2浓度约为740×10-6)会导致紫贻贝的钙化率下降至25%。钙化过程的改变可能会进一步影响贝类的其他生理过程,如能量转化、代谢和繁殖(王有基等, 2014)的过程。据Navarro等(2013)研究发现,海水酸化(CO2浓度约为1200×10-6)会导致智利蓝贻贝(Mytilus chilensis)摄食率和吸收效率显著降低,从而引起贝类的吸收能量转化为生长能量大大降低。因此,探究海水酸化对贻贝能量分配的影响对于研究贝类酸化的耐受能力是至关重要的。目前,多数研究的酸化系统都是在实验室内进行模拟,为了更好地获得海水酸化对紫贻贝生理活动影响的相关信息,本研究采用野外围隔和现场流水相结合的实验方法,研究了海水酸化对紫贻贝摄食吸收和代谢的影响,探讨了酸化胁迫对紫贻贝能量分配的情况,研究结果对于深入认识紫贻贝应对海水酸化胁迫的生理代谢机制提供了基础数据。
1 材料与方法 1.1 实验地点的选择实验地点位于山东省荣成市桑沟湾楮岛海域半封闭的船舶避风港湾(37°02'38.3"N, 122°33'30.3"E),该港湾为长方形,长为150 m,宽为100 m,水深约为5 m,潮差≤2.0 m。通过湾北面约10 m的口门与外海相通,外海的潮汐过程驱动湾内外的海水交换。
1.2 实验材料实验所用紫贻贝于2016年5月10日采自山东省荣成市桑沟湾近海养殖区,采集时选取长势健康且形态一致的紫贻贝,采集后使用自然海水清洗贝壳表面附着物,暂养于双层实验池内(0. 8 m×0.5 m×0.5 m),置于楮岛码头海区内长方形金属框的网箱内(2.0 m× 2.0 m×1.0 m),暂养72 h后用于后续酸化实验。
1.3 模拟酸化实验系统的搭建与生物驯化设置2个海水pH处理组。pH为8.0组(桑沟湾楮岛海区自然海水pH)和pH为7.7组(根据IPCC预测的22世纪末期海洋pH)。pH为8.0组,在网箱内通过充入干净的空气进行控制; pH为7.7组,通过控制CO2和空气的流量获得CO2与空气的饱和气体,以便得到目标pH的酸化海水。酸化实验的搭建见图 1 (专利号201611109362.X)。
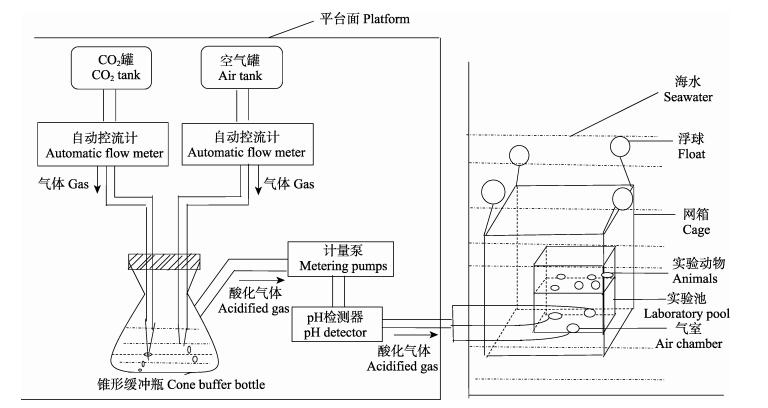
|
图 1 酸化实验系统 Fig.1 The seawater acidification experimental system |
暂养结束后,挑选健康、形态一致的紫贻贝进行标号后称量,分配到各个双层实验池中。pH为8.0组和pH为7.7组各分配45枚贻贝[壳长为(54.22± 4.68) mm]。每个处理组3个重复,每个重复15枚贻贝。选取9枚贻贝在实验开始的第10天和第30天测定其滤水率、同化效率、耗氧率和排氨率、壳高、壳长、壳宽和湿重。
实验在2016年5~6月进行,持续时间为30 d。实验期间,每天08:00、12:00和18:00测量海水的温度(T)、盐度(S)、溶解氧(DO)、pH和总碱度(TA),观察紫贻贝的生长情况。实验过程中没有紫贻贝死亡。海水的温度、盐度、DO和pH等水质参数采用便携式水质分析仪(YSI公司, Professional Plus,美国)进行测定,TA采用自动电位滴定仪(848MPT, 瑞士)测定。海水中无机碳体系各组分,利用的海水CO2系统计算公式软件(CO2_SYS_XLS_v2.1),通过海水中的温度、盐度、pH、TA计算得出海水无机碳体系中碳酸氢根离子浓度(HCO3-)、碳酸根离子浓度CO32-、CO2分压(pCO2)、方解石饱和度(Ωcalc)和文石饱和度(Ωarag)等参数。
1.4 现场流水实验 1.4.1 实验设计与搭建实验用的流水装置搭建在桑沟湾楮岛码头,实验用水直接取自码头内的海水。实验流水集装箱(1.5 m×1.0 m×0.8 m)内设1个进水口,利用水泵接于楮岛码头内的水箱(1.5 m×1.5mx 1.5 m); 1个流水口,通过分流管接于码头上的流水槽(0.3 mx0.2 m×0.1 m); 1个溢水口,集装箱内的水面始终保持在一个固定平面。实验开始时,水箱内充入利用CO2和空气预先配好的pH为7.7的酸化海水,或是直接充入200目筛绢过滤好的自然海水,利用水泵,水流从水箱→集装箱→流水槽不断地流出。实验期间,集装箱始终保持流水状态。采用YSI-556型溶氧仪测定水温、盐度、DO。
1.4.2 实验方法滤水实验测定方法 将紫贻贝分别放入流水槽中适应1 h,水流流速控制在200 ml/min范围内,以3个不放贻贝的流水槽作为空白组。实验持续3 h,每隔1 h从流水槽出水口接水样100 ml,利用便携式颗粒计数器PAMAS (测定粒径范围2~200 μm,S4031GO,德国)测定水样瓶中水体颗粒物数量。另外,从空白组的流水槽接水样1000 ml,利用预先灼烧并称重的GF/C玻璃纤维滤膜(孔径为1.2 μm,450℃灼烧4 h,重量保存至小数点后5位)收集水样中悬浮颗粒物浓度(TPM),抽滤后的GF/C膜用锡纸包好,并放入-20℃冰箱保存。
耗氧排氨实验测定方法 在集装箱中放置12个透明玻璃密封槽(∅0.15 m×0.1 m),其中,3个不放紫贻贝的密封槽作为空白组。槽内设有1个带有阀门的进水管、出水管,密封槽进水管利用分流装置接入至进水泵。紫贻贝放入密封罐,在流水的条件下适应1 h。耗氧实验开始时,关闭槽内的进水泵,静水环境下驯化2 h,依次用手持溶氧仪(Vernier ODO-BTA, 德国)测定密封槽内的溶解氧含量。实验结束后,取100 ml海水用于氨氮(NH4+-N)测定。
粪便的收集 将紫贻贝放入透明的聚乙烯水管(∅ 0.1 m× 0.3 m)内,两端固定20 μm的筛绢,放置在实验海区的网箱内,实验持续24 h。实验结束后,利用预先灼烧的GF/C玻璃纤维滤膜收集贻贝的粪便,用铝箔纸包好,并放入-20℃冰箱保存。
实验过程中,采集和保存的水样按照《海洋调查规范》(GB/T12763- 2007)进行测定。实验结束后,分离紫贻贝软组织,在60℃烘干至恒重后,称其重量并记录。回到实验室后,将GF/C玻璃纤维滤膜收集的水样和粪便样品,先用60℃烘干至恒重称其重量(W60),测其样品的总干重(TPM),之后在450℃条件下,用马弗炉煅烧4 h后称重(W450),计算样品的无灰分重量(POM),预先灼烧的GF/C玻璃纤维滤膜重量(W0)。样品的总干重(WTPM)和样品无灰分重量(WPOM)的计算公式:
| $ W_{\mathrm{POM}}=W_{60}-W_{450} ; \quad W_{\mathrm{TPM}}=W_{60}-W_{0} $ |
滤水率(Clearance rate,CR,L/h·g)=FR(L/h)×(C1- C0)/C1/W
式中,FR为流水槽的流速,C1、C0分别为实验组和空白组实验水体中颗粒物数量。
同化效率(Absorption efficiency,AE,%)=(F-E)/ [(1-E)F] (Conover, 1966)
式中,F为颗粒物无灰分干重/食物总干重; E为粪便无灰分干重/粪便总干重。
耗氧率(Respiration rate,RR,μmol/h×g)=[Ct0-Ct]× Vr×60/(t1-t0)/W
式中,t1、t0分别为实验开始与结束时间; Ct0、Ct为空白组和实验结束时贻贝组中溶解氧浓度; Vr为密封槽的体积; W为贝类的软组织干重。
排氨率(Ammonia excretion rate,AER,μmol/h·g)= [Ct0-Ct]×(V/1000)x1)/t/W
式中,Ct0、Ct分为贻贝组与空白组氨氮浓度; V为密封槽的体积; t为驯化时间; W为贝类的软组织干重。
组织干重标准化
| $ Y_{s}=\left(W_{s} / W_{e}\right)^{b} \times Y_{\mathrm{e}} $ |
式中,Ys是生物软组织干重标准化后的生理参数; Ws是标准重量(1 g); We为测得的动物的组织干重; Ye是未标准化的生理参数; b为0.67(Wang et al, 2015)。
生长余力(SFG)
| $ \begin{array}{c}{P=A-(R+U)} \\ {A=C \times \mathrm{AE}} \\ {C=\mathrm{CR}_{\mathrm{max}}(\mathrm{L} / \mathrm{h} \cdot \mathrm{g}) \times \mathrm{POM}(\mathrm{mg} / \mathrm{L}) \times 23(\mathrm{J} / \mathrm{mg})}\end{array} $ |
(Slobodkin et al, 1961; Widdows et al, 1979)
式中,C为摄食能(Ingested energy),食物的能量转换系数为23 J/mg; A为吸收能(Absorbed energy); R为耗氧能(Respired energy),其能量转换系数为0.456 J/μmol; U为排泄能(Excreted energy),其能量转化系数为0.349 J/h。
氧氮比(O/N)为呼吸氧原子数与排出氨态氮原子数之比,计算公式:
| $ \mathrm{O} / \mathrm{N}=(\mathrm{RR} / 16) /(\mathrm{ER} / 14) $ |
采用Excel 2007和SPSS 16.0软件进行数据的整理和方差分析。实验结果采用平均数±标准差(Mean± SD)表示,采用t检验进行显著性差异分析,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 实验水环境的变化 2.1.1 海水水环境参数的变化情况2016年5~6月野外围隔实验海区水环境参数的日均变化情况见表 1。从表 1可以看出,在实验过程中,温度、盐度、DO的变化比较稳定,无显著差异(P > 0.05)。实验海区海水温度波动范围为17~21℃; 盐度的波动范围为31.5~32.5;DO的变化范围为5.7~6.2 mg/L; 自然海水pH的变化范围为7.96±0.48,实验组海水pH的变化范围为7.68±0.43。
|
|
表 1 水环境参数的日均变化情况 Tab.1 The daily values of chemical factors of seawater |
实验过程中,实验海水的TA、HCO3-、CO32-、pCO2、Ωcalc和Ωarag变化见表 2。从表 2可以看出,各无机碳参数在海水中的变化范围分别为2047.48~2219.97 μmol/kg、1912.29~2108.96 μmol/kg、46.47~119.69 μmol/kg、604.4~1459.94 μatm、1.13~2.93、0.73~1.88。海水中的TA和HCO3-浓度的变化相似,无显著差异(P > 0.05)。在不同的酸化条件下,海水中的CO32-、pCO2、Ωcalc和Ωarag浓度有显著差异(P < 0.05);而pH为8.0组中的CO32-、Ωcalc和Ωarag显著高于酸化海水pH为7.7组,pH为8.0组自然海水中的pCO2显著低于酸化海水pH为7.7组。
|
|
表 2 海水无机碳体系各组分浓度 Tab.2 Concentration of carbonate system paramaters in the seawater |
海水酸化胁迫对桑沟湾海域紫贻贝滤水率和同化效率的影响见图 2。从图 2A可以看出,在酸化胁迫下,第10天和第30天紫贻贝的滤水率分别为(8.30± 0.31)、(6.40±0.24) L/h·g,相比于自然海水组,分别下降了31.05%和23.58%,差异显著(F=10.20, P < 0.05; F=9.50, P < 0.05)。

|
图 2 不同酸化和时间处理下紫贻贝滤水率(A)和同化效率(B)的变化 Fig.2 The clearance rate (A) and absorption efficiency (B) of M.galloprovincialis at the different pH and experiment time 图中相同时段内标有的不同字母的数据之间差异显著(P < 0.05),下同 Data with different letters for the same time mean significant differences from each other (P < 0.05), the same as below |
从图 2B可以看出,紫贻贝的同化效率受酸化胁迫和酸化时间的影响。在酸化第10天,同化效率的平均值为44.44%,与自然海水组相比,下降极显著(F=40.67, P < 0.01);在酸化第30天,同化效率的平均值为61.20%,与自然海水组相比,显著增加(F=14.67, P < 0.05)。
2.3 海水酸化胁迫对紫贻贝代谢生理的影响海水酸化胁迫对紫贻贝RR和AER影响见图 3。从图 3A、图 3B可以看出,紫贻贝受海水胁迫后,其RR和AER变化规律非常相似,均随着酸化时间呈上升趋势。显著性t检验分析结果显示,在酸化第10天,RR增加,但不显著(F=1.36, P > 0.05);AER显著增加(F=27.68, P < 0.05);在酸化第30天,RR显著增加(F= 12.86, P < 0.05),AER增加极显著(F=33.29, P < 0.01)。
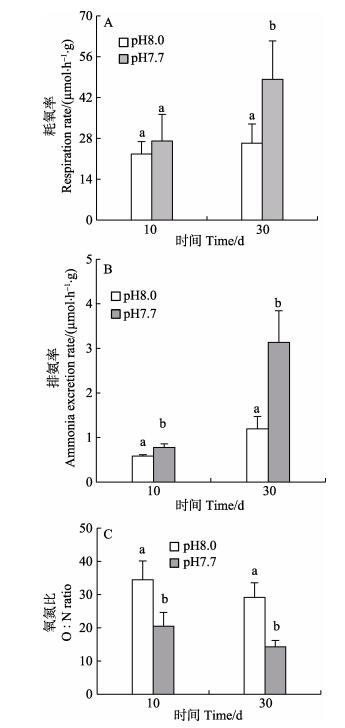
|
图 3 不同酸化和时间处理下紫贻贝耗氧率(A)、排氨率(B)和氧氮比(O/N)的变化 Fig.3 The respiration rate (A), ammonia excretion rate (B) and O/N ratio (C) of M.galloprovincialis at the different pH and experiment time |
从图 3C可以看出,紫贻贝O/N随酸化胁迫时间的延长而减少。在酸化胁迫下,第10天和第30天紫贻贝的O/N的平均值分别为20.50和14.28,与自然海水组相比,显著下降(F=17.08, P < 0.05; F=55.25, P < 0.01)。
2.4 海水酸化胁迫对紫贻贝能量收支的影响在海水酸化胁迫下,对紫贻贝能量收支的各项参数进行计算,结果见表 3。从表 3可以看出,在短期酸化胁迫10 d后,紫贻贝的摄食能和吸收能显著降低(F=14.02, P < 0.05; F=21.22, P < 0.05),呼吸能无显著差异(F=2.23, P > 0.05),排泄能显著增加(F=5.62, P < 0.05),经计算单位软体部干重生长余力极显著降低(F=120.88, P < 0.01) (图 4)。在中期酸化胁迫(30 d)后,紫贻贝的摄食能显著降低(F=12.09, P < 0.05),吸收能增加极显著(F=32.48, P < 0.01),呼吸能和排泄能显著升高(F=7.48, P < 0.05; F=16.43, P < 0.05),呼吸能和排泄能共占总摄食能的12.84%,生长余力极显著增加(F= 179.94, P < 0.01) (图 4)。
|
|
表 3 海水酸化胁迫对紫贻贝能量收支的影响 Tab.3 Impact of seawater acidification on the energy budget of M.galloprovincialis (Mean±SD) |

|
图 4 不同酸化条件不同处理时间下紫贻贝生长余力的变化 Fig.4 The SFG of M.galloprovincialis at the different pH and experiment time |
滤水率是研究贝类摄食生理的重要参数(Riisgård, 1991),它的大小直接受到生物所处环境的理化因子的影响(匡世焕等, 1996; 张继红等, 2005)。Fernández-Reiriz等(2012)、Wang等(2015)、Sui等(2016)研究发现,海水酸化对滤食性贝类滤水率的影响因种类而异,厚壳贻贝(Mytilus coruscus)、紫贻贝的幼贝在海水酸化条件下,其滤水率未受影响。Liu等(2012)对处于海水酸化下合浦珠母贝(Pinctada fucata)的代谢生理进行研究发现,合浦珠母贝的滤水率在酸化条件下显著增加。但更多的研究表明,海水酸化胁迫会导致滤水率显著降低,Liu等(2012)在同一酸化条件下对栉孔扇贝(Chlamys farreri)和贻贝(Mytilus edutis)滤水率的研究发现,2种海洋贝类的滤水率均显著降低。Fernández-Reiriz等(2012)研究发现,槽蛤仔(Ruditapes decussatus)的滤水率受到酸化胁迫的显著抑制。这与本研究结果相似,在海水酸化pH为7.7的条件下,紫贻贝滤水率均显著降低(图 2A),并随酸化时间加长,紫贻贝第10天滤水率的平均值高于第30天。Navarro等(2013)研究发现,酸化时间对智利蓝贻贝摄食活动也具有重要的影响,贻贝(CO2浓度约为750×10-6)在酸化海水中酸化35 d后,其摄食活性显著低于实验开始阶段(0 d)。从贝类的摄食行为中观察发现,在pH≤7.0的海水酸化下,太平洋牡蛎、食用牡蛎(Ostrea edulis)和紫贻贝这3种海洋贝类均表现为贝壳持续张开,行为活动极度不活泼,呈现一种极近“麻痹状态”,生长受到抑制,死亡率增加(Bamber et al, 1990)。
贝类同化效率对海水酸化同样敏感。Wang等(2015)在室内模拟pH为7.7的海水酸化研究显示,海水酸化对厚壳贻贝的同化效率几乎没有产生影响。但Fernández-Reiriz等(2011、2012)在pH=Δ-0.4的酸化条件下酸化78 d后发现,槽蛤仔幼体同化效率显著降低,但是,紫贻贝幼体同化效率却显著增加,说明酸化对海洋贝类的影响具有明显的种属特异性。而本研究发现,紫贻贝在同一酸化条件下,同化效率在第10天下降,在30 d时增加(图 2B)。出现这一现象的原因可能是因为短期酸化胁迫会显著影响贝类消化系统,但是,在长期的酸化环境下,紫贻贝逐渐适应这一环境,通过调节自身的营养吸收能力来抵消这种酸化的不利环境(Wang et al, 2015)。Areekijseree等(2004)研究发现,贝类体内某些消化吸收酶如淀粉酶、肽酶、葡萄糖苷酶在pH较低时,其活性会显著增加,机体通过提高某些营养消化酶的活性,促进营养的吸收利用,使机体免受酸化损伤。这种现象对于紫贻贝这一物种应对酸化胁迫是非常有利的生存策略,但更深层次的生理机制方面的研究还有待进一步研究。
3.2 海水酸化对紫贻贝代谢生理的影响RR和AER是研究贝类代谢中最广泛的指标。研究发现,海水酸化会对RR和AER产生不同程度的影响(Thomsen et al, 2010; Fernández-Reiriz et al, 2012; Wang et al, 2015; Sui et al, 2016; Hu et al, 2017)。一方面,酸化时间会对贝类的代谢产生影响。厚壳贻贝在酸化处理3 d,其RR和AER几乎没有产生影响,但利用相似的实验方法酸化14 d后发现,酸化会显著降低贻贝的RR和AER (Wang et al, 2015; Sui et al, 2016)。另一方面,海洋酸化对贝类代谢的影响具有明显的种属特异性。Fernández-Reiriz等(2011)在长期的酸化研究中发现,槽蛤仔的RR显著下降,AER显著增加,而在紫贻贝中,虽然AER的变化一样,但对RR却几乎没有影响。本研究发现,在海水酸化胁迫条件下,紫贻贝的RR和AER都显著升高(图 3A、图 3B)。Lannig等(2010)认为,酸化会影响贝类细胞内离子浓度(H+、CO32-、HCO3-、Ca2+和Mg2+)的变化,贝类通过提高代谢速率来维持细胞内酸碱离子的稳定。
O/N是表示生物利用代谢底物的一个重要指标,反映有机生物在特定的环境状态下体内脂肪、糖类和蛋白质代谢的比例关系(Ruyet et al, 2004; 姜娓娓等, 2017)。另外,O/N值的高低可以作为生物体适应环境压力的指标之一(Widdows et al, 1971)。当生物体以蛋白质代谢为主时,O/N值约为7.0~9.3;当生物以脂肪和碳水化合物代谢为主时,O/N值通常高于24 (Mayzaud et al, 1973)。本研究中,紫贻贝受到酸化处理后的O/N值变化波动范围为14.28~20.46,显著低于对照组(P < 0.05, 图 3C),说明在海水酸化胁迫下,紫贻贝的供能物质由脂肪和碳水化合物逐渐向蛋白质过渡。
3.3 海水酸化对紫贻贝能量分配的影响在环境压力下,生长余力是估算生物整体生理状态的一个重要能量指标。研究发现,通过海水酸化对贝类摄食能、吸收能、呼吸能和排泄能等生理过程的研究,可以反映出海水酸化对海洋贝类的生长余力的影响(Berge et al, 2006; Fernández-Reiriz et al, 2011; Sanders et al, 2013; Range et al, 2014)。在受到海水酸化胁迫后,贝类生长余力的降低,常常伴随着摄食能和吸收能的减少、呼吸能和排泄能的增加、蛋白质的降解等过程,这已经在紫贻贝(Thomsen et al, 2010; Fernández-Reiriz et al, 2011)、厚壳贻贝(Wang et al, 2015)、槽蛤仔(Fernández-Reiriz et al, 2012)、长牡蛎(Lannig et al, 2010)中发现。在本研究中,在短期酸化胁迫10 d,紫贻贝降低摄食、吸收能量,增加呼吸代谢能量消耗,最终导致贝类生长的能量减少,生长下降(表 3)。这与Thomsen等(2010)研究结果相一致,贝类往往会通过增加能量的需求和氮损失的协同作用来应对海水酸化胁迫的压力。Fernández-Reiriz等(2011)研究发现,酸化胁迫导致槽蛤仔滤水、摄食降低,引起能量吸收的减少,氨代谢增加,生长变慢。本研究发现,紫贻贝在短期酸化10 d,生长余力与对照组相比下降了28.65% (图 4)。这与Miller等(2009)关于美洲牡蛎的研究结果一致。Navarro等(2013)研究发现,智利蓝贻贝幼贝在CO2中浓度约为750×10-6、CO2高浓度约为1200×10-6的酸化海水中,生长率显著下降,分别下降13%和28%。在这一情况下,假设贻贝在正常海水(CO2浓度约为380×10-6)中,其组织产量为42120 kg/month,在中、高CO2浓度的海水中处理后,其产量将分别减少5500、12000 kg/month。这种现象说明在海水酸化中,贝类生长的降低,不仅会对贝类的健康产生危害,更严重的是这将会对贝类的养殖产业产生不可估量的损失。但值得注意的是,随着酸化胁迫延长至30 d后,紫贻贝的生长余力显著增加,与自然海水相比,增加了30.70%,这种现象可能与长时间酸化胁迫后,紫贻贝同化效率和吸收能的增加有关,尽管贝类的呼吸能和排泄能显著增加,但代谢能仅占摄食能的12.84%,所以,吸收能的显著增加是造成贝类生长余力显著增加的主要原因(表 3、图 4)。另外,Fernández-Reiriz等(2012)通过相同的酸化条件,利用CO2气体进行室内酸化模拟78 d后发现,紫贻贝稚贝同化效率的增加,吸收能增加,引起生长余力增加,这与本研究结果相一致。在长期酸化下,紫贻贝生长余力的增加,为以后抗逆品种的选育提供了很好的思路。需要指出的是,因实验场地、天气等原因,本研究仅持续了30 d,对紫贻贝而言,在长期(半年以上)酸化条件下,是否能够通过稳定的高吸收效率来输送足够的生长能维持生长,尚需要长期尺度的海水酸化实验进行证实。
Areekijseree M, Engkagul A, Kovitvadhi U, et al. Temperature and pH characteristics of amylase and proteinase of adult freshwater pearl mussel, Hyriopsis (Hyriopsis) bialatus Simpson 1900. Aquaculture, 2004, 234(1): 575-587 |
Bamber RN. The effects of acidic seawater on three species of lamellibranch mollusk. Journal of Experimental Marine Biology and Ecology, 1990, 143(3): 181-191 DOI:10.1016/0022-0981(90)90069-O |
Berge JA, Bjerkeng B, Pettersen O, et al. Effects of increased sea water concentrations of CO2 on growth of the bivalve Mytilus edulis L.. Chemosphere, 2006, 62(4): 681-687 DOI:10.1016/j.chemosphere.2005.04.111 |
Caldeira K, Wickett ME. Ocean model predictions of chemistry changes from carbon dioxide emissions to the atmosphere and ocean. Journal of Geophysical Research Oceans, 2005, 110(9) DOI:10.1029/2004JC002671 |
Conover RJ. Assimilation of organic matter by zooplankton. Limnology and Oceanography, 1966, 11(3): 338-345 DOI:10.4319/lo.1966.11.3.0338 |
Department of Agriculture, Fisheries Bureau. China fishery statistics yearbook. Beijing: China Agricultural Press, 2017 [ 农业部渔业局. 中国渔业统计年鉴. 北京: 中国农业出版社, 2017]
|
Doney SC, Lima I, Moore JK, et al. Skill metrics for confronting global upper ocean ecosystem-biogeochemistry models against field and remote sensing data. Journal of Marine Systems, 2009, 76(1-2): 95-112 DOI:10.1016/j.jmarsys.2008.05.015 |
Fabry VJ. Ocean science. Marine calcifiers in a high-CO2 ocean. Science, 2008, 320(5879): 1020-1022 DOI:10.1126/science.1157130 |
Feely RA, Sabine CL, Lee K, et al. Impact of anthropogenic CO2 on the CaCO3 system in the oceans. Science, 2004, 305(5682): 362-366 DOI:10.1126/science.1097329 |
Fernández-Reiriz MJ, Range P, Álvarez-Salgado XA, et al. Physiological energetics of juvenile clams Ruditapes decussatus in a high CO2 coastal ocean. Marine Ecology Progress, 2011, 433: 97-105 DOI:10.3354/meps09062 |
Fernández-Reiriz MJ, Range P, Álvarez-Salgado XA, et al. Tolerance of juvenile Mytilus galloprovincialis to experimental seawater acidification. Marine Ecology Progress, 2012, 454(2): 65-74 |
Ferrari MC, Mccormick MI, Munday PL, et al. Putting prey and predator into the CO2 equation-qualitative and quantitative effects of ocean acidification on predator-prey interactions. Ecology Letters, 2011, 14(11): 1143-1148 DOI:10.1111/j.1461-0248.2011.01683.x |
Gazeau F, Quiblier C, Jansen JM, et al. Impact of elevated CO2 on shellfish calcification. Geophysical Research Letters, 2007, 34(7): L07603 |
Green MA, Jones ME, Boudreau CL, et al. Dissolution mortality of juvenile bivalves in coastal marine deposits. Limnology and Oceanography, 2004, 49(3): 727-734 DOI:10.4319/lo.2004.49.3.0727 |
Hu M, Lin D, Shang Y, et al. CO2-induced pH reduction increases physiological toxicity of nano-TiO2 in the mussel Mytilus coruscus. Scientific Reports, 2017, 7 |
Jiang WW, Fang JG, Li JQ, et al. Effects of temperature change on physiological and biochemical activities of Haliotis discus hannai Ino. Journal of Fishery Sciences of China, 2017, 24(2): 220-230 [ 姜娓娓, 方建光, 李加琦, 等. 温度胁迫对皱纹盘鲍生理和生化活动的影响. 中国水产科学, 2017, 24(2): 220-230] |
Liu WG, He MX. Effects of ocean acidification on the metabolic rates of three species of bivalve from southern coast of China. Chinese Journal of Oceanologhy and Limnology, 2012, 30(2): 206-211 DOI:10.1007/s00343-012-1067-1 |
Kuang SH, Fang JG, Sun HL, et al. Seasonal variation of filtration rate and assimilation efficiency of scallop Chlamys farreri in Sanggou Bay. Oceanologia et Limnologia Sinica, 1996, 27(2): 194–199 [匡世焕, 方建光.桑沟湾栉孔扇贝不同季节滤水率和同化率的比较.海洋与湖沼, 1996, 27(2): 194–199] http://www.cnki.com.cn/Article/CJFDTotal-HYFZ199602011.htm
|
Lannig G, Eilers S, Pörtner HO, et al. Impact of ocean acidification on energy metabolism of oyster, Crassostrea gigas—changes in metabolic pathways and thermal response. Marine Drugs, 2010, 8(8): 2318-2339 DOI:10.3390/md8082318 |
Mayzaud P. Respiration and nitrogen excretion of zooplankton. Ⅱ. Studies of the metabolic characteristics of starved animals. Marine Biology, 1973, 21(1): 19-28 |
Michaelidis B, Ouzounis C, Paleras A, et al. Effects of long-term moderate hypercapnia on acid-base balance and growth rate in marine mussels Mytilus galloprovincialis. Marine Ecology Progress, 2005, 293(1): 109-118 |
Miller AW, Reynolds AC, Sobrino C, et al. Shellfish face uncertain future in high CO2 world: Influence of acidification on oyster larvae calcification and growth in estuaries. PLoS One, 2009, 4(5): e5661 DOI:10.1371/journal.pone.0005661 |
Navarro JM, Torres R, Acuña K, et al. Impact of medium-term exposure to elevated pCO2, levels on the physiological energetics of the mussel Mytilus chilensis. Chemosphere, 2013, 90(3): 1242-1248 DOI:10.1016/j.chemosphere.2012.09.063 |
Range P, Chícharo MA, Ben-Hamadou R, et al. Impacts of CO2 -induced seawater acidification on coastal Mediterranean bivalves and interactions with other climatic stressors. Regional Environmental Change, 2014, 14(1): 19-30 |
Riisgård HU. Suspension feeding in the polychaete Nereis diversicolor. Marine Ecology Progress, 1991, 70(1): 29-37 |
Ruyet PL, Mahé K, Bayon NL, et al. Effects of temperature on growth and metabolism in a Mediterranean population of European sea bass, Dicentrarchus labrax. Aquaculture, 2004, 237(1): 269-280 |
Sanders MB, Bean TP, Hutchinson TH, et al. Juvenile king scallop, Pecten maximus, is potentially tolerant to low levels of ocean acidification when food is unrestricted. PLoS One, 2013, 8(9): e74118 DOI:10.1371/journal.pone.0074118 |
Slobodkin LB, Richman S. Calories/gm. in species of animals. Nature, 1961, 191(4785): 299-299 |
Sui Y, Kong H, Huang X, et al. Combined effects of short-term exposure to elevated CO2, and decreased O2, on the physiology and energy budget of the thick shell mussel Mytilus coruscus. Chemosphere, 2016, 155: 207-216 DOI:10.1016/j.chemosphere.2016.04.054 |
Talmage SC, Gobler CJ. Effects of past, present, and future ocean carbon dioxide concentrations on the growth and survival of larval shellfish. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(40): 17246-17251 DOI:10.1073/pnas.0913804107 |
Timmins-Schiffman E, O'Donnell MJ, Friedman CS, et al. Elevated pCO2, causes developmental delay in early larval Pacific oysters, Crassostrea gigas. Marine Biology, 2013, 160(8): 1973-1982 DOI:10.1007/s00227-012-2055-x |
Thomsen J, Melzner F. Moderate seawater acidification does not elicit long-term metabolic depression in the blue mussel Mytilus edulis. Marine Biology, 2010, 157(12): 2667-2676 DOI:10.1007/s00227-010-1527-0 |
Wang YJ, Li LS, Li QZ, et al. Research progress on eco-physiological responses of shellfish under ocean acidification and global warming. Acta Ecologica Sinica, 2014, 34(13): 3499-3508 [ 王有基, 李丽莎, 李琼珍, 等. 海洋酸化和全球变暖对贝类生理生态的影响研究进展. 生态学报, 2014, 34(13): 3499-3508] |
Wang YJ, Li LS, Hu MH, et al. Physiological energetics of the thick shell mussel Mytilus coruscus, exposed to seawater acidification and thermal stress. Science of the Total Environment, 2015, 514: 261-272 DOI:10.1016/j.scitotenv.2015.01.092 |
Widdows J, Bayne BL. Temperature acclimation of Mytilus edulis with reference to its energy budget. Journal of the Marine Biological Association of the United Kingdom, 1971, 51(04): 827 DOI:10.1017/S0025315400018002 |
Widdows J, Bayne BL, Livingstone DR, et al. Physiological and biochemical responses of bivalve molluscs to exposure to air. Comparative Biochemistry and Physiology Part A: Physiology, 1979, 62(2): 301-308 DOI:10.1016/0300-9629(79)90060-4 |
Zhang JH, Fang JG, Sun S, et al. Clearance rate, ingestion rate and absorption efficiency of cultivated clam Ruditapes philippinarum in Jiaozhou Bay, China. Oceanologia et Limnologia Sinica, 2005, 36(6): 548-555 [ 张继红, 方建光, 孙松, 等. 胶州湾养殖菲律宾蛤仔的清滤率、摄食率、吸收效率的研究. 海洋与湖沼, 2005, 36(6): 548-555 DOI:10.3321/j.issn:0029-814X.2005.06.009] |



