2. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
鼠尾藻(Sargassun thunbergii)是北太平洋西部特有的暖温性海藻,在我国北起辽东半岛,南至雷州半岛的硇洲岛均有广泛分布,是某些海域潮间带的优势藻种(曾呈奎, 1962)。鼠尾藻在食品、工业、医药、饲料(饵料)、环保等方面都具有特殊的价值,如鼠尾藻是海参(Apostichopus japonicus)的优质饲料,是提取褐藻胶、甘露醇、碘等的重要工业原料,还是降低海区富营养化、净化重金属污染海区的优质藻种等(包杰等, 2008; 韩晓弟等, 2005; 刘朝阳等, 2006; 张尔贤等, 1995; 郑怡, 1994; 魏玉西等, 2002)。
近年来,对鼠尾藻的研究越来越深入和完善,鼠尾藻的人工养殖技术不断成熟(王飞久等, 2006; 李美真等, 2009; 孙修涛等, 2010; 陈洁等, 2016)。但在海藻的人工育苗过程中,杂藻附着是很突出的问题,鼠尾藻育苗时期最主要的是附着硅藻的侵害,其他的附着杂藻主要是绿藻和红藻类(李美真等, 2009),如刚毛藻(Chladophora)、浒苔(Enteromorpha)、水云、石莼(Ulue pertusa)和仙菜等,常用的除杂藻方法有洗刷苗帘、药浴(柠檬酸、硫酸铵、硝酸铵溶液)和淡水浸泡苗帘、干露等(贾柽等, 2012; 李美真等, 2009; 李生尧等, 2009),但这些药物处理均对海藻幼苗产生一定程度的伤害。药物处理和淡水浸泡能有效去除杂藻,但在鼠尾藻幼孢子体时期,使用这些药物和淡水处理对种苗是否有影响还未知。本研究以山东青岛太平湾海区自然生长的鼠尾藻为材料,以此海区常见的石莼和绢丝藻(Callithamnion corymbosum)为绿藻和红藻类杂藻的代表藻,探究以淡水配制的1%柠檬酸、1%硝酸铵、3%硫酸铵溶液和淡水分别处理不同时间,是否能有效去除杂藻,又能保证鼠尾藻苗种的健康生长。
光是调控植物生长发育的关键生态因子之一,藻类对可见光的吸收波长主要集中在400~510 nm的蓝紫光区和610~720 nm的红橙光区(韩军军等, 2017)。汪文俊等(2009)研究发现,蓝光始终促进海带(Laminaria japonica)幼孢子体的生长,在红光下藻体生长极为缓慢。赵凤娟(2007)研究表明,相同光强条件下的蓝光和白光相比较,蓝光不能满足鼠尾藻幼苗早期生长的需要。Kim等(2015)研究发现,日光灯、红光、绿光下生长的红藻龙须菜(Gracilaria tikvahiae)具有较高的生长速率。而不同光质对鼠尾藻的光合和生长的影响还未知。本研究以白光为对照,探究蓝光、红光分别对鼠尾藻生长和光合生理的影响。
本研究利用不同光质、不同药物浓度和淡水对鼠尾藻幼苗及其附着杂藻进行处理,采用叶绿素荧光和液相氧电极技术,揭示了鼠尾藻和杂藻在不同处理时光合生理的变化与异同,探究鼠尾藻人工育苗过程中,适宜的光质培养条件及幼苗期间有效的杂藻清除方法,旨在进一步完善鼠尾藻人工育苗技术,为鼠尾藻的大规模养殖提供技术支撑。
1 材料与方法 1.1 实验材料本研究于2017年6月20日在山东青岛太平角潮间带礁石区,采集健康、近成熟的雌雄鼠尾藻,在野外进行简单清洗,然后带回实验室,用过滤消毒的海水彻底清洗,在显微镜下检查生殖托的成熟情况。低温室中(14℃左右)培养,培养液为灭菌海水,营养盐为NaNO3-N:4 mg/L,KH2PO4-P:0.4 mg/L,放置适量比例雌雄生殖托(雌:雄=3:1),下层铺灭菌玻璃片用于受精卵的附着和收集。采样第2天即排卵和精子,2~3 d后取出藻体,海水中的游离幼孢子体充气悬浮培养,玻璃片上的幼孢子体按下面的方法进行实验。本研究所使用的鼠尾藻幼孢子体大小均在0.5 cm以下。
将附着在鼠尾藻玻璃片上的菱形藻(Nitzschia)刮下后悬浮培养,培养条件与鼠尾藻相同。
叶绿素荧光实验的鼠尾藻嫩芽(梁洲瑞等, 2011)、石莼和绢丝藻样品于2017年9月11日在青岛太平角潮间带礁石区采集,藻体生长状态良好。
1.2 实验方法将实验材料置于GXZ智能型光照培养箱(宁波江南仪器厂)中培养,培养液为灭菌海水,营养盐为NaNO3-N:4 mg/L,KH2PO4-P:0.4 mg/L,光强为60 μmol photons/(m2×s),温度为18℃,每3 d换水1次,使用Oxygraph液相氧电极测定表观光合速率(Pn)和呼吸耗氧速率(R),叶绿素荧光成像系统(IMAGING-PAM)测定光系统Ⅱ(PSⅡ)的最大荧光产量Fv/Fm。测定方法:样品暗处理30 min后测定Fv/Fm。每个处理组设置3个重复。
1.2.1 光质对鼠尾藻幼孢子体光合生理、相对生长速率及菱形藻光合生理的影响取出藻体后,将附着在玻璃片上的鼠尾藻幼孢子体分为3组,共9个玻璃片,每个玻璃片在显微镜(Nikon E200,日本)下随机选取约50个鼠尾藻幼孢子体拍照记录。用1 L的烧杯分别放在以白光(色温为5000~7000 K)、蓝光(波长为460~475 nm)、红光(波长为620~635 nm)LED灯为光源的光照培养箱中培养,7 d后再次在显微镜下拍照。采用Image-Pro Plus 5.1图像分析软件,对实验所拍照片进行分析,测量鼠尾藻幼孢子体的长度。幼孢子体相对生长速率(Relative growth rate,RGR)计算公式:
| $ {\rm{RGR = }}100 \times ({\rm{ln}}{L_2} - {\rm{ln}}{L_1})/t $ |
式中,L1、L2分别为培养前后幼孢子体的长度,t为培养时间。
悬浮充气培养的鼠尾藻幼孢子体在不同光质的光照培养箱中适应3 d,分别在对应光质下测定Pn和R。
将菱形藻按照同样的方法测出不同光质下的Pn和R。
1.2.2 不同药物浓度对鼠尾藻及杂藻光合生理的影响将鼠尾藻幼孢子体(长度为0.5 cm以下)及鼠尾藻新生嫩芽分别在淡水配制1%柠檬酸(pH=2.27)中浸泡1、3、5 min,在淡水配制1%硝酸铵(pH=5.96)中浸泡3、5、10 min,在淡水配制3%硫酸铵(pH=5.88)中浸泡3、5、10 min,浸泡后,马上用海水冲洗5 min,测定浸泡处理后,在对照条件下恢复培养2、24 h后的Pn和R。
用相同的药物处理方法处理鼠尾藻幼孢子体、石莼和绢丝藻,测定浸泡处理后,在对照条件下恢复培养1 d或1、3 d后的Fv/Fm。
1.2.3 淡水不同时间对鼠尾藻及杂藻光合生理的影响将鼠尾藻幼孢子体、鼠尾藻新生嫩芽、石莼及绢丝藻分别在淡水中浸泡30 min、1 h,测定浸泡处理后,在对照条件下恢复培养1、3 d后的Fv/Fm。
1.3 数据分析数据分析与作图采用Excel软件,用T检验进行显著性差异分析(P < 0.05为显著差异)。
2 结果 2.1 光质对鼠尾藻幼孢子体光合生理、相对生长速率及菱形藻光合生理的影响从图 1a可以看出,在不同光质培育7 d后,鼠尾藻幼孢子体的Pn在蓝光下最大,白光下次之,红光下最小。其中,幼孢子体在蓝光下的Pn明显大于白光和红光下(P < 0.05),而白光与红光间无显著差异(P > 0.05)。幼孢子体的R在白光下最大,红光下最小,其中,白光和蓝光明显大于红光(P < 0.05),而白光与蓝光间无显著差异(P > 0.05)。从图 1b可以看出,在不同光质培育7 d后,菱形藻的Pn在红光下最大,蓝光次之,白光下最小。菱形藻在红光下的Pn明显大于白光和蓝光(P < 0.05),白光与蓝光间无显著差异(P > 0.05)。菱形藻的R在蓝光下最大,白光下最小,蓝光明显大于白光(P < 0.05),其他无显著差异(P > 0.05)。
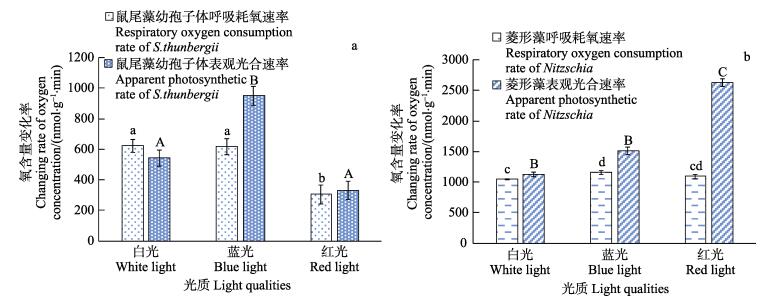
|
图 1 不同光质下培育7 d后鼠尾藻、菱形藻Pn和R的影响 Fig.1 Apparent photosynthetic rate and respiratory oxygen consumption rate of S. thunbergii and Nitzschia after cultured in white, blue and red light for 7 days 图中不同字母为差异显著,相同字母为差异不显著。小写字母为呼吸速率差异,大写为表观光合速率差异 Different letters in the diagram indicate significant differences, and the same letters indicate no significant differences. Lowercase letters represent respiration rate, and capital letters represent photosynthetic rate |
从图 2a可以看出,在白光、蓝光和红光下鼠尾藻与菱形藻Pn比值均小于1,其中,蓝光下最大,白光次之,红光下最小,各组间均有显著差异(P < 0.05)。从图 2b可以看出,在不同光质下,鼠尾藻Pn/R值蓝光下最大,白光下最小。其中,蓝光下Pn/R值显著大于白光和红光(P < 0.05),白光与红光间无显著差异(P > 0.05)。鼠尾藻幼孢子体在蓝光下Pn/R最大,即光合活性最大,蓝光适宜鼠尾藻幼孢子体的生长。从图 2c可以看出,不同光质下,菱形藻的Pn/R值红光下最大,白光下最小。方差分析结果显示,白光、蓝光和红光3个处理组间均差异显著(P < 0.05)。菱形藻在红光下Pn/R值最大,即光合活性最大,红光适宜菱形藻的生长。
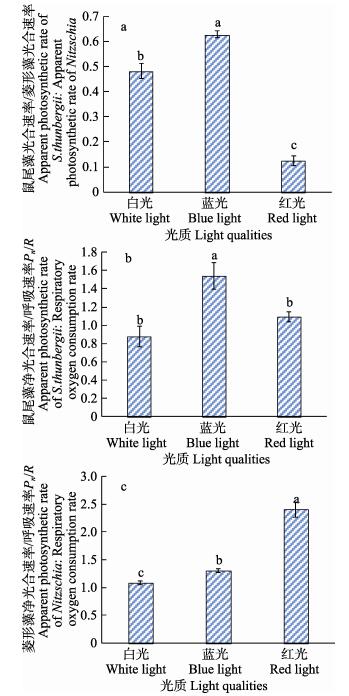
|
图 2 不同光质对鼠尾藻Pn/菱形藻Pn、鼠尾藻Pn/R、菱形藻Pn/R的影响 Fig.2 The ratio of apparent photosynthetic rate of S.thunbergii, and Nitzschia, the ratio of apparent photosynthetic rate and respiratory oxygen consumption rate of S.thunbergii and Nitzschia 图中不同字母为差异显著,相同字母为差异不显著,下同 Different letters in the diagram indicate significant difference, and the same letters indicate no significant difference, the same as below |
从图 3可以看出,不同光质条件下,培育7 d后,鼠尾藻幼孢子体的RGR蓝光下最大,为18.08%,红光下最小,为17.17%。方差分析结果显示,3个处理组间无显著差异(P > 0.05)。
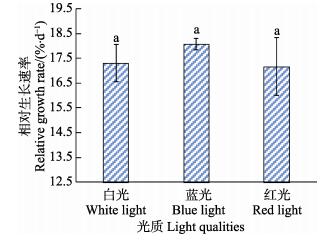
|
图 3 不同光质条件下培育7 d后鼠尾藻幼孢子体的RGR Fig.3 Relative growth rate of the young sporophytes after cultured in white, blue and red light for 7 days |
1%硝酸铵(pH=5.96)处理鼠尾藻幼孢子体后,对应时间的Pn、R和总光合速率(呼吸速率和光合速率的总和)见表 1。从表 1可以看出,处理3 min组随着恢复时间的延长,幼孢子体的Pn逐渐降低,R逐渐升高,总光合速率逐渐升高,与对照组相比无显著差异(P > 0.05)。处理5、10 min组随着恢复时间的延长,鼠尾藻的Pn、R和总光合速率都逐渐降低。5 min后,随着恢复时间延长,Pn和R逐渐下降,药物处理可能对鼠尾藻幼孢子体造成了不可逆的损伤,超过了其恢复的极限,时间越久越趋于死亡。
|
|
表 1 1%硝酸铵处理不同时间对鼠尾藻幼孢子体Pn和R的影响 Tab.1 Apparent photosynthetic rate and respiratory oxygen consumption rate of S. thunbergii young sporophytes after 1% ammonium nitrate treatment (nmol/g×min) |
表 2为3%硫酸铵(pH=5.88)处理鼠尾藻幼孢子体后,对应时间的Pn、R和总光合速率。恢复2 h和恢复24 h的Pn、R和总光合速率均未恢复正常水平,且处理3、5、10 min组恢复24 h的Pn、R和总光合速率均分别低于其恢复2 h的,3%硫酸铵比1%硝酸铵酸性稍强,3%硫酸铵药物处理可能也对鼠尾藻幼孢子体造成了不可逆的损伤,时间越久越趋于死亡。
|
|
表 2 3%硫酸铵处理不同时间对鼠尾藻幼孢子体Pn和R的影响 Tab.2 Apparent photosynthetic rate and respiratory oxygen consumption rate of S. thunbergii young sporophytes after 3% ammonium sulfate treatment (nmol/g×min) |
1%柠檬酸(pH=2.27)处理鼠尾藻幼孢子体后, 对应时间的Pn、R和总光合速率见表 3。从表 3可以看出,1%柠檬酸处理对鼠尾藻幼孢子体有较大伤害,且时间越长伤害越大。处理1、3、5 min组恢复2、24 h时,Pn均为负值,R随着处理时间的增加逐渐降低,随着恢复时间的增加逐渐升高,但仍远远低于对照组,不能恢复到正常水平。相对于硫酸铵和硝酸铵,柠檬酸对鼠尾藻幼孢子体的伤害更大。
|
|
表 3 1%柠檬酸处理不同时间对鼠尾藻幼孢子体Pn和R的影响 Tab.3 Apparent photosynthetic rate and respiratory oxygen consumption rate of S. thunbergii young sporophytes after 1% citric acid treatment(nmol/g×min) |
图 4为1%硝酸铵、3%硫酸铵组处理鼠尾藻幼孢子体后,各对应时间的Fv/Fm。从图 4a可以看出,1%硝酸铵处理3、5 min和3%硫酸铵处理3 min并在恢复1、3 d后,Fv/Fm均显著低于对照组(P < 0.05),各组处理后,恢复1、3 d之间均无显著差异(P > 0.05)。恢复3 d后的鼠尾藻Fv/Fm值均小于0.6,鼠尾藻不能恢复正常水平。从图 4b可以看出,硝酸铵、硫酸铵处理组对鼠尾藻嫩芽影响较小,1 d后均可恢复正常水平,1%硝酸铵处理3、5 min和3%硫酸铵处理3 min后,Fv/Fm均显著低于对照组(P < 0.05),各处理组恢复1 d后,Fv/Fm与对照组均无显著差异(P > 0.05),其中,1%硝酸铵5 min、3%硫酸铵3 min组处理后,Fv/Fm均显著低于恢复1 d的Fv/Fm(P < 0.05),3%硝酸铵处理3 min后,与恢复1 d组间无显著差异(P > 0.05)。
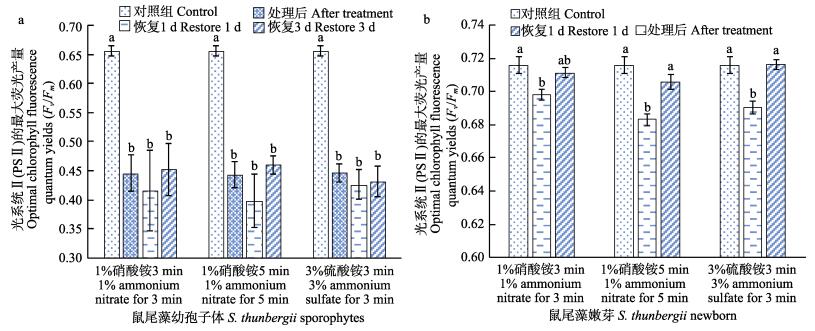
|
图 4 不同药物处理对鼠尾藻幼孢子体、鼠尾藻嫩芽Fv/Fm的影响 Fig.4 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of S. thunbergii young sporophytes and newborn branches after different medicine treatment |
从图 5a可以看出,1%硝酸铵和3%硫酸铵处理对石莼的影响不同。1%硝酸铵药物处理时间越长,石莼的Fv/Fm越低,1%硝酸铵处理5 min恢复1 d后,Fv/Fm显著低于对照组(P < 0.05),其他无显著差异(P > 0.05)。3%硫酸铵处理对石莼影响较小,各组间无显著差异(P > 0.05)。从图 5b可以看出,1%硝酸铵、3%硫酸铵药物处理对绢丝藻Fv/Fm的影响显著不同。1%硝酸铵处理3、5 min,各组Fv/Fm显著低于对照组(P < 0.05),其中,处理3 min后恢复1 d时,Fv/Fm显著低于3 min其他时间(P < 0.05),其他无显著性差异(P > 0.05)。3%硫酸铵浸泡3 min,对绢丝藻Fv/Fm的影响不明显(P > 0.05)。
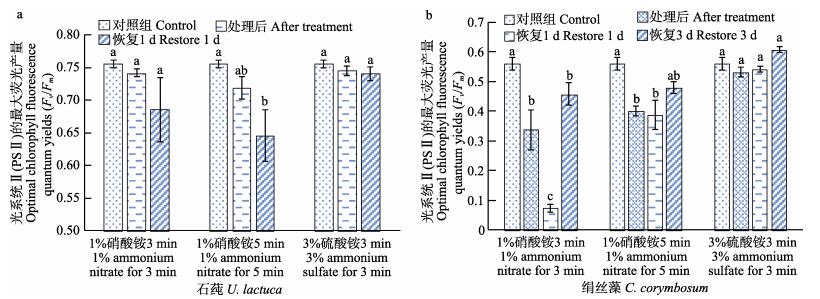
|
图 5 不同药物处理对石莼、绢丝藻Fv/Fm的影响 Fig.5 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of U. lactuca and C. corymbosum after different medicine treatment |
从图 6a可以看出,淡水处理对鼠尾藻幼孢子体的Fv/Fm有显著影响。淡水处理30 min、1 h后,各组Fv/Fm显著低于对照组(P < 0.05),但处理后与恢复1、3 d各组间均无显著差异(P > 0.05),淡水处理对鼠尾藻幼孢子体有一定的伤害,不易恢复。由图 6b可以看出,淡水处理30 min、1 h后,鼠尾藻嫩芽Fv/Fm显著低于对照组(P < 0.05),其他无显著差异(P > 0.05),淡水处理对鼠尾藻嫩芽影响较小,且1 d后可恢复正常。
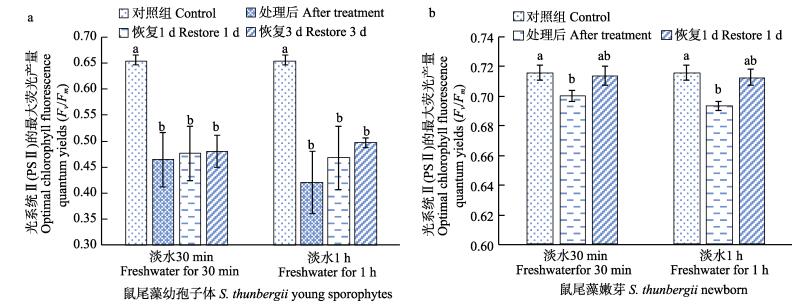
|
图 6 淡水处理不同时间对鼠尾藻幼孢子体、鼠尾藻嫩芽Fv/Fm的影响 Fig.6 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of S. thunbergii young sporophytes and newborn branches after fresh water treatment |
淡水处理对石莼Fv/Fm的影响见图 7a。从图 7a可以看出,淡水处理30 min、1 h对石莼Fv/Fm的影响不太明显。淡水30 min恢复1 d的Fv/Fm显著低于对照组(P < 0.05),可能是取样点误差。淡水处理30 min与对照组及处理1 h各组间与对照组均无显著差异(P > 0.05)。从图 7b可以看出,淡水处理时间越长,绢丝藻的Fv/Fm越小,恢复时间越长,绢丝藻Fv/Fm逐渐变大,藻体逐渐恢复。淡水30 min、1 h处理后和恢复1 d的Fv/Fm均显著低于对照组和恢复3 d组(P < 0.05),恢复3 d与对照组间无显著差异(P > 0.05)。
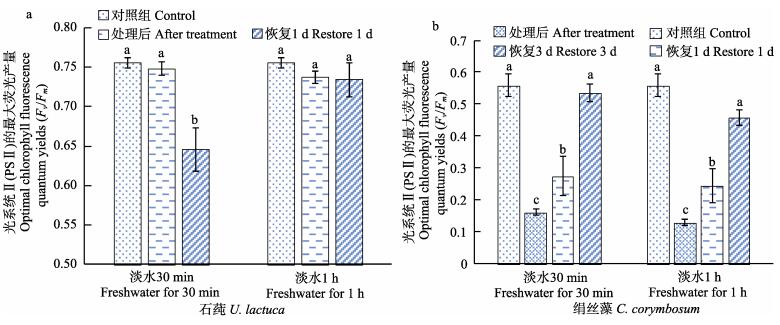
|
图 7 淡水处理不同时间对石莼、绢丝藻Fv/Fm的影响 Fig.7 The optimal chlorophyll fluorescence quantum yields (Fv/Fm) of U. lactuca and C. corymbosum after fresh water treatment |
净光合放氧速率与净呼吸耗氧速率的比(Pn/R)是衡量细胞内物质积累的一个重要参数,它受众多因素影响,如细胞生长状态、营养环境等,Pn/R值越高,说明光合作用活性越高(王超等, 2008)。在变化的生长环境中,不同物种光合作用比值以及个体本身光合作用与呼吸作用比值,对衡量物种新陈代谢具有重要的参考意义(Humphrey, 1975)。光质对鼠尾藻幼孢子体生长的影响已有报道,赵凤娟(2007)、赵自国(2008)研究表明,在蓝光条件下,幼苗的生长速度显著低于在相同光强白光条件下的幼苗生长速度,蓝光不能满足鼠尾藻幼苗早期生长的需要。但本研究中,鼠尾藻幼孢子体在蓝光照射下,生长速率和光合速率均高于白光,且鼠尾藻幼孢子体的Pn/R在蓝光下最大,即其在蓝光下光合活性最大。汪文俊等(2009)研究发现,蓝光可作为一种能量来源,从而直接影响光能吸收和传递过程,褐藻的主要捕光色素为叶绿素a和岩藻黄素,岩藻黄素的吸收峰恰位于蓝光区,可高效吸收利用蓝光。因此,当照射光中蓝光的比例增加时,其光合活性明显增大。对于蓝光对鼠尾藻生长发育的影响及其机制,还需进一步的研究。
硅藻是微藻的一种,在地球上分布广泛,硅藻污染是藻类配子体及幼苗早期培育过程中经常遇到的问题,硅藻与配子体争夺营养、光照、附着基等生长因素,从而限制和影响配子体的生长发育。庄树宏等(1999、2001)研究发现,红光能高效激活硅藻叶绿素分子从而加速光合速率,而蓝光对硅藻细胞的生长具有抑制和伤害作用。本研究中,菱形藻在红光下的光合速率和Pn/R值明显高于白光和蓝光,但蓝光和白光无显著差异,红光下硅藻的光合活性最大,红光对硅藻叶绿素分子的激活作用效果明显。不同光质下,鼠尾藻硅藻光合速率Pn的比值在蓝光下最大,显著大于红光。综上所述,在鼠尾藻的培育过程中,增大蓝光的照射或减少红光的照射,在一定程度上能促进鼠尾藻的生长且抑制硅藻的生长。
3.2 不同药物浓度对鼠尾藻及杂藻光合生理的影响杂藻附着是鼠尾藻早期幼苗培育过程中常见问题,杂藻往往拥有比苗种更广的环境适应范围,杂藻大范围的覆盖苗帘,会使刚下海的幼苗大量脱苗、窒息死亡,导致人工育苗失败(李美真等, 2009)。本研究发现,1%硝酸铵3 min处理组对鼠尾藻幼孢子体光合和呼吸作用几乎无影响,而1%硝酸铵处理5、10 min、3%硫酸铵、1%柠檬酸处理后,鼠尾藻幼孢子体的光合作用和呼吸作用均显著受到影响,可能对鼠尾藻幼孢子体产生了不可逆的损伤,超出了其恢复极限,且时间越长,伤害越大。叶绿素荧光实验中,药物处理抑制了鼠尾藻幼孢子体PSⅡ的活性,对其光合作用产生了不可恢复的损害;对鼠尾藻嫩芽的影响较小,且一定时间后可恢复正常;对石莼和绢丝藻也有伤害,且随着时间延长,伤害越大。1%硝酸铵、3%硫酸铵和1%柠檬酸处理分别对鼠尾藻、石莼、绢丝藻的光合生理产生了不同的抑制作用,可能是由药物酸碱度不同、不同藻类细胞壁和细胞膜对酸的透性不同引起的。海藻的细胞壁外层成分主要是纤维素,内侧主要是细胞膜,不同藻类中成分不完全一致,对酸的透性也不一样;且细胞内的代谢活动主要是由蛋白质组成的各种酶的酶促反应引起的,酸透过细胞壁和细胞膜进入细胞内,对酶的活性产生降低或失效的影响,从而影响藻类的代谢活动,对藻的光合生理产生影响(赵焕登等, 1987)。
液相氧电极和叶绿素荧光实验均表明,1%柠檬酸、1%硝酸铵、3%硫酸铵药物处理能对鼠尾藻幼孢子体和绢丝藻等杂藻产生不可逆的伤害,而对鼠尾藻嫩芽影响较小,因此,在鼠尾藻早期幼苗的杂藻清除中,应避免使用这些药物。
3.3 淡水浸泡处理对鼠尾藻幼孢子体及杂藻的光合生理的影响李美真等(2009)研究表明,淡水浸泡1 h,鼠尾藻苗帘可有效除去多管藻、三叉仙菜(Ceramium kondoi)等红藻类杂藻。陈洁等(2015)研究发现,淡水浸浴法去除污损藻类的效果因种而异,需要根据污损藻类的种类而定,对于三叉仙菜,1 h淡水浸浴可100%去除,同时不会损伤鼠尾藻藻体。刘启顺等(2006)研究表明,淡水浸泡苗帘,每次30 min,可清除杂藻,对鼠尾藻的幼苗无伤害。本研究结果为淡水浸泡对鼠尾藻幼孢子体有伤害,对鼠尾藻嫩芽的影响很小,可能是因为鼠尾藻幼孢子体生理机能未完全成熟,承受淡水浸泡的能力还比较弱,随着鼠尾藻幼苗的长大,其承受淡水浸泡的能力逐渐变强。淡水30 min、1 h对石莼影响较小,对绢丝藻有较大影响,且在3 d后有所恢复,需及时冲洗。鼠尾藻育苗早期不宜使用淡水浸泡除去杂藻,待鼠尾藻长大一些后,每次淡水浸泡30 min,可清除杂藻,对鼠尾藻的幼苗无伤害。
4 结论鼠尾藻的人工育苗技术趋于完善,但在育苗早期过程中,杂藻附着问题还没有简单易行的方法。光质的选择方面可以用白光和蓝光的组合调节生长。药物处理对杂藻生理状态有一定的影响,但在鼠尾藻幼苗的早期生长过程中不宜使用药物清除杂藻,在鼠尾藻嫩芽时期用淡水浸泡30 min,可清除杂藻,对鼠尾藻的幼苗无伤害。
Bao J, Tian XL, Dong SL, et al. Effect of temperature, salinity and light intensity on nitrogen and phosphorus uptake by Sargassum thunbergii. Journal of Fishery Sciences of China, 2008, 2(15): 293-300 [ 包杰, 田相利, 董双林, 等. 温度、盐度和光照强度对鼠尾藻氮、磷吸收的影响. 中国水产科学, 2008, 2(15): 293-300] |
Chen J, Zhang JH, Li JQ, et al. The growth characteristics of long-line cultured seaweed Sargassum thunbergii in the Sanggou Bay. Progress in Fishery Sciences, 2016, 37(1): 120-126 [ 陈洁, 张继红, 李加琦, 等. 桑沟湾筏式养殖鼠尾藻(Sargassum thunbergii)的生长特性. 渔业科学进展, 2016, 37(1): 120-126] |
Chen J. A study on farming techniques of Sargassum thunbergii and application in integrated multi-tropic aquaculture. Master s Thesis of Shanghai Ocean University, 2015, 27–32 [陈洁.鼠尾藻人工养殖技术及在综合养殖系统中应用的研究.上海海洋大学硕士研究生学位论文, 2015, 27–32]
|
Han JJ, Zhong CH, He PM, et al. Effects of different light-qualities on growth and physiological characteristics of free living conchocelis of Pyropia haitanensis. Journal of Fisheries of China, 2017, 41(2): 230-239 [ 韩军军, 钟晨辉, 何培民, 等. 不同光质LED光源对坛紫菜自由丝状体生长和生理特性的影响. 水产学报, 2017, 41(2): 230-239] |
Han XD, Li LP. Characteristics and utilization of Sargassum thunbergii. Special Economic Animal and Plant, 2005, 8(1): 27-27 [ 韩晓弟, 李岚萍. 鼠尾藻特征特性与利用. 特种经济动植物, 2005, 8(1): 27-27 DOI:10.3969/j.issn.1001-4713.2005.01.027] |
Humphrey GF. The photosynthesis: Respiration ratio of some unicellular marine algae. Journal of Experimental Marine Biology and Ecology, 1975, 18(2): 111-119 DOI:10.1016/0022-0981(75)90068-4 |
Jia C, Yang B, Xie EY. Studies on the prevention and cure for predators and rivals in artificial breeding of Sargassum naozhouense Tseng et Lu. Journal of Aquaculture, 2012, 33(7): 35-39 [ 贾柽, 杨彬, 谢恩义. 硇洲马尾藻人工育苗常见敌害生物及防治初探. 水产养殖, 2012, 33(7): 35-39 DOI:10.3969/j.issn.1004-2091.2012.07.010] |
Kim JK, Mao YX, Kraemer G, et al. Growth and pigment content of Gracilaria tikvahiae McLachlan under fluorescent and LED lighting. Aquaculture, 2015, 436: 52-57 DOI:10.1016/j.aquaculture.2014.10.037 |
Li MZ, Ding G, Zhan DM, et al. A method for early production of large-size Sargassum thunbergii seedling in North China. Progress in Fishery Sciences, 2009, 30(5): 75-82 [ 李美真, 丁刚, 詹冬梅, 等. 北方海区鼠尾藻大规格苗种提前育成技术. 渔业科学进展, 2009, 30(5): 75-82 DOI:10.3969/j.issn.1000-7075.2009.05.013] |
Li SY, Ye DS, Guo WL, et al. Investigation and prevention of harmful organisms for the cultivation of Sargassum fusiforme (Harv.) Okam. Modern Fisheries Information, 2009, 24(9): 19-22 [ 李生尧, 叶定书, 郭温林, 等. 羊栖菜栽培敌害生物调查及其防治. 渔业信息与战略, 2009, 24(9): 19-22 DOI:10.3969/j.issn.1004-8340.2009.09.007] |
Liang ZR, Wang FJ, Sun XT, et al. Effects of light intensity, temperature and salinity on newborn branches of Sargassum thunbergii evaluated with chlorophyll fluorescence assay. Marine Sciences, 2011, 35(12): 21-27 [ 梁洲瑞, 王飞久, 孙修涛, 等. 利用叶绿素荧光技术揭示光照、温度和盐度对鼠尾藻嫩芽的影响. 海洋科学, 2011, 35(12): 21-27] |
Liang ZR, Wang FJ, Sun XT, et al. Primary investigations on the photosynthesis and respiration of leaves of Sargassum thunbergii using liquid-phase oxygen measurement system. Journal of Fisheries of China, 2012, 36(12): 1842-1853 [ 梁洲瑞, 王飞久, 孙修涛, 等. 利用液相氧电极技术对鼠尾藻叶光合及呼吸作用的初步研究. 水产学报, 2012, 36(12): 1842-1853] |
Liu CY, Sun XQ, Fan SL. Current difficulties encountered and developmental strategies of Apostichopus japonicus aquaculture. Feed Industry, 2006, 27(22): 28-30 [ 刘朝阳, 孙晓庆, 范士亮. 当前刺参养殖面临的主要困境及发展策略. 饲料工业, 2006, 27(22): 28-30 DOI:10.3969/j.issn.1001-991X.2006.22.009] |
Liu QS, Jiang HT, Liu YX, et al. Seed rearing technique of Sargassum thunbergii o'kuntze. Shandong Fisheries, 2006(12): 5-9 [ 刘启顺, 姜洪涛, 刘雨新, 等. 鼠尾藻人工育苗技术研究. 齐鲁渔业, 2006(12): 5-9] |
Sun XT, Wang FJ, Wang WJ, et al. Large scale breeding of Sargassum thunbergii based on sexual reproduction. Progress in Fishery Sciences, 2010, 31(3): 84-91 [ 孙修涛, 王飞久, 汪文俊, 等. 基于有性繁殖的鼠尾藻规模化繁育试验. 渔业科学进展, 2010, 31(3): 84-91 DOI:10.3969/j.issn.1000-7075.2010.03.012] |
Wang C, Qiao HJ, Pan GH, et al. Studies on the parameters of physiology of Enteromorpha prolifera collected from the Qingdao Olympic sailing center. Marine Sciences, 2008, 32(8): 13-15 [ 王超, 乔洪金, 潘光华, 等. 青岛奥帆基地海域漂浮浒苔光合生理特点研究. 海洋科学, 2008, 32(8): 13-15] |
Wang FJ, Sun XT, Li F. Studies on sexual reproduction and seedling-rearing of Sargassum thunbergii. Marine Fisheries Research, 2006, 27(5): 1-6 [ 王飞久, 孙修涛, 李锋. 鼠尾藻的有性繁殖过程和幼苗培育技术研究. 海洋水产研究, 2006, 27(5): 1-6] |
Wang WJ, Sun XT, Wang FJ, et al. Effect of light quality on young sporophyte growth and rhizoid development of Laminaria japonica Aresch. Progress in Fishery Sciences, 2009, 30(5): 113-118 [ 汪文俊, 孙修涛, 王飞久, 等. 光质对海带幼孢子体生长和假根发育的影响. 渔业科学进展, 2009, 30(5): 113-118 DOI:10.3969/j.issn.1000-7075.2009.05.019] |
Wei XY, Yu SG. Studies on the antioxidative activity of ethanlic extracts from two kinds of brown algae. Marine Sciences, 2002, 26(9): 49-51 [ 魏玉西, 于曙光. 两种褐藻乙醇提取物的抗氧化活性研究. 海洋科学, 2002, 26(9): 49-51 DOI:10.3969/j.issn.1000-3096.2002.09.015] |
Zeng CK. China's economy algae Records. Beijing: Science Press, 1962 [ 曾呈奎. 中国经济海藻志. 北京: 科学出版社, 1962]
|
Zhang EX, Yu LJ, Xiao X. The scavenging action to O2- and OH- of polysaccharides. Chinese Journal of Biochemical Pharmaceutics, 1995, 16(1): 9-11 [ 张尔贤, 俞丽君, 肖湘. 多糖类物质对O2-和OH-的清除作用. 中国生化药物杂志, 1995, 16(1): 9-11] |
Zhao FJ. Studies on genetic structure of Sargassum thunbergii and S. muticum populations and germling development of S. thunbergii. Doctoral Dissertation of the Institute of Oceanology, Chinese Academy of Sciences, 2007, 65–75 [赵凤娟.马尾藻种群遗传及早期发育的研究.中国科学院海洋研究所博士研究生学位论文, 2007, 65–75]
|
Zhao HD, Gao SD. Studies of acid tolerance of porphyra and ULVA 1 effects of pH on respiration and growth of Porphyra Yezoensis and Ulue Pertusa. Journal of Ocean University (Natural Science), 1987, 17(2): 67-71 [ 赵焕登, 高尚德. 条斑紫菜(Porphyra yezoensis Ueda)和孔石莼(Ulue pertusa Kjellm)对酸耐受力的研究—I. pH对条斑紫菜和孔石莼呼吸强度和致死酸度试验. 中国海洋大学学报(自然科学版), 1987, 17(2): 67-71] |
Zhao ZG. Study on the early development of three macroalgae species. Doctoral Dissertation of Northeast Normal University, 2008, 35–47 [赵自国.三种大型海藻的早期发育研究.东北师范大学博士研究生学位论文, 2008, 35–47]
|
Zheng Y. Detection of some Fujian seaweeds for hemagglutinins. Journal of Fujian Normal University (Natural Science), 1994, 10(1): 101-105 [ 郑怡. 福建部分海藻凝集素的检测. 福建师范大学学报(自然科学版), 1994, 10(1): 101-105] |
Zhuang SH, Hendrik S. The effect of light intensity and quality on the growth of benthic algae community (Ⅰ) phytopigment variations. Journal of Yantai University (Natural Science and Engineering), 1999, 12(2): 108-113 [ 庄树宏, Hendrik Sven. 光照强度和波长对底栖藻类种群生长的影响(Ⅰ) —光合色素的变化. 烟台大学学报(自然科学与工程版), 1999, 12(2): 108-113] |
Zhuang SH, Hendrik S. The effects of light intensity and quality on benthic algae communities (Ⅱ) the dynamics and adaptive modes of community and populations. Acta Ecologica Sinica, 2001, 21(12): 2057-2066 [ 庄树宏, Hendrik Sven. 光强和光质对底栖藻类群落影响(Ⅱ)—群落和种群的动态和适应模式. 生态学报, 2001, 21(12): 2057-2066 DOI:10.3321/j.issn:1000-0933.2001.12.014] |



