2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
近年来,随着石斑鱼人工杂交苗种繁育技术的进步,且杂交子代存在明显的杂交优势,杂交石斑鱼逐渐成为市场的新宠(李炎璐等, 2015; 邵彦翔等, 2017)。褐龙斑是褐石斑鱼(Epinephelus bruneus ♀)与鞍带石斑鱼(E. lanceolatus ♂)的杂交子代,存在明显的杂交优势,是具有较大养殖潜力的石斑鱼新品种。由于规模化养殖时间较短,目前国内外尚没有褐龙斑疾病的报道。2017年7月,山东省某养殖场褐龙斑出现急性、大量死亡。调查褐龙斑发病情况,取濒死鱼的组织进行电镜切片观察,在病鱼脾、肾等组织内发现大量的虹彩病毒样颗粒。
虹彩病毒是20面体状的大型DNA病毒,共分为5个病毒属,其中,肿大细胞病毒属(Megalocytivirus)的虹彩病毒是鱼类的重要病原之一(Jancovich et al, 2012)。依据病毒的主要衣壳蛋白(Major capsid protein, MCP)基因,细胞肿大病毒属虹彩病毒可分类为3大类群(基因型),即主要感染海水鱼类的真鲷虹彩病毒(Red sea bream iridovirus, RSIV)类群、主要感染淡水鱼类的传染性脾肾坏死病毒(Infectious spleen and kidney necrosis virus, ISKNV)类群和主要感染鲆鲽鱼类的大菱鲆红体病虹彩病毒(Turbot reddish body iridovirus, TRBIV)类群(Fu et al, 2011; Kurita et al, 2012)。真鲷虹彩病毒能导致多种鱼类发病死亡,严重威胁着世界鱼类养殖业的发展(Inouye et al, 1992)。因此,真鲷虹彩病毒病长期以来被世界动物卫生组织(OIE)和中国列为鱼类重要疫病(Jung et al, 2000; Rodge et al, 1997; Weng et al, 2002; Chua et al, 1994)。
本研究通过疾病调查、病鱼的临床检查、组织病理和超微病理观察、病原初步筛查和分子生物学鉴定,确认感染褐龙斑的病毒为真鲷虹彩病毒,可为该病的深入研究提供参考。
1 材料与方法 1.1 实验材料发病濒死和健康的褐龙斑均取自山东省某石斑鱼养殖场。TSA、TCBS培养基购自北京陆桥生物制品有限公司,海洋动物组织DNA提取试剂盒购自天根生化科技(北京)有限公司,Ex Taq DNA聚合酶、dNTPs、DNA Marker购自TaKaRa公司;所用引物由上海生工生物工程技术服务有限公司合成。
1.2 疾病调查与临床检查调查养殖环境及病鱼死亡情况;观察病鱼活动情况,对濒死病鱼进行观察和剖检。
1.3 组织病理及超微病理观察参照史成银(2004)的方法,取濒死病鱼和健康鱼的肝、脾、肾、头肾、鳃、心脏、胃和肠道组织制成石蜡切片和超薄电镜切片,利用光学、透射电子显微镜观察拍照。
1.4 寄生虫观察和细菌分离取濒死病鱼的鳃丝、体表黏液制成水浸压片,显微镜下观察。使用病鱼的肝、肾、脾接种TSA和TCBS平板后,28℃培养48 h,观察细菌生长情况,进行细菌检测。
1.5 组织DNA提取和PCR检测提取濒死病鱼脾、肝、头肾和肾组织的DNA,根据中华人民共和国出入境检验检疫行业标准《真鲷虹彩病毒病检疫技术规范》(SN/T 1675-2014),使用引物1-F/1-R和4-F/4-R进行PCR检测(表 1)。50 µl的PCR反应体系:10×Reaction buffer(含20 mmol/L Mg2+) 5 µl,2.5 mmol/L dNTPs 4 µl,20 µmol/L引物各1 µl,5 U/µl Taq酶1 µl,100 ng/µl的模板DNA 4 µl,补足超纯水至50 µl。PCR反应程序:95℃预变性2 min;94℃ 30 s,58℃ 60 s,72℃ 60 s,共进行30个循环;最后72℃延伸5 min。用10 g/L琼脂糖凝胶电泳观察结果。
|
|
表 1 本研究中的PCR引物序列及其目标产物大小 Tab.1 Sequences of PCR primers and products length in this study |
参照史成银(2004),用引物MCP-iridoF和MCP-iridoR扩增MCP基因全长(表 1)。50 µl的PCR反应体系:10×Reaction buffer (含20 mmol/L Mg2+) 5 µl,2.5 mmol/L dNTPs 4 µl,20 µmol/L引物各1 µl,5 U/µl Taq酶1 µl,100 ng/µl的模板DNA 4 µl,补足超纯水至50 µl。PCR反应程序:94℃预变性5 min;94℃ 2 min,57℃ 1 min,72℃ 1 min,35个循环;最后,72℃延伸5 min。用10 g/L琼脂糖凝胶电泳检查结果。PCR产物由上海生工生物技术有限公司从两端单向测通,再拼接出完整的PCR产物序列,用Blast比对分析测序结果。
1.7 虹彩病毒的系统发育分析依据Blast比对结果,选取18种(株)具有代表性的虹彩病毒,从GenBank下载各病毒的MCP基因全长序列,用MEGA 7.0构建虹彩病毒系统发育树,分析、鉴定感染褐龙斑的病毒在虹彩病毒科中的分类地位。各病毒的名称及GenBank登录号为:ATV (NC_ 005832)、CIV (AF303741)、FLIV-JJY (AY633990)、FV3 (U36913)、GIV (AY666015)、IIV-3 (DQ643392)、ISKNV (NC_003494)、ISKNV SB04 (KY440040)、LCDV-1 (NC_001824)、LCDV-C (AY380826)、RSIV-1 (AB666328)、RSIV 2HSB (AB666318)、RSIV-8 (AB666335)、RSIV-9 (AB666336)、RSIV 10GG (AB666324)、RSIV Ehime-1 (AB080362)、RSIV TGA14 (AB666320)、TRBIV (GQ273492)。
2 结果 2.1 疾病调查与临床检查褐龙斑以循环水工厂化养殖,发病时的水温为28℃、盐度为31、pH为7.5、溶氧为4.5 mg/L、养殖密度为1000尾/40 m3。发病初期,病鱼活力明显下降。随病程发展,病鱼反应迟钝、伏底,并出现死亡。4个发病池,日死亡率约10%,10 d内累积死亡率达80%。
病鱼为2龄鱼,全长为29.5~31.5 cm,体重约为500 g。多数鱼体表未见明显异常,个别鱼尾鳍有溃疡病灶。病鱼鳃丝鲜红,无溃烂(图 1A)。解剖可见病鱼空肠空胃,无明显发炎。肝局部出血,呈现不均匀的颜色。脾和肾严重肿大、易碎,肾脏色淡(图 1B)。

|
图 1 患病褐龙斑 Fig.1 Diseased fish A:病鱼外观无明显异常;B:脾和肾严重肿大,肾脏色淡 A: No obvious abnormality in the appearance; B: Swollen spleen and kidney, pale kidney |
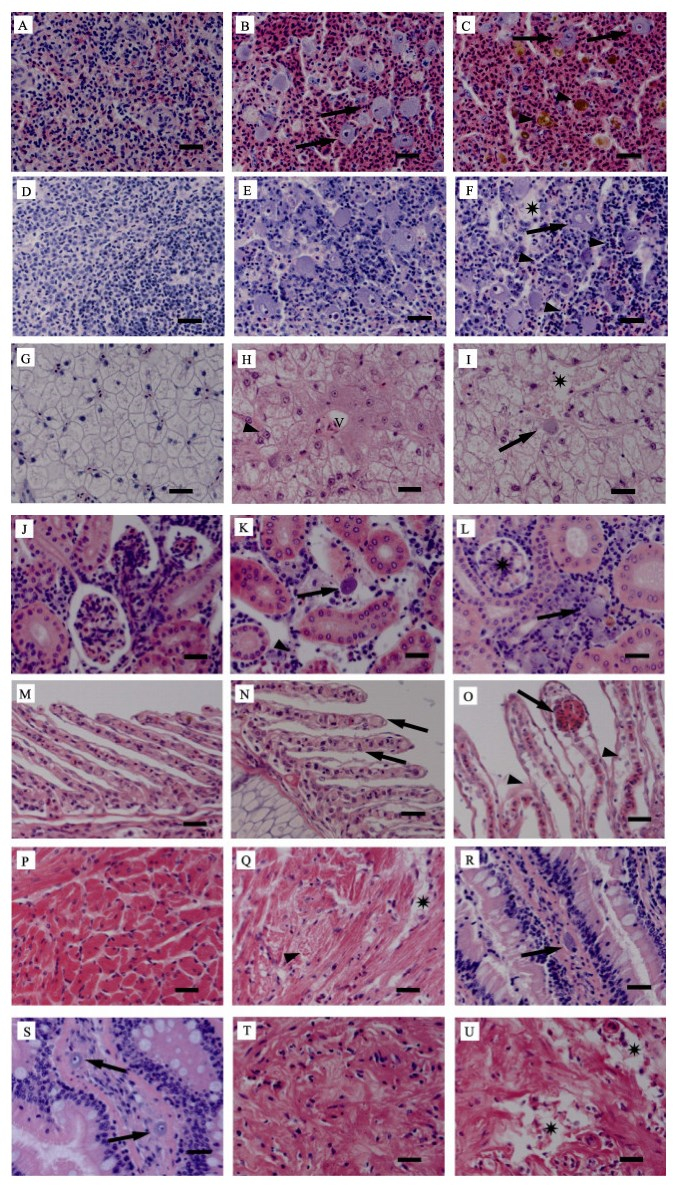
健康鱼脾实质细胞饱满、清晰、排列紧密(图 2A)。病鱼脾组织细胞坏死,被大量红细胞浸润,出现严重淤血。组织中填充有大量嗜碱性的肿大细胞,直径为10~15 µm,细胞质均一化(图 2B)。脾出现大量铁血黄素沉积(图 2C)。健康鱼的头肾呈致密的网状结构(图 2D)。病鱼的头肾组织中可见大量嗜碱性的肿大细胞(图 2E),且组织结构松散,大量细胞发生核固缩,红细胞浸润,多见细胞崩解后形成的坏死灶(图 2F)。健康鱼肝脏细胞大小、形状均一,结构清晰排列紧密(图 2G)。病鱼肝脏细胞膜崩解,边界模糊,细胞连成一片,造成双核假象;细胞核肿大而核质溶解呈透亮状;肝血窦周围细胞发生淀粉样变性,胞质呈现云雾状的嗜酸性染色(图 2H)。病鱼肝脏内可见局灶性坏死,并零星出现嗜碱性的肿大细胞(图 2I)。健康鱼的肾组织结构饱满、清晰(图 2J)。病鱼的肾造血组织坏死、细胞核固缩;出现嗜碱性的肿大细胞,但数量比脾和头肾组织中少。病鱼肾小管上皮细胞肿胀,细胞核空泡化(图 2K)。肾小球血管球细胞水样变性,肾小囊腔变窄(图 2L)。健康鱼鳃上皮细胞单层有序排列,次级鳃丝结构清晰(图 2M)。病鱼鳃组织结构松散,次级鳃丝肿胀(图 2N),且上皮细胞剥离、脱落;部分柱细胞断裂,导致毛细血管扩张症(图 2O)。健康鱼心肌细胞结构清晰规整(图 2P)。病鱼心肌纤维结构松散、紊乱,心肌退化变性,胞质液化呈均质玻璃样物质。严重者心肌细胞坏死,细胞崩解留下带状坏死灶(图 2Q)。病鱼肠组织病变不明显;肠黏膜固有层零星出现细胞质均一、嗜碱性的肿大细胞,细胞核固缩于细胞边缘,或异常肿大,核质溶解呈透亮状(图 2R、图 2S)。病鱼胃黏膜下层退化变性,细胞出现坏死崩解,留下不规则的坏死灶(图 2U)。
|
图 2 患病鱼组织病理变化(标尺为20 µm) Fig.2 Histopathological changes in the diseased fish (Bar=20 µm) A:健康鱼脾组织;B:病鱼脾脏组织中大量嗜碱性的肿大细胞(箭头);C:病鱼脾脏内大量的血铁黄素沉积(三角箭头) D:健康鱼头肾组织;E:病鱼头肾组织中大量嗜碱性的肿大细胞;F:病鱼头肾组织中出现局灶性坏死(星号),细胞核固缩(三角箭头)和嗜碱性的肿大细胞(箭头);G:健康鱼肝组织;H:病鱼肝血窦(V)周围的细胞淀粉样变性,出现双核假象(三角箭头);I:病鱼肝脏局灶性坏死(星号)及零星出现的肿大细胞(箭头);J:健康鱼肾组织;K:病鱼肾造血组织坏死、细胞核固缩(三角箭头)并出现肿大细胞(箭头);L:病鱼肾小球细胞空泡化(星号);M:健康鱼鳃组织;N:病鱼次级鳃丝肿胀(箭头);O:病鱼次级鳃丝上皮细胞剥离(三角箭头),柱细胞断裂致毛细血管扩张症(箭头);P:健康鱼心组织;Q:病鱼心肌退化变性(三角箭头)及坏死(星号);R、S:病鱼肠粘膜固有层中零星出现的肿大细胞(箭头);T:健康鱼胃组织;U:病鱼胃组织退化变性、坏死(星号) A: Spleen tissues of healthy fish; B: Enlarged cells with basophilic cytoplasm in the spleen of diseased fish (solid arrows); C: Hemosiderin deposition in the spleen of diseased fish (arrowheads); D: Head kidney tissues of healthy fish; E: Enlarged cells with basophilic cytoplasm in the head kidney of diseased fish; F: Localized necrosis (asterisk), karyopyknosis (arrowheads) and enlarged cells with basophilic cytoplasm (solid arrow) in the head kidney of diseased fish; G: Liver tissues of healthy fish; H: Amyloidosis of hepatocytes around the blood vessels (V) and false appearance of double nucleus (arrowhead) in the liver of diseased fish; I: Focal necrosis (asterisk) and scattered enlarged cell (solid arrow) in the liver of diseased fish; J: Kidney tissues of healthy fish; K: Hematopoietic necrosis, karyopyknosis (arrowhead) and enlarged cell (solid arrow) in the kidney of diseased fish; L: Hydropic degeneration of glomerulus (asterisk) in the kidney of diseased fish; M: Gill tissues of healthy fish; N: Oedema (solid arrows) of secondary lamellar in diseased fish; O: Exfoliation (arrowheads) and telangiectasis (arrow) of secondary lamellar in diseased fish; P: Heart tissues of healthy fish; Q: Myocardial degeneration (arrowhead) and necrosis (asterisk) of the heart in diseased fish; R and S: Scattered enlarged cells (solid arrows) in lamina propria of the intestine in diseased fish; T: Stomach tissues of healthy fish; U: Degeneration and necrosis of the stomach in diseased fish (asterisk) |
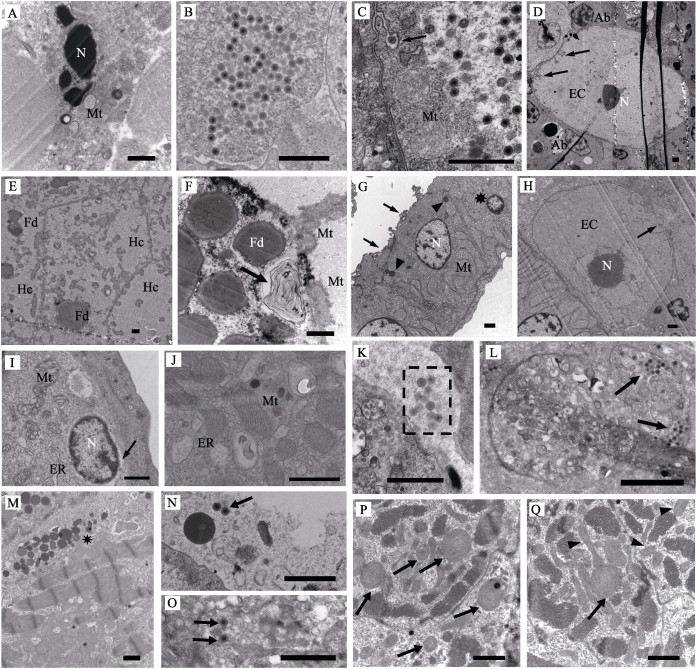
透射电镜观察发现,病鱼脾造血组织细胞核异染色质增多,核膜可见但不清晰,核周隙明显扩张,严重者细胞核碎裂。细胞质中内质网囊泡化,线粒体肿胀、嵴消失(图 3A)。肿大细胞胞质中存在大量虹彩病毒样病毒粒子,无囊膜,直径为130~150 nm (图 3B)。病鱼头肾造血组织中发现含有大量病毒颗粒的肿大细胞,且线粒体肿胀、嵴消失,细胞质中囊泡增多;特别是肿大细胞的细胞膜内陷形成大量树枝状沟回结构(图 3C)。出现核固缩的凋亡小体(图 3D)。病鱼肝细胞膜出现破损或结构异常,核内大部分染色质溶解,核外形可见,粗面内质网囊泡化形成的小泡脱粒、破裂,线粒体破损;严重者细胞核消失,出现嗜锇性髓鞘样小体,胞内模糊不清,结构基本消失(图 3E、图 3F)。病鱼肾小管上皮细胞核固缩或出现核沟,细胞内出现初级溶酶体,线粒体嵴肿胀呈管泡状,刷状缘发生断裂(图 3G)。肾造血组织肿大细胞的细胞膜内陷,核形状异常,核仁增大(图 3H)。病鱼次级鳃丝上皮细胞、柱状细胞病变严重。线粒体嵴肿胀、空泡化,基质电子密度增大;出现S或Y形的畸形线粒体,以及大量纵向嵴线粒体;细胞核周间隙扩张,粗面内质网囊泡化并脱粒(图 3I、图 3J)。病鱼鳃血管及白细胞中观察到大量的病毒粒子(图 3K、图 3L),表明病毒可经由血液循环感染鱼体各个组织。病鱼心肌细胞出现灶性溶解损伤,可见大量初级溶酶体(图 3M)。血管及白细胞中可见零星的病毒粒子(图 3N、图 3O)。心肌细胞的线粒体损伤,出现大量髓样体(图 3P)。还可见许多纵向嵴、嵴溶解和形状畸形的线粒体(图 3Q)。
|
图 3 病鱼的超微病理变化(标尺为1 µm) Fig.3 Ultrastructural changes in the diseased fish (Bar=1 µm) A:破碎的细胞核(N)和肿胀的线粒体(Mt);B:脾肿大细胞内大量的病毒粒子;C:肿大细胞的线粒体(Mt)肿胀、细胞膜内陷(箭头);D:肿大细胞(EC)的细胞膜内陷(箭头)、细胞核(N),可见凋亡小体(Ab);E:坏死的肝细胞(Hc);F:肝脏细胞中髓鞘样小体(箭头)、脂肪滴(Fd)和线粒体(Mt);G:肾小管上皮细胞核固缩(星号),出现初级溶酶体(三角箭头),线粒体(Mt)肿大,刷状缘断裂(箭头);H:肿大细胞(EC)肾脏中细胞的胞膜内陷(箭头),细胞核(N)形状异常,核仁增大,I:鳃上皮细胞核(N)周隙扩大(箭头),线粒体(Mt)、内质网(ER)肿大变形;J:鳃细胞出现异常的纵向嵴线粒体(Mt);K:鳃血管中的病毒粒子(虚框内);L:鳃中白细胞内的病毒粒子(箭头);M:心肌细胞出现大量初级溶酶体(星号);N:心脏血管中的病毒粒子(箭头);O:心脏中白细胞内的病毒粒子(箭头);P:心脏细胞中髓样变性的线粒体(箭头);Q:心脏细胞中髓样变性(箭头)、出现纵向嵴(三角箭头)的线粒体 A: Collapsed cell nucleus (N) and swollen mitochondria (Mt); B: Numerous viral particles in the cytoplasm of enlarged splenic cell; C: Swollen mitochondria (Mt) and invagination of cell membrane (solid arrow) in the enlarged cell of the head kidney; D: Invagination of cell membrane (solid arrows) in the enlarged cell of the head kidney(EC), nucleus (N), apoptotic body (Ab); E: Necrotic hepatocytes (Hc); F: Myelin figures in the cell of hepatocytes (solid arrow), fat droplet (Fd) and mitochondria (Mt); G: Karyopyknosis (asterisk), primary lysosomes (arrowheads), swollen mitochondria (Mt) and broken brush border (solid arrows) of renal tubular epithelial cells; H: Invagination of cell membrane (solid arrows) in the kidney cell, abnormal nucleus (N) and perinuclear space nucleolus in the enlarged cell (EC); I: Enlargement of nuclear gap in the gill epithelium (solid arrow), swelling deformation of mitochondria (Mt) and endoplasmic reticulum (ER) in gill epithelial cell; J: Abnormal mitochondria (Mt) with longitudinal cristae in the gill cells; K: Viral particles in vascular cavity of gill (dotted rectangle); L: Viral particles in leucocytes in the gill (solid arrows); M: Numerous primary lysosomes (asterisk) in myocardial cells; N: Scattered viral particles in vascular cavity of the heart (solid arrow); O: Viral particles in leucocytes of the heart(solid arrow); P: Myelin figures (solid arrows) of mitochondria in the heart cells; Q: Myelin figure (solid arrow) and longitudinal cristae (arrow heads) of mitochondria in the heart cells |
所检患病褐龙斑均未观察到寄生虫。病鱼的肝、肾、脾接种的TSA和TCBS培养基上仅长出零星的菌落,非细菌性疾病特征。经16S rDNA测序鉴定,分别为哈维氏弧菌(Vibrio harveyi)、弧菌(Vibrio spp.)、美人鱼发光杆菌(Photobacterium damselae)、假交替单胞菌(Pseudoalteromonas sp.)、交替单胞菌(Alteromonas sp.)、亚硫酸盐杆菌(Sulfitobacter sp.)等。
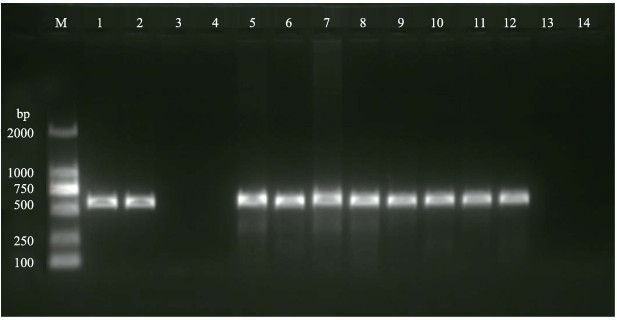
2.5 病鱼组织的PCR检测3尾病鱼的脾、头肾等组织,用引物1-F/1-R和4-F/4-R进行PCR检测,结果均为强阳性,而健康褐龙斑未扩增出任何条带(图 4、图 5)。依据行业标准SN/T 1675-2014,可初步判定在褐龙斑各组织中发现的病毒为RSIV。

|
图 4 使用引物1-F/1-R检测患病和健康褐龙斑 Fig.4 PCR results of diseased and healthy fish using primer 1-F/1-R M:DL2000 DNA Marker;1~2:阳性对照;3~4:阴性对照;5~8:1号病鱼的脾、肝、头肾和肾;9~10:2号病鱼的脾和肾;11~12:3号病鱼的脾和肾;13~14:健康鱼的脾和肾 M: DL2000 DNA Marker; 1~2: Positive control; 3~4: Negative control; 5~8: Sample from spleen, liver, head kidney and kidney of diseased fish #1; 9~10: Sample from spleen and kidney of diseased fish #2; 11~12: Sample from |
|
图 5 使用引物4-F/4-R检测患病和健康褐龙斑 Fig.5 PCR results of diseased and healthy fish using primer 4-F/4-R M:DL2000 DNA Marker;1~2:阳性对照;3~4:阴性对照;5~8:1号病鱼的脾、肝、头肾和肾;9~10:2号病鱼的脾和肾;11~12:3号病鱼的脾和肾;13~14:健康鱼的脾和肾 M: DL2000 DNA Marker; 1~2: Positive control; 3~4: Negative control; 5~8: Sample from spleen, liver, head kidney and kidney of diseased fish #1; 9~10: Sample from spleen and kidney of diseased fish #2; 11~12: Sample from spleen and kidney of diseased fish #3; 13~14: Sample from spleen and kidney of healthy fish |
从病鱼脾组织中扩增得到了病毒(命名为LZ170711株)DNA片段,长度为1581 bp。经Blast比对分析,该序列包含MCP基因完整的编码区及其上游57个、下游162个核苷酸。其中,MCP基因编码区全长为1362 bp,编码453个氨基酸。
与GenBank数据库中18种(株)虹彩病毒的相应序列进行比对发现,LZ170711株与细胞肿大病毒属虹彩病毒各毒株相似性在94%以上;而与蛙病毒属、淋巴囊肿病毒属、绿虹彩病毒属和虹彩病毒属虹彩病毒各毒株的相似性均在55%以下。在细胞肿大病毒属内,与RSIV各分离株相似性均超过97%,与ISKNV和TRBIV的各分离株相似性为94.5%~ 95.1%。LZ170711与RSIV TGA14、RSIV 10GG、RSIV-8、RSIV-9的MCP基因序列完全一致,与RSIV Ehime-1、RSIV 2HSB株有9个核苷酸的差异,相似性为97.9%。
依据上述结果,用Mega 7软件构建了包含19种(株)虹彩病毒的系统发育树(图 6)。从图 6可以明显看出,这些虹彩病毒分为5个病毒属,LZ170711株位于细胞肿大病毒属内,且与RSIV各分离株的关系最近。

|
图 6 依据MCP基因构建的19种(株)虹彩病毒系统发育树 Fig.6 Phylogenetic tree of 19 iridovirus isolates (strains) based on the complete coding sequence of MCP gene |
鱼类感染了肿大细胞虹彩病毒后,通常会体色变暗、游动异常、反应迟钝、嗜睡,且出现脾、肾组织肿大等症状(王庆等, 2010; 何建国等, 1998)。本研究发现,患病褐龙斑反应迟钝,脾、肾肿大,且脾质地易碎。类似的病症在患病尖吻鲈(Lates calcarifer)和褐篮子鱼(Siganus fuscescens)中也有报道(文琳等, 2015; 雷燕等, 2014)。这些症状可用于肿大细胞虹彩病毒病的预警和初步诊断。
在组织病理方面,观察到病鱼各组织中存在细胞变性、凋亡等由病毒感染引起的典型病变。病鱼脾和头肾是肿大细胞虹彩病毒的靶器官,病理切片中可见大量嗜碱性、匀质化、直径为15~20 µm的肿大细胞,是该病的重要病理特征(Jancovich et al, 2012)。通过超薄切片的电镜观察,在脾脏、头肾的肿大细胞中发现大量装配完成尚未释放的病毒粒子。令人感兴趣的是,在电镜超薄切片中,经常可以观察到肿大细胞的细胞膜具有大量的树枝状沟回结构,其形成原因和生理学意义尚不清楚,值得进一步研究。此外,在病鱼心脏和鳃的血管、白细胞内也发现了一定数量的病毒粒子,表明肿大细胞虹彩病毒可以通过血液循环在鱼体各器官和组织内扩散(秦蕾等, 2009)。尤其值得指出的是,一方面,本研究发现患病褐龙斑出现明显的心肌萎缩、断裂、间隙变大等病理特征,与此前报道的感染了虹彩病毒的条石鲷(Oplegnathus fasciatus)心脏病理特征一致(李华等, 2011)。另一方面,在超薄切片中观察到,病鱼心肌细胞的线粒体病变明显。大量的心肌细胞线粒体或出现纵向嵴,或退化成同心圆状的髓样体,意味着其呼吸功能的严重丧失。综合上述病理特征,病鱼心脏出现了严重的病理损伤,影响了鱼体的血液循环,造成供氧不足,由此导致病鱼表现出游泳无力、反应迟钝、嗜睡等表观症状。
MCP是虹彩病毒最主要的结构蛋白,其基因既高度保守,又有足够的变异性,可以充分反映虹彩病毒的演化关系,是虹彩病毒分类鉴定的重要依据(Inouye et al, 1992; Chou et al, 1998)。本研究测定并分析了感染褐龙斑的虹彩病毒的MCP基因,构建了虹彩病毒系统发育树,证实该病毒在分类地位上属于虹彩病毒科细胞肿大病毒属真鲷虹彩病毒类群。感染褐龙斑的该病毒与感染真鲷(Pagrus major)的RSIV-8、感染高体
Chou HY, Hsu CC, Peng TY. Isolation and characterization of a pathogenic iridovirus from cultured grouper (Epinephelus sp.) in Taiwan. Fish Pathology, 1998, 33(4): 201-206 DOI:10.3147/jsfp.33.201 |
Chua FHC, Ng ML, Woo JJ, et al. Investigation of outbreaks of a novel disease, 'Sleepy Grouper Disease', affecting the brown-spotted grouper, Epinephelus tauvina Forskal. Journal of Fish Diseases, 1994, 17(4): 417-427 DOI:10.1111/jfd.1994.17.issue-4 |
Fu X, Li N, Liu L, et al. Genotype and host range analysis of infectious spleen and kidney necrosis virus (ISKNV). Virus Genes, 2011, 42(1): 97-109 DOI:10.1007/s11262-010-0552-x |
He JG, Weng SP, Huang ZJ, et al. Identification of outbreak and infectious diseases pathogen of Siniperca chuatsi. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1998, 37(5): 74-77 [ 何建国, 翁少萍, 黄志坚, 等. 鳜暴发流行病病毒性病原研究. 中山大学学报(自然科学版), 1998, 37(5): 74-77 DOI:10.3321/j.issn:0529-6579.1998.05.018] |
Inouye K, Yamano K, Maeno Y, et al. Iridovirus infection of cultured red sea bream, Pagrus major. Fish Pathology, 1992, 27(1): 19-27 DOI:10.3147/jsfp.27.19 |
Jancovich JK, Chinchar VG, Hyatt A, et al. Family Iridoviridae. In: Virus taxonomy. Classification and nomenclature of viruses. Ninth report of the International Committee on Taxonomy of Viruses, 2012, 193-210 |
Jung SJ, Oh MJ. Iridovirus-like infection associated with high mortalities of striped beakperch, Oplegnathus fasciatus (Temminck et Schlegel), in southern coastal areas of the Korean Peninsula. Journal of Fish Diseases, 2000, 23(3): 223-226 DOI:10.1046/j.1365-2761.2000.00212.x |
Kurita J, Nakajima K. Megalocytiviruses. Viruses, 2012, 4(4): 521-538 DOI:10.3390/v4040521 |
Lei Y, Qi RR, Tang SL, et al. Diagnosis of iridovirus disease in spinefoot Siganus fuscescens. Journal of Dalian Ocean University, 2014, 29(3): 236-240 [ 雷燕, 戚瑞荣, 唐绍林, 等. 褐篮子鱼虹彩病毒病的诊断. 大连海洋大学学报, 2014, 29(3): 236-240] |
Li H, Sun ZP, Li Q, et al. Characterization of an iridovirus detected in rock bream (Oplegnathus fasciatus; Temminck and Schlegel). Chinese Journal of Virology, 2011, 27(2): 158-164 [ 李华, 孙志鹏, 李强, 等. 条石鲷检出的虹彩病毒特性研究. 病毒学报, 2011, 27(2): 158-164] |
Li YL, Chen C, Wang QY, et al. Comparative analysis of growth characteristics between hybrid F1 by Epinephelus moara (♀)×Epinephelus septemfasciatus (♂) and the offspring of their parents. Progress in Fishery Sciences, 2015, 36(3): 42-49 [ 李炎璐, 陈超, 王清印, 等. 云纹石斑鱼(E. moara)(♀)×七带石斑鱼(E. septemfasciatus)(♂)杂交F1生长特征与其亲本子代的比较. 渔业科学进展, 2015, 36(3): 42-49] |
Qin L, Wang YG, Shi CY, et al. Pathological study on the infection of Scophthalmus maximus by an iridovirus. Progress in Fishery Sciences, 2009, 30(5): 6-12 [ 秦蕾, 王印庚, 史成银, 等. 一种虹彩病毒感染大菱鲆的病理学研究. 渔业科学进展, 2009, 30(5): 6-12 DOI:10.3969/j.issn.1000-7075.2009.05.002] |
Rodge HD, Kobs M, Macartney A, et al. Systemic iridovirus infection in freshwater angelfish, Pterophyllum scalare (Lichtenstein). Journal of Fish Diseases, 1997, 20(1): 69-72 DOI:10.1046/j.1365-2761.1997.d01-106.x |
Shao YX, Chen C, Li YL, et al. Effects of low temperature stress on serum biochemical indices of the juvenile hybrid of Epinephelus moara ♀×Epinephelus lanceolatus ♂. Progress in Fishery Sciences, 2017, 38(2): 70-76 [ 邵彦翔, 陈超, 李炎璐, 等. 低温胁迫对云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交后代血清生化指标的影响. 渔业科学进展, 2017, 38(2): 70-76] |
Shi CY. Studies on virial reddish body syndrome of farmed turbot Scophthalmus maximus in China. Doctoral Dissertation of Ocean University of China, 2004 [史成银.我国养殖大菱鲆病毒性红体病的研究.中国海洋大学博士研究生学位论文, 2004] http://cdmd.cnki.com.cn/Article/CDMD-10423-2004131319.htm
|
Wang Q, Zeng WW, Liu C, et al. Identification and characterization analysis on a megalocytivirus isolated from diseased marbled sleepy goby, Oxyeleotris marmoratus. Acta Hydrobiologica Sinica, 2010, 34(6): 1150-1156 [ 王庆, 曾伟伟, 刘春, 等. 云斑尖塘鳢肿大细胞病毒属虹彩病毒的分离与鉴定. 水生生物学报, 2010, 34(6): 1150-1156] |
Wen L, Lei Y, Qi RR, et al. Diagnosis of iridovirus disease in sea bass Lates calcarifer. Chinese Journal of Fisheries, 2015, 28(4): 28-32 [ 文琳, 雷燕, 戚瑞荣, 等. 尖吻鲈Lates calcarifer虹彩病毒病的诊断. 水产学杂志, 2015, 28(4): 28-32 DOI:10.3969/j.issn.1005-3832.2015.04.006] |
Weng SP, Wang YQ, He JG, et al. Outbreaks of an iridovirus in red drum, Sciaenops ocellata (L.), cultured in southern China. Journal of Fish Diseases, 2002, 25(11): 681-685 |



