2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 农业农村部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao); Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Qingdao 266071
细菌计数方法是微生物学研究的基础技术,主要分为直接计数法和间接培养计数法。直接计数法主要有显微镜观察法(包括光学显微镜技术、荧光显微镜技术等)和比浊计数法等;间接培养计数法主要有平板菌落计数法(包括传统平板计数法、微菌落技术等)和最大或然数计数法(Most probable number,MPN法,也称为稀释培养法)等(王婷婷等, 2008)。传统的直接计数法不能区分细菌的死活,且灵敏度低、线性范围狭窄,间接培养计数法虽然能确定活菌数量,但工作量大,难以对大批量样品进行同时操作。例如,食品安全国家标准中的菌群计数法采用MPN法和平板计数法(GB 4789.3-2010),这2种方法都需要培养24~48 h,且工作量大、检测线性范围窄,难以进行快速、大批量的检测工作,MPN法的精确性还存在疑问;为了简化检测程序、缩短检测时间,国内外学者进行了大量的快速检测方法的研究,提出了电阻抗检测法、Sim PlateTM全平皿计数法、微菌落技术、最大或然数-聚合酶链式反应计数法(MPN-PCR法)、流式细胞仪测定法等检测方法,取得了一定的成果,但也存在不同的缺陷和不足。例如,流式细胞仪测定法虽然灵敏度、简便性都有了较大的提升,但由于其成本昂贵,且不能区分细菌的死活,在实际应用中受到了很大的制约。
MTT是3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐,能穿过细胞膜被活细胞线粒体中的琥铂酸脱氢酶还原,形成蓝紫色不溶于水的甲瓒(Formazan) (Mosmann, 1983),死细胞酶活性丧失而没有颜色反应。用有机溶剂溶解甲瓒后(边兴艳, 1998),测定溶液的吸光度(OD值)而确定活细胞数(Gerlier et al, 1986)。该法快速、经济、操作相对简便、重复性较好,近年来被广泛应用到大肠杆菌(Escherichia coli) (王栩等, 2002)、保加利亚乳杆菌(Lactobacillus bulgaricus)、嗜热链球菌(Streptococcus thermophilus) (黄立坤等, 2008)、伴放线菌嗜血菌(Haemophilus actinomycetemcomitans) (王忠朝等, 2010)和酵母菌(龚加路等, 2016)等的活菌计数中。
三磷酸腺苷(ATP)是所有生命活动的能量载体(Velten et al, 2007),活细菌中ATP含量会维持在一定范围,细菌死亡后ATP会在短时间内被细胞内酶所分解(Holm-Hansen et al, 1966),样品中ATP含量即可间接反映活细菌数量。ATP生物发光法(Miller et al, 1992; Selan et al, 1992; Nyrén, 1994; McElroy et al, 1949)是荧光素酶在Mg2+条件下催化荧光素与ATP反应形成荧光素-AMP的复合物,与O2结合时发光,发光强度与ATP浓度呈线性关系,从而检测活菌的数量(Moyer et al, 1983; Grönroos et al, 1983)。ATP生物发光法操作简便,能快速得到结果,与传统的平板计数法相比,不仅能区分细菌的死活,而且还能检测出不可培养的微生物(Hammes et al, 2010)。
借鉴实时定量PCR的扩增曲线原理,利用微生物类似于PCR扩增的指数生长曲线(Brewster, 2003),建立了高通量生长曲线法,该法与传统的MPN法完全不同,是根据细菌生长达到特定浊度的时间进行活菌的计数,在微孔板的微量培养体积上,设置多个平行,以高通量的方式对微生物的生长进行实时监测,达到类似实时定量PCR那样在极宽的线性范围进行微生物的准确计数的效果。在上述背景下,本研究对MTT比色法、ATP生物发光法和高通量生长曲线法进行了比较。
1 材料与方法 1.1 细菌实验用副溶血弧菌(Vibrio parahaemolyticus)的编号为20130629002S01(以下简称2S01),取自中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理学研究室(王娜等, 2016; Dong et al, 2017)。将冻存的2S01菌株在胰蛋白胨大豆琼脂培养基(TSA)平板上划线,28℃培养12 h,挑取单个菌落接种于胰蛋白胨大豆肉汤培养基(TSB)中,于28℃以110 r/min过夜振荡培养,3000 r/min离心10 min,并用磷酸缓冲溶液(PBS)清洗沉淀、重悬,调整其OD600 nm=0.5,经平板计数方法检测其浓度约为1.12×108 CFU/ml。取2 ml接种于200 ml TSB培养基中,在28℃以110 r/min恒温震荡培养4~6 h,待细菌刚达到指数生长期时,用冷冻离心机4℃离心3次,并用PBS溶液清洗沉淀、重悬,调整其OD600 nm=0.5,备用。
1.2 MTT比色法 1.2.1 检测波长确定将100 μl重悬菌液加入96孔细胞培养板(Corning, 美国),然后每孔加入20 μl 5 mg/ml的MTT溶液(溶于PBS溶液并经0.22 µm滤膜过滤除菌)(Solarbio),用微孔板振荡仪混匀,放入37℃恒温培养箱孵育2 h,取出后于4000 r/min离心10 min,吸出上清液,每孔加入150 μl DMSO (Solarbio, 中国),振荡混匀10 min,设定Varioskan Flash全波长扫描式多功能读数仪(Thermo, 美国)波长在400~700 nm范围内进行波长扫描,只加DMSO作为空白对照组,每组3个平行。
1.2.2 MTT溶液的使用剂量在相同量的菌液中分别加入终浓度为0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/ml的MTT溶液,充分反应后离心,弃上清液,每组3个平行,按MTT比色法的步骤测量各组OD值。
1.2.3 干扰物质的影响以DMSO为参比,以PBS溶液和121℃灭菌20 min的死亡菌体为样品,用MTT法测量,每组3个平行。
1.2.4 MTT溶液与菌液反应时间分别将MTT法的37℃孵育反应经0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h后,离心弃上清液,终止反应,每组3个平行,按上述方法测量各组OD值。
1.2.5 检测范围与标准曲线将浓度为1×109 CFU/ml的菌悬液按2倍浓度梯度依次稀释为9.77×105~1×109 CFU/ml,每组3个平行,用MTT法测量各组OD值,用SigmaPlot 12.0软件进行数据分析,用Polynomial进行线性分析,建立菌液浓度与其反应后OD值的标准曲线。
1.3 ATP生物发光法 1.3.1 试剂盒可靠性检测按增强型ATP检测试剂盒(Beyotime)说明书操作步骤用试剂盒提供的ATP标准品进行试剂盒验证,并建立标准曲线。
1.3.2 检测范围与标准曲线将调整OD后的菌液稀释成浓度为3×103、1×104、3×104、1×105、3×105、1×106、3×106、1×107、3×107、1×108、3×108、1×109 CFU/ml的菌悬液,然后按照试剂盒说明书测量各组相对发光度值(RLU),每组3个平行,建立菌液浓度与其反应后RLU的标准曲线。
1.4 高通量生长曲线法 1.4.1 不同浓度菌液连续培养进行OD值测定将调整OD后的菌液稀释成1×102、1×103、1×104、1×105、1×106、1×107、1×108、1×109 CFU/ml的菌悬液,每个梯度取2 µl,用8通道移液器加至预先加有198 μl TSB培养基的96孔板中,每个浓度3个重复,设置PBS空白对照,用涡旋振荡仪混匀,放入28℃恒温培养箱,300 r/min振荡培养。在培养的0、1、2、3、4、5、6、7、8、9、10、11 h测定OD600 nm。
1.4.2 建立标准曲线将细菌培养时间和OD600 nm的读数扣除未接种细菌的培养基孔的OD600 nm值,用SigmaPlot 12.0软件进行数据分析,按Sigmoid曲线类型用3参数模式拟合,根据拟合出的方程,统计其各组菌液生长曲线达到a/2值的时间x0,建立菌液浓度与该时间的标准曲线。
1.5 副溶血弧菌菌液的测量取10份不同浓度的副溶血弧菌菌液,分别用3种计数方法与平板计数法进行对比,分析3种计数方法的计数结果(C)与平板计数法的计数结果(CP)的线性关系和变异系数(C.V.)。
| $ {\rm{C}}{\rm{.V}}{\rm{. = }}\left( {C - {C_{\rm{P}}}} \right)/{C_{\rm{P}}} \times 100\% $ |
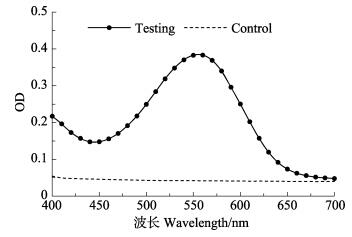
MTT经细菌产物呈蓝紫颜色,将培养的副溶血弧菌悬液进行波长扫描(图 1),结果显示,蓝紫色产物的最大吸收峰值在550~560 nm之间。DMSO的吸光度对实验组吸光度影响很小,且没有峰值出现,属于背景吸收,因此,将MTT法的检测波长定为555 nm。
|
图 1 MTT产物甲瓒的光吸收检测波长扫描 Fig.1 The scanning of photoabsorption detection wavelength of formazan produced by MTT |
设定不同的MTT用量进行分析,结果显示(图 2),当细菌反应液中MTT浓度为0.2 mg/ml,产生甲瓒沉淀的量最多,甲瓒的吸收曲线呈现峰值,因此,将MTT终浓度定为0.2 mg/ml。MTT量超过0.2 mg/ml时,产生的甲瓒量会逐渐减少。

|
图 2 MTT浓度对检测结果的影响 Fig.2 Effects of the MTT concentration on the measuring results |
以DMSO为参照,用PBS或灭活菌体作为样品进行MTT反应检测,所得的检测值很低(表 1),经t检验,得出3组数据两两间均无显著差异(P > 0.05),因此,可以忽略这些干扰物对实验结果的影响。
|
|
表 1 不同干扰物以DMSO为对照时的OD值 Tab.1 OD value of the different interfering substances compared with DMSO |
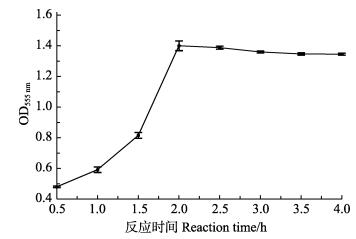
细菌与MTT的反应时间在0.5~2 h时,形成甲瓒的量在逐渐增多,2 h后维持在相对稳定的数量(图 3),因此,将反应时间定为2 h。
|
图 3 反应时间对检测结果的影响 Fig.3 Effects of reaction time on the measuring results |
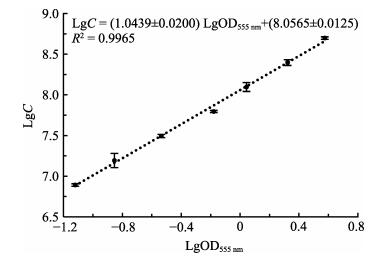
通过选择上述参数,用优化的MTT法在微孔板中进行副溶血弧菌的高通量活菌计数,用SigmaPlot的Polynomial线性分析,当菌液浓度为7.81×106~2.50×108 CFU/ml时,其对应的OD555 nm值与活菌数的线性关系极显著,线性范围跨度约为2个细菌浓度数量级,其关系式为LgC=(1.0439± 0.0200)LgOD555 nm+(8.0565±0.0125),R2=0.9965 (图 4)。
|
图 4 菌液浓度对数LgC与OD值对数LgOD555 nm的标准曲线 Fig.4 Standard curve between the logarithmic concentration of bacteria (LgC) and logarithmic OD555 nm value (LgOD555 nm) |
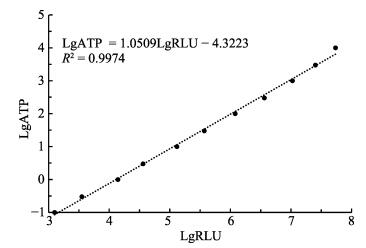
用增强型ATP检测试剂盒对ATP标准溶液进行检测,ATP标准溶液浓度在1.0×10‒1~1.0×104 nmol/L时,ATP浓度的对数(LgATP)与发光强度对数(LgRLU)的线性关系极显著,其关系式为LgATP=1.0509LgRLU-4.3223,R2=0.9974(图 5),表明该试剂盒在该范围内的测定结果可靠。
|
图 5 ATP浓度对数(LgATP)与相对发光强度(RLU)对数(LgRLU)的标准曲线 Fig.5 Standard curve between the logarithmic concentration of ATP (LgATP) and logarithmic relative intensity of luminescence(LgRLU) |
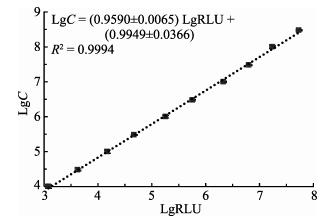
用增强型ATP试剂盒对已知浓度的副溶血弧菌样品进行检测,用SigmaPlot的Polynomial线性分析,当菌液浓度在1.0×104~3.0× 108 CFU/ml时,其对应的相对发光强度对数(LgRLU)与活菌数对数(LgC)的线性关系极显著,线性范围跨度约为4.5个细菌浓度数量级,其关系式为LgC= (0.9590±0.0065)LgRLU+(0.9949±0.0366),R2=0.9994 (图 6)。
|
图 6 菌液浓度对数LgC与相对发光强度对数LgRLU的标准曲线 Fig.6 Standard curve between the logarithmic concentration of bacteria (LgC) and logarithmic intensity of luminescence(LgRLU) |
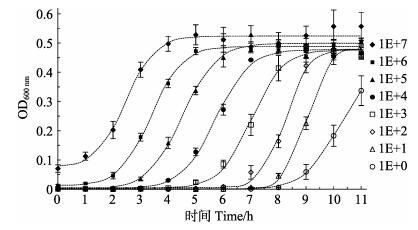
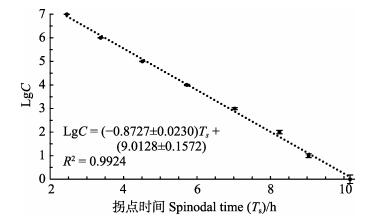
将浓度为1.0×100~1.0×107 CFU/ml的副溶血弧菌加到预先加有培养基的多孔板中,每隔1 h,测定OD600 nm值,扣除未接种细菌孔的OD600 nm后,得出各初始浓度的细菌吸光度所代表的生长变化,可看到这些生长变化都呈S形(Sigmoid)曲线分布,不同浓度的S曲线在拐点处的生长速率基本接近,经SigmaPlot的Sigmoid曲线类型3参数模式拟合,得到各初始浓度的细菌生长曲线(图 7)。用SigmaPlot的Polynomial线性分析,取各浓度拟合曲线的拐点时间参数(Ts),即为生长达到最大值的50%的生长时间,该时间在所测定的初始细菌浓度范围内均与活菌数的对数值(LgC)具有极显著的线性关系,线性关系跨度达7个数量级,其关系式为LgC= –(0.8727±0.0230)Ts+ (9.0128±0.1572),R2=0.9924(图 8)。
|
图 7 各初始浓度菌液的生长曲线 Fig.7 Growth curve of each initial concentration of bacteria |
|
图 8 菌液浓度LgC与生长曲线的拐点时间(Ts)的标准曲线 Fig.8 Standard curve between the concentration of bacteria (LgC) and the spinodal time (Ts) of growth curves |
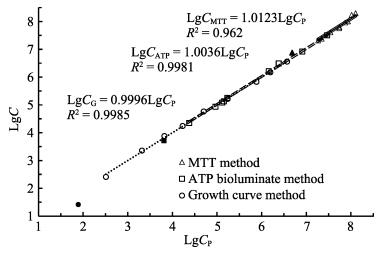
分别采用MTT比色法、ATP发光法和高通量生长曲线法对10份不同浓度的副溶血弧菌菌液进行检测,并与平板计数法进行比较(图 9)。结果显示,MTT法计数的9个在线性范围内的样品计数值的对数(LgCMTT)与平板计数法结果的对数(LgCP)之间具有极显著的线性关系(R2=0.9620,P=3.42×10-7),其关系式为LgCMTT/LgCP=1.0123(图 9)。9个样品的变异系数为(18.50±12.03)%,超出检测线性范围的1个样品的浓度为4.82×106 CFU/ml,其变异系数为36.61%。ATP发光法计数的9个在线性范围内的样品计数值的对数(LgCATP)与平板计数法的结果的对数(LgCP)之间具有极显著的线性关系(R2=0.9981, P=1.72×10-11),其关系式为LgCATP/LgCP=0.9981(图 9)。9个样品的变异系数为(8.59±5.90)%,超出检测线性范围的1个样品的浓度为6.43×103 CFU/ml,其变异系数为23.65%。高通量生长曲线法计数的9个在线性范围内的样品计数值的对数(LgCG)与平板计数法结果的对数(LgCP)之间具有极显著的线性关系(R2=0.9985, P=3.89× 10-11),其关系式为LgCG/LgCP=0.9985(图 9)。9个样品的变异系数为(9.78±7.46)%,超出线性范围的1个样品的浓度为77.00 CFU/ml,其变异系数为68.43%。
|
图 9 3种高通量活菌计数法与平板计数法的结果比较 Fig.9 Comparison of logarithmic counting value three high throughput counting methods for living bacteria(LgC) and logarithmic value of plate counting (LgCP) |
上述3种方法与平板计数法的比较显示,ATP发光法和高通量生长曲线法的曲线斜率很接近1,说明这2种方法与平板计数法得出的结果高度接近,而MTT法的斜率与1有所偏离,而且在偏低或偏高浓度上有明显系统误差,说明这一方法所得结果存在一定误差。
3 讨论平板计数作为活菌计数的最基本方法,通常能应用于大多数需要进行活菌计数的场合,但在一些研究不同培养条件,例如液体发酵(高戈等, 2017)或固体发酵(孙静等, 2017)等;理化因素,例如消毒剂或紫外线等处理;药物制剂,例如中草药或抑菌剂等;这些对特定细菌生长或存活的影响效果时,需要大量的活菌计数工作,而平板计数方法由于工作量大,材料消耗大,在用到这些大量研究对象时效率很低,且不确定度高(凌云等, 2010),因此,需要高效可靠的活菌计数方法。工作效率较高的细菌计数法可采用酶标板的高通量OD值测定,但该方法并不能区分样本中的活菌和死菌,而且如果样本中存在大量带颜色的或悬浮物等干扰光吸收的物质时(孙静等, 2017),就难以进行直接的OD值测定。因此,需要其他的活菌计数方法以弥补在特定应用中的不足。
MTT比色法操作相对简单,能满足高通量操作的需求,适用于较高浓度的活菌数检测,但其检测的线性范围只有2个数量级的跨度。当活菌数较低时,MTT的反应产物过低,从而在OD555 nm值太低而超出检测的线性范围,不适用于检测浓度太低或太高的细菌,由于高通量分析实验的场合常常会有细菌数量大大偏离MTT检测范围的情况发生,这种方法实际上在高通量活菌计数的应用中受到了较大局限,与之前报道的MTT比色法在大肠杆菌活菌计数研究的结论相符合(汪志荣等, 2011)。对7.8×106~2.5×108 CFU/ml线性范围内的实际样品进行检测时,所得结果与平板计数结果有一定偏离,5×106 CFU/ml以下的检测结果可能会有明显偏差。此外,不同种类和不同生理状态的细菌中琥珀酸脱氢酶含量可能不同,对多种细菌混合检测的适用性可能受影响。
ATP生物发光法操作更加简便,是3种方法中检测速度最快的,准确性比MTT法高,反应速度较快,能对样品进行实时的检测反馈,线性范围能达到4个数量级的跨度。对1×104~3×108 CFU/ml跨度的线性范围内的实际样品进行检测时,所得结果与平板计数结果高度吻合,对104 CFU/ml以下的检测结果偏差明显增加(Chen et al, 2006)。在检测较低浓度的活菌时,需要较长的检测时间来收集微弱的发光,对于大量样品的高通量检测来说,顺序检测过程会造成前后样品的时间差太大,ATP的发光会逐渐消散而对准确性造成显著影响(发光会逐渐消散而对准确性造成显著影Selan et al, 1992)。因此,该方法也不适于大样本量的高通量检测。此外,如果样品中有其他来源的ATP干扰,也会对分析的准确性产生很大的影响。
高通量生长曲线法准确性略低于ATP发光法,在本研究的手动操作条件下,检测的线性范围达7个数量级以上,对特别低或特别高的活菌数都能进行有效检测。对100~107 CFU/ml跨度的线性范围内的实际样品进行检测时,所得结果与平板计数结果高度吻合,102 CFU/ml以下的实际样品检测时有误差增大的可能,与Brewster(2003)的研究结果相符。高通量生长曲线法操作耗费时间较长,而且需要定时对OD值进行测定,如果完全人工手动操作,这个过程将较为辛苦。该方法不需要借助特别试剂,可以不受试剂缺乏的限制而得以应用。如果有自动生长曲线测定仪,那这样的操作将十分方便,而且能进一步增加其检测的线性范围和结果的准确性。
综合比较3种高通量方法:ATP生物发光法与高通量生长曲线法有很好的准确性,MTT比色法准确度稍差;而高通量生长曲线法有最宽的线性范围,也最适合高通量测定。
Bian XY. MTT assay and its application. International Journal of Laboratory Medicine, 1998, 19(2): 83-85 [ 边兴艳. MTT比色法及其应用. 国际检验医学杂志, 1998, 19(2): 83-85] |
Brewster JD. A simple micro-growth assay for enumerating bacteria. Journal of Microbiological Methods, 2003, 53(1): 77-86 DOI:10.1016/S0167-7012(02)00226-9 |
Chen FC, Godwin SL. Comparison of a rapid ATP bioluminescence assay and standard plate count methods for assessing microbial contamination of consumers' refrigerators. Journal of Food Protection, 2006, 69(10): 2534-2538 DOI:10.4315/0362-028X-69.10.2534 |
Dong X, Bi DX, Wang HL, et al. pirABvp-bearing Vibrio parahaemolyticus and Vibrio campbellii pathogens isolated from the same AHPND-affected pond possess highly similar pathogenic plasmids. Frontiers in Microbiology, 2017, 8: 1859 DOI:10.3389/fmicb.2017.01859 |
Gao G, Zhu KL, Zhang QQ, et al. Simplified fermentation of a functional probiotics and the application in prawn (Litopenaeus vannamei) bio-floc breeding. Progress in Fishery Sciences, 2017, 38(3): 140-147 [ 高戈, 朱开玲, 张庆起, 等. 一株功能益生菌的简易发酵及其在凡纳滨对虾(Litopenaeus vannamei)生物絮团养殖中的应用. 渔业科学进展, 2017, 38(3): 140-147] |
Gerlier D, Thomasset N. Use of MTT colorimetric assay to measure cell activation. Journal of Immunological Methods, 1986, 94(1-2): 57-63 DOI:10.1016/0022-1759(86)90215-2 |
Gong JL, Deng J, Wu HC, et al. Research on the optimum condition of MTT in yeast count. China Condiment, 2016(1): 10-14 [ 龚加路, 邓静, 吴华昌, 等. MTT法在酵母菌活菌计数中最佳条件的研究. 中国调味品, 2016(1): 10-14 DOI:10.3969/j.issn.1000-9973.2016.01.003] |
Grönroos M, Mäenpää J, Nieminen AL, et al. 548 Correlation of steroid receptor contents with medroxyprogesterone and tamoxifen effects in endometrial cancer assayed by barin vitro ATP-bioluminescence method. Journal of Steroid Biochemistry, 1983, 19(S1): 194 |
Hammes F, Goldschmidt F, Vital M, et al. Measurement and interpretation of microbial adenosine tri-phosphate (ATP) in aquatic environments. Water Research, 2010, 44(13): 3915 DOI:10.1016/j.watres.2010.04.015 |
Holm-Hansen O, Booth CR. The Measurement of adenosine triphosphate in the ocean and its ecological significance. Limnology and Oceanography, 1966, 11(4): 510-519 DOI:10.4319/lo.1966.11.4.0510 |
Huang LK, Du P, Huo GC. Inquiring into the method of counting live germ with MTT. Food Industry, 2008(3): 62-65 [ 黄立坤, 杜鹏, 霍贵成. MTT法测定乳酸菌活菌数的研究. 食品工业, 2008(3): 62-65 DOI:10.3969/j.issn.1006-6195.2008.03.028] |
Ling Y, Wang LB, Shen H, et al. Uncertainty evaluation for plate counts of coliforms in foods. Food & Machinery, 2010, 26(5): 75-77 [ 凌云, 王李宝, 沈辉, 等. 食品中大肠菌群平板计数结果不确定度的评定. 食品与机械, 2010, 26(5): 75-77] |
McElroy WD, Strehler BL. Factors influencing the response of the bioluminescent reaction to adenosine triphosphate. Archives of Biochemistry, 1949, 22(3): 420-433 |
Miller JN, Nawawi MB, Burgess C. Detection of bacterial ATP by reversed flow-injection analysis with luminescence detection. Analytica Chimica Acta, 1992, 266(2): 339-343 DOI:10.1016/0003-2670(92)85061-A |
Mosmann T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. Journal of Immunological Methods, 1983, 65(1-2): 55-63 DOI:10.1016/0022-1759(83)90303-4 |
Moyer JD, Henderson JF. Nucleoside triphosphate specificity of firefly luciferase. Analytical Biochemistry, 1983, 131(1): 187-189 DOI:10.1016/0003-2697(83)90152-5 |
Nyrén P. Apyrase immobilized on paramagnetic beads used to improve detection limits in bioluminometric ATP monitoring. Luminescence, 1994, 9(1): 29-34 |
Selan L, Berlutti F, Passariello C, et al. Reliability of a bioluminescence ATP assay for detection of bacteria. Journal of Clinical Microbiology, 1992, 30(7): 1739-1742 |
Sun J, Song XL, Huang J. Optimization of fermentation conditions and analysis of the nutrition components of soybean meal fermented with Bacillus firmus. Progress in Fishery Sciences, 2017, 38(3): 163-171 [ 孙静, 宋晓玲, 黄倢. 豆粕的坚强芽孢杆菌(Bacillus firmus)发酵工艺优化及其营养成分分析. 渔业科学进展, 2017, 38(3): 163-171] |
Velten S, Hammes F, Boller M, et al. Rapid and direct estimation of active biomass on granular activated carbon through adenosine tri-phosphate (ATP) determination. Water Research, 2007, 41(9): 1973-1983 DOI:10.1016/j.watres.2007.01.021 |
Wang N, Wang HL, Bai N, et al. Isolation of lysogenic phage in Vibrio parahaemolyticus and its relationship with the pathogenicity of the host bacteria. Progress in Fishery Sciences, 2016, 37(2): 105-110 [ 王娜, 王海亮, 白楠, 等. 副溶血弧菌(Vibrio parahaemolyticus)中溶源噬菌体与其宿主菌致病力的相关性. 渔业科学进展, 2016, 37(2): 105-110] |
Wang TT, Deng TL, Liao MX. Discussions on the methodology of aquatic bacteria counting. World Sci-Tech R & D, 2008, 30(2): 138-142 [ 王婷婷, 邓天龙, 廖梦霞. 水生细菌计数方法研究进展及展望. 世界科技研究与发展, 2008, 30(2): 138-142 DOI:10.3969/j.issn.1006-6055.2008.02.007] |
Wang X, Wu YC, Xia SP, et al. Inquiring into the method of counting live germ with MTT. Journal of Luzhou Medical College, 2002, 25(4): 291-293 [ 王栩, 邬于川, 夏世平, 等. MTT法进行活菌计数的方法学探讨. 泸州医学院学报, 2002, 25(4): 291-293 DOI:10.3969/j.issn.1000-2669.2002.04.005] |
Wang ZC, Fan LY, Cai W, et al. Study on counting of H. actinomycetemcomitans by MTT colorimetric method. Journal of Modern Medicine & Health, 2010, 26(8): 1121-1123 [ 王忠朝, 范丽苑, 蔡炜, 等. MTT法用于检测伴放线菌嗜血菌的研究. 现代医药卫生, 2010, 26(8): 1121-1123] |
Wang ZR, Gao Q, Ma CX, et al. Experimental study on the application of MTT colorimetric method in counting live Escherichia coli. Acta Scientiae Circumstantiae, 2011, 31(12): 2642-2650 [ 汪志荣, 高琼, 马传鑫, 等. MTT法测定大肠杆菌活菌数实验研究. 环境科学学报, 2011, 31(12): 2642-2650] |



