2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 农业农村部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071;
3. 大连海洋大学水产与生命学院 大连 116023
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao); Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity; Qingdao 266071;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023
水产养殖是一种典型的大群体操作,其疾病诊断和流行病学研究是基于少量样品的测试而完成的。样品的代表性是得出正确的疾病诊断结果和可靠的流行病学研究结论的关键,但这一关键在生产中常常被忽视。对一个群体进行随机采样时,达到95%可信度的采样率所需被全部检测到的样品数量与群体中疫病的不同流行率及群体大小相关,以含有10万个以上个体的大群体为例,在2%的疾病流行率时的被检测的样本数要求达到150;10%流行率时要求达到30个样本(Ossiander et al, 1973),这样的采样率在实际生产的诊断应用中如果都进行单尾检测会造成极高的成本,使养殖业者难以承受,而并样检测则能够降低成本,但也很容易造成假阴性的现象。因此,需对并样检测方法进行评估,来保证诊断结果的可靠性和可行性(Williams et al, 2001)。在OIE标准及美国标准中,都有最多每5个个体进行并样的建议,但这样的并样方法在水生动物疾病研究中并没有明确的研究数据支持(OIE, 2017; FHS, 2014)。在陆生动物疾病研究中,也只有少量研究报道(Muñoz-Zanzi et al, 2000; Arnold et al, 2009; Rovira, 2008)。因此,有必要对水生动物疾病样品检测中的并样问题开展研究。
自2003年以来,泰国养殖斑节对虾(Penaeus monodon)出现生长缓慢综合征(MSGS),造成了严重的经济损失(Chayaburakul et al, 2004)。在2009年,泰国研究者在生长缓慢的斑节对虾肝胰腺中检测到虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP) (Tourtip et al, 2009),EHP感染并没有明显的临床病变特征,对于该病原的诊断主要通过组织学观察、PCR法、地高辛标记核酸探针原位杂交法以及LAMP检测方法(Tangprasittipap et al, 2013; Suebsing et al, 2013)。2013年,中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理学研究室建立了EHP的SYBR Green qPCR方法,并首次在中国养殖的凡纳滨对虾(Litopenaeus vannamei)中检出EHP。进一步对养殖对虾群体的单尾EHP载量和体长关系分析表明,对虾肝胰腺样品总DNA(HpDNA)中EHP载量在10 copies/(ng HpDNA)以上时,代表了较高的风险水平(刘珍等, 2016)。Liu等(2018)建立了EHP的TaqMan探针qPCR方法,灵敏度高于SYBR Green qPCR和套式PCR方法,并证实上述EHP载量与对虾生长关系的存在,这些研究为EHP的检测和防控提供了多项技术手段。
EHP的定量检测对于养殖风险的判定具有重要意义,但针对大抽样量存在过高的检测工作量和成本问题,为了提高EHP检测的适用性和有效性,有必要考虑应用并样检测方案。本研究以TaqMan qPCR的EHP检测方法为基础,考察不同并样方案对EHP检测的影响,以期为水生动物病原检测技术的实际应用和水生动物流行病学监测提供技术依据。
1 材料与方法 1.1 材料来源2017年6月~7月自山东海阳和潍坊2家养殖场分批采集凡纳滨对虾,海阳样品编号为60401~60450,潍坊样品编号为60301~60350、61401~61450和70701~70750。每尾活虾用3倍以上体积的95%乙醇进行保存。
1.2 肝胰腺总DNA提取95%乙醇中保存的对虾肝胰腺组织经无菌海水冲洗去除乙醇后,用一次性解剖刀片切取约30 mg,利用海洋动物组织基因组DNA提取试剂盒(天根生化科技有限公司)提取处理好的样品肝胰腺总DNA,用核酸分析仪(NanoDrop 2000c, Thermo)测定样品的DNA浓度,并分析提取的DNA质量,然后根据DNA浓度的不同,对其进行适当地稀释后,将DNA样品置于‒20℃冰箱保存。
1.3 样品EHP载量的检测将1.2中保存的DNA样品用Liu等(2018)建立的TaqMan探针法实时荧光qPCR进行检测,根据本研究并样检测时的阴性对照扩增曲线确定阴性循环阈值(CtN)为31,对各样品EHP载量进行计算。
1.4 样品的并样检测方案 1.4.1 海阳样品的并样检测将山东海阳的50份样品按照样品编号顺序,每5个为1组,对每个样品取10 µl DNA至1.5 ml离心管中,充分混匀后,确定其浓度仍在200 ng/µl,得到10个5:1 (5P)并样方式的样品,分别命名为H5P01~H5P10,再对这10个样品采取同样的方法进行并样,得到2个25:1 (25P)并样方式的样品,分别命名为H25P01和H25P02。对这12个新并样的样品进行EHP检测,与组内对应样品检测结果取平均值进行比较。
1.4.2 潍坊样品的并样检测将山东潍坊的3次跟踪采样的样品分别按照山东海阳样品的并样方法进行处理,每批样品得到5:1 (5P)并样后的10个样品,分别命名为W5P01~W5P30,再对30个样品采取同样的方法进行并样,得到6个25:1 (25P)并样方式的样品,分别命名为W25P01~W25P06,接着对这6个样品每2个进行并样,得到3个50:1 (50P)并样样品,分别命名为W50P01~W50P03,对50P的3个样品两两并样,得到3个100:1 (100P)并样样品,分别命名为W100P01~W100P03,最后对50P的3个样品进行并样,得到1个150:1 (150P)并样样品W150P01。对并样后的各样品进行EHP载量检测,与单个样品检测的结果进行比较。
1.5 并样检测的定性分析为了考察在不同阳性强度的水平下并样对阳性检出的影响,通过划定不同的假定临界循环值(Ca),分别用海阳和潍坊样品的EHP检测的循环阈值(Ct)与Ca值比较,样品扩增曲线在Ca值之前升起,即Ct≤Ca,则判定为分析阳性,否则为分析阴性,求出不同Ca值的各并样组阳性和阴性数目。根据并样组的单个样品分析阳性判定并样组已知阳性,即并样组中有1个及1个以上单一样品为阳性,则并样组为已知阳性。以上述阴性和阳性数据为基础,计算不同假定临界循环值下的已知阳性数/检测到的阳性数、不同并样模式的已知阳性率和测试阳性率、不同已知阳性率的各并样组的已知阳性数/检测到的阳性数、低阳性率并样组的已知阳性数和检测阳性数、不同并样模式的诊断灵敏度和诊断特异性(OIE, 2017)。
1.6 并样检测的定量分析在Microsoft Excel 2016中,根据单一样品的EHP载量,按各并样组进行平均,计算并样组EHP的已知载量。与各并样组实际检测的载量进行比较,包括计算检测值与已知载量值的差值和变异系数,分析已知载量与实际检测之间的相关系数(R),根据函数式P=TDIST(t, df, 2) (其中,
对山东海阳50个样品和山东潍坊3次采样的150个样品逐尾进行EHP的载量检测(表 1)。其中,海阳群体样品有18个阳性,32个阴性,阳性率为36%;潍坊第1、2次采样群体中样品全部为阴性;第3次采样群体中样品全部为阳性,阳性率为100%。
|
|
表 1 凡纳滨对虾样品中肝胰腺的EHP拷贝数 Tab.1 EHP copies in hepatopancreas of farmed L. vannamei |
分别对海阳和潍坊样品进行不同模式的并样检测,比较在不同Ca值下,并样组已知阳性数和检测阳性数(表 2)。结果显示,在低假定灵敏度下,带阳性的并样实际检测容易出现阴性,5:1并样时,在多种灵敏度下都存在检出的阳性数量下降的情况,而高灵敏度下实际检测的阳性数量符合已知阳性数量,而50:1以上并样的检测差异主要出现在极低灵敏度的情况。
|
|
表 2 不同假定灵敏度下并样组阳性情况 Tab.2 The positive number of sample detection at different assumed sensitivities |
比较2个采样群体不同并样模式的分组在16~31个临界循环的假定灵敏度下总的已知阳性率和并样检测阳性率(表 3),结果显示,较高并样率下的阳性率总是大于或等于较低并样率下的阳性率。从潍坊群体的50:1~ 150:1并样的已知阳性率变化可以看到,对单一样品(并样率1:1)并样或从较低并样率的样本再并样时,并样已知阳性率变化范围符合关系:较低并样率的阳性率≤较高并样率的阳性率≤较低并样率的阳性率×较高并样率/较低并样率。当并样前各组阳性率相同时,并样后就有同样的阳性率,当并样前有各并样模式中根据单样品检测结果推定的已知阳性率略高于对并样进行实际检测所得出的阳性率。
|
|
表 3 不同并样模式的阳性率 Tab.3 The positive rates under different pooling modes |
按不同并样组中个体的阳性率区间,统计所有16~31个临界循环的假定灵敏度下各并样组按单样品推定的已知阴性或阳性的数量,与并样组经实验检测所得的相应数量进行比较(表 4)。结果显示,当阳性率在0.1%~10.0%时,25:1~150:1的并样组均未测出阳性,阳性率为10.1%~20.0%时,上述并样组的实验测试所得的阳性数量与已知阳性数量也有出入,20.0%阳性时,5:1并样组也只测出已知阳性的1/2数量的阳性;阳性率在40.0%的5:1并样组的测试阳性与已知阳性也有少量差异,但30.1%~40.0%阳性率的25:1~150:1并样组所有样品均检出了与已知阳性数量相同的结果;更高阳性率的各并样组的实验测试阳性数量与已知阳性数量均没有差异。
|
|
表 4 不同阳性率的并样的已知/检测的阴性和阳性数比较 Tab.4 Comparison of known and detected negative or positive numbers of pooled samples with different positive rate of single sample in pooled group |
对并样组内阳性率(即并样组中的单样品的阳性率)低而未能有效检出的情况进行具体分析(表 5),结果显示,在海阳样品中,最终并样组(25:1)中有2尾以下对虾为阳性(阳性率8.0%)时,其相关的5:1和25:1有已知阳性的并样组均未能检出阳性;最终并样组有3尾对虾为阳性(阳性率12.0%)时,其相关的5:1已知阳性的并样组有部分阳性检出,但25:1并样组未能检出;最终并样组中有4尾对虾为阳性(阳性率为16.0%)时,相关的5:1并样组有部分阳性检出,但25:1的并样组未能检出。在潍坊样品中,最终并样组(150:1)有2尾对虾为阳性(阳性率1.3%)时,其相关的所有5:1~150:1并样组均未能检出阳性;有6尾对虾为阳性(阳性率4.0%)时,已知阳性5:1并样组部分能检出阳性,但25:1~150:1的并样组均未能检出阳性;有10和17尾对虾为阳性(阳性率分别为6.7%和11.3%)时,已知阳性的5:1、25:1和50:1并样组能有阳性检出,但100:1和150:1的并样均为能检出。
|
|
表 5 低阳性率的并样检测分析 Tab.5 Detection of pooled samples with low positive rate |
统计所有16~31个临界循环的假定灵敏度下不同并样模式的已知阳性和已知阴性对应于检测阳性和检测阴性的数量,其中,已知阳性并样检出为阳性则为真阳性,已知阴性检出为阳性则为假阳性,已知阴性检出为阴性则为真阴性,已知阳性检出为阴性则为假阴性,计算得出各并样模式下的诊断灵敏度和诊断特异性(表 6),结果显示,5:1~50:1的诊断灵敏度均不低于80%,且5:1和50:1的诊断灵敏度接近,100:1 ~150:1的诊断灵敏度有所下降。5:1~25:1的诊断特异性为99.5%~98.8%,50:1~150:1的诊断特异性均达100%。
|
|
表 6 不同并样模式的诊断灵敏度和诊断特异性 Tab.6 Diagnostic sensitivity and diagnostic specificity of different pooling modes |
对海阳和潍坊群体单样品EHP载量平均值和并样检测的EHP载量进行比较(表 7)。结果显示,海阳样品的10个5:1并样检测值有4个高于单样品平均值,6个低于单样品平均值,其中,3个并样的差值在平均值的50%以上;2个25:1并样的检测值分别不高于和低于平均值的50%。潍坊样品的5:1并样中,20个阴性并样中1个检出了弱阳性,其余阴性并样在31个循环内仍为阴性;9个阳性并样的检测值均高于平均值,其差异幅度为平均值的10%~183%。潍坊样品25:1并样中,4个阴性并样有1个在31个循环内检出了弱阳性;2个阳性并样的检测值均低于平均值,差异幅度在平均值的5%~50%范围。50:1~150:1的并样中,除了阴性并样的检测值依然为阴性,其余阳性并样的检测值均低于平均值,差异幅度在14%~61%范围。总体来说,在31个循环的检测灵敏度区间,海阳和潍坊的5:1~150:1并样的定量检测结果与单个样品的平均值的比值在(0.27±0.28)~(2.83±0.08)范围内,平均为(1.26±0.78),说明各种并样模式所得的定量检测结果在数量级水平能大致反映样品的平均EHP载量。
|
|
表 7 海阳样品2种检测结果的比较 Tab.7 The comparison of two kinds of test results of samples from Haiyang |
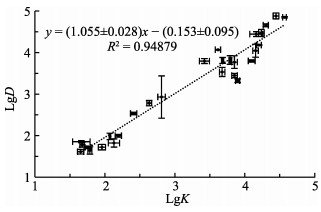
分析并样的EHP载量的定量检测值的对数(LgD)与并样组根据单一样品计算得到的已知量的对数(LgK)的关系(图 1),结果显示,二者呈线性关系(R=0.9741),相关性极显著(P=2.64×10-19),LgD= (1.055±0.028)LgK-(0.153±0.095)。
|
图 1 并样的EHP载量的定量检测值与并样组已知量的相关性 Fig.1 The correlation between of the detected amounts and the known amounts of EHP in pooling groups LgK:根据单样品检测求出的并样组EHP量的对数;LgD:检测到的并样组EHP量的对数 LgK: The logarithmic of EHP amount of the pooled samples calculated from the data of single samples; LgD: The logarithmic of EHP amount of the pooled samples directly detected |
2017年国家虾蟹产业技术体系开展的被动监测结果显示,虾肝肠胞虫(EHP)已在中国虾类主要养殖区广泛分布,在山东、河北、江苏、上海、浙江、福建、广东、海南和新疆均有不同程度地检出。EHP感染引起的肝胰腺微孢子虫病(HPM)是近年来养殖对虾经常发生生长缓慢的主要原因,对虾肝胰腺中EHP的载量在10 copies/ng HpDNA以上时,代表了较高的风险(刘珍等, 2016),而且体长相同时,EHP阳性群体的平均体重比阴性群体低30%,个体大小和体重差异显著增加(刘雅梅等, 2017)。由于EHP感染还没有有效的防治药物,苗种产地检疫工作中进行该病原的定性或定量检测,对于该病的预防具有重要意义。本研究对采集的2个群体的样品进行逐尾检测,海阳群体采样的阳性率为36%;而潍坊群体前2次采样共计100尾稚虾,经31个循环的扩增均未检出阳性,表明早期采样可能遇到阳性率很低的情况,需要进行大样本量的采样和检测。PCR检测的成本可达40~200元/反应,在认证实验室开展检测的成本可能更高,养殖场对大样本量的逐尾检测从成本来说显然是无法承受的,因此,并样检测通常是产业唯一能接受的检测方式。
在大量样本中检出很少的阳性对于检测方案是个挑战。在阳性率低的情况下,并样检测随着混合样本数的增加,样本中阳性靶标会被稀释,这就需要检测方法具有很高的灵敏性和特异性(顾卫东, 1998; Arnold et al, 2009)。中国水产科学研究院黄海水产研究所海水养殖病害防控与分子病理学实验室建立的EHP的TaqMan探针qPCR方法,比套式PCR和SYBR Green qPCR方法有更高的灵敏性和特异性(Liu et al, 2018)。在此基础上,本研究用海阳和潍坊养殖场采集的凡纳滨对虾样品分别进行5:1、25:1、50:1、100:1和150:1并样检测。由于并样率越高,样本越低,为了避免使用大量单个个体在高比例并样时数据量过低使结果难以统计比较,本研究采用了设定不同临界循环数的假定灵敏度的方式对qPCR定量结果进行定性分析的方法,从而使每个样品的1次qPCR的定量结果能产生16个可定性分析的数据,模拟了样品中存在高于和低于临界目标核酸量时所产生的多种组合状态。
对并样阳性率的分析表明,并样率越高,并样检测所得到的阳性率也越高。推算单样本感染率均值(r)可以通过并样数(n)和并样阳性率(rp),经公式r=1–(1–rp)1/n估测,方差(ν)通过公式ν=[rp(1–rp)(2/n–1)]/(nT)计算,其中,T为样品总数(Kline et al, 1989; 顾卫东, 1998),上述关系对于较高阳性率或较高并样率的情况误差很大,用本研究中海阳和潍坊的5:1并样的已知阳性率推算的单样本感染率与实际数据的差异系数达25%~71%。从本研究的数据来看,并样的阳性率符合“较低并样率的阳性率≤较高并样率的阳性率≤较低并样率的阳性率×较高并样率/较低并样率”的关系。
对EHP的并样检测来说,更重要的结果是得出采样群体内是否有阳性存在。群体中流行率越高,所需的采样率越低(Ossiander et al, 1973)。本研究的定性分析揭示,样品个体阳性率 > 20%时,5:1~150:1的各并样组检测到的阳性率与已知情况完全一致;但在样品中个体阳性率 < 20%时,并样检测结果会出现差异。在潍坊样品中,阳性率≤10/150时,100:1~ 150:1并样均无法有效检出阳性,但50:1以下的并样有较稳定的检出;阳性率≤6/150时,25:1以上的并样均无法检出阳性;阳性率≤2/150时,所有并样均无法检出阳性。在海阳的样品中,阳性率≤4/25时,25:1的并样无法有效检出阳性,阳性率≤2/25时,5:1以上的并样均无法检出阳性。考虑到不同流行率所需的采样率(Ossiander et al, 1973),由上述情况推测,如果1个群体只进行1个检测反应,则最灵敏的情况只能检出群体中7%以上的阳性率,应采集50尾样品合并为1个并样检测;而如果该群体的平均EHP载量在10 copies/ng HpDNA的水平,则可能只能检出16%以上的阳性,应采集25尾对虾合并为1个并样检测。Muñoz-Zanzi等(2000)通过成本分析表明,对牛群的并样检测的最低成本与并样率和疫病流行率有关,流行率在0.5%~3.0%范围内,最低成本的并样率在15:1~6:1范围。
前人多数采用数理统计计算对并样开展研究。在并样检测灵敏度和特异性方面,滕海英等(2011)研究了给定灵敏度和特异性下并样方法对提高总阳性率的估计精度的作用。Muñoz-Zanzi等(2006)对影响并样检测的灵敏度和特异性的流行率、并样率、感染动物的病原浓度和检测方法的检测限等参数进行了推演。本研究则结合实际检测数据,统计假定灵敏度下所得出的已知阳性、已知阴性、检测阳性和检测阴性的数量,根据OIE诊断方法验证标准(OIE, 2017)计算得出各并样模式下的诊断灵敏度和诊断特异性。结果表明,无论哪种并样模式均有很好的诊断特异性;而诊断灵敏度在5:1~50:1并样率下均不低于80%,5:1和50:1的诊断灵敏度十分接近,但100:1~ 150:1的诊断灵敏度有明显下降。从这一分析来看,OIE标准和美国标准规定并样不超过5个个体的要求(OIE, 2017; FHS, 2014),在多数情况下可以考虑扩展到50个个体。
EHP感染的风险与其载量有较强的关系(刘珍等, 2016),定量分析对于EHP检测具有重要意义。本研究观察到并样检测的定量结果与单一个体检测的平均值具有极显著相关性(P=2.64×10-19),测定值与个体平均值的比在0.27~2.29范围,处于同一数量级,可以为群体量的测定提供参考。
综上所述,通过基于TaqMan qPCR的EHP检测的并样分析,在定性上国际标准中推荐的5:1并样检测方式可以扩展到50:1的检测方式,可为群体中存在7%以上的感染率提供兼顾准确性和低成本的检测方案,其诊断特异性和诊断灵敏度与5:1并样检测接近,可以缩短检测时间,节省检测费用。更低感染率的检测应通过增加检测反应数量实现,简单提高并样率反而会降低有效检测的能力;并样检测的定量结果能用于群体感染载量水平的粗略评估。并样检测评估为水生动物疫病诊断和流行病学调查提供了参考依据。
Arnold ME, Mueller-Doblies D, Carrique-Mas JJ, et al. The estimation of pooled-sample sensitivity for detection of Salmonella in turkey flocks. Journal of Applied Microbiology, 2009, 107(3): 936-943 DOI:10.1111/jam.2009.107.issue-3 |
Chayaburakul K, Nash G, Pratanpipat P, et al. Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand. Diseases of Aquatic Organisms, 2004, 60(2): 89-96 |
FHS. Suggested procedures for the detection and identification of certain finfish and shellfish pathogens. American Fisheries Society, 2014, http://www.afs-fhs.org/bluebook/bluebook-index.php
|
Gu WD. Estimation of vector prevalence by using pool sampling. Chinese Journal of Parasitology and Parasitic Diseases, 1998, 16(1): 29-33 [ 顾卫东. 混合样本方法估测媒介感染率. 中国寄生虫学与寄生虫病杂志, 1998, 16(1): 29-33] |
Kline RL, Brothers TA, Brookmeyer R, et al. Evaluation of human immunodeficiency virus seroprevalence in population surveys using pooled sera. Journal of Clinical Microbiology, 1989, 27(7): 1449-1452 |
Liu YM, Qiu L, Cheng DY, et al. The relationship of body length and weight in the Litopenaeus vannamei populations detected Enterocytozoon hepatopenaei. Progress in Fishery Sciences, 2017, 38(4): 96-103 [ 刘雅梅, 邱亮, 程东远, 等. 检出虾肝肠胞虫(Enterocytozoon hepatopenaei)的凡纳滨对虾(Litopenaeus vannamei)群体的体长和体重关系. 渔业科学进展, 2017, 38(4): 96-103] |
Liu YM, Qiu L, Sheng AZ, et al. Quantitative detection method of Enterocytozoon hepatopenaei using TaqMan probe real-time PCR. Journal of Invertebrate Pathology, 2018, 151: 191-196 DOI:10.1016/j.jip.2017.12.006 |
Liu Z, Zhang QL, Wan XY, et al. Development of real-time PCR assay for detecting microsporidian Enterocytozoon hepatopenaei and the application in shrimp samples with different growth rates. Progress in Fishery Sciences, 2016, 37(2): 119-126 [ 刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测. 渔业科学进展, 2016, 37(2): 119-126] |
Muñoz-Zanzi CA, Johnson WO, Thurmond MC, et al. Pooled- sample testing as a herd-screening tool for detection of bovine viral diarrhea virus persistently infected cattle. Journal of Veterinary Diagnostic Investigation, 2000, 12(3): 195-203 DOI:10.1177/104063870001200301 |
Muñoz-Zanzi C, Thurmond M, Hietala S, et al. Factors affecting sensitivity and specificity of pooled-sample testing for diagnosis of low prevalence infections. Preventive Veterinary Medicine, 2006, 74(4): 309-322 DOI:10.1016/j.prevetmed.2005.12.006 |
OIE. Manual of diagnostic tests for aquatic animals. 2017, http://www.oie.int/international-standard-setting/aquatic-manual/access-online/
|
Ossiander FJ, Wedemeyer G. Computer program for sample sizes required to determine disease incidence in fish populations. Journal of the Fisheries Research Board of Canada, 1973, 30(9): 1383-1384 DOI:10.1139/f73-223 |
Rovira A, Cano JP, Mu oz-Zanzi C. Feasibility of pooled-sample testing for the detection of porcine reproductive and respiratory syndrome virus antibodies on serum samples by ELISA. Veterinary Microbiology, 2008, 130(1): 60-68 |
Suebsing R, Prombun P, Srisala J, et al. Loop-mediated isothermal amplification combined with colorimetric nanogold for detection of the microsporidian Enterocytozoon hepatopenaei, in penaeid shrimp. Journal of Applied Microbiology, 2013, 114(5): 1254-1263 DOI:10.1111/jam.2013.114.issue-5 |
Tangprasittipap A, Srisala J, Chouwdee S, et al. The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus (Litopenaeus) vannamei. BMC Veterinary Research, 2013, 9(1): 139 DOI:10.1186/1746-6148-9-139 |
Teng HY, Zhang LM, Sun QW, et al. Pooled sampling method under given sensitivity and specificity in improving accuracy of point estimator of population rate. Academic Journal of Second Military Medical University, 2011, 32(1): 72-75 [ 滕海英, 张罗漫, 孙庆文, 等. 给定灵敏度和特异度下混合样本方法对提高总体率点估计精度的作用. 第二军医大学学报, 2011, 32(1): 72-75] |
Tourtip S, Wongtripop S, Stentiford GD, et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (Decapoda: Penaeidae): Fine structure and phylogenetic relationships. Journal of Invertebrate Pathology, 2009, 102(1): 21-29 |
Williams CJ, Moffitt CM. A critique of methods of sampling and reporting pathogens in populations of fish. Journal of Aquatic Animal Health, 2001, 13(4): 300-309 DOI:10.1577/1548-8667(2001)013<0300:ACOMOS>2.0.CO;2 |



