2. 山东省海洋生物研究院 青岛 266104
2. Marine Biology Institute of Shandong Province, Qingdao 266104
我国海藻化工原料短缺问题日渐凸显,铜藻(Sargassum horneri)等经济褐藻的生产得到瞩目,但受环境变化的影响,定生型铜藻资源却不断衰退。铜藻不连续分布在我国暖温带,生长于潮间带(曾呈奎等, 1959),受温度和光照等环境因子影响,其富含褐藻胶(Alginate)、岩藻黄素(Fucoxanthin)、褐藻多酚(Phlorotannin)等多种活性物质(杨金生等, 2017; Liaaen-Jensen et al, 1978; Hosokawa et al, 2010; 秦绪龙等, 2007; Liu et al, 2012),具有重要的开发和应用前景(曾呈奎, 2000; 詹冬梅等, 2016)。为了更好开展铜藻的综合利用,有必要对铜藻的生长和营养组分积累的影响因素进行研究。
目前,国内已对一些马尾藻(Scagassum)类海藻的营养组分开展了研究,如詹冬梅等(2016)和胡斌(2015a, b)对鼠尾藻(Sargassum thunbergii)、海黍子(Sargassum miyabei)和铜藻进行营养分析和评价;付贵权等(2015)研究了金属胁迫对马尾藻生长及生化特性影响;姜宏波等(2009)研究了温度及光强对鼠尾藻组成的影响; 张建伟(2014)研究了环境因子对瓦氏马尾藻(Sargassum vachellianum)生长及光合作用的影响;詹冬梅等(2013)研究了光照及温度对海黍子组分的影响。铜藻在该方面研究资料较少,在不同培养条件下,铜藻生长及组分变化对它的养殖生产及其综合利用有着重要参考价值。
1 材料与方法 1.1 材料2017年1月,在山东荣成海域(37°15′N, 122°35′E)海带(Laminaria japonica)养殖筏架上采集铜藻。去除杂藻和污垢,在10℃、100 μmol/(m2·s)室内水族箱中适应3 d。适应后,选择生长状态良好的藻体作为实验材料。
1.2 实验设计光照实验因铜藻在室内培养,10℃时,虽长得不是最快,但该温度下培养的藻体色泽好、藻体健壮,因此,光照实验的温度设定为10℃。取健康藻体250 g放入水族箱中,设置光照为50、100、200、300 μmol/(m2·s),3个平行,光照周期为24 L,充气悬浮培养,每隔1 d换水1次,实验周期为15 d,结束时,藻体于80℃烘干,密封袋冷冻保存。
温度实验 设置温度为5℃、10℃、15℃、20℃、25℃,培养光照为150 μmol/(m2·s)。其余培养条件同光照组。
光照组和温度组的藻体生长 取约3 g健康铜藻放入1 L锥形瓶中,加入800 ml过滤海水,在光照培养箱培养,设置3个平行,分别在光照组和温度组进行培养,3 d换水1次并称重记录。称重时,用滤纸吸干藻体表面多余水分。
1.3 测定方法 1.3.1 铜藻比生长速率(Relative growth rate, RGR, %)的测定比生长速率的计算公式:
| $ {\rm{RGR}} = \left[ {{{\left({{W_t}/{W_0}} \right)}^{1/t}} - 1} \right] \times 100 $ |
式中,Wt为实验中期或结束时藻体鲜重(g),W0为实验开始时藻体鲜重(g),t为培养时间(d)。
1.3.2 灰分、粗脂肪、粗蛋白含量的测定灰分采用560℃煅烧法;粗脂肪采用索氏提取法;粗蛋白称取铜藻干粉1 g,精确至0.0001 g,移入250 ml干燥的定氮瓶中,加入1000 kjeltabs Cu/45一粒(4.5 g K2SO4,0.5 g CuSO4·5H2O),加入10 ml浓硫酸,定氮瓶口上放置小漏斗反应10 min,待样品变黑放置消化炉上,420℃消化2 h,待样品成透明蓝绿荧光色即消化完成,冷却片刻,放入蛋白质检测仪测定。
1.3.3 光合色素含量的测定可溶性蛋白(Soluble)采用南京建成蛋白检测试剂盒(A045-2)考马斯亮蓝法测定。准确称取待测藻体0.5 g,液氮冻存研磨,加入可溶性蛋白提取液,6000 r/min离心30 min,取上清液,定容至5 ml,采用酶标仪测定波长为595 nm处的吸光值。
可溶性多糖(Soluble sugar)采用南京建成植物可溶性糖检测试剂盒(50T)蒽酮比色法测定。取铜藻干粉0.1 g放入10 ml离心管中,加入1 ml蒸馏水,盖紧离心管盖,沸水浴10 min,冷却后,4000 r/min离心10 min,取上清液,定容至10 ml,用酶标仪测定波长为620 nm处的吸光值。
光合色素参照Wellburn(1994)的方法提取。取0.1 g藻体研磨,4℃用8 ml 80%丙酮避光浸泡24 h后,4000 r/min离心10 min,取上清液,定容至10 ml,用酶标仪在665、652、510、480 nm处测定。叶绿素a (Chl-a)和类胡萝卜素(Carotenoid, Car)的计算公式:
| $ w({\rm{Ch}}1 - a) = \left({16.29 \times {\rm{O}}{{\rm{D}}_{665\;{\rm{nm}}}} - 8.54 \times {\rm{O}}{{\rm{D}}_{652\;{\rm{nm}}}}} \right) \times V/W/1000 $ |
| $ w({\rm{Car}}) = 7.6 \times \left({{\rm{O}}{{\rm{D}}_{480\;{\rm{nm}}}} - 1.49 \times {\rm{O}}{{\rm{D}}_{510\;{\rm{nm}}}}} \right) \times V/W/1000 $ |
式中,V为浸提丙酮的体积(ml), W为藻体鲜重量(g),单位为mg/g。
1.3.4 特有成分含量的测定褐藻胶参照尚德荣等(2011)方法。准确称取1.0 g铜藻干粉于50 ml小烧杯中,加入2.0 mol/L HCl 30 ml过夜,次日用纱绢将其水洗,蒸馏水4次,双蒸水1次,直至无氯离子为止,将水洗后的样品再用0.1 mol/L醋酸钙溶液30 ml浸泡2 h,用蒸馏水洗5次,将洗下的水溶液混合混匀,用0.1 mol/L的NaOH溶液滴定,指示剂为酚酞,按照下述公式即可得到褐藻胶的含量。
| $ 褐藻胶含量\left(\% \right) = \left({C \times V \times 0.2160} \right) \times 100/m $ |
式中,C为NaOH的摩尔浓度(mol/L),V为滴定消耗的NaOH体积数(ml),0.2160为1.0 ml 0.1 mol/L NaOH标准溶液,相当于0.2160 g褐藻酸钠,m为海藻样品的重量(g)。
岩藻黄素参照闫相勇等(2014)的方法测定。准确称取1.0 g铜藻干粉,在60℃的条件下,用20 ml甲醇避光静置,浸提2次,每次1 h。取浸提液,4000 r/min,离心10 min后取上清液,转入梨形分液漏斗中,加入正己烷充分震荡混匀,静置分层,保留上清液,下层甲醇水溶液再次转入分液漏斗进行萃取,直至甲醇水溶液不再出现黄色为止。将所有上清液汇合混匀定容。在岩藻黄素特定吸收波长为450 nm下测吸光度值,并按以下公式计算岩藻黄素的含量。
| $ 岩藻黄素\left({{\rm{mg}}/{\rm{g}}} \right) = \left({{\rm{O}}{{\rm{D}}_{455\;{\rm{nm}}}} \times n \times V \times 1000} \right)/\left({A_{1{\rm{cm}}}^{1\% } \times M \times 100} \right) $ |
式中,n为稀释倍数,
褐藻多酚参照严小军等(2000)的方法测定。铜藻干粉过40目筛后,准确称取0.1~0.15 g于25 ml试管中,加入15%的乙醇3 ml浸泡24~48 h,采用微波提取法,微波辐射功率为700 MHz,微波辐射时间为10 s。6000 r/min离心10 min,取上清液,定容至3 ml,混匀后取50 μl水样置于1.5 ml Ep管中,加水稀释至700 μl,混合均匀,加入100 μl Folin-Denis试剂混匀,3 min后加入200 μl饱和碳酸钠溶液,充分混匀,3 h后用酶标仪在710 nm处测定吸光值。将1%(W/V)间苯三酚标准液稀释200倍成标准液,呈梯度将不同体积的1%间苯三酚标准液置于15 ml试管中,按照上述方式测定吸光值绘制出标准工作曲线。样品测得的吸光值代入标准工作曲线公式即可得到褐藻多酚的含量。
1.4 数据分析采用Microsoft Excel 2013软件整理数据,SPSS 13.0软件进行单因子方差分析(One way, ANOVA),P < 0.05为差异显著,数据以平均值±标准差(Mean± SD)表示。采用Origin 8.5软件制图。
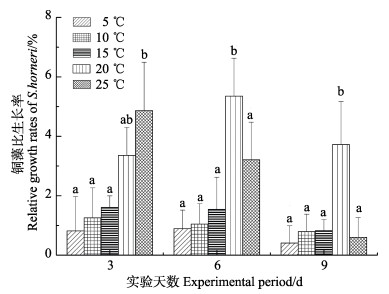
2 结果与分析 2.1 温度对铜藻生长及营养成分的影响 2.1.1 温度对铜藻生长的影响温度对铜藻生长有着重要的影响。从图 1可以看出,5℃~15℃对铜藻生长无影响,20℃时,RGR明显比5℃~15℃组高,生长迅速,25℃时0~3 d生长迅速,3~9 d时,RGR明显减少,后期铜藻出现了掉叶、腐烂、产生黏膜的现象,不适宜铜藻生长。温度对铜藻的生长有着明显的影响(P < 0.05)。由此看出,铜藻在20℃左右时生长速率更快。
|
图 1 温度对铜藻比生长速率的影响 Fig.1 Effects of different temperature on relative growth rate of S. horneri 同组中标有不同小写字母表示组间有显著性差异(P < 0.05),标有相同小写字母者表示组间无显著性差异(P > 0.05), 下同 The means with different letters being significantly different at the 0.05 probability level, and the means with the same letters within the same column are not significantly different. The same as below |
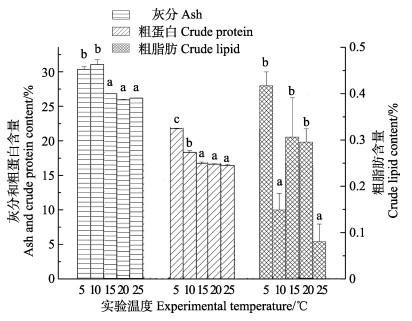
从图 2可以看出,5℃、10℃灰分含量最高,矿物质积累明显增加,温度升高时含量减少,说明10℃、15℃对灰分有明显影响(P < 0.05)。5℃时粗蛋白含量最多,为21.76%,差异显著(P < 0.05),随着温度增加,粗蛋白含量呈逐渐减少趋势,后平稳至17%左右。粗脂肪在10℃、25℃含量最少,其他温度组含量在0.3%~0.4%左右,差异显著(P < 0.05)。
|
图 2 不同温度对灰分、粗蛋白、粗脂肪含量的影响 Fig.2 Effects of different temperature on ash, crude lipid and crude protein content of S. horneri |
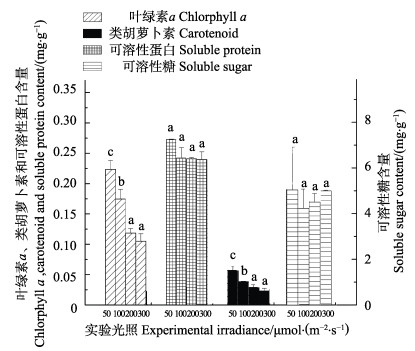
从图 3可以看出,25℃时叶绿素a含量最高,为0.248 mg/g,差异显著。类胡萝卜素同样25℃含量最高,为0.048 mg/g,差异显著。可溶性蛋白受温度影响显著(P < 0.05),20℃最小,25℃含量突增至3.283 mg/g。20℃可溶性糖含量最高,达到14.986 mg/g,其他组含量在7~9 mg/g之间,差异显著(P < 0.05)。
|
图 3 不同温度对铜藻叶绿素a、类胡萝卜素、可溶性糖、可溶性蛋白含量的影响 Fig.3 Effects of different temperature on Chl-a, carotenoid, soluble sugar and soluble protein content of S. horneri |
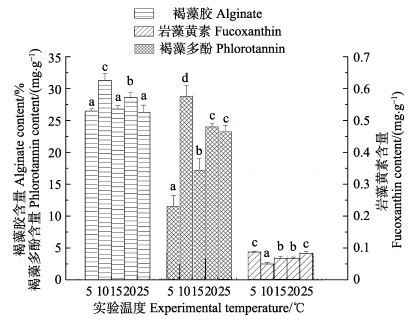
从图 4可以看出,10℃时,褐藻胶含量最多,为31.269%,5℃、15℃、25℃时,含量基本相同,与10℃相比差异显著(P < 0.05)。10℃时,岩藻黄素最高为0.558 mg/g,除了10℃时激增外,其他各组随温度呈显著增加趋势(P < 0.05)。而褐藻多酚含量在5℃时最高,为4.289 mg/g,各温度间差异显著(P < 0.05),10℃时最低,为2.416 mg/g,随着温度的上升含量逐渐增高,至25℃时,褐藻多酚含量为4.170 mg/g,与5℃时含量接近。
|
图 4 不同温度对褐藻胶、褐藻多酚、岩藻黄素含量的影响 Fig.4 Effects of different temperature on alginate, phlorotannin and fucoxanthin content of S. horneri |
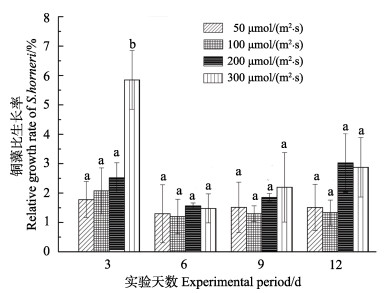
不同光照下,铜藻RGR见图 5。从图 5可以看出,光照的变化对藻体生长影响大体一致,t0~t3期间,光强为300 μmol/(m2·s)铜藻RGR最快,差异显著(P < 0.05),而其他光照组间差异不显著(P > 0.05)。t3~t12,铜藻总体生长缓慢,RGR缓慢增加。从实验各时段可以看出,铜藻适宜较高光强生活,高光在前期对铜藻生长有明显促进作用,中期在不同光照下,无显著差异(P > 0.05),之后,高光照较低光照RGR增长幅度更大。
|
图 5 不同光照对铜藻比生长速率的影响 Fig.5 Effects of different irradiance on relative growth rate of S. horneri |
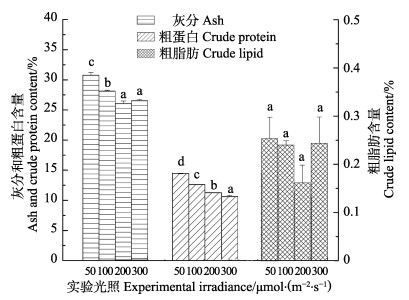
不同光照对铜藻基础组分含量的影响见图 6。从图 6可以看出,50 μmol/(m2·s)组藻体灰分含量最高,为30.767%,且差异显著,含矿物质最多,200、300 μmol/(m2·s)光照下的灰分分别为25.956%、26.481%。50 μmol/(m2·s)组粗蛋白含量最高,为14.427%,300 μmol/(m2·s)粗蛋白含量为10.527%。200 μmol/(m2·s)组粗脂肪含量最低,显著低于其他各组(P < 0.05),而其他光照组间差异不显著(P > 0.05)。
|
图 6 不同光照强度对灰分、蛋白质、脂肪含量的影响 Fig.6 Effects of different irradiance on ash crude lipid and crude protein content of S. horneri |
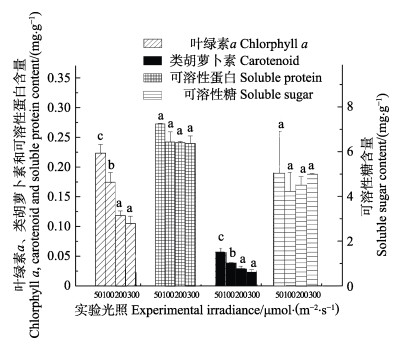
光照对铜藻光合色素含量的影响见图 7。从图 7可以看出,Chl-a含量随光照的增加而减少(P < 0.05),50 μmol/(m2·s)时Chl-a含量最高,为0.293 mg/g,逐渐减少到0.105 mg/g。类胡萝卜素与Chl-a的含量变化趋势一致,50 μmol/(m2·s)时含量最多。光照对可溶性蛋白和可溶性多糖含量没有显著影响。
|
图 7 不同光照强度对铜藻叶绿素a、类胡萝卜素、可溶性糖、可溶性蛋白含量的影响 Fig.7 Effects of different irradiance on Chl-a, carotenuid, soluble sugar and soluble protein content of S. horneri |
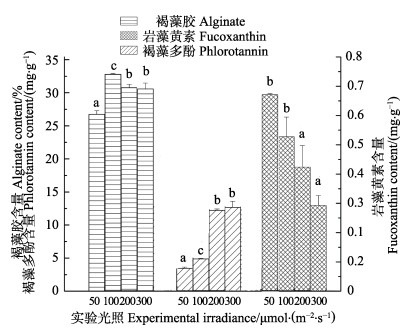
褐藻胶含量在100 μmol/(m2·s)光照时最高,为32.785%,50 μmol/(m2·s)时褐藻胶含量最低,为26.726%。岩藻黄素含量随光照增加而减少(P < 0.05),光照为50 μmol/(m2·s)时,岩藻黄素含量最高,为0.669 mg/g,300 μmol/(m2·s)含量最低。褐藻多酚含量随光照增加而增加(P < 0.05),光照为300 μmol/(m2·s)时,褐藻多酚含量最高,为12.073 mg/g,远高于光照为50 μmol/(m2·s)的3.390 mg/g (图 8)。
|
图 8 不同光照强度对褐藻胶、褐藻多酚、岩藻黄素含量的影响 Fig.8 Effects of different irradiance on alginate, phlorotannin and fucoxanthin content of S. horneri |
海藻生长对温度及光照变化敏感(Jones et al, 1984; Glenn et al, 1990)。本研究结果表明,较强光照[200~300 μmol/(m2·s)]及温度(约为20℃)有利于铜藻生长,人工养殖中可考虑适当提高光强从而增加产量。超过适宜温度(25℃)藻体出现掉叶、变深、产生黏液现象;铜藻生长随光照增加而增加,在一定温度下增加光照,铜藻可获得较快的生长速率。孙建璋等(2016)在南麂列岛进行铜藻人工栽培研究显示,水温为17~20℃、表层强光下,铜藻生长较快,与本研究结果一致。姜宏波等(2009)研究表明,适宜温度下,较高光照时,瓦氏马尾藻和鼠尾藻的生长出现停滞。产生这种原因可能是由于铜藻比瓦氏马尾藻和鼠尾藻有更高的光照需求。
3.2 铜藻组分随温度和光照的变化可溶性蛋白大多是一些酶和功能性蛋白,参与大多数的代谢反应,可溶性糖有维持藻体体内渗透势的作用,是衡量植物代谢水平的一个重要指标,二者皆影响着藻体的生命活动(Xu et al, 2006)。研究结果显示,在适宜的温度及光照下,可溶性糖及可溶性蛋白含量较高。
岩藻黄素作为捕光复合体,在光合作用的光化学系统中起着重要的作用(Bertrand, 2010)。10℃时,铜藻类内的岩藻黄素达到最高,高温及高光照不利于铜藻产生岩藻黄素。
铜藻中褐藻胶不是在生长最快速的环境条件下含量最高,铜藻在10℃、100 μmol/(m2·s)环境条件下,产生较多的褐藻胶,受温度和光照影响显著。在对鼠尾藻中褐藻胶含量随季节变化的研究发现,在鼠尾藻生长快速的6月,褐藻胶含量较高(詹冬梅等, 2018)。在室内培养时发现,稍低一些温度及光照强度下培养的铜藻,在色泽及健壮程度比生长速率最高时的铜藻要好一些。由此推测,铜藻中褐藻胶含量可能与铜藻生长速度及其藻体健壮程度都相关。
褐藻多酚是发现于褐藻且仅存于褐藻中的一族天然产物,抗氧化活性极强,是褐藻在遇到不适环境时的一种化学抵御物质(魏玉西等, 2002; Barwell et al, 1989)。本研究中,在高光为200、300 μmol/(m2·s)、低温和高温下,褐藻多酚的含量均有上升,推测原因可能是由于环境不适宜,铜藻为了保护藻体的健康生长而产生的一种防御机制。
4 结论光照强度、周期和光质等都对光合作用有着直接的影响,温度影响光合作用暗反应和呼吸作用的酶活性,这也是自然条件下,藻体体内生化组成呈季节性变化的原因(纪明侯, 1963; 王志芳等, 2008)。本研究结果显示,室内培养铜藻在20℃左右、200~300 μmol/(m2·s)环境条件下,生长速率最快,而铜藻在10℃、100 μmol/(m2·s)环境条件下,藻体色泽及健壮程度更好,各组分随温度及光照强度变化而变化。研究结果对铜藻养殖及其活性物质提取具有重要的参考价值。
Barwell CJ, Blunden G, Manandhar PD. Isolation and characterization of brown algal polyphenols as inhibitors of α-amylase, lipase and trypsin. Journal of Applied Phycology, 1989, 1(4): 319-323 DOI:10.1007/BF00003468 |
Bertrand M. Carotenoid biosynthesis in diatoms. Photosynthesis Research, 2010, 106(1-2): 89-102 DOI:10.1007/s11120-010-9589-x |
Fu GQ, Han TT, Gong XY, et al. Effect of Cu2+stress on growth and physiological biochemical characteristics of Sargassum hemiphyllum. South China Fisheries Science, 2015, 11(4): 34-39 [ 付贵权, 韩婷婷, 巩秀玉, 等. 重金属Cu2+胁迫对半叶马尾藻生长及生理生化特性的影响. 南方水产科学, 2015, 11(4): 34-39 DOI:10.3969/j.issn.2095-0780.2015.04.005] |
Glenn EP, Smith CM, Doty MS. Influence of antecedent water temperatures on standing crop of a Sargassum spp. dominated reef flat in Hawaii. Marine Biology, 1990, 105(2): 323-328 |
Hosokawa M, Miyashita T, Nishikawa S, et al. Fucoxanthin regulates adipocytokine mRNA expression in white adipose tissue of diabetic/obese KK-Aymice. Archives of Biochemistry and Biophysics, 2010, 504(1): 17-25 DOI:10.1016/j.abb.2010.05.031 |
Hu B, Song LP, Mao SQ, et al. Nutrient analysis of Sargassum horneri and its nutritional evaluation. Journal of Guangdong Ocean University, 2015a, 35(06): 100-104 [ 胡斌, 宋理平, 冒树泉, 等. 铜藻的营养成分分析与营养学评价. 广东海洋大学学报, 2015a, 35(6): 100-104] |
Hu B, Song LP, Zhang YH, et al. Nutrient analysis and nutritional evaluation of Sargassum kjellmaniamum along the coast of Rongcheng, Shandong Province. Journal of Yangtze University(Natural Science), 2015b, 12(33): 21-24 [ 胡斌, 宋理平, 张延华, 等. 荣成沿海海黍子的营养成分分析与营养学评价. 长江大学学报(自科科学), 2015b, 12(33): 21-24] |
Hu B, Wan BL, Xu P, et al. Research progress in nutrition of seaweed Sargassum. Chinese Journal of Fisherie, 2016, 29(1): 48-53 [ 胡斌, 王秉利, 许鹏, 等. 马尾藻营养成分研究进展. 水产学杂志, 2016, 29(1): 48-53 DOI:10.3969/j.issn.1005-3832.2016.01.010] |
Ji MH. Studies on the chemical composition of the Chinese econoiviic brown seaweeds Ⅱ. Seasonl variations in the main chemical components of Laminaria japonica, Sargressum pallidum and Sargassum pallidum and Sargassum kjellmanianum from the North China. Oceanology et Limnology Sinica, 1963, 5(1): 1-10 [ 纪明侯. 我国经济褐藻的化学成分研究—Ⅱ.北方产海带、海蒿子和海黍子的主要化学成分季节变化. 海洋与湖沼, 1963, 5(1): 1-10] |
Jiang HB, Tian XL, Dong SL, et al. Effects of temperature and light intensity on the growth and biochemical composition of Sargassum thunbergii. Chinese Journal of Applied Ecology, 2009, 20(1): 185-189 [ 姜宏波, 田相利, 董双林, 等. 温度和光照强度对鼠尾藻生长和生化组成的影响. 应用生态学报, 2009, 20(1): 185-189] |
Jones RI, Reynolds CS. The ecology of freshwater phytoplankton. London: Cambridge University Press, 1984
|
Liaaen-Jensen S. Chapter 1-marine carotenoids. Marine Natural Products, 1978, 1-73 |
Liu L, Heinrich M, Myers S, et al. Towards a better understanding of medicinal uses of the brown seaweed Sargassum in traditional chinese medicine: A phytochemical and pharmacological review. Journal of Ethnopharmacology, 2012, 142(3): 591-619 DOI:10.1016/j.jep.2012.05.046 |
Qin XL, Wan SB, Jiang T. Reasarch progresses in eckols of phlorotannins. Transactions of Oceanology and Limnology, 2007(S1): 176-181 [ 秦绪龙, 万升标, 江涛. Eckol类褐藻多酚的研究进展. 海洋湖沼通报, 2007(S1): 176-181] |
Shang DR, Ning JS, Zhao YF, et al. Establishment of the determination on kelp alginate. Food Science and Technology, 2011, 36(8): 252-254 [ 尚德荣, 宁劲松, 赵艳芳, 等. 海带中褐藻胶含量测定方法的建立. 食品安全与检测, 2011, 36(8): 252-254] |
Sun JZ, Zhuang DG, Yang JB, et al. Primary study on enhancement technique of Sargassum horneri around Nanji Islands. Moderm Fisheries Informtion, 2010, 25(1): 23-27 [ 孙建璋, 庄定根, 杨加波, 等. 南麂列岛铜藻增殖技术的初步研究. 现代渔业信息, 2010, 25(1): 23-27 DOI:10.3969/j.issn.1004-8340.2010.01.007] |
Wang ZF, Zhang QS, Pan JH. Seasonal variation of population structure in Sargassum thunbergii. Journal of Fishery Sciences of China, 2008, 15(6): 992-998 [ 王志芳, 张全胜, 潘金华. 烟台芦洋湾鼠尾藻种群生物量结构的季节变化. 中国水产科学, 2008, 15(6): 992-998 DOI:10.3321/j.issn:1005-8737.2008.06.013] |
Wei YX, Guo DS. Rearching progress in brown algal polyphenolics. Marine Sciences, 2002, 26(10): 18-20 [ 魏玉西, 郭道森. 褐藻中多酚化合物的研究进展. 海洋科学, 2002, 26(10): 18-20 DOI:10.3969/j.issn.1000-3096.2002.10.006] |
Wellburn AR. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution. Journal of Plant Physiology, 1994, 144(3): 307-313 DOI:10.1016/S0176-1617(11)81192-2 |
Yan XJ, Zhou TC, Lou QX, et al. Seasonal chances of content of phlorotannins. Marine Sciences, 1996, 20(5): 39-42 [ 严小军, 周天成, 娄清香, 等. 褐藻多酚含量的季节变化. 海洋科学, 1996, 20(5): 39-42] |
Yan XJ, Lou QX, Wu ZZ, et al. Determination of vicinal phenolic hydroxyl in brown algal oolyphenol. Marine Sciences, 2000, 24(12): 3-5 [ 严小军, 娄清香, 吴真真, 等. 褐藻多酚连三羟基的测定. 海洋科学, 2000, 24(12): 3-5 DOI:10.3969/j.issn.1000-3096.2000.12.002] |
Yan XY, Liu YX, Wu YP, et al. Optimizing the processes of extracting and purifying fucoxanthin from Laminaria japonica. Journal of Chinese Institute of Food Science and Technology, 2014, 14(3): 115-121 [ 闫相勇, 刘翼翔, 吴永沛, 等. 海带岩藻黄素的提取及纯化工艺研究. 中国食品学报, 2014, 14(3): 115-121] |
Yang JS, Chen JJ, Pan YY. Application of alginate biological activity and recent researeh progress. Rural Economy and Science-Technology, 2017, 28(5): 90-91 [ 杨金生, 陈晶晶, 潘玉英. 褐藻胶生物活性应用及最新研究进展. 农村经济与科技, 2017, 28(5): 90-91 DOI:10.3969/j.issn.1007-7103.2017.05.035] |
Xu RY, Niimi Y, Han DS. Changes in endogenous abscisic acid and soluble sugars levels during dormancy-release in bulbs of Lilium rubellum. Scientia Horticulturae, 2006, 111(1): 68-72 DOI:10.1016/j.scienta.2006.08.004 |
Zhan DM, Wang XY, Xin ML, et al. Nutritional constituents of three kinds of Sargassum. Journal of Guangxi Academy of Sciences, 2016, 32(3): 221-225 [ 詹冬梅, 王翔宇, 辛美丽, 等. 三种马尾藻的营养组成分析. 广西科学院学报, 2016, 32(3): 221-225] |
Zhan DM, Wu HY, Liu MX, et al. Impact of illumination on growth and biochemical composition of Sargassum muticum. Pogress in Fishery Science, 2013, 34(1): 140-144 [ 詹冬梅, 吴海一, 刘梦侠, 等. 光照强度对海黍子生长及部分生化指标的影响. 渔业科学进展, 2013, 34(1): 140-144 DOI:10.3969/j.issn.1000-7075.2013.01.021] |
Zhan DM, Lv F, Luan Q, et al. The growth's and constituent ingredinet's seasonal variations of Sargassum thunbergii on different tidal zone in Rongcheng, Shandong. Journal of Dalian Ocean University, 2018, 33(3): 295-299 [ 詹冬梅, 吕芳, 栾青, 等. 山东荣成不同潮位鼠尾藻生长及化学组分的季节性变化. 大连海洋大学学报, 2018, 33(3): 295-299] |
Zhang JW, Liu YY, Wu HL, et al. Effects of different environmental factors on growth and photosynthesis of Sargassum vachellianum. Journal of Fishery Sciences of China, 2014, 21(6): 1227-1235 [ 张建伟, 刘媛媛, 吴海龙, 等. 环境因子对瓦氏马尾藻生长及光合作用的影响. 中国水产科学, 2014, 21(6): 1227-1235] |
Zeng CK. Seaweed in China. Third Volumes, Phaeophyceae. Beijing: Science Press, 2000 [ 曾呈奎. 中国海藻志.第Ⅲ卷, 褐藻门. 北京: 科学出版社, 2000]
|
Zeng CK, Zhang JF. On the discontinuous distribution of some brown algae on the China coast. Oceanologia et Limnologia Sinica, 1959(2): 86-92 [ 曾呈奎, 张峻甫. 关于几种褐藻在中国沿岸的不连续分布. 海洋与湖沼, 1959(2): 86-92] |



