2. 中国水产科学研究院淡水渔业 研究中心 无锡 214081;
3. 中国水产科学研究院黄海水产研究所 海洋科学与技术试点国家实验室海洋生态 与环境科学功能实验室(青岛) 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 青岛 266071
2. Freshwater Fisheries Research Center of Chinese Academy of Fishery Sciences, Wuxi 214081;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao); Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Shandong Provincial Key Laboratory of Fishery Resources and Ecological Environment, Qingdao 266071
牙鲆(Paralichthys olivaceus)是亚洲沿岸分布的唯一鲆科鱼类,因其个体大、味道鲜美,是东亚各国重要的海水经济鱼类。近年来,由于沿海污染严重,加之捕捞过度,牙鲆自然资源显著减少(陈睿毅等, 2013; 童爱萍等, 2015)。我国在20世纪80年代开始进行牙鲆增殖放流研究(吴鹤洲等, 1987),但规模不大,以放流品种平均年放流量为指标统计,2004年牙鲆仅占放流鱼类总量的7%(刘莉莉, 2007),累计放流约70万尾(张秀梅等, 2009)。从2005年开始,随着政府各部门投入的增加,牙鲆增殖放流数量增大(宋娜等, 2010),目前,牙鲆已成为我国海水鱼类增殖放流的主要品种之一。但是,单纯一味追求放流数量的增长并不能一定起到很好的增殖效果,关键要进行放流策略的研究以及放流效果的评估(刘琦, 2009)。
准确有效地鉴别放流牙鲆是进行放流效果评估的前提。目前,在牙鲆放流中常用的标记手段包括生态标记、体外标记、体内标记和分子标记(于广宝等, 2016; 刘芝亮等, 2013; 徐永江等, 2017; Sekino et al, 2005; Liu et al, 2017)。其中,生态标记、耳石荧光标记存在消退问题(朱学武等, 2017),体外标记(挂牌法)适用于大规格苗种,目前,放流牙鲆的规格(体长5 cm左右)限制了体外标记的使用。分子标记需要明确所有参与繁殖亲本的遗传学信息(童爱萍, 2015),目前,我国放流实施单位多、苗种来源不明等,现阶段很难构建参与繁殖亲本群体的遗传学信息数据库(罗刚等, 2016)。因此,急需开发一种适合大规模牙鲆的群体标记方法。
耳石元素指纹标记是鱼类标记放流研究领域中的一项重要技术手段。耳石是鱼类内耳自然生物矿化沉积形成的碳酸钙结构,是鱼类形成最早的硬组织,其微结构可以用来判读鱼类的年龄等生物学信息,而沉积其中的元素信息则记录了鱼类过去生活过的环境信息(王玉堃, 2015)。水环境中的化学元素通过鱼类鳃部等组织进入血液,经过血液传输等一系列生理过程沉积在耳石生长轮上(窦硕增等, 2011),形成不同的生境元素沉积特征,即元素指纹(Elemental fingerprints)。锶(Sr)元素常被用于反演洄游性鱼类的海、淡水生境履历,进而了解并重建其资源的时空动态、产卵场位置、群体关联性等重要的渔业信息。因此,人为提高水体中Sr浓度,达到异常增加耳石中局部Sr含量、形成特殊的Sr元素指纹标记的目的。该标记技术在溯河性鱼类中研究较为广泛(Skalski et al, 2009; Schroder et al, 1995),在淡水鱼类中的应用也有报道(李秀启等, 2017),但在海水鱼标记放流中的应用尚未见报道。此外,以往的报道多为在养殖水体中直接添加Sr化合物进行标记,但缺乏通过饵料食源进行Sr标记的研究。因此,本研究拟探讨通过饵料的应用进行牙鲆耳石Sr元素指纹标记的可行性,并获取最适暴露浓度等重要参数,以期为科学进行牙鲆增殖放流效果评估、优化牙鲆增殖放流策略提供科学依据,同时,也为海水鱼类耳石微化学标记工作提供重要的基础信息和技术参考。
1 材料与方法 1.1 实验方法本实验于2016年6月24日在中国水产科学研究院北戴河中心实验站开始进行,实验鱼为80日龄、全长(6.58±0.59) cm的牙鲆幼鱼。实验鱼养殖在300 L玻璃钢圆形水槽内,每天08:00和14:00各投喂1次含氯化锶的配合饲料。实验设0、1、8、64 g/kg 4个Sr标记饲料梯度(SrCl2∙6H2O g/颗粒饲料kg),持续标记10 d。各梯度组实验鱼规格一致,数量均为400尾。标记期间,各梯度投喂量为鱼体总重的2%,实验鱼摄食完毕后立刻吸底,保证各梯度均无残饵。上午投喂结束后,换水清槽,然后加过滤海水并保持24 h流水,换水量为5个循环。标记期间记录各梯度实验鱼死亡率,标记后30 d测量记录实验鱼生长性状并采集样本,-20℃保存。各梯度组均选取2个样本进行耳石微化学分析(表 1)。
|
|
表 1 牙鲆耳石微化学分析样品信息 Tab.1 Sampling details of Japanese flounder for otolith microchemical analysis |
由于测试成本较高,各梯度组分别选取大小相对一致的2尾实验鱼采集耳石。利用剪刀、尖头镊等工具将矢耳石取出后,用清水、酒精清洗,38℃烘干。将烘干耳石样本用AB胶固定在包埋盒底座上,室温静置20 min,用环氧树脂(Epofix,丹麦Struers公司;rensin与hardener质量比7:1)包埋,38℃烘干12 h以上。用AB胶将包埋块固定在载玻片上,经2 h凝固后使用装配有金刚石磨轮的碾磨机(Discoplan-TS型,丹麦Struers公司)切割碾磨。切割后标本经初磨(500目砂轮)、精磨(1200目砂纸)打磨至耳石核心暴露,用磨抛机(LabPol-35,丹麦Struers公司)装备织布机抛光盘配合抛光液抛光,至耳石表面无明显划痕。样品放入超纯水中超声清洗5 min后,自然条件下晾干24 h,完全干燥后,使用真空镀膜机(JEE-420,日本电子株式会社)蒸镀碳膜(36 A,25 s)。为增加可比性,本实验统一使用左矢耳石进行元素指纹分析。
1.3 耳石元素指纹分析使用日本电子株式会社的JXA-8100型电子探针微区分析仪(EPMA)进行耳石Sr和Ca的微化学分析。自耳石核心沿最长径至耳石边缘的一条直线进行定量线分析(Line transect analysis)。由于耳石中Sr离子含量远小于Ca离子含量,按照国际惯例将Sr/Ca离子含量比值标准化,即统一用Sr离子含量与Ca离子含量×103的比值表示。EPMA的参数设定:加速电压为15 kV,电子束电流为2.0×10–8 A;束斑直径为2 μm,每点驻留时间15 s;以间距4 μm连续进行打点测定。标准样品使用碳酸钙(CaCO3)和钛酸锶(SrTiO3)。所有耳石线分析完后再进行面分析(Mapping analysis)。这时,EPMA加速电压和电子束电流分别为15 kV,5.0×10–7 A,束斑直径为2 μm,每点驻留时间为30 ms,像素为4×4 μm。
1.4 数据处理利用Excel 2010对定量线分析检测的Sr、Ca含量及Sr/Ca比值、测定点、耳石径等数据进行整理及处理,并对Sr/Ca比值作图。使用SPSS 19.0软件对各梯度组的不同阶段Sr/Ca比值及生长数据进行Duncan多重比较,检验各梯度组的不同阶段与对照组Sr/Ca比值及生长差异性,P < 0.05表示差异显著。
2 结果与分析 2.1 各梯度组牙鲆耳石定量线分析的Sr/Ca比值图 1为恢复养殖30 d牙鲆耳石定量线分析结果。对照组和1 g/kg梯度组均保持相对稳定的Sr/Ca值(P > 0.05),未出现Sr/Ca比值高峰,说明1 g/kg梯度组未形成明显的Sr元素指纹标记。8 g/kg和64 g/kg梯度组分别形成1~2个Sr/Ca比值波峰,Sr峰区Sr/Ca比值较对照组差异显著(P < 0.05),说明8 g/kg和64 g/kg梯度组均形成了明显的Sr元素指纹标记。进一步分析得知,8 g/kg梯度组的BDHFE-5在距离耳石核心的780 μm处开始Sr/Ca比值明显增大,904 μm处之后Sr/Ca比值趋于平稳,即BDHFE-5在距离耳石核心的780~904 μm处耳石区段形成波峰,最高峰值为10.18;BDHFE-6在距离耳石核心的780~956 μm处耳石区段形成波峰,最高峰值为10.73;64 g/kg梯度组的BDHFE-7在距离耳石核心的640~724 μm处耳石区段形成波峰,最高峰值为62.60;BDHFE-8在距离耳石核心的560~684 μm处耳石区段形成波峰,最高峰值为143.64。8 g/kg梯度组Sr峰值为正常均值倍数为2.14~2.22,64 g/kg梯度组Sr峰值为正常均值倍数上升至6.60~18.27,表明随浓度的增加,Sr元素在耳石上的沉积明显增强(表 2)。
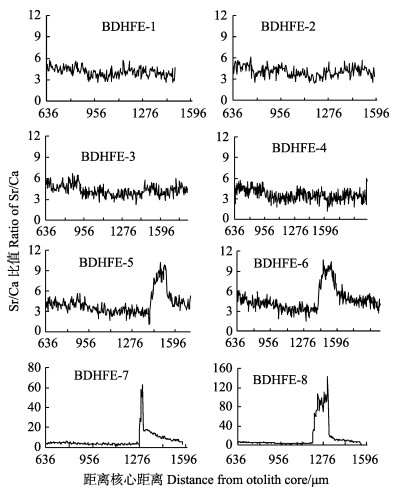
|
图 1 各梯度组牙鲆耳石定量线分析
Fig.1 Fluctuation of otolith Sr/Ca ratio along line transects from the core (0 μm) to the edge in the otoliths of Japanese flounder (P. olivaceus) from different concentration groups
|
|
|
表 2 不同浓度组牙鲆耳石Sr/Ca比值微化学变化 Tab.2 Fluctuation of Sr/Ca microchemistry in otoliths of Japanese flounder (P. olivaceus) from different concentration groups |
对标记后恢复30 d的对照组、1、8、64 g/kg梯度组Sr元素在耳石上沉积的面分布进行上机分析,结果见图 2。对照组和1 g/kg梯度组耳石上未出现“高锶环带”。8 g/kg和64 g/kg梯度组均出现了红色“高锶环带”,与耳石本底颜色对比明显。即8 g/kg和64 g/kg梯度组可对牙鲆幼鱼耳石进行明显Sr元素指纹标记。但64 g/kg梯度组“高锶环带”较8 g/kg梯度组的宽,且64 g/kg梯度组“高锶环带”外延至耳石边缘颜色较8 g/kg梯度组的黄,Sr含量较8 g/kg梯度组的高。
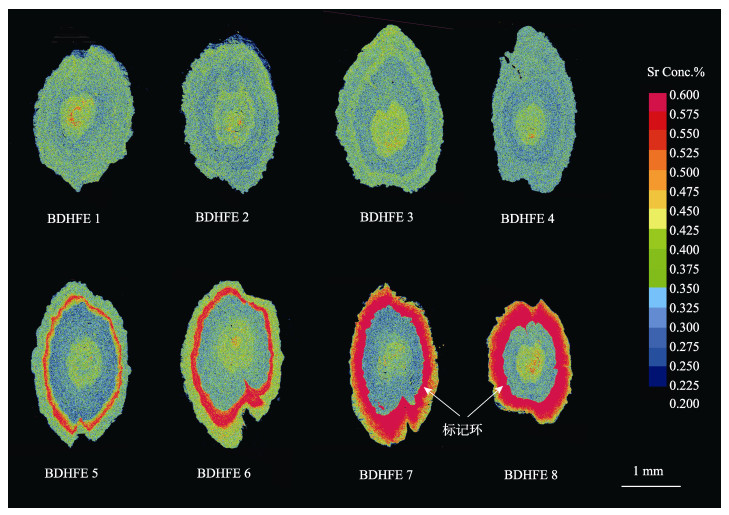
|
图 2 不同浓度组牙鲆耳石恢复30日锶沉积状况面分布
Fig.2 Sr concentration maps in otoliths of Japanese flounder (P. olivaceus) from different Sr concentration groups at 30 days after Sr marking experiments
|
由表 3可知,标记实验前各梯度组全长差异不显著(P > 0.05);恢复30 d,1和8 g/kg梯度组全长差异不显著,对照组、64 g/kg梯度组全长差异不显著,1、8 g/kg梯度组牙鲆全长显著大于对照组、64 g/kg梯度组全长差异显著(P < 0.05)。标记期间,各梯度组均未出现实验鱼死亡。
|
|
表 3 不同Sr浓度组牙鲆全长变化情况(n=30) Tab.3 Variations of total length of Japanese flounder (P. olivaceus) from different Sr concentration groups (n=30) |
耳石具有非细胞性和代谢惰性,即使在饥饿时也不会发生重吸收,沉积在耳石中的生境元素能永久性保存(熊瑛等, 2015)。因此,人为适当改变鱼类周围环境或食物中的元素含量极可能在耳石上产生元素标记,并永久保存。Judd等(1965)利用火焰发射光谱法将Sr元素检测极限降至0.1 μg/ml以下,使Sr元素作为一种标记元素成为可能。
但有报道称,随着标记鱼的生长,Sr的相对含量逐渐下降,最终造成Sr标记消失。如Yamada等(1979)对银大麻哈鱼(Oncorhynchus kisutch)进行Sr标记时发现,标记结束后,处理组Sr含量是对照组的32倍,秋季回捕时处理组是对照组的1.4倍,生长至成鱼后,处理组与对照组无法区分。Steven等(1995)也报道了此现象。其原因为原子吸收光谱法(AAS)和电感耦合等离子体质谱(ICP-MS)等检测方法只能检测均一化后的整体耳石样品。因此,随着鱼体成长,耳石上Sr标记部分所占比重越来越少,从而限制了耳石上Sr标记检出的效果。与之相比,EPMA可以精确分析耳石剖面上的不同位置的Sr含量沉积情况,从而不受标记鱼生长等限制,可避免上述局限。通过定量线分析可以准确确定标记位置及标记Sr含量的波动;通过面分布可直观测到Sr标记环宽窄、浓度的高低、标记位置等,是一种检测耳石元素指纹标记的有效方法。
耳石Sr标记可在鱼类胚胎、仔稚鱼、幼鱼及成鱼等不同阶段标记,对标记鱼死亡及生长影响很小,操作简单,劳动强度小,适合大规模标记。耳石Sr标记不受年龄、生长等影响,可通过多次标记、不同发育阶段或结合其他元素标记等方法,区分不同年份不同单位放流鱼,应用前景广阔。
3.2 不同剂量外源锶对锶标记的影响鱼类通过周围水环境或食物两种途径,将元素摄入体内,经过一系列的代谢、循环沉积到耳石上(付自东等, 2007; 王臣等, 2015; Troy et al, 2016)。因此,Sr标记可以通过浸泡和投喂两种方式完成。张辉等(2015)采用Sr含量为12 mg/L的海水标记大黄鱼(Pseudosciaena crocea) 7 d,标记出现在距离耳石核心的0.65~0.80 mm处耳石区段。王臣等(2015)研究表明,外源50~400 mg/L浓度的Sr均能在大麻哈鱼(Oncorhynchus keta)耳石上大量沉积,50~200 mg/L浓度组Sr/Ca比值极大值逐渐升高,而400 mg/L低于200 mg/L组极大值。投喂法Sr标记在溯河性鱼类和淡水鱼类中研究较多,检测对象多为鳞片、脊椎骨和鳃盖骨。Ophel等(1968)研究发现,以每400 g湿饲料中含32 g乳酸锶为标记饲料,投喂21 d,标记金鱼(Carassius auratusvar)的鳞片,含Sr量大概是对照组的10倍。Yamada等(1979)以16月龄的银大麻哈鱼为研究对象,连续投喂10000 mg/L锶标记饲料60 d后形成Sr标记,其脊椎骨Sr含量是对照组的32倍。Guillou等(1987)研究发现,全长20~23 cm溪红点鲑(Salvelinus fontinalis)摄食200~3200 μg Sr/g的标记饲料6周,Sr可对溪红点鲑鳃盖骨标记,且鳃盖骨Sr含量随标记饲料Sr含量增加而增多;同时其还发现投喂6周200 μg Sr/g含量的标记饲料,鳃盖骨Sr含量约是对照组的5倍,但投喂4周相同Sr含量的标记饲料,鳃盖骨Sr含量增长不显著。但投喂法耳石Sr标记在海水鱼类中的应用未见报道。本研究首次采用投喂法对海水鱼进行耳石Sr标记,研究发现,1 g/kg梯度组牙鲆耳石未出现Sr标记,8、64 g/kg梯度组牙鲆耳石均形成Sr标记,且64 g/kg梯度组Sr/Ca比极大值较8 g/kg梯度组大,其标记环较8 g/kg梯度组宽。由此可知,首先,通过饵料进行标记需要外源Sr达到一定剂量后才能在耳石上形成有效地标记;其次,在一定剂量范围内,Sr沉积随外源Sr剂量的增加而增强。
本研究发现,不同梯度组Sr标记位置不同,相同梯度组Sr标记数据不稳定。如8 g/kg梯度组Sr/Ca比值极大值位于距耳石核心838 μm左右,64 g/kg梯度组Sr/Ca比值极大值位于距耳石核心664 μm左右。又如,8 g/kg梯度组2个样本Sr/Ca比值极大值分别位于距耳石核心848、828 μm处等。一方面高浓度组较低浓度组可能更早的在鱼体内富集到一定浓度水平的Sr,从而较早的在耳石上反映出来,另一方面高浓度组也会导致鱼体内外源Sr浓度较高,使得其恢复时间也要长于低浓度组。
3.3 锶标记对于标记鱼生长死亡的影响稳定Sr是一种对鱼类无害的元素(Yamada, 1979),Skov等(2001)研究发现,白斑狗鱼(Esox lucius)在1500 mg/L氯化锶溶液中浸泡23 h,不影响其死亡率。张辉等(2015)研究表明,加入6 mg/L锶的标记组与对照组死亡尾数差异不显著,并指出了低浓度Sr标记大黄鱼是可行的。本研究发现,处理组和对照组均未出现死亡现象,即氯化锶对鱼类来说是安全的。因此,从标记鱼死亡率和安全角度考虑,Sr标记也是可行的。
通过对不同梯度组生长数据分析可知,在初始全长无差异的前提下,处理组投喂含Sr饲料后,生长发生了变化,虽然变化不大,但经Duncan多重比较,低剂量梯度组(1、8 g/kg组)较高剂量梯度组及对照组生长快,且差异显著(P < 0.05)。宋洪建(2013)研究发现,当Sr浓度为10 mg/L时,大麻哈鱼稚鱼的各项生长指标最高。因此,可以推断在适宜的范围内,一定剂量的Sr可促进鱼类生长。然而,宋洪建(2013)通过Sr对大麻哈鱼稚鱼的生长、存活率、肌肉抗氧化酶、ATP酶及AKP酶活性、肝脏及肾脏组织影响研究发现,随着Sr浓度的升高,Sr开始对肝组织产生一些毒副作用。Snyder等(1992)研究指出,高剂量Sr可导致虹鳟(Oncorhynchus mykiss)稚鱼眼组织白内障。因此,在实际标记工作中,建议选择低剂量Sr标记为宜。而结合本研究结果不难发现,8 g/kg的饲料标记浓度是牙鲆耳石Sr标记的较为可行且效果明显的浓度。
综上所述,以投喂标记饲料的方式对牙鲆耳石Sr标记是可行的。类似的耳石元素指纹标记应该可对拟放流鱼类苗种进行大规模标记,且一旦标记成功将不会受外界影响,并一生保存。理论上,耳石元素指纹标记成本低,标记方法简便易操作,对放流苗种损伤小。通过耳石微化学分析,可区分放流群体和野生群体,反演放流群体放流后生活史,为有效评估放流效果提供有力技术支撑。但在后续的工作中还需进一步优化标记时间,探索多次锶标记、不同元素组合标记等方法制备特有元素指纹标记,以期大规模标记不同地域、不同年份放流牙鲆,为科学评估牙鲆放流效果奠定基础,为海水鱼类标记放流提供数据支撑。
Chen RY, Wang GX, Liu HJ, et al. Difference in parental contribution to reproduction in Japanese flounder (Paralichthys olivaceus). Journal of Fishery Sciences of China, 2013, 20(4): 698-705 [ 陈睿毅, 王桂兴, 刘海金, 等. 牙鲆亲本对子代贡献率的实验研究. 中国水产科学, 2013, 20(4): 698-705] |
Dou SZ, Yokouchi K, Yu X, et al. Reconstructing migratory history of fish using otolith strontium: Calciums ratios by EPMA: A case study. Oceanologia et Limnologia Sinica, 2011, 42(4): 512-520 [ 窦硕增, 横内一樹, 于鑫, 等. 基于EPMA的耳石Sr : Ca比分析及其在鱼类生活履历反演中的应用实例研究. 海洋与湖沼, 2011, 42(4): 512-520] |
Fu ZD, Xie TM, Song ZB. Studies on elemental fingerprints in otolith of fish. Chinese Journal of Applied and Environmental Biology, 2007, 13(2): 278-283 [ 付自东, 谢天明, 宋昭彬. 鱼类耳石元素指纹研究进展. 应用与环境生物学报, 2007, 13(2): 278-283 DOI:10.3321/j.issn:1006-687X.2007.02.030] |
Guillou A, Noüe JD. Use of strontium as a nutritional marker for farm-reared brook trout. Progressive Fish-Culturist, 1987, 49: 34-39 DOI:10.1577/1548-8640(1987)49<34:UOSAAN>2.0.CO;2 |
Judd JM, Coveart AE. Flame emission spectrophotometric method for the determination of stable strontium and calcium in fish. Atomic Energy of Canada Limited, 1965, 2518: 21 |
Li XQ, Cong XR, Shi JH, et al. Feasibility analysis of releasing individuals of Aristichthys nobilis identification based on otolith Sr markers. Journal of Lake Sciences, 2017, 29(4): 914-922 [ 李秀启, 丛旭日, 师吉华, 等. 耳石锶标记在识别鳙(Aristichthys nobilis)放流个体的可行性. 湖泊科学, 2017, 29(4): 914-922] |
Liu LL. Status of marine fishery resources enhancement and release in Shandong and the primary study of SD simulation. Masterxs Thesis of Ocean University of China, 2007 [刘莉莉.山东省海洋渔业资源增殖放流的发展现状及其SD仿真的初步研究.中国海洋大学硕士研究生学位论文, 2007] http://cdmd.cnki.com.cn/Article/CDMD-10423-2008011589.htm
|
Liu Q. Japanese flounder marking techniques and juveniles released for stock enhancement. Masterxs Thesis of Ocean University of China, 2009 [刘奇.褐牙鲆标志技术与增殖放流试验研究.中国海洋大学硕士研究生学位论文, 2009] http://cdmd.cnki.com.cn/Article/CDMD-10423-2009173170.htm
|
Liu YX, Yang RQ, Liu Y, et al. Use of microsatellite DNA profiling to identify Japanese flounder, Paralichthys olivaceus of hatchery origin. Journal of the World Aquaculture Society, 2017, 48(2): 353-359 DOI:10.1111/jwas.2017.48.issue-2 |
Liu ZL, Xu YJ, Liu XZ, et al. Tagging of Japanese flounder using T-bar tags. Progress in Fishery Sciences, 2013, 34(6): 80-86 [ 刘芝亮, 徐永江, 柳学周, 等. T型标志牌标记牙鲆苗种. 渔业科学进展, 2013, 34(6): 80-86 DOI:10.3969/j.issn.1000-7075.2013.06.012] |
Luo G, Zhuang P, Zhao F, et al. Development status existing issues and countermeasure in the selection of suitable species for stock enhancement. Marine Fisheries, 2016, 38(5): 551-560 [ 罗刚, 庄平, 赵峰, 等. 我国水生生物增殖放流物种选择发展现状、存在问题及对策. 海洋渔业, 2016, 38(5): 551-560 DOI:10.3969/j.issn.1004-2490.2016.05.012] |
Ophel IL, Judd JM. Marking fish with stable strontium. Journal of the Fisheries Research Board of Canada, 1968, 25(7): 1333-1337 DOI:10.1139/f68-119 |
Schroder SL, Knudsen CM, Volk EC. Marking salmon fry with strontium chloride solutions. Canadian Journal of Fisheries and Aquatic Sciences, 1995, 52: 1141-1149 DOI:10.1139/f95-111 |
Sekino M, Saitoh K, Yamada T, et al. Genetic tagging of released Japanese flounder (Paralichthys olivaceus) based on polymorphic DNA markers. Aquaculture, 2005, 244: 49-61 DOI:10.1016/j.aquaculture.2004.11.006 |
Skalski JR, Buchanan RA, Griswold J, et al. Review of marking methods and release-recapture designs for estimating the survival of very small fish: Examples from the assessment of salmonid fry survival. Reviews in Fisheries Science, 2009, 17(3): 391-401 DOI:10.1080/10641260902752199 |
Skov C, Grønkjær P, Nielsen C. Marking pike fry otoliths with alizarin complexone and strontium: An evaluation of methods. Journal of Fish Biology, 2011, 59(3): 745-750 |
Snyder RJ, McKeown BA, Colbow K, et al. Use of dissolved strontium in scale marking of juvenile salmonids: Effects of concentration and exposure time. Canadian Journal of Fisheries and Aquatic Sciences, 1992, 49: 788-782 |
Song HJ. Allometric growth of chum salmon larvae and effects of strontium on physiological indices of their juveniles. Masterxs Thesis of Northeast Agricultural University, 2013 [宋洪建.大麻哈鱼仔鱼异速生长和锶对其稚鱼生理指标的影响.东北农业大学硕士研究生学位论文, 2013] http://cdmd.cnki.com.cn/Article/CDMD-10224-1013207684.htm
|
Song N, Gao TX, Han G. Application of molecular marker in fishery stock enhancement. Chinese Fisheries Economics, 2010, 28(3): 111-117 [ 宋娜, 高天翔, 韩刚. 分子标记在渔业资源增殖放流中的应用. 中国渔业经济, 2010, 28(3): 111-117 DOI:10.3969/j.issn.1009-590X.2010.03.020] |
Steven LS, Curtis MK, Eric CV. Marking salmon fry with strontium chloride solutions. Canadian Journal of Fisheries and Aquatic Sciences, 1995, 52: 1141-1149 DOI:10.1139/f95-111 |
Tong AP, Si F, Liu HJ, et al. Application of mtDNA and microsatellite markers to distinguish the released or non- released Japanese flounder Paralichthys olivaceus. Journal of Fishery Sciences of China, 2015, 22(4): 630-637 [ 童爱萍, 司飞, 刘海金, 等. mtDNA和微卫星标记在放流牙鲆和非放流牙鲆鉴定中的应用. 中国水产科学, 2015, 22(4): 630-637] |
Tong AP. Application of mtDNA and microsatellite markers in Japanese flounder stock enhancement. Masterxs Thesis of Shanghai Ocean University, 2015 [童爱萍. mtDNA和微卫星标记在放流牙鲆中的应用研究.上海海洋大学硕士研究生学位论文, 2015] http://cdmd.cnki.com.cn/Article/CDMD-10264-1015974956.htm
|
Troy J, Morgan HB, Thomas PQ. Can dietary reliance on Pacific salmon eggs create otolith Sr/Ca signatures that mimic anadromy in resident salmonids?. Environmental Biology of Fishes, 2016, 99: 237-247 DOI:10.1007/s10641-016-0470-4 |
Wang C, Liu W, Zhan PR, et al. Exogenous Sr2+ sedimentation on otolith of chum salmon embryos. Chinese Journal of Applied Ecology, 2015, 26(10): 3189-3194 [ 王臣, 刘伟, 战培荣, 等. 外源Sr2+在大麻哈鱼胚胎耳石上的沉积. 应用生态学报, 2015, 26(10): 3189-3194] |
Wang YK. Preliminary studies on the population ecology based on fish otolith microstructure and microchemistry. Doctoral Dissertation of Ocean University of China, 2015 [王玉堃.耳石微细结构和微化学示踪技术在鱼类种群生态学研究中的应用.中国海洋大学博士研究生学位论文, 2015] http://cdmd.cnki.com.cn/Article/CDMD-10423-1015716182.htm
|
Wu HZ, Ruan HC, Wang XC, et al. Studies on the ecological basis of resources multiplication and stocking experiment on the false halibut Paralichthys olivaceus in Jiaozhou Bay. Marine Sciences, 1987, 6: 52-53 [ 吴鹤洲, 阮洪超, 王新成, 等. 胶州湾牙鲆资源增殖的生态学基础及种苗放流实验研究. 海洋科学, 1987, 6: 52-53] |
Xiong Y, Liu HB, Tang JH, et al. Application of otolith microchemistry on reconstruction of migratory patterns and stock discrimination in marine fishes. Chinese Bulletin of Life Sciences, 2015, 27(7): 953-959 [ 熊瑛, 刘洪波, 汤建华, 等. 耳石微化学在海洋鱼类回游类型和种群识别研究中的应用. 生命科学, 2015, 27(7): 953-959] |
Xu YJ, Liu XZ, Zhang K, et al. Tagging juvenile Japanese flounder (Paralichthys olivaceus) with coded wire tags. Progress in Fishery Sciences, 2017, 2017(1): 168-174 [ 徐永江, 柳学周, 张凯, 等. 编码金属标签对牙鲆苗种标记的效果. 渔业科学进展, 2017, 2017] |
Yamada SB, Mulligan TJ, Fairchild SJ. Strontium marking of hatchery-reared coho salmon (Oncorhynchus kisutch, Walbaum). Journal of Fish Biology, 1979, 14: 267-275 DOI:10.1111/jfb.1979.14.issue-3 |
Yu GB, Li G. The technology of seed rearing of Japanese flounder based on ecology mark. China Fisheries, 2016(7): 102-105 [ 于广宝, 李刚. 牙鲆生态标记放流鱼苗培育技术. 中国水产, 2016(7): 102-105 DOI:10.3969/j.issn.1002-6681.2016.07.042] |
Zhang H, Jiang YZ, Yuan XW, et al. Strontium marking on otolith of Larimichthys crocea. Journal of Fishery Sciences of China, 2015, 22(6): 1270-1277 [ 张辉, 姜亚洲, 袁兴伟, 等. 大黄鱼耳石锶标志技术. 中国水产科学, 2015, 22(6): 1270-1277] |
Zhang XM, Wang XJ, Tu Z, et al. Current status and prospect of fisheries resource enhancement in Shandong Province. Chinese Fisheries Economics, 2009, 2(27): 51-58 [ 张秀梅, 王熙杰, 涂中, 等. 山东省渔业资源增殖放流现状与展望. 中国渔业经济, 2009, 2(27): 51-58] |
Zhu XW, Xu YJ, Liu XZ, et al. Physiological mechanisms for degeneration of blind-side hypermelanosis in pond-cultured Japanese flounder (Paralichthys olivaceus). Progress in Fishery Sciences, 2017, 38(1): 103-110 [ 朱学武, 徐永江, 柳学周, 等. 池塘养殖牙鲆(Paralichthys olivaceus)无眼侧体色黑化消褪机理. 渔业科学进展, 2017, 38(1): 103-110] |




