2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 烟台开发区天源水产有限公司 烟台 264006
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Yantai Tianyuan Aquatic Product Co., Ltd. Yantai 264006
水解鱼蛋白(Fish protein hydrolysate, FPH)是将水产品加工下脚料在一定条件下水解后获得的一种含游离氨基酸和不同肽链长度多肽的蛋白质寡肽(Liaset et al, 2008; 王新星等, 2011)。目前,国内外关于水解鱼蛋白对肉食性鱼类生长性能的影响开展了大量研究,相关的研究表明,将水解鱼蛋白以适当的比例添加至高植物蛋白饲料中,能显著提高大部分肉食性鱼类的生长和饲料利用(Espe et al, 1999; Zheng et al, 2012; 卫育良等, 2014);但对于其如何影响肌纤维的形态结构却缺乏研究。多细胞动物的基本结构包括上皮组织、结缔组织、肌肉组织和神经组织4种,其中,具有收缩能力的肌肉组织是动物生存和运动的基本保障,也是水产品主要的可食部分,而肌纤维是肌肉的基本构成单位,肌纤维横截面积和肌纤维密度是描述肌纤维组织形态结构的2个主要特征。有研究报道,在一定范围内,随着饲料中水解鱼蛋白的增加,罗非鱼的肌纤维横截面积出现显著增加的趋势(Silva et al, 2017),这表明,水解鱼蛋白对鱼类的肌纤维可能具有重要的调控作用。因此,有必要进一步开展水解鱼蛋白对肉食性鱼类肌肉纤维组织形态结构影响的研究。
作为我国北方工厂化养殖重要的肉食性海水鱼类,本团队先后开展了水解鱼蛋白对大菱鲆(Scophthalmus maximus L.)生长性能、蛋白质代谢、脂肪沉积、非特异性免疫等方面的研究工作(卫育良等, 2014; 牟玉超等, 2016; Wei et al, 2016; Xu et al, 2016; Zheng et al, 2013a),然而,水解鱼蛋白如何影响大菱鲆肌肉纤维组织形态结构仍然缺乏研究。因此,本实验以大菱鲆为研究对象,通过在饲料中添加不同水平的水解鱼蛋白,研究水解鱼蛋白对大菱鲆生长、体组成和肌纤维组织形态结构的影响,以期为水解鱼蛋白在大菱鲆配合饲料的应用进一步提供基础数据。
1 材料与方法 1.1 水解鱼蛋白的制备水解鱼蛋白的制备以太平洋狭鳕鱼(Theragra chalcogramma)为原料,参照Zheng等(2012)的方法进行制备。水解鱼蛋白的化学组成及氨基酸组成见表 1。
|
|
表 1 水解鱼蛋白的化学组成和氨基酸组成(%干物质) Tab.1 The proximate chemical composition and amino acid composition of fish protein hydrolysate (% Dry matter) |
本实验饲料配方以鱼粉、水解鱼蛋白为主要动物蛋白源,以花生粕、大豆浓缩蛋白、谷朊粉和玉米蛋白为主要植物蛋白源,以鱼油和豆油为主要脂肪源;实验设2个对照组,正对照组鱼粉为44%,负对照组鱼粉为22%,设4个实验组,PH18A组为22%的鱼粉和18%的水解鱼蛋白,PH4.5A组为22%的鱼粉和4.5%的水解鱼蛋白,PH4.5B组为17%的鱼粉和4.5%的水解鱼蛋白,PH18B组为0.5%的鱼粉和18%的水解鱼蛋白。实验饲料配方及营养组成见表 2,实验饲料的氨基酸组成见表 3。
|
|
表 2 实验饲料配方及营养组成(%干物质) Tab.2 Formulation and proximate chemical composition of experimental diets (% Dry matter) |
|
|
表 3 实验饲料的氨基酸组成(%干物质) Tab.3 The amino acid composition of experimental diets (% Dry matter) |
首先,将所有饲料原料粉碎后过80目筛网,然后,根据实验配方将原料混合均匀后制作成等氮等脂的颗粒饲料,在烘箱内50℃烘干,存放在–20℃冷库备用。
1.3 实验鱼及养殖管理本实验以初始体重为(11.98±0.03) g的大菱鲆为饲养对象,于2017年8~10月在山东烟台开发区天源水产有限公司进行为期56 d的养殖实验。实验开始前,进行为期14 d的暂养实验,使鱼体适应养殖环境,然后,对大菱鲆幼鱼饥饿24 h,选取健康有活力的大菱鲆幼鱼随机分配到18个桶中(6个处理,3个重复),每桶25尾鱼。养殖期间,每天早(07:30)晚(16:30)进行人工饱食投喂。
实验养殖条件如下:用体积为150 L的圆柱形养殖桶;采用深井海水,流速为5 L/min,连续充气,溶氧高于7 mg/L,流水养殖模式;采用自然光照,水温为13℃~16℃;盐度为32,pH为7.5~8.0。
1.4 样品采集及生化指标测定 1.4.1 样品采集实验开始时,随机取20尾健康有活力的大菱鲆,保存于–20℃,用于后续鱼体成分分析。实验结束时,禁食24 h,称取每桶鱼的总重量,记录每桶鱼的尾数,用于计算相关生长指标。然后,每桶取3尾大菱鲆,取背部相同位置的肌肉,分成2份,1份放入Davison固定液中固定保存,用于肌肉组织切片的分析,1份放入液氮中速冻,于–80℃下保存,用于肌肉氨基酸的测定。最后,每桶取5尾全鱼,于–20℃冰箱保存,用于鱼体成分分析。
1.4.2 常规及生化指标测定饲料和全鱼样品在105℃烘干至恒重,采用凯氏定氮法(VELP,UDK142 automatic distillation unit,意大利)测定粗蛋白质含量;采用索氏抽提法测定粗脂肪含量(FOSS脂肪测定仪SOXTEC 2050,瑞典),采用失重法测定灰分含量,样品在马福炉中灼烧16 h (550℃)。测定饲料、肌肉及水解鱼蛋白中氨基酸及牛磺酸组成的前处理。首先进行冷冻干燥,然后在110℃下用6 mol/L的HCl水解22~24 h;测定饲料中游离氨基酸的前处理,采用8 %的三氯乙酸溶解,涡旋3 min,超声波15 min,12000 r/min离心15 min,前处理完成后,所有氨基酸及牛磺酸均采用日立L-8900型氨基酸分析仪(Hitachi L-8900 automatic amino acid analyzer, Hitachi, 日本)测得。
1.5 样本切片制备及测量方法 1.5.1 石蜡切片的制备肌肉样本按常规H.E染色,石蜡包埋后用石蜡切片机切片,注意包埋时肌纤维长轴与蜡块切片垂直,制成横切片(厚度为6 μm)。
1.5.2 肌纤维横截面积和密度的测定本实验主要针对肌纤维横截面积和密度进行统计分析。于10×20倍镜下拍照,测其肌纤维横截面积,每个处理3个重复,每个重复选取6条肌纤维,用Photoshop软件根据标尺测定肌纤维长径(沿各个方向测定的肌纤维横截面轮廓两边界间平行线之间距离的最大值)和短径(沿各个方向测定的肌纤维横截面轮廓两边界间平行线之间距离的最小值),并根据椭圆面积计算公式(面积=0.25×π×长径×短径)计算肌肉纤维横截面积。其次,将切片于10×4倍镜下随机选取视野,每个处理3个重复,每个重复选取6个视野,拍照后用Photoshop软件根据标尺计算0.088 mm2内肌肉纤维个数,并换算成1 mm2内肌肉纤维的个数,得到肌肉纤维密度。
1.6 数据计算与统计方法成活率(Survival rate, SR, %)=100×实验结束每桶鱼尾数/实验开始每桶鱼尾数
特定生长率(Specific growth rate, SGR, %/d)= 100×[ln(终末体重)–ln(初始体重)]/实验天数
摄食率(Feed intake, FI, %/d)=100×每尾鱼摄食的饲料干物质重/[(实验结束时鱼体重+实验开始时鱼体重)/2×养殖实验天数]
饲料效率(Feed efficiency, FE)=(终末体重–初始体重)/每尾鱼摄食的饲料干物质重
增重率(Weight gain rate, WGR, %)=100×(终末体重–初始体重)/初始体重
蛋白质效率(Protein efficiency ratio, PER)=(终末体重–初始体重)/蛋白摄入量
蛋白沉积率(Protein productive value, PPV, %)= 100×[(实验终鱼体蛋白含量–实验初鱼体蛋白含量)/蛋白摄入量]
所有实验数据均用平均值±标准误(Mean±SE)表示,数据采用SPSS 17.0进行单因素方差分析(One-way ANOVA),差异显著(P < 0.05)后,进行Tukey多重比较(Tukey’s multiple comparison tests)。
2 实验结果 2.1 水解鱼蛋白对大菱鲆生长性能及饲料利用的影响不同饲料处理对大菱鲆生长及饲料利用的影响见表 4。6个处理组的存活率均无显著差异(P > 0.05)。与正对照组相比,除PH18A组的特定生长率显著高于正对照组外(P < 0.05),PH4.5A组、PH4.5B组和PH18B组显著低于正对照组(P < 0.05),饲料效率、蛋白质沉积率和蛋白质效率变化趋势与特定生长率相似;摄食率除PH18A组和PH18B组与正对照组无显著差异外(P > 0.05),PH4.5A组和PH4.5B组的摄食率显著高于正对照组(P < 0.05)。与负对照组相比,PH4.5A组、PH4.5B组、PH18A组和PH18B组的特定生长率显著高于负对照组(P < 0.05);饲料效率、蛋白质效率和蛋白质沉积率的变化趋势与特定生长率相似;摄食率在PH4.5B组显著高于负对照组(P < 0.05),PH4.5A组的摄食率与负对照组无显著差异(P > 0.05),PH18A组和PH18B组的摄食率均显著低于负对照组(P < 0.05)。
|
|
表 4 水解鱼蛋白对大菱鲆生长和饲料利用的影响(平均值±标准误) Tab.4 The effects of fish protein hydrolysate on the growth and feed utilization of turbot (Mean±SE) |
不同饲料处理对大菱鲆体组成的影响见表 5。与正对照组相比,除PH4.5B组的粗蛋白含量显著低于正对照组外(P < 0.05),PH4.5A组、PH18A组和PH18B组的粗蛋白与正对照组无显著差异(P > 0.05),粗脂肪变化趋势与粗蛋白相同;除PH18A组和PH18B组的水分含量与正对照组无显著差异外(P > 0.05),PH4.5B组和PH4.5A组的水分含量显著高于正对照组(P < 0.05),灰分含量变化趋势与水分相似。与负对照组相比,除PH4.5B组和负对照组的粗蛋白差异不显著外(P > 0.05),PH4.5A组、PH18A组和PH18B组的粗蛋白显著高于负对照组(P < 0.05);除PH18A组的粗脂肪显著高于负对照组外(P < 0.05),PH4.5A组、PH4.5B组和PH18B组的粗脂肪含量与负对照组无显著差异(P > 0.05);除PH4.5A组、PH4.5B组的水分和负对照组无显著外(P > 0.05),PH18A组和PH18B组的水分含量显著低于负对照组(P < 0.05),灰分含量变化趋势与水分相似。
|
|
表 5 水解鱼蛋白对大菱鲆体成分的影响(平均值±标准误) Tab.5 The effects of fish protein hydrolysate on body composition of turbot (Mean±SE) |
水解鱼蛋白对大菱鲆肌肉氨基酸组成的影响见表 6。6个处理组之间总氨基酸含量无显著差异(P > 0.05);必需氨基酸总量也无显著差异(P > 0.05),但精氨酸在PH4.5A组的含量显著高于PH18A组、PH18B组、正对照组和负对照组(P < 0.05)。非必需氨基酸总量也无显著差异(P > 0.05),但牛磺酸在PH18B组的含量显著低于PH4.5B组和负对照组(P < 0.05),丙氨酸在PH4.5A组的含量显著低于PH4.5B组、PH18A组、PH18B组、正对照组和负对照组(P < 0.05),半胱氨酸在PH4.5A组、PH4.5B组、PH18A组、正对照组和负对照组的含量均存在显著差异(P < 0.05),由高到低依次为正对照组、PH4.5A组、PH18A组、负对照组和PH4.5B组。
|
|
表 6 水解鱼蛋白对大菱鲆肌肉氨基酸组成的影响(平均值±标准误) (‰干物质) Tab.6 The effects of fish protein hydrolysate on amino acid composition of turbot muscle (Mean±SE) (‰ Dry matter) |
水解鱼蛋白对大菱鲆肌纤维组织形态结构的影响见表 7。不同处理组10×4倍及10×20倍光学显微镜下大菱鲆肌纤维横截面切片视野见图 1。对于大菱鲆肌肉纤维长径和短径,PH18A组的肌纤维长径显著高于PH4.5B组(P < 0.05),6个处理组的肌纤维短径无显著差异(P > 0.05)。对于大菱鲆肌肉纤维的横截面积,PH18A组显著高于PH18B组、正对照组、PH4.5A组、负对照组和PH4.5B组(P < 0.05),而PH18B组显著高于PH4.5B组(P < 0.05),与正对照组、PH4.5A组、负对照组无显著差异(P > 0.05)。对于大菱鲆肌肉纤维密度,PH4.5B组显著高于PH18A组和PH18B组(P < 0.05),但与正对照组、负对照组和PH4.5A组无显著差异(P > 0.05)。
|
|
表 7 水解鱼蛋白对大菱鲆肌纤维组织形态结构的影响(平均值±标准误) Tab.7 The effects of fish protein hydrolysate on morphological structure of muscle fiber of turbot(Mean±SE) |
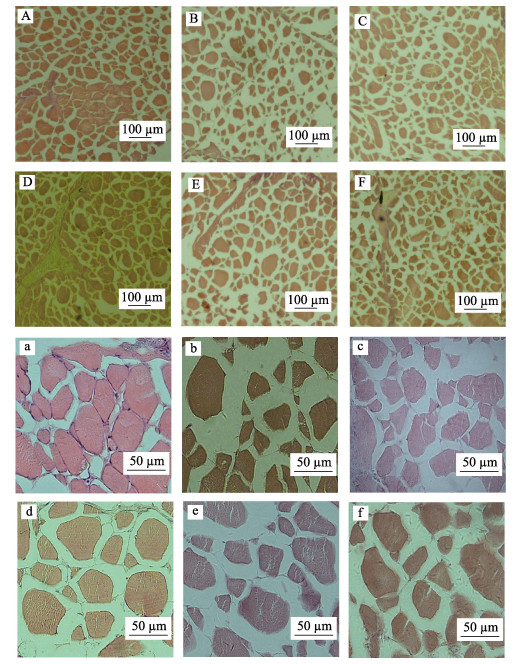
|
图 1 光学显微镜下大菱鲆肌纤维横截面示例图
Fig.1 Cross section of turbot muscle fibers under an optical microscope
A:正对照组(10×4);B:PH4.5A组(10×4);C:PH4.5B组(10×4);D:PH18A组(10×4);E:PH18B组(10×4);F:负对照组(10×4) a:正对照组(10×20);b:PH4.5A组(10×20);c:PH4.5B组(10×20);d:PH18A组(10×20);e:PH18B组(10×20);f:负对照组(10×20) A: Positive control group(10×4); B: PH4.5A group(10×4); C: PH4.5B group(10×4); D: PH18A group(10×4); E: PH18B group(10×4); F: Negative control group(10×4) a: Positive control group(10×20); b: PH4.5A group(10×20); c: PH4.5B group(10×20); d: PH18A group(10×20); e: PH18B group(10×20); f: Negative control group(10×20) |
在之前水解鱼蛋白影响大菱鲆生长性能的研究上发现,低水平水解鱼蛋白替代鱼粉,有利于大菱鲆生长,而高水平替代则显著抑制大菱鲆生长(Wei et al, 2016; Xu et al, 2016)。但是,在随后本团队尚未发表的研究中发现,饲料鱼粉水平相同的情况下,添加18%的水解鱼蛋白,与不添加和4.5%的水解鱼蛋白添加组相比,生长和饲料利用显著提高。然而,该研究是在饲料中鱼粉水平相同情况下进行的,增加饲料中水解鱼蛋白的水平相比对照组,相当于用水解鱼蛋白替代了饲料中的混合植物蛋白,因而,生长和饲料利用的提高可以认为主要是大菱鲆对水解鱼蛋白的利用优于混合植物蛋白,而不一定是高水平水解鱼蛋白促进了大菱鲆的生长。因此,为进一步研究水解鱼蛋白对大菱鲆生长的作用规律,本实验设计了鱼粉相同条件下,设计4.5%和18%的水解鱼蛋白添加入饲料中及4.5%和18%水解鱼蛋白替代相同蛋白的鱼粉2种情况开展研究。结果显示,在鱼粉含量相同(22%鱼粉)的条件下,将添加4.5%的水解鱼蛋白的PH4.5A组、18%水解鱼蛋白的PH18A组和未添加水解鱼蛋白的负对照组大菱鲆的生长及饲料利用进行对比,3组的生长和饲料利用依次为PH18A组 > PH4.5A组 > 负对照组且均产生显著差异,这与本团队尚未发表的在相同鱼粉条件下,添加水解鱼蛋白对大菱鲆生长的研究结果相似。在水解鱼蛋白替代等蛋白的鱼粉时,即在鱼粉为22%的负对照组中,用4.5%和18%的水解鱼蛋白分别替代5%和21.5%的等蛋白鱼粉PH4.5B组和PH18B组,将这2组的生长结果及饲料利用与负对照组进行对比,结果显示,PH4.5B组和PH18B组的生长和饲料利用相比负对照组均显著提高。同样,在鱼粉为44%的正对照组中,用水解鱼蛋白替代22%的鱼粉PH18A组,也有相似的结果,这进一步表明18%和4.5%的水解鱼蛋白对大菱鲆的生长、饲料利用可能均具有显著促进作用。此外,本实验中水解鱼蛋白的添加量18%虽然已经超过之前认为的12%高水平水解鱼蛋白组的抑制大菱鲆生长的添加量,但是却没有发现对大菱鲆生长和饲料利用有明显的抑制作用。这一结果不但与之前在大菱鲆上的研究结果相反(Wei et al, 2016; Xu et al, 2016),而且也与在牙鲆(Paralichthys olivaceus) (Zheng et al, 2012; Zheng et al, 2013b; 许团辉等, 2012)、大西洋鳕鱼(Gadus morhua)(Aksnes et al, 2006a; Bakke et al, 2010)、虹鳟(Oncorhynchus mykiss) (Aksnes et al, 2006b)、大西洋鲑(Salmo salar) (Espe et al, 2012; Hevrøy et al, 2005; Refstieet al, 2004; Kousoulaki et al, 2009)、军曹鱼(Rachycentron canadum) (Mach et al, 2011)等肉食性鱼类上的研究结果相反。高水平水解鱼蛋白之所以会显著抑制鱼类的生长,其主要原因是水解鱼蛋白中含有大量的游离氨基酸,这些游离氨基酸在肠道的吸收利用上与完整蛋白不同步,这样导致大量的氨基酸被用于分解提供能量,而不是用于蛋白质合成,从而降低了肉食性鱼类对含高水平水解鱼蛋白饲料中蛋白质的吸收和利用(Espe et al, 1999; Hevrøy et al, 2005)。但是,对于大菱鲆,Peres等(2005)报道,饲料中添加13.8%的晶体氨基酸,相比无添加的鱼粉组,大菱鲆的生长和饲料利用均无显著差异,这表明大菱鲆可以耐受较高的晶体氨基酸。而Wei等(2016)在对比添加晶体氨基酸和高水平水解鱼蛋白的生长结果后猜测,高水平水解鱼蛋白抑制大菱鲆生长的原因,可能并不主要是因为水解鱼蛋白中含有高比例的游离氨基酸。因此,由于本实验所用水解鱼蛋白的制作方法与之前的完全一致(Xu et al, 2016),而本实验出现18%的水解鱼蛋白仍促进鱼类的生长,一方面可能是大菱鲆本身对水解鱼蛋白中的晶体氨基酸具有较强的适应能力;另一方面,2次实验所用的大菱鲆可能因为来源不同,存在品种的差异,而18%的水解鱼蛋白可能仍然是本实验所用大菱鲆的适宜含量,而不会产生抑制作用。因此,接下来需要再次通过更高水平的水解鱼蛋白验证这一假设。
3.2 水解鱼蛋白对大菱鲆体组成及肌肉氨基酸组成的影响鱼类在食物不充足的条件下,为维持生命活动,不同程度消耗脂肪、糖原和蛋白质3类贮能物质,而多数鱼类优先消耗糖原和脂肪,其次消耗蛋白质(Stirling, 1976; Kutty, 1978),随着鱼体大量消耗贮能物质,水分的相对含量增加(Love, 1970)。由大菱鲆体成分相关数据表分析可知,对比PH18B组、PH4.5B组与负对照组,粗蛋白和粗脂肪的变化趋势由高到低为PH18B组、PH4.5B组与负对照组,水解鱼蛋白提高了大菱鲆体内粗脂肪和粗蛋白的含量,促进了大菱鲆的生长。对比正对照组与PH18A组鱼体组成数据,在低植物蛋白饲料中,18%的水解鱼蛋白促进大菱鲆的生长,却未改变大菱鲆体成分,这表明18%的水解鱼蛋白和22%的鱼粉不但对大菱鲆生长产生的相似的作用效果,而且不影响鱼体的营养组成。
本实验在对肌肉18种氨基酸分析发现,必需氨基酸中除精氨酸,非必需氨基酸中除牛磺酸、丙氨酸、半胱氨酸有显著差异外,其他氨基酸成分、总氨基酸、必需氨基酸总量均无显著差异,这与卫育良等(2014)的研究结果相似。这说明本实验中的饲料由于采用复合植物蛋白源,大部分的必需氨基酸含量可能已经能满足大菱鲆对饲料中必需氨基酸的需要, 因而在添加水解鱼蛋白的处理组并未引起鱼体大部分氨基酸含量的显著变化(卫育良等, 2014)。
3.3 水解鱼蛋白对大菱鲆肌纤维组织形态结构的影响肌肉是动物的基本结构组织,肌肉根据其结构不同,可以分为心肌、平滑肌和横纹肌,大菱鲆作为一种经济鱼类,具有很高的食用价值,因此,其横纹肌的肌纤维成为本次实验的研究重点。肌纤维横截面积是描述肌肉组织形态结构的重要参数,营养状况和运动量对肌纤维横截面积的大小有重要影响(Johnston et al, 2000a、2000b、2003)。大菱鲆作为底栖冷水性生物,运动量较少,因此,在本实验中,饲料营养组成成为影响其肌肉纤维横截面积的一个主要因素。大菱鲆的肌纤维呈椭圆或多边形等不规则形状,本实验以肌纤维形状最多的椭圆形为标准,计算其横截面积。结果显示,添加18%水解鱼蛋白的PH18B组和PH18A组的肌纤维横截面积比PH4.5B组、PH4.5A组、正对照组、负对照组明显增大,说明18%水解鱼蛋白在促进大菱鲆生长的同时,也促进了肌纤维增粗;添加4.5%水解鱼蛋白PH4.5B组和PH4.5A的肌纤维横截面积与不添加水解与蛋白的负对照组的肌纤维横截面积无显著差异,说明在高植物蛋白饲料中,4.5%水解鱼蛋白对大菱鲆肌肉的肌纤维横截面积无显著影响。
畜禽动物出生的最初阶段,其肌纤维增生过程占据其主导地位,即其肌纤维总数量在后期生长发育过程中变化不大(de Almeida et al, 2010),然而,在鱼类上,Silva等(2017)在对罗非鱼的研究中认为,营养素等因素会影响鱼类整个生长过程中的肌纤维增生机制,进而影响肌纤维总数量。在无其他外界条件影响下,动物出生后肌肉体积的增加主要是由于已经存在的肌纤维体积的增大,随着肌纤维的增粗,肌肉间结缔组织与脂肪组织的增加,肌纤维密度下降,即随着机体体重的增加,肌纤维横截面积增大,肌纤维密度降低(Macintosch et al, 2006; 秦召等, 2006; Johnston et al, 2000a、2000b、2003)。研究表明,鱼体的生长与肌纤维横截面积成正比例关系,与肌纤维密度成反比例关系(Johnston et al, 2000a、2000b、2003)。在本实验中,添加18%水解鱼蛋白的PH18B组和PH18A组的肌纤维密度比PH4.5B组、PH4.5A组、正对照组和负对照组明显降低,说明18%水解鱼蛋白在促进大菱鲆生长的同时,降低了肌纤维密度。而添加4.5%水解鱼蛋白PH4.5B组和PH4.5A的肌纤维密度与不添加水解鱼蛋白的负对照组的肌纤维横密度无显著差异,说明在高植物蛋白饲料中,4.5%水解鱼蛋白具对肌肉的肌纤维密度也无显著影响。
4 结论在高植物蛋白饲料中添加18%和4.5%的水解鱼蛋白,均可以提高大菱鲆的饲料效率和蛋白沉积率,促进其生长,且18%的水解鱼蛋白优于4.5%;18%的水解鱼蛋白促进了大菱鲆肌肉纤维横截面积增加,降低了大菱鲆的肌肉纤维密度,而4.5%的水解鱼蛋白在高植物蛋白饲料中,对大菱鲆肌纤维横截面积和肌纤维密度均无显著的影响。
Aksnes A, Hope B, Høstmark Ø, et al. Inclusion of size fractionated fish hydrolysate in high plant protein diets for Atlantic cod, Gadus morhua. Aquaculture, 2006a, 261(3): 1102-1110 DOI:10.1016/j.aquaculture.2006.07.038 |
Aksnes A, Hope B, Jönsson E, et al. Size-fractionated fish hydrolysate as feed ingredient for rainbow trout (Oncorhynchus mykiss) fed high plant protein diets. Ⅰ: Growth, growth regulation and feed utilization. Aquaculture, 2006b, 261(1): 305-317 DOI:10.1016/j.aquaculture.2006.07.025 |
de Almeida FLA, Pessotti NS, Pinhal D, et al. Quantitative expression of myogenic regulatory factors MyoD and myogenin in pacu (Piaractus mesopotamicus) skeletal muscle during growth. Micron, 2010, 41(8): 997-1004 DOI:10.1016/j.micron.2010.06.012 |
Bakke S, Jordal AEO, Gomez-Requeni P, et al. Dietary protein hydrolysates and free amino acids affect the spatial expression of peptide transporter PepT1 in the digestive tract of Atlantic cod (Gadus morhua). Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology, 2010, 156(1): 48-55 DOI:10.1016/j.cbpb.2010.02.002 |
Espe M, Sveier H, Hogoy I, et al. Nutrient absorption and growth of Atlantic salmon (Salmo salar L.) fed fish protein concentrate. Aquaculture, 1999, 174(1-2): 119-137 DOI:10.1016/S0044-8486(98)00502-X |
Espe M, Ruohonen K, El-Mowafi A. Hydrolysed fish protein concentrate (FPC) reduces viscera mass in Atlantic salmon (Salmo salar) fed plant-protein-based diets. Aquaculture Nutrition, 2012, 18(6): 599-609 DOI:10.1111/j.1365-2095.2012.00944.x |
Hevrøy EM, Espe M, Waagbø R, et al. Nutrient utilization in Atlantic salmon (Salmo salarL.) fed increased levels of fish protein hydrolysate during a period of fast growth. Aquaculture Nutrition, 2005, 11(4): 301-313 DOI:10.1111/j.1365-2095.2005.00357.x |
Johnston IA, Alderson R, Sandham C, et al. Patterns of muscle growth in early and latematuring populations of Atlantic salmon (Salmo salar L.). Aquaculture, 2000a, 189(3-4): 307-333 DOI:10.1016/S0044-8486(00)00372-0 |
Johnston IA, Alderson R, Sandham C, et al. . Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon (Salmo salar L.). Aquaculture, 2000b, 189(3-4): 335-349 DOI:10.1016/S0044-8486(00)00373-2 |
Johnston IA, Manthri S, Alderson R, et al. Freshwater environment affects growth rate and muscle fibre recruitment in seawater stages of Atlantic salmon (Salmo salar L.). Journal of Experimental Biology, 2003, 206(8): 1337-1351 DOI:10.1242/jeb.00262 |
Kousoulaki K, Albrektsen S, Langmyhr E, et al. The water soluble fraction in fish meal (stickwater) stimulates growth in Atlantic salmon (Salmo salar L.) given high plant protein diets. Aquaculture, 2009, 289(1-2): 74-83 DOI:10.1016/j.aquaculture.2008.12.034 |
Kutty MN. Ammonia quotient in sockeye salmon (Oncorhynchus nerka). Journal of the Fisheries Research Board of Canada, 1978, 35(7): 1003-1005 DOI:10.1139/f78-162 |
Liaset B, Espe M. Nutritional composition of soluble and insoluble fractions obtained by enzymatic hydrolysis of fish-raw materials. Process Biochemistry, 2008, 43(1): 42-48 DOI:10.1016/j.procbio.2007.10.007 |
Love M. The chemical biology of fishes. Quarterly Review of Biology, 1970 |
Mach DTN, Nortvedt R. Free amino acid distribution in plasma and liver of juvenile cabia (Rachycentron canadum) fed increased levels of lizardfish silage. Aquaculture Nutrition, 2011, 17(2): 644-656 DOI:10.1111/j.1365-2095.2010.00814.x |
Macintosch R, Gardiner F, Mccomas J. Skeletal muscle: Form and function. Champaign: Human Kinetics, 2006 |
Mu YC, Liang MQ, Zheng KK, et al. Effects of small molecule weight fish protein hydrolysate in high plant protein diets on the expression of liver IGF-Ⅰ receptor and the growth of juvenile turbot (Scophthalmus maximus L.).. Progress in Fishery Sciences, 2016, 37(3): 50-57 [牟玉超, 梁萌青, 郑珂珂, 等. 高植物蛋白饲料中不同水平低分子水解鱼蛋白对大菱鲆(Scophthalmus maximus L.)幼鱼生长及肝脏IGF-Ⅰ受体表达的影响. 渔业科学进展, 2016, 37(3): 50-57] |
Peres H, Oliva-Teles A. The effect of dietary protein replacement by crystalline amino acid on growth and nitrogen utilization of turbot Scophthalmus maximus juveniles. Aquaculture, 2005, 250(3-4): 755-764 DOI:10.1016/j.aquaculture.2005.04.046 |
Qin Z, Kang XT, Li GX. Relationship between histological characteristics of muscle fiber and meat quality. Journal of Anhui Agricultural Sciences, 2006, 34(22): 5872-5873, 5878 [秦召, 康相涛, 李国喜. 肌纤维组织学特性与肌肉品质的关系. 安徽农业科学, 2006, 34(22): 5872-5873, 5878 DOI:10.3969/j.issn.0517-6611.2006.22.054] |
Refstie S, Olli JJ, Standal H. Feed intake, growth, and protein utilization by post-smolt Atlantic salmon (Salmo salar) in response to graded levels of fish protein hydrolysate in the diet. Aquaculture, 2004, 239(1-4): 331-349 DOI:10.1016/j.aquaculture.2004.06.015 |
Silva TCD, Rocha JDAM, Moreira P, et al. Fish protein hydrolysate in diets for Nile tilapia post-larvae. Pesquisa Agropecuária Brasileira, , 2017, 52(7): 485-492 DOI:10.1590/s0100-204x2017000700002 |
Stirling HP. Effects of experimental feeding and starvation on the proximate composition of the European bass Dicentrarchus labrax. Marine Biology, 1976, 34(1): 85-91 DOI:10.1007/BF00390791 |
Wang XX, Kong FH, Xu TH, et al. Evaluation on the nutritional composition of fish protein hydrolysate. Progress in Fishery Sciences, 2011, 32(3): 104-110 [王新星, 孔凡华, 许团辉, 等. 水解鱼蛋白营养组成及评价. 渔业科学进展, 2011, 32(3): 104-110 DOI:10.3969/j.issn.1000-7075.2011.03.016] |
Wei YL, Liang MQ, Mu YC, et al. The effect of ultrafiltered fish protein hydrolysate level on growth performance, protein digestibility and mRNA expression of PepT1 in juvenile turbot (Scophthalmus maximus L.).. Aquaculture Nutrition, 2016, 22: 1006-1017 DOI:10.1111/anu.12319 |
Wei YL, Liang MQ, Zheng KK, et al. The effects of fish protein hydrolysate on the digestibility of juvenile turbot (Scophthalmus maximus L.). Acta Hydrobiologica Sinica, 2014, 38(5): 910-920 [卫育良, 梁萌青, 郑珂珂, 等. 水解鱼蛋白对大菱鲆幼鱼消化率的影响. 水生生物学报, 2014, 38(5): 910-920] |
Xu HG, Mu YC, Zhang Y, et al. Graded levels of fish protein hydrolysate in high plant diets for turbot (Scophthalmus maximus): Effects on growth performance and lipid accumulation. Aquaculture, 2016, 454: 140-147 DOI:10.1016/j.aquaculture.2015.12.006 |
Xu TH, Gao XP, Liang MQ, et al. Effects of small size-fractionated fish protein hydrolysate substitution of fish meal in high plant protein diets on the growth performance and non-specific immunity of Japanese flounder, Paralichthys olivaceus. Progress in Fishery Sciences, 2012, 33(3): 60-69 [许团辉, 高湘萍, 梁萌青, 等. 高植物蛋白饲料中以低分子水解蛋白替代鱼粉对牙鲆生长性能及非特异性免疫的影响. 渔业科学进展, 2012, 33(3): 60-69 DOI:10.3969/j.issn.1000-7075.2012.03.009] |
Zheng KK, Liang MQ, Yao HB, et al. Effect of dietary fish protein hydrolysate on growth, feed utilization and IGF-Ⅰ levels of Japanese flounder (Paralichthys olivaceus). Aquaculture Nutrition, 2012, 18(3): 297-303 DOI:10.1111/j.1365-2095.2011.00896.x |
Zheng KK, Liang MQ, Yao HB, et al. Effect of size-fractionated fish protein hydrolysate on growth and feed utilization of turbot (Scophthalmus maximus L.). Aquaculture Research, 2013a, 44(6): 895-902 DOI:10.1111/j.1365-2109.2012.03094.x |
Zheng KK, Xu TH, Qian CS, et al. Effect of low molecular weight fish protein hydrolysate on growth performance and IGF-Ⅰ expression in Japanese flounder (Paralichthys olivaceus) fed high plant protein diets. Aquaculture Nutrition, 2013b, 20(4): 372-380 |



