烹调对于获得可口和安全的肉制品是必不可少的,而加热是一种广泛应用于肉制品加工的传统工艺。深受人们喜爱的畜禽类瘦肉及鱼类肌肉本质上属于骨骼肌,骨骼肌中的蛋白质为动物肌肉形成物理结构、提供酶和受体(Coultate, 2001)。肉类蛋白约占肌肉重量的20%,是构成肉制品结构的主要成分。蛋白质在热处理过程中会经历结构修饰,例如氧化、降解、变性和聚集等一系列改变。肉蛋白在加热时经历实质性的结构变化,因此,肉制品的质构在热处理后会发生急剧变化,最终影响作为商品的质量与价值。虽然超高压、超声、脉冲电场技术等有助于嫩化畜禽类肉制品,杀灭肉中微生物的新技术层出不穷,但热处理在现阶段仍作为肉制品熟化和杀菌的唯一手段。研究不同手段热处理方式对不同肉蛋白的结构影响仍具有十分重要的现实意义。作者综述了肌肉类蛋白结构、不同种类肉蛋白在烹饪过程中的结构变化,以及由此引起的肉制品质量变化等内容,为各种肉类产品制定更科学的加工工艺,为更合理的运用加热方法以及加热时肉质调控的研究提供理论依据。
1 肌肉蛋白的组成和结构肌肉由75%的水、20%的蛋白质、3%的脂肪和2%的可溶性非蛋白质物质组成。在2%可溶性非蛋白质中,金属和维生素占3%,非蛋白含氮物质占45%,碳水化合物占34%,无机化合物占18%。肌肉蛋白质主要可以分为以下3类:肌原纤维、肌浆和结缔组织蛋白。肌原纤维蛋白占总蛋白含量的50%~55%(Lanier, 1986),肌浆蛋白约占30%~34%,其余10%~15%的蛋白质是结缔组织。
1.1 肌原纤维蛋白肌原纤维蛋白是肌肉的最重要成分,对肉的品质和应用有重要影响,比如肌原纤维蛋白通常能够形成凝胶网络并由于截留水分而增加持水能力。肌肉97%的持水能力由肌原纤维蛋白质的存在所决定(Amiri et al, 2018)。肌原纤维蛋白结构见图 1,它可进一步分为3个亚类:直接参与肌肉收缩的蛋白,调节肌肉收缩的蛋白以及细胞骨架蛋白(Kong et al, 2007)。肌球蛋白和肌动蛋白是主要的肌丝纤维蛋白,通过有序装配,构成肌原纤维结构。调节蛋白包括原肌球蛋白(Tropomyosin)、肌钙蛋白复合体(Troponin)、α-肌动蛋白素(α-Actinin)、C蛋白(C-protein)、M线蛋白(M-line proteins)、H蛋白(H-proteins)、X蛋白(X-proteins)。细胞骨架蛋白有伴肌球蛋白(Titin)、伴肌动蛋白(Nebulin)、肌间线蛋白(Desmin),还伴随着一些次级的多肽,例如细丝蛋白(Filamin)和Zeugmatin蛋白等,这一类蛋白对肌肉收缩起到调节和稳定的作用。
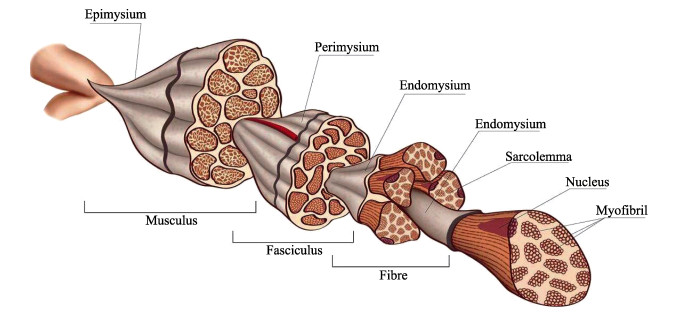
|
图 1 肌原纤维结构(包含肌内膜、肌束膜和肌外膜) (https://www.vcg.com/creative/812600076) Fig.1 The structural build-up of the myofibrillar (including endomysium, perimysium and epimysium) (https://www.vcg.com/creative/812600076) |
肌肉通常含有约20%的含氮化合物,可溶于肌肉肌浆,种类繁多,分子量范围从100 Da到100000 Da不等(Haard et al, 1994),呈球形或柱形蛋白,等电点大部分在中性和碱性范围。主要有肌红蛋白和参与肌肉收缩功能反应的酶蛋白,例如糖酵解酶系、三羧酸循环及脂肪酸β-氧化酶系、氧化磷酸化酶系、与电子传递体相关的酶系等。现已证明,肌浆蛋白变性对肌肉质地参数如色泽和保水性等有显著影响(Joo et al, 1999; Sayd et al, 2006)。肌浆网与钙调节蛋白协同作用实现骨骼肌中钙储存、释放和再摄取的过程平衡(Rossi et al, 2006)。胶原蛋白是一种糖蛋白,占结缔组织干物质含量的55%~95%,由约7112 cm长、直径36~38 cm、分子量30万的原胶原单体组成。肌内膜是分隔单个肌纤维的薄结缔组织层,也是形成结缔组织结构的初始单位。肌束膜则包裹肌内膜束,形成肌纤维束,亦属于结缔组织层。纤维束有初级束和次级束之分,分别由初级和次级肌束膜将它们分开。肌外膜即整个肌肉周围的表层,它不仅将单个肌纤维束结合到位,还将肌肉组结合在一起。肌内膜是由胶原原纤维网络组成的鞘构成,肌束膜由呈规则波浪状图案的胶原纤维(胶原原纤维成束)构成,肌外膜由多层胶原纤维组成的厚片构成(Nishimura et al, 2002)。胶原蛋白分Ⅰ型、Ⅱ型、Ⅲ型、Ⅴ型和Ⅺ型(Gelse et al, 2003)。肌内膜、肌束膜和肌外膜主要是Ⅰ型和Ⅲ型,连接肌内膜纤维网状层和肌肉细胞膜基底膜的主要Ⅳ型(Listrat et al, 1999)。丝状胶原蛋白Ⅴ型在哺乳动物物种中属于次要成分,但是在鱼类肌肉中含量较为丰富(Sato et al, 1998)。
1.3 结缔组织蛋白肌肉结缔组织由细胞和细胞外基质即结缔组织组成(Nishimura, 2010)。结缔组织的主要成分是胶原蛋白,对肉的嫩度影响至关重要。结缔组织中还含有少量的弹性蛋白,网状蛋白和蛋白多糖(Bendall, 1967)。
1.4 肌节结构肌纤维占总肌肉体积的75%~92%,由长线状结构的肌原纤维构成,其中肌节是最小的收缩单位,也是横纹肌产生力的基本机制,其结构见图 2。肌节在肌肉生长和生理周期过程中不断更新,具有特征性的条纹外观,在光显微镜下可观察到精准对齐、交替的明带(I带)和暗带(A带)。A带的中心区域称为H带,其中心是M线。肌球蛋白在A带中组成粗肌丝,肌动蛋白单体聚集被组装成跨越I带并与A带中粗纹重叠的细肌丝。肌节的侧边界称Z线,细肌丝被锚定在此处。

|
图 2 肌节、粗丝和细丝组建结构(Tornberg, 2005) Fig.2 The structural build-up of the sarcomere, the thin and thick filaments (Tornberg, 2005) |
肌球蛋白分子量约为520 kDa,由6条多肽链组成。其中,有2条220 kDa重链,2对20 kDa左右的轻链,通常分为头和杆2个功能单元,重链的氨基末端和2对轻链形成球形的头部,杆由2条重链α螺旋弯曲构成。粗肌丝由250~300个肌球蛋白分子和一些其他相关蛋白形成。每个肌球蛋白分子的尾部朝向M线集合成束,构成粗肌丝的主干;球状的头侧由粗肌丝的主干向四周伸出形成横桥。当肌肉安静时,横桥的头部与主干方向垂直,并与肌纤维蛋白相对应。
单体的肌动蛋白是由一条多肽链构成的球形分子,又称球状肌动蛋白(G-actin),由球状肌动蛋白纵向聚合形成纤维状肌动蛋白(F-actin) (Asghar et al, 1980)。在低离子强度的溶液中,肌动蛋白以单体球状存在。当离子强度提高时,单体聚合成直径为70 的双扭螺旋纤维结构,成为细肌丝的主体。原肌球蛋白呈首尾相连长杆状,2条肽链以双螺旋形式绕在肌动蛋白构成的双螺旋沟壁上,同时肌钙蛋白复合体也紧贴在细肌丝上,可调节肌肉收缩的作用、参与肌节的装配(Ferrante et al, 2011)。
2 肉类蛋白的热变性行为蛋白质发生构象变化的温度被称为变性温度。在许多有关肉类生物化学和研究热处理对产品质量和特性的影响的文献中,变性温度被认为是肉类特性快速变化的关键点。经过热处理的肉类蛋白质变性后,蛋白质链之间会发生强烈反应,即蛋白质—蛋白质相互作用,紧接着导致蛋白质聚集(凝结或凝胶化)。目前可以通过一系列机械、化学和微观结构测量的方法来研究蛋白热变性过程中的变性温度、形成凝胶能力和类型。
差示扫描量热法(DSC)是目前国内外研究肉中蛋白质变性温度范围的主要方法。它是研究蛋白质稳定的热力学和动力学有力工具,通过相变温度,焓热,效能等反应蛋白变性程度(易薇等, 2004)。DSC可以原位分析复杂蛋白质混合物或者单个蛋白而不溶解肌肉组织,已被广泛用于研究牛肉、猪肉和鱼肉等肌肉蛋白质的热性质(Ishiwatari et al, 2013; Johnson 2013; Thorarinsdottir et al, 2002)。蛋白质二级结构的变化可通过圆二色谱(CD)和拉曼光谱测定。跟踪蛋白质展开的另一种方法是测量蛋白质的表面疏水性,常使用荧光探针8-苯胺基-1-萘磺酸盐(ANS)技术和疏水相互作用层析法技术(Huang et al, 2004)。而溴酚蓝(BPB)可与蛋白质疏水位点结合这一特性的发现,一定程度上避免了肌原纤维大部分天然结构遭破坏,降低了溶解过程中蛋白质降解的风险(Chelh et al, 2006)。近年来,傅立叶红外光谱(FTIR)等振动光谱学方法可快速、无损的跟踪肉类蛋白质的二次、三次结构变化和水合力(Perisic et al, 2013)。Böcker等(2006)采用FTIR显微光谱分析,肌纤维在膨胀和收缩过程中三级结构的变化可能与肌球蛋白分子二级结构的变化直接相关。作为一种无损技术,质子核磁共振(NMR)弛豫术提供了关于蛋白质中的水质子和可交换质子之间相互作用的直接信息,从而可以了解肌肉中水的理化状态(Bertram et al, 2004b)。在肉类烹调过程中连续进行的1H NMR T2弛豫测量可揭示不同温度下所含水的若干性质变化,反映肌球蛋白变性和肌肉纤维的纵向收缩(Bertram et al, 2004a)。
2.1 肌浆蛋白根据Hamm(1977)的报道,大多数肌浆蛋白在40℃~ 60℃之间聚集。Davey等(1974)发现,牛颈部肌肉肌浆蛋白的热聚集迟滞到90℃。他们还首次提出肌浆蛋白可能在熟肉的稠度中起作用,加热使得热诱导聚集的肌浆蛋白在肌肉的结构成分之间形成凝胶,从而将它们连接在一起。另外,低温长时间加热,肌浆蛋白中的一些酶可以对牛肉具有嫩化作用。Laakkonen等(1970)等发现,在烹饪温度低于60℃时,胶原酶可以在肉中保持活性,而在更快的加热或高于70℃~80℃时,胶原酶失活。他们的研究还表明,剪切力的显著降低至少需要6 h的加热方可实现,亦即方能达到嫩化效果。Tian等(2016)也发现牛肉嫩度与肌浆蛋白强度有一定的联系,强度低则嫩度较好。在鱼糜制品加工领域,因肌浆蛋白中含有诸多易于导致蛋白降解的酶类和影响鱼糜制品白度的色素类物质,通常需要将其通过漂洗工艺进行去除。
2.2 肌原纤维蛋白肌原纤维蛋白在溶液中的变性通常会导致凝胶形成,特别是肌球蛋白,它以0.5%(w/w)的极低浓度即可形成凝胶(Hermansson et al, 1988),而肌浆蛋白需要达到约3%(w/w)才能变成凝胶。如果在溶液中存在肌动蛋白,则所获得的凝胶会更牢固(Yasui et al, 1980)。离子强度和pH是影响凝胶强度的重要因素,改变溶液离子强度和pH值,会干扰离子间的静电作用,并决定肌球蛋白以单体形式还是以细丝形式存在。当离子摩尔浓度在0.47~0.68范围内,肌球蛋白单从粗丝结构中分离出来,从而分散在溶液中(Yamamoto et al, 1988)。在离子强度较大或中性pH条件下,以单体形式分散的肌球蛋白分子形成的凝胶具有大孔的粗网络。在较低的离子强度下,肌球蛋白分子组装成细丝状,类似于肌肉中的天然粗丝(Sun et al, 2011)。在加热过程中形成更牢固的凝胶,特别是细丝越长,所形成的凝胶网络越均匀,且内部孔径越小(Sharp et al, 1992)。Ishioroshi等(1983)发现,在pH 6.0时,肌球蛋白热诱导形成的凝胶的硬度在0.4~1.0 mol/L KCl范围内保持恒定水平,但在0.4 mol/L KCl以下硬度增加,在0.2 mol/L KCl达到最大值,并在0.2 mol/L KCl之下降低。他的发现印证了凝胶强度取决于肌球蛋白分子的状态,丝状肌球蛋白比单体肌球蛋白形成更坚硬的凝胶。
肌球蛋白的凝胶形成分两步进行,加热至30℃~ 50℃,肌球蛋白球状头部的聚集即会发生,也是凝胶发生的第一步,第二步发生需在50℃以上。Sharp等(1992)发现,在30℃加热30 min后,肌球蛋白分子的外观没有改变;35℃加热后,其他类型的新结构开始形成,例如通过头部二聚化聚集成二量体;加热至40℃后,天然肌球蛋白分子几乎全部消失,仅剩具有聚集的头部单体;加热到50℃,肌原纤维单独的尾部已难以区分;在50℃~60℃温度下,形成更大的球状聚集体,肌球蛋白尾部螺旋结构变化、疏水基团相互作用、凝胶网络成形。
关于加热时肌球蛋白二级结构的变化,Morita等(1991)发现,pH为6.0和0.6 mol/L KCl时,LMM的α-螺旋含量在约30℃开始降低,并在70℃达到最小值;温度加热到65℃表面疏水性逐渐增加,而在较高温度下再次降低。Yuan等(2017)发现温度从50℃加热到90℃,鳙鱼肌球蛋白的α-螺旋和肌球蛋白簇的直径分别单调减少和增加。在50℃下加热的肌球蛋白倾向于通过头部连接形成小的、开放的簇,其尾部向外伸展,而在90℃下通过肌球蛋白头部和尾部共同形成较大且封闭的簇,所以在50℃时形成的肌球蛋白凝胶网络更加一致和均匀。富含α螺旋结构的肌球蛋白尾部在40℃以下,不参与凝胶的形成(King et al, 1995)。加热到40℃,肌球蛋白尾部被破坏,α-螺旋的含量下降,氨基酸暴露于表面并参与凝胶的形成。40℃~60℃范围内,β-折叠急剧增加,从约0%增加到约15%,无规则卷曲的含量主要在40℃~80℃之间增加。随着温度的升高,肌球蛋白的持水性、硬度、β-折叠和无规则卷曲均增加,而α-螺旋则减少。由此可知,肌球蛋白结构性质的变化决定了其在热致凝胶化过程中的功能性质(Chan et al, 1992; Liu et al, 2008),α-螺旋的损失与β-折叠的形成同时发生,α-螺旋结构的丧失可能导致巯基、疏水基等活性基团的暴露,导致温度诱导的化学交联,形成三维保水凝胶网络。
肌肉蛋白中发现典型的DSC热转变曲线由3个主要转变区组成,3个峰高分别对应肌球蛋白及其亚基,肌浆蛋白及胶原蛋白和肌动蛋白。根据文献,鸡胸肌的肌球蛋白及其亚基典型转变温度为49℃~57℃,肌浆蛋白的转变温度为61℃~67℃,肌动蛋白的转变温度为76℃~79℃(Rahbari et al, 2018)。猪背长肌肌球蛋白变性温度在53℃~58℃,肌浆蛋白结缔、肌动球蛋白和结缔组织蛋白的变性温度在61℃~68℃,肌动蛋白在75℃~83℃变性(Mitra et al, 2017)。牛上脑肌肉的肌球蛋白变性温度是55℃,胶原蛋白变性温度是65℃,肌动蛋白变性温度大约在75℃(孙红霞等, 2018)。阿拉斯加鳕鱼鱼糜中肌原纤维蛋白DSC图谱表现出4个吸热转变,前3个峰(36.4℃, 47.9℃和52.7℃)与肌球蛋白变性有关,第4个峰(66.2℃)与肌动蛋白变性有关(Lee et al, 2016)。
2.3 结缔组织蛋白在53℃~63℃时胶原变性,可能首先涉及氢键的断裂,使原纤维结构松弛,然后胶原分子收缩(Martens et al, 1982)。如果不受限制,胶原纤维在加热至60℃~70℃之间时,收缩至其静止长度的1/4。如果随后胶原纤维耐热分子间键不够稳定,则胶原纤维在进一步加热时会溶解并形成明胶(Light et al, 1985)。在年幼动物中,肌外膜主要含有热不稳定的交联,肌束膜是热不稳定和稳定交联的混合物,肌内膜含有热稳定交联。随着动物年龄的增长,热不稳定交联越来越多地转化为热稳定的交联。更高水平的热稳定交联导致烹饪期间结缔组织中有更大的张力(Lawrie, 1989)。胶原蛋白的热转变是渐进的,并且在变性过程中,结晶和无定形区域共存。在烹饪过程中发生的胶原纤维和原纤维的收缩可以人为地分为2个阶段。首先是胶原纤维不受肌肉纤维或肌肉纤维束限制而收缩,为自由收缩;胶原纤维和原纤维表面的波纹度越高,收缩幅度越大。然后,胶原纤维和原纤维在肌肉纤维和肌肉纤维束上施加压力,胶原纤维的热收缩受到肌肉纤维的限制。
Wu等(1985)利用扫描电子显微镜观察了加热至60℃和80℃,1 h后引起的牛胸骨下颌的肌外膜、肌束膜和肌内膜的结构变化。肌外膜在烹饪后没有显示出大的变化,而肌束膜胶原和肌内膜胶原在60℃时变成颗粒状并在80℃开始胶凝。对于不同类型胶原的增溶作用也存在差异,其中Ⅰ型胶原在加热时比Ⅲ型胶原更容易溶解(Burson et al, 1986)。水产来源的肌肉中以结缔组织为主的肌基质蛋白含量普遍低于畜禽类,因而更容易被消化吸收。
3 烹调后肉及肉制品的结构与品质变化肉类的重要质地品质包括诸如脂肪和水分的保持、外观和肉制品的食用质量等因素。食用质量的概念又包括质构、多汁性等。除了从胴体上切割下的较完整肉块外,作者还将介绍汉堡肉饼,乳化香肠等肉制品的变化。肉类种类繁多,纵观国内外的研究,牛肉、猪肉、鸡肉、鸭肉的肌肉组织形态以及随加热条件的变化程度有很多共同点,亦存在明显差别(刘茹等, 2012)。鱼的横纹肌与高等脊椎动物类似,由三大部分组成,即收缩蛋白、结缔组织和脂类。鱼类肌肉与高等脊椎动物肌肉最显著的区别是多种鱼纤维类型将鱼肉分隔成多层。在大多数鱼类中,高糖酵解和厌氧型的白色纤维占所有肌肉的90%~95%。红色肌肉纤维通常被限制在沿着侧线的窄区域上,并且构成不到10%的肌肉组织。红肌中肌红蛋白较多,收缩缓慢,有持久性,相反,白肌收缩迅速易疲劳。中间或粉红色纤维处于红色和白色肌肉纤维之间的中间位置,在功能等其他方面也介于红肌和白肌之间。与高等脊椎动物不同的是,大多数鱼类的生长贯穿于整个生命,肌肉的生长是肌肉细胞数目的增加与现有纤维尺寸增加的综合作用结果(Anders et al, 2006)。另外,鱼肉与高等脊椎动物的蛋白组成、含量也存在很大的差异。刘茹等(2012)发现,鱼肉的盐溶性蛋白高于猪肉,而水溶性蛋白、不溶性蛋白和脂肪含量均低于猪肉。凝胶电泳结果显示,56 kD和48 kD 2条蛋白带差异显著。再如,鱼肉肌球蛋白无论是对热还是冷环境的稳定性均很差。
另一方面即加热方法的不同。湿热烹调方法有炖煮和水煮等,表面传热系数高的热水或冷凝蒸汽能有效地将热量传递到肉表面(Hanson, 2004)。相比之下,在烤炉炙烤或烘烤等干热烹饪中,热量从火焰、烤炉或其他热源传递到肉表面,从而在肉产品内部产生温度梯度,导致内部温度升高、水分损失、蛋白质变性、肉纤维收缩,并且特殊的分解产物和褐变反应会导致肉类形成独特的外观。传统上,食物温度的增加通过传导,对流和辐射传热来实现。近年来,红外辐射、微波和无线电波等非传统加热方式在肉类热处理中的应用亦不断增加(Półtorak et al, 2015)。
3.1 微观结构变化未经粉碎处理的完整肉加热后胶原组织变性融化,肌肉细胞破裂,随后会引起明显的显微组织收缩,第1相主要发生在大约50℃~60℃,收缩横向于纤维轴,第2相主要发生在70℃~100℃,主要平行于纤维轴;肌节长度随着加热温度的升高而显著减小(Palka et al, 1999)。干热烹调导致肌肉纵向和横向收缩率(17.4%和13.4%)高于湿热加热组的收缩率(12.2%和5.9%) (Chumngoen et al, 2018)。鉴于肌节长度变化与烹饪损失成反比,故采用肌节长度表现烹饪损失较为客观(Ovissipour et al, 2017; Kong et al, 2008)。
作为鱼类肌肉蛋白深加工制品,鱼糜及其制品加工原理与加工技术一直是国内外研究者关注的研究热点。鱼糜制品加工即充分利用鱼类蛋白受热结构变化的原理进行的。鱼类肌肉中盐溶性蛋白加盐擂溃蛋白大分子展开,40℃温度以下,蛋白质分子间的二硫键慢慢形成,在疏水作用力、氢键、离子键等的共同作用下后形成溶胶,随后在90℃以上温度作用下,蛋白质大分子包裹水分,形成紧致有序的立体网状结构,从而形成具有特殊口感的弹性凝胶。且这种凝胶形成能力通常都要高于畜禽类肌肉。
不同于鱼糜制品,汉堡肉饼及乳化香肠等产品的制造过程通常将肉切碎成细肉匀浆,肉块粉碎后拌以盐与调味料,随后加热,大幅改变了肌肉系统的结构。复杂的肉系统不仅包括溶解的蛋白质,还包括肉纤维、结缔组织和脂肪等不溶性成分,这些组分的量和状态对胶凝性能均有较大影响。与乳化香肠相比,汉堡肉整体纤维和纤维碎片的出现率更高,其含量高达50%~70%,导致受热后收缩更大。乳化香肠中,因肌肉彻底粉碎搅拌因而肌原纤维蛋白被抽提出,在加热时产生密集的蛋白质网络—凝胶,通过毛细管作用力可有效地保持水分。
3.2 持水性在加热和烹饪过程中,水从肌肉结构中流失,蛋白质逐渐变得坚硬。加热较长时间后,一些蛋白质(如肌浆和胶原蛋白)将凝胶化并可继续保持水分,烹调后肌肉的水合作用与味道、嫩度、颜色和多汁性密切相关。
未经粉碎处理的完整肉中大部分水分保持在肌原纤维内(±80%),主要在粗丝和细丝之间的空间中。肉类结构中水分分布的宏观变化必然源于这种间距的变化,从而降低肉的保水性。在45℃至75℃~80℃的温度范围内,随着温度的增加,蒸煮损失百分比增加,超过80℃,烹饪损失百分比逐渐减少。并且,在50℃~65℃,蒸煮损失的增幅最大(van der Sman, 2007),其对应于肌肉细胞体积发生最大变化的温度范围,正如上述已提及的Sharp等(1992)所说,纤维轴的横向收缩主要发生在40℃~60℃时,因为在此温度范围内,纤维与其周围内膜之间的间隙(在宰后僵直期就已经存在)被扩大,此时宏观得以表现。在60℃~70℃时,结缔组织网络和肌纤维纵向协同收缩,收缩程度随温度升高而增加。这种收缩导致在烹饪中大量水分损失,水分是由被收缩的结缔组织施加在细胞外空隙中的压力排出。
汉堡肉同完整肉的损失趋势类似,在60℃~80℃的温度范围内,水分损失的增加最大(Tornberg, 2005)。这可能是由于汉堡肉中整纤维和纤维碎片发生更严重的收缩。虽然多数研究者都认为胶原蛋白是加热时导致肉收缩和水分转移的重要因素,但关于胶原蛋白在烹调过程中对肌肉收缩和液体排出有何具体作用,尚存在一定争议。如上所述,核磁共振显示,大部分水分保持在肌纤维中,汉堡肉烹饪过程中的水分损失与完整肉相似(Purslow et al, 2016),结缔组织结构在绞碎中被破坏,亦可说明胶原蛋白在蒸煮损失的形成中并未产生作用。
3.3 质构国际标准组织(ISO)将食物质地定义为“通过机械、触觉以及视、听感受器可感知的食物产品的所有流变和结构(几何和表面)属性”。质地较之风味更影响消费者的食物偏好。
目前关于加热温度对肉嫩度的影响在兔肉、牛肉、猪肉和鱼肉等不同品种上都有相关报道,其总体变化趋势一致,随着加热温度的上升,剪切力值主要在2个阶段发生明显变化:原料肉在加热温度为50℃~ 65℃时剪切力值出现明显下降,继续加热,在65℃~ 80℃阶段的剪切力上升最为显著,大于80℃后剪切力基本保持稳定。由于所取肉的种类和部位的不同,还存在加热初期(45℃~50℃)剪切力持续上升的情况。对热加工过程中肉剪切力2个阶段的上升早期主要有2种不同的解释:一种理论认为第一个阶段(50℃之前)剪切力的上升主要是由于肌肉结缔组织的变性和热收缩,第二个阶段(65℃~80℃)的上升主要归因于肉中肌原纤维蛋白的变性;另一种理论认为第一个阶段的上升主要是由于肌原纤维蛋白的变化,第二个阶段是因为结缔组织的变性。这种差异可能是因为肉的种类和部位的不同而造成(孙红霞等, 2018)。
未经粉碎处理的完整肉,肉韧性的最初提高可能是由于结缔组织的热收缩,而肉韧性的第二次提高可能是由于肌原纤维蛋白的热变性(Li et al, 2013; Wattanachant et al, 2005)。据Christensen等(2000)的报道,在加热至50℃时,由于卷曲的胶原纤维变直,使得一定横截面中胶原纤维的浓度增加,随后增加了承载能力,从而增加了韧性。在60℃以上的最终熟制温度下,肌动蛋白和肌浆蛋白的热变性增加了肌纤维的断裂强度,导致肉韧性的第二次提高。Kong等(2007)对三文鱼加热处理中品质变化做了相关研究,其剪切力随温度的变化可分成4个阶段:(1)快速增韧,剪切力从原始肌肉增加到第一个峰值;(2)快速嫩化,剪切力从第一个峰值下降到最小值;(3)缓韧,剪切力又增加到第二峰值;(4)缓慢嫩化,随着加热时间的延长,肌肉逐渐变软。
对于韧性只增加一次的情况,例如草鱼肉块经70℃热处理后硬度值达到最高,此时肌肉组织收缩紧密。但构成肌基质的胶原蛋白持续受高温影响,会部分溶解成明胶而导致鱼肉软化,故硬度不再升高(陈惠等, 2017)。此外,与较高的温度相比,30 h以上的低温加热减少了烹饪损失,获得多汁但鲜嫩的肉,结缔组织弱化和较低程度的肌原纤维改变可以解释低温长时的嫩化作用(Becker et al, 2015)。因此,在温度和时间这2个参数之间找到平衡很重要。
纤维的空间排列对于肉的质地极其重要,因为碎肉结构不再是各向异性,是或多或少崩解的肌纤维网络,纤维束随机分布在肉糜中,而裂缝优先穿过肌原纤维块。在材料中传播到裂纹断裂应力远小于穿过肉纤维所需的应力,结缔组织的收缩,水的大量损失有助于形成更致密的产品,这些结构变化导致碎肉在整个温度范围内硬度增加。
4 总结加热处理除了熟化作用以保证口感外,更重要的是杀灭腐败微生物,从而延长肉的保质期。通常肉内部温度达到65℃~75℃时大多数微生物可被杀死,在121℃高温下肉中的微生物几乎全部被杀死,即使存在极少数微生物也不致引起肉的腐败变质。但温度升高的同时,持水性、质构等品质向不理想的方向发展。不仅增加生产成本,过高的温度还会导致肉制品口感和营养品质的下降。深入探索肌浆蛋白、肌原纤维蛋白和结缔组织蛋白在加热条件下的变化机制及其对肉制品品质变化的具体影响过程,能够更科学的为各种水产、禽肉来源的肉类产品制定加工工艺,为更合理的运用加热方法以及加热时肉质调控的研究提供理论依据。
由于存在不同物种和不同部位肉的差异,肌浆蛋白、肌原纤维蛋白和胶原纤维蛋白在加热过程中结构变化大不相同,还需对各种肉类和肉制品状态进行详尽的分类,综合其文献信息。目前,针对热处理对单种肉蛋白或肉整体的影响研究较多,有关热处理过程中温度、时间等因素对肉所含各种蛋白之间的相互影响研究尚不充分。再者,随着冷杀菌技术的不断发展,超高压技术和超声技术广泛应用到肉加工产业中。压力已经被证明影响肉蛋白变性、溶解、聚集和凝胶化的过程(Sun et al, 2011; Sikes et al, 2009),超声辅助可以嫩化肉的质地(Chang et al, 2015),故越来越多的研究者着眼于新技术,但是热处理作为传统且工厂生产的唯一主要手段,研究者们还需在新型热处理方式,冷杀菌辅助热处理对肉制品的理化层面影响进行深入研究。
Amiri A, Sharifian P, Soltanizadeh N. Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins. International Journal of Biological Macromolecules, 2018, 111: 139-147 DOI:10.1016/j.ijbiomac.2017.12.167 |
Anders K, Marit B, Ruohonen K. Muscle fibre growth and quality in fish. Archiv Fur Tierzucht, 2006, 49: 137-146 |
Asghar A, Pearson AM. Influence of ante- and postmortem treatments upon muscle composition and meat quality. Advances in Food Research, 1980, 26: 53-213 DOI:10.1016/S0065-2628(08)60318-3 |
Becker A, Boulaaba A, Pingen S, et al. Low temperature, long time treatment of porcine M. longissimus thoracis et lumborum in a combi steamer under commercial conditions. Meat Science, 2015, 110: 230-235 DOI:10.1016/j.meatsci.2015.07.024 |
Bendall JR. The elastin content of various muscles of beef animals. Journal of the Science of Food and Agriculture, 1967, 18(12): 553-558 DOI:10.1002/jsfa.2740181201 |
Bertram HC, Engelsen SB, Busk H, et al. Water properties during cooking of pork studied by low-field NMR relaxation: Effects of curing and the RN--gene. Meat Science, 2004a, 66(2): 437-446 DOI:10.1016/S0309-1740(03)00132-3 |
Bertram HC, Ersen HJ. Applications of NMR in meat science. Annual Reports on NMR Spectroscopy, 2004b, 53: 157-202 DOI:10.1016/S0066-4103(04)53003-X |
Böcker U, Ofstad R, Bertram HC, et al. Salt-induced changes in pork myofibrillar tissue investigated by FT-IR microspectroscopy and light microscopy. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6733-6740 DOI:10.1021/jf060178q |
Burson DE, Hunt MC. Heat-induced changes in the proportion of types Ⅰ and Ⅲ collagen in bovine Longissimus dorsi. Meat Science, 1986, 17(2): 153-160 DOI:10.1016/0309-1740(86)90061-6 |
Chan JK, Gill TA, Paulson AT. The dynamics of thermal denaturation of fish myosins. Food Research International, 1992, 25(2): 117-123 DOI:10.1016/0963-9969(92)90152-U |
Chang HJ, Wang Q, Tang CH, et al. Effects of ultrasound treatment on connective tissue collagen and meat quality of beef semitendinosus muscle. Journal of Food Quality, 2015, 38(4): 256-267 DOI:10.1111/jfq.12141 |
Chelh I, Gatellier P, Sante-Lhoutellier V. Technical note: A simplified procedure for myofibril hydrophobicity determination. Meat Science, 2006, 74(4): 681-683 DOI:10.1016/j.meatsci.2006.05.019 |
Chen H, Liu Y, Li ZP, et al. The influence of thermal treatment on grass crap quality and volatile flavor compounds. Food and Machinery, 2017, 33(9): 53-58 [陈惠, 刘焱, 李志鹏, 等. 热加工对草鱼鱼肉品质及风味成分的影响. 食品与机械, 2017, 33(9): 53-58] |
Christensen M, Purslow PP, Larsen LM. The effect of cooking temperature on mechanical properties of whole meat, single muscle fibres and perimysial connective tissue. Meat Science, 2000, 55(3): 301-307 DOI:10.1016/S0309-1740(99)00157-6 |
Chumngoen W, Chen CF, Tan FJ. Effects of moist- and dry-heat cooking on the meat quality, microstructure and sensory characteristics of native chicken meat. Animal Science Journal, 2018, 89(1): 193-201 DOI:10.1111/asj.12864 |
Coultate T. Food proteins: Processing applications. International Journal of Food Science and Technology, 2001, 36(4): 452 DOI:10.1046/j.1365-2621.2001.0437d.x |
Davey CL, Gilbert KV. Temperature-dependent cooking toughness in beef. Journal of the Science of Food and Agriculture, 1974, 25(8): 931-938 DOI:10.1002/jsfa.2740250808 |
Ferrante MI, Kiff RM, Goulding DA, et al. Troponin T is essential for sarcomere assembly in zebrafish skeletal muscle. Journal of Cell Science, 2011, 124(4): 565-577 DOI:10.1242/jcs.071274 |
Gelse K, Pöschl E, Aigner T. Collagens-structure, function, and biosynthesis. Advanced Drug Delivery Reviews, 2003, 55(12): 1531-1546 DOI:10.1016/j.addr.2003.08.002 |
Haard NF, Simpson BK, Pan BS. Sarcoplasmic proteins and other nitrogenous compounds. Seafood Proteins, 1994, 13 |
Hamm R. Changes of muscle proteins during the heating of meat. Physical, 1977, 101 |
Hanson RE. Processing equipment/smoking and cooking equipment. Encyclopedia of Meat Sciences, 2004, 1062 |
Hermansson AM, Langton M. Filamentous structures of bovine myosin in diluted suspensions and gels. Journal of the Science of Food and Agriculture, 1988, 42(4): 355-369 DOI:10.1002/jsfa.2740420409 |
Huang M, Bian K. Researching development on the methods of protein hydrophobicity estimation. Science and Technology of Cereals, Oils and Foods, 2004, 12(2): 31-32 |
Ishioroshi M, Samejima K, Yasui T. Heat-induced gelation of myosin filaments at a low salt concentration. Agricultural and Biological Chemistry, 1983, 47(12): 2809-2816 |
Ishiwatari N, Fukuoka M, Sakai N. Effect of protein denaturation degree on texture and water state of cooked meat. Journal of Food Engineering, 2013, 117(3): 361-369 DOI:10.1016/j.jfoodeng.2013.03.013 |
Johnson CM. Differential scanning calorimetry as a tool for protein folding and stability. Archives of Biochemistry and Biophysics, 2013, 531(1-2): 100-109 DOI:10.1016/j.abb.2012.09.008 |
Joo ST, Kauffman RG, Kim BC, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle. Meat Science, 1999, 52(3): 291-297 DOI:10.1016/S0309-1740(99)00005-4 |
King L, Seidel JC, Lehrer SS. Unfolding domains in smooth muscle myosin rod. Biochemistry, 1995, 34(20): 6770-6774 DOI:10.1021/bi00020a023 |
Kong FB, Tang JM, Lin MS, et al. Thermal effects on chicken and salmon muscles: Tenderness, cook loss, area shrinkage, collagen solubility and microstructure. LWT - Food Science and Technology, 2008, 41(7): 1210-1222 DOI:10.1016/j.lwt.2007.07.020 |
Kong FB, Tang JM, Rasco B, et al. Kinetics of salmon quality changes during thermal processing. Journal of Food Engineering, 2007, 83(4): 510-520 DOI:10.1016/j.jfoodeng.2007.04.002 |
Laakkonen E, Wellington GH, Sherbon JN. Low-temperature, long-time heating of bovine muscle. 1. Changes in tenderness, water-binding capacity, pH and amount of water-soluble components. Journal of Food Science, 1970, 35(2): 175-177 DOI:10.1111/j.1365-2621.1970.tb12131.x |
Lanier TC. Functional-properties of surimi. Food technology, 1986, 40(3): 107-114 |
Lawrie R. Connective tissue in meat and meat products. Meat Science, 1989, 26(4): 325-326 DOI:10.1016/0309-1740(89)90016-8 |
Lee MG, Yoon WB. Developing an effective method to determine the heat transfer model in fish myofibrillar protein paste with computer simulation considering the phase transition on various dimensions. International Journal of Food Engineering, 2016, 12(9): 889-900 DOI:10.1515/ijfe-2016-0084 |
Li C, Wang DY, Xu WM, et al. Effect of final cooked temperature on tenderness, protein solubility and microstructure of duck breast muscle. LWT - Food Science and Technology, 2013, 51(1): 266-274 DOI:10.1016/j.lwt.2012.10.003 |
Light N, Champion AE, Voyle C, et al. The rôle of epimysial, perimysial and endomysial collagen in determining texture in six bovine muscles. Meat Science, 1985, 13(3): 137-149 DOI:10.1016/0309-1740(85)90054-3 |
Listrat A, Picard B, Geay Y. Age-related changes and location of type Ⅰ, Ⅲ, Ⅳ, Ⅴ and Ⅵ collagens during development of four foetal skeletal muscles of double-muscled and normal bovine animals. Tissue and Cell, 1999, 31(1): 17-27 DOI:10.1054/tice.1998.0015 |
Liu R, Yin T, Xiong SB, et al. Comparative studies on microstructure and basic components of fish and pork. Food Science, 2012, 33(13): 49-52 [刘茹, 尹涛, 熊善柏, 等. 鱼肉和猪肉的微观结构与基本组成的比较研究. 食品科学, 2012, 33(13): 49-52] |
Liu R, Zhao SM, Xiong SB, et al. Role of secondary structures in the gelation of porcine myosin at different pH values. Meat Science, 2008, 80(3): 632-639 DOI:10.1016/j.meatsci.2008.02.014 |
Martens H, Stabursvik E, Martens M. Texture and colour changes in meat during cooking related to thermal denaturation of muscle proteins. Journal of Texture Studies, 1982, 13(3): 291-309 DOI:10.1111/j.1745-4603.1982.tb00885.x |
Mitra B, Rinnan A, Ruiz-Carrascal J. Tracking hydrophobicity state, aggregation behaviour and structural modifications of pork proteins under the influence of assorted heat treatments. Food Research International, 2017, 101: 266-273 DOI:10.1016/j.foodres.2017.09.027 |
Morita JI, Yasui T. Involvement of hydrophobic residues in heat-induced gelation of myosin tail subfragments from rabbit skeletal muscle. Agricultural and Biological Chemistry, 1991, 55(2): 597-599 |
Nishimura T. The role of intramuscular connective tissue in meat texture. Animal Science Journal, 2010, 81(1): 21-27 DOI:10.1111/j.1740-0929.2009.00696.x |
Nishimura T, Futami E, Taneichi A, et al. Decorin expression during development of bovine skeletal muscle and its role in morphogenesis of the intramuscular connective tissue. Cells Tissues Organs, 2002, 171(2-3): 199-214 DOI:10.1159/000063713 |
Ovissipour M, Rasco B, Tang JM, et al. Kinetics of protein degradation and physical changes in thermally processed Atlantic salmon (Salmo salar). Food and Bioprocess Technology, 2017, 10(10): 1865-1882 DOI:10.1007/s11947-017-1958-4 |
Palka K, Daun H. Changes in texture, cooking losses, and myofibrillar structure of bovine M. semitendinosus during heating. Meat Science, 1999, 51(3): 237-243 DOI:10.1016/S0309-1740(98)00119-3 |
Perisic N, Afseth NK, Ofstad R, et al. Characterizing salt substitution in beef meat processing by vibrational spectroscopy and sensory analysis. Meat Science, 2013, 95(3): 576-585 DOI:10.1016/j.meatsci.2013.05.043 |
Półtorak A, Wyrwisz J, Moczkowska M, et al. Microwave vs. convection heating of bovine Gluteus medius muscle: Impact on selected physical properties of final product and cooking yield. International Journal of Food Science and Technology, 2015, 50(4): 958-965 DOI:10.1111/ijfs.12729 |
Purslow PP, Oiseth S, Hughes J, et al. The structural basis of cooking loss in beef: Variations with temperature and ageing. Food Research International, 2016, 89(Pt 1): 739-748 |
Rahbari M, Hamdami N, Mirzaei H, et al. Effects of high voltage electric field thawing on the characteristics of chicken breast protein. Journal of Food Engineering, 2018, 216: 98-106 DOI:10.1016/j.jfoodeng.2017.08.006 |
Rossi AE, Dirksen RT. Sarcoplasmic reticulum: The dynamic calcium governor of muscle. Muscle and Nerve, 2006, 33(6): 715-731 DOI:10.1002/mus.20512 |
Sato K, Ohashi C, Muraki M, et al. Isolation of intact type Ⅴ collagen from fish intramuscular connective tissue. Journal of Food Biochemistry, 1998, 22(3): 213-225 DOI:10.1111/j.1745-4514.1998.tb00240.x |
Sayd T, Morzel M, Chambon C, et al. Proteome analysis of the sarcoplasmic fraction of pig Semimembranosus muscle: Implications on meat color development. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2732-2737 DOI:10.1021/jf052569v |
Sharp A, Offer G. The mechanism of formation of gels from myosin molecules. Journal of the Science of Food and Agriculture, 1992, 58(1): 63-73 DOI:10.1002/jsfa.2740580112 |
Sikes AL, Tobin AB, Tume RK. Use of high pressure to reduce cook loss and improve texture of low-salt beef sausage batters. Innovative Food Science and Emerging Technologies, 2009, 10(4): 405-412 DOI:10.1016/j.ifset.2009.02.007 |
Sun HX, Huang F, Ding ZJ, et al. Changes in tenderness and water-holding capacity and underlying mechanism during beef stewing. Food Science, 2018, 39(1): 84-90 [孙红霞, 黄峰, 丁振江, 等. 不同加热条件下牛肉嫩度和保水性的变化及机理. 食品科学, 2018, 39(1): 84-90] |
Sun XD, Holley RA. Factors influencing gel formation by myofibrillar proteins in muscle foods. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(1): 33-51 DOI:10.1111/j.1541-4337.2010.00137.x |
Thorarinsdottir KA, Arason S, Geirsdottir M, et al. Changes in myofibrillar proteins during processing of salted cod (Gadus morhua) as determined by electrophoresis and differential scanning calorimetry. Food Chemistry, 2002, 77(3): 377-385 DOI:10.1016/S0308-8146(01)00349-1 |
Tian XJ, Wu W, Yu QQ, et al. Quality and proteome changes of beef M. longissimus dorsi cooked using a water bath and ohmic heating process. Innovative Food Science and Emerging Technologies, 2016, 34: 259-266 DOI:10.1016/j.ifset.2016.02.013 |
Tornberg E. Effects of heat on meat proteins - Implications on structure and quality of meat products. Meat Science, 2005, 70(3): 493-508 DOI:10.1016/j.meatsci.2004.11.021 |
van der Sman RGM. Moisture transport during cooking of meat: An analysis based on Flory-Rehner theory. Meat Science, 2007, 76(4): 730-738 DOI:10.1016/j.meatsci.2007.02.014 |
Wattanachant S, Benjakul S, Ledward DA. Effect of heat treatment on changes in texture, structure and properties of Thai indigenous chicken muscle. Food Chemistry, 2005, 93(2): 337-348 DOI:10.1016/j.foodchem.2004.09.032 |
Wu FY, Dutson TR, Smith SB. A scanning electron microscopic study of heat-induced alterations in bovine connective tissue. Journal of Food Science, 1985, 50(4): 1041-1044 DOI:10.1111/j.1365-2621.1985.tb13007.x |
Yamamoto K, Samejima K, Yasui T. Heat-induced gelation of myosin filaments. Agricultural and Biological Chemistry, 1988, 52(7): 1803-1811 |
Yasui T, Ishioroshi M, Samejima K. Heat-induced gelation of myosin in the presence of actin. Journal of Food Biochemistry, 1980, 4(2): 61-78 DOI:10.1111/j.1745-4514.1980.tb00646.x |
Yi W, Hu YQ. The application of differential scanning calorimetry (DSC) in the protein thermal denaturation. Chinese Pharmaceutical Journal, 2004, 39(6): 401-403 [易薇, 胡一桥. 差示扫描量热法在蛋白质热变性研究中的应用. 中国药学杂志, 2004, 39(6): 401-403 DOI:10.3321/j.issn:1001-2494.2004.06.001] |
Yuan L, Liu YA, Ge J, et al. Effects of heat treatment at two temperatures on the myosin cluster of bighead carp for gel formation. CyTA - Journal of Food, 2017, 15(4): 574-581 DOI:10.1080/19476337.2017.1321045 |



