2. 上海海洋大学食品学院 上海 201306
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306
虾青素是类胡萝卜素的一种,易溶于丙酮、乙醇等有机溶剂,具有抗氧化、消炎、提高免疫力、预防心血管疾病及抗肿瘤等多种生物活性(赵玲等, 2011; Al-Amin et al, 2015; 王吉桥等, 2012; Zhang et al, 2014; Abdelzaher et al, 2016; Ko et al, 2016; 聂玉晨等, 2016),在食品、饲料、医药和化妆品等行业具有广阔的应用前景。与其他类胡萝卜素相同,虾青素可通过淬灭单线态氧和清除自由基而发挥强大的抗氧化活性(姜淼等, 2011),同时虾青素分子两端还各连接有1个紫罗兰酮环,每个紫罗酮环上含有羟基和酮基,这种独特的分子结构使它可以从内到外与细胞膜相连,其多烯链可以捕获细胞膜中的自由基,末端环可以清除细胞膜表面和内部的自由基,这使虾青素比其他类胡萝卜素显示出更好的生物活性(Kishimoto et al, 2016; Yamashita, 2013; Guerin et al, 2003)。但同时这种独特的分子结构也使虾青素分子很容易受到光、热、氧等的作用而遭到破坏。此外,虾青素的水溶性差,这使它在各个领域的应用受到了很大的限制。
微胶囊技术是一种用来保护被包裹物料,并对其原有化学性质不产生影响的新技术。为此,许多学者对具有良好水分散性和稳定性的虾青素微胶囊产品进行了研究,如侯会绒等(2015)采用喷雾干燥法对克氏原螯虾壳虾青素微胶囊化工艺进行了响应面法优化,虾青素包埋率可达到92.89%。Chen等(2016)采用美拉德反应的产物作为壁材,通过高压均质化对雨生红球藻的全细胞进行喷雾干燥使其微胶囊化,发现微胶囊后的产品在低温充氮避光条件下储存30 d后,虾青素保留率仍在95%以上,远高于未进行微胶囊化的产品。
微胶囊技术采用高分子聚合物的囊壁将常温下性质不稳定的固体、液体或气体包埋封存,从而达到隔绝外界光、氧等因素的目的,在食品、医药等领域得以广泛研究和应用。针对脂溶性内容物的微胶囊化方法主要有:喷雾干燥法(黄卉等, 2009)、复凝聚法、真空冷冻干燥法(周庆新等, 2017)等。其中复凝聚法产率及效率较高,产品致密性好,但易受残留溶剂和凝聚剂的影响,产品粒径大。真空冷冻干燥法虽可以较好维持样品的原有生物活性状态,但真空冷冻过程耗能较大、生产成本较高。而本研究采用的喷雾干燥法操作简便,微胶囊化产品颗粒大小均匀,具有优良的流动性、溶解性和分散性,是微胶囊技术中应用最为广泛的方法(胡志和等, 2016; 付力丹等, 2016)。
本研究采用喷雾干燥法对分离提纯后的南极磷虾(Euphausia superba)虾青素进行微胶囊化,以麦芽糊精与羟丙基-β-环糊精(HP-β-CD)为复合壁材、聚山梨酯-80为乳化剂,以包埋率和微胶囊化产率为考察指标,通过单因素和响应面实验对南极磷虾虾青素喷雾干燥工艺进行了优化,获得了南极磷虾虾青素喷雾干燥微胶囊化最佳工艺条件,并对比分析了该工艺条件下制备的虾青素微胶囊产品的稳定性,以期为南极磷虾的高效利用和虾青素产品的研究开发提供理论依据。
1 材料与方法 1.1 材料 1.1.1 原料与试剂南极磷虾源虾青素,实验室自制;虾青素标准品,纯度97%,美国Sigma公司;麦芽糊精、HP-β-CD、阿拉伯胶,浙江千裕生物科技有限公司;辛烯基琥珀酸淀粉酯,浙江德清三富食品有限公司;蔗糖脂肪酸酯(SE-9),广西高通食品科技有限公司;聚山梨酯-80,天津大茂化学试剂厂;正己烷、石油醚、丙酮等试剂均为分析纯,广州化学试剂厂。
1.1.2 仪器与设备EYELA-SD-1000型喷雾干燥机(Rikakika公司,日本);UV2550型紫外可见分光光度计(Shimadzu公司,日本);GB204型电子天平(Mettler公司,瑞士);79-1型磁力加热搅拌器(天津市赛得利斯实验分析仪器制造厂);T50型高速分散均质机(IKA工业设备公司,德国);SHZ-82A型水浴恒温振荡器(江苏金坛市精达仪器制造有限公司);3K30型台式高速冷冻离心机(Sigma公司,德国);Quanta 400 FEG场发射扫描电镜(飞利浦FEI公司,荷兰)。
1.2 方法 1.2.1 微胶囊化工艺参考胡婷婷等(2014)的方法并略作改动。按比例称取壁材于烧杯中,加适量水充分溶解,磁力搅拌器恒温搅拌30 min;称取芯材加入一定量的乳化剂制成芯材溶液。在壁材溶液中边搅拌边缓慢滴加芯材溶液,搅拌均匀后均质乳化备用。设置喷雾干燥器进风温度170℃、喷雾气体压力0.17 Mpa,调节进样量使出口温度控制在90℃,在此条件下进行喷雾干燥,制备南极磷虾虾青素微胶囊产品。
1.2.2 虾青素标准曲线的绘制用乙醇溶解虾青素,通过紫外–可见光分光光度计在400~600 nm波长范围内扫描,吸收图谱显示在478 nm波长处有明显的吸收峰。配制不同质量浓度虾青素标品溶液,分别为0、0.5、1.0、2.0、2.5、5.0和10.0 μg/ml。得到回归方程y=0.0358x+0.0116(y为吸光度,x为虾青素质量浓度),R2=0.9961。
1.2.3 微胶囊化的效果评定参考胡婷婷等(2014)的方法,以包埋率和微胶囊化产率为指标。计算公式如下:
| $ \begin{array}{l} 包埋率\left({\rm{\% }} \right){\rm{ = }}\\ \frac{{微胶囊虾青素含量 - 微胶囊表面虾青素含量}}{{微胶囊虾青素含量}} \times 100 \end{array} $ |
| $ 微胶囊化产率\left({\rm{\% }} \right){\rm{ = }}\frac{{微胶囊虾青素含量}}{{虾青素起初加入量 }} \times 100 $ |
微胶囊虾青素含量的测定:准确称取0.50 g干燥后的虾青素微胶囊粉,加10 ml水搅拌成均一体系,再加入丙酮–石油醚溶液(体积比为1:1)振荡提取后,取上层有机相5 ml氮气吹干后复溶于乙醇中,在478 nm下测吸光度,根据标准曲线计算微胶囊中虾青素含量。
微胶囊表面虾青素含量的测定:准确称取0.50 g干燥后的虾青素微胶囊粉,加10 ml正己烷振荡提取,离心分离后取5 ml氮气吹干后复溶于乙醇中,在478 nm下测吸光度,根据标准曲线计算微胶囊表面虾青素含量。
1.2.4 各因素对微胶囊化效果的影响分别以阿拉伯胶、HP-β-CD和辛烯基琥珀酸淀粉酯为壁材,麦芽糊精为填充剂,设置壁材复配组合Ⅰ组为m(麦芽糊精):m(阿拉伯胶)=1:3、Ⅱ组为m(麦芽糊精):m(HP-β-CD)=1:3、Ⅲ组为m(麦芽糊精):m(阿拉伯胶):m(HP-β-CD)=1:1:3、Ⅳ组为m(麦芽糊精):m(辛烯基琥珀酸淀粉酯):m(HP-β-CD)=1:1:3。加入一定比例的聚山梨酯-80作为乳化剂,虾青素为芯材。选定虾青素添加质量分数5%、聚山梨酯-80添加质量分数0.5%(均以壁材总量计)、固形物(壁材、芯材与乳化剂)浓度0.20 g/ml,以微胶囊包埋率和产率为指标评价,考察壁材对微胶囊化效果的影响。
以虾青素微胶囊最佳壁材配比为壁材原料,选取虾青素添加质量分数(3%、5%、7%、9%和11%)、聚山梨酯-80添加质量分数(0.5%、1%、1.5%、2%和2.5%)、固形物浓度(0.10、0.15、0.20、0.25和0.30 g/ml)作为实验因素,综合分析各个因素对微胶囊产率和包埋率的影响。
1.2.5 响应面法优化虾青素微胶囊工艺实验为确定虾青素微胶囊的最佳工艺条件,综合各单因素实验结果,根据Box-Behnken中心组合设计原理,选择对虾青素微胶囊化效果有显著影响的3个因素:虾青素添加质量分数(A)、聚山梨酯-80添加质量分数(B)、固形物浓度(C)为自变量,以包埋率(Y)为响应值,利用Design-Expert 8.0.6软件进行3因素3水平的响应面实验优化,实验因素和水平设置见表 1。
|
|
表 1 响应面实验因素水平 Tab.1 Factors and levels of response surface methodology |
水分含量的测定:参照食品安全国家标准GB 5009.3-2016《食品中水分的测定》,直接干燥法。
溶解度的测定:参照文献所述方法(Montero et al, 2016)略作修改,称取适量虾青素微胶囊样品用蒸馏水充分溶解后,8000 r/min离心20 min去上清液,取沉淀干燥后称重。
| $ 溶解度\left({\rm{\% }} \right) = 1 - \frac{{{W_1}}}{{\left({1 - M \times W} \right)}} \times 100 $ |
式中,W1干燥后沉淀的质量(g);M为微胶囊样品的水分含量(%);W为微胶囊样品的质量(g)。
休止角的测定:参照食品安全国家标准GB 11986-1989《表面活性剂:粉体和颗粒休止角的测定》,固定圆锥底法。
表面形态观察:应用热场发射扫描电子显微镜观察微胶囊表面形态结构。在样品台上贴上一层双面胶,将微胶囊样品轻轻撒在上面,并吹去多余的粉末,镀金后扫描电子显微镜下观察、拍照。
1.2.7 虾青素微胶囊稳定性研究温度对微胶囊产品的影响:取适量虾青素微胶囊产品及未进行微胶囊化的虾青素晶体,分别置于4℃、25℃、40℃、60℃和80℃条件下,24 h后取样测定虾青素保留率,考察温度对微胶囊化前后虾青素产品稳定性的影响。
自然光对微胶囊产品的影响:取适量虾青素微胶囊产品及未进行微胶囊化的虾青素晶体,室温25℃密封,自然光条件下保存30 d,定期取样测定虾青素保留率,考察自然光对微胶囊化前后虾青素产品稳定性的影响。
空气中氧气对微胶囊产品的影响:取适量虾青素微胶囊产品及未进行微胶囊化的虾青素晶体,分别置于表面皿中,室温25℃避光条件下保存30 d,定期取样测定虾青素保留率,考察空气中氧气对微胶囊化前后虾青素产品稳定性的影响。
虾青素保留率按如下公式计算:
| $ \begin{array}{l} 虾青素保留率\left({\rm{\% }} \right){\rm{ = }}\\ \frac{{不同条件作用后样品中的虾青素含量}}{{作用前样品中虾青素含量}} \times 100 \end{array} $ |
不同壁材种类对微胶囊化效果的影响结果见图 1。由图 1可知,在几种壁材组合中,以Ⅱ组微胶囊化效果最好,Ⅳ组次之,Ⅰ组微胶囊化效果最差。与Ⅱ组相比,Ⅳ组微胶囊化包埋率相差不大,但微胶囊化产率明显偏低,这可能是由于在加入了一定量的辛烯基琥珀酸淀粉酯后,乳化液的流动性变差,导致喷雾干燥过程出现黏壁的现象,导致微胶囊化产率降低。与Ⅳ组相比,Ⅲ组壁材组合中以阿拉伯胶代替了辛烯基琥珀酸淀粉酯,导致包埋率下降,此结果与孔令晓等(2010)对辛烯基琥珀酸淀粉酯作为壁材对微胶囊包埋率的影响表述一致。因此,最终选择Ⅱ组m(麦芽糊精):m(HP-β-CD)=1:3为虾青素微胶囊最佳壁材配比进行后续实验。
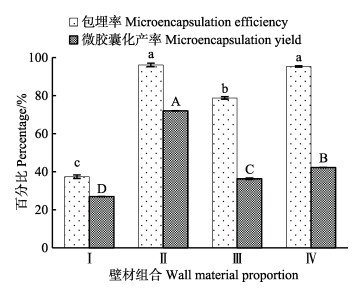
|
图 1 壁材种类对虾青素微胶囊化效果的影响 Fig.1 Effects of different wall materials on the microencapsulation efficiency and yield of astaxanthin 注:Ⅰ:m(麦芽糊精):m(阿拉伯胶)=1:3; Ⅱ:m(麦芽糊精):m(HP-β-CD)=1:3; Ⅲ:m(麦芽糊精):m(阿拉伯胶):m(HP-β-CD)=1:1:3; Ⅳ:m(麦芽糊精):m(辛烯基琥珀酸淀粉酯):m(HP-β-CD)=1:1:3;上标不同小写字母表示包埋率差异显著(P<0.05),不同大写字母表示微胶囊化产率差异显著(P<0.05).下同 Note:Ⅰ: m(maltodextrin):m(acacia)=1:3; Ⅱ: m(maltodextrin):m(HP-β-CD)=1:3; Ⅲ: m(maltodextrin):m(acacia):m(HP-β-CD)=1:1:3; Ⅳ: m m(maltodextrin): m(octenyl succinic anhydride modified starch): m(HP-β-CD)=1:1:3; Data with different lowercases are significantly (P < 0.05) different of microencapsulation efficiency, and with different capital letters are significantly (P < 0.05) different of microencapsulation yield. The same as below |
不同虾青素添加量对微胶囊化效果的影响结果见图 2。由图 2可知,虾青素微胶囊化效果随着虾青素添加质量分数的增加呈现先上升后下降的趋势,并在虾青素添加质量分数为5%时微胶囊化效果最好,这可能是由于当虾青素添加质量分数过高时,在壁材用量相同的情况下,包裹过多的芯材使得囊壁变薄,甚至破裂,从而导致了包埋率和产率的降低(Tonon et al, 2011)。因此确定虾青素添加质量分数较适的工艺参数为5%。
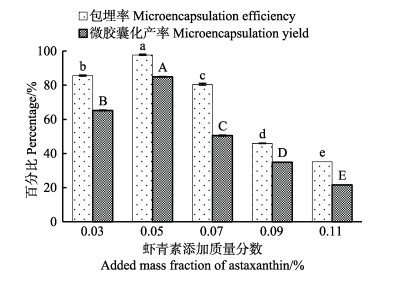
|
图 2 虾青素添加质量分数对虾青素微胶囊化效果的影响 Fig.2 Effects of added mass fraction of astaxanthin on the microencapsulation efficiency and yield of astaxanthin |
在预实验过程中发现以蔗糖酯为乳化剂时,乳化效果差,油相与水相不能很好的融合在一起,而聚山梨酯-80具有较好的乳化效果,因此选择聚山梨酯-80作为乳化剂。不同聚山梨酯-80添加量对微胶囊化效果的影响结果见图 3。由图 3可知,随着聚山梨酯-80添加质量分数的增加虾青素微胶囊化效果,呈现先上升后下降的趋势,并在聚山梨酯-80添加质量分数为1.0%时微胶囊化效果最好。因此,确定聚山梨酯-80添加质量分数1.0%作为较适的工艺参数。
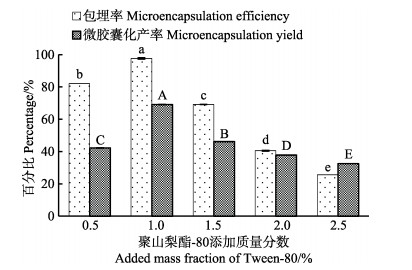
|
图 3 聚山梨酯-80对虾青素微胶囊化效果的影响 Fig.3 Effects of added mass fraction of Tween-80 on the microencapsulation efficiency and yield of astaxanthin |
不同固形物浓度对微胶囊化效果的影响结果见图 4。由图 4可知,随着固形物浓度的增加虾青素微胶囊化效果呈现先上升后下降的趋势,并在固形物浓度为0.20 g/ml时微胶囊化效果最好。这是由于当固形物浓度适当增加时,乳状液黏度相应增加,可以减少乳液在喷雾干燥过程中内部的漩涡流动,有利于虾青素与壁材的接触,使喷雾干燥过程中壁材更容易成膜,从而提高微胶囊化效果。但当固形物浓度过大时,乳液黏度大,喷雾干燥过程中水分蒸发速度受到影响,容易出现黏壁现象,导致微胶囊化效果降低(胡婷婷等, 2014)。因此确定固形物浓度0.20 g/ml作为虾青素微胶囊较适工艺参数。

|
图 4 固形物浓度对虾青素微胶囊化效果的影响 Fig.4 Effects of solid concentration on the microencapsulation efficiency and yield of astaxanthin |
由单因素实验可知,不同因素对虾青素微胶囊化效果的影响程度不同,根据单因素实验结果,选择出影响较大的3个因素:虾青素添加质量分数(A)、聚山梨酯-80添加质量分数(B)、固形物浓度(C)为自变量,以微胶囊化包埋率为响应值,自变量因素和水平设置见表 1,根据Box- Behnken实验设计方案进行实验,结果见表 2。
|
|
表 2 响应面设计方案与实验结果 Tab.2 Experimental design and results for response surface analysis |
经多元回归拟合,得到虾青素提取率的二次多项回归方程为:Y=98.67–1.12A–3.06B–0.70C–1.04AB+ 0.45AC–1.15BC–3.64A2–5.61B2–3.09C2。对表 2中所得实验结果进行方差分析,结果见表 3。
|
|
表 3 响应面二次模型方差分析 Tab.3 ANOVA for response surface quadratic model |
由方差分析可知,模型极显著(P<0.0001),失拟项不显著(P=0.7425 > 0.05),说明该模型与实际拟合程度好。R2=0.9936,RAdj2=0.982,说明该模型拟合程度良好,实验误差小,能够反映响应值的变化。同时可知,各因素对虾青素微胶囊化的影响程度依次为:B > A > C,即聚山梨酯-80添加质量分数 > 虾青素添加质量分数 > 固形物浓度;交互项AB、BC项显著(P<0.05),AC项不显著,表明虾青素添加质量分数和聚山梨酯-80添加质量分数、聚山梨酯-80添加质量分数和固形物浓度对虾青素微胶囊化有交互影响的作用,而虾青素添加质量分数和固形物浓度对虾青素微胶囊化交互影响的作用不明显。
2.5.2 响应面交互作用分析与优化结果确定各因素交互作用对虾青素包埋率的影响见图 5。由图 5可知,聚山梨酯-80添加质量分数对虾青素包埋率的影响最大,其次为虾青素添加质量分数和固形物浓度。虾青素添加质量分数与固形物浓度交互作用对虾青素包埋率影响不显著(P > 0.05),聚山梨酯-80添加质量分数与固形物浓度、虾青素添加质量分数与聚山梨酯-80添加质量分数交互作用对虾青素提取率影响显著(P < 0.05),且聚山梨酯-80添加质量分数与固形物浓度交互作用影响大于虾青素添加质量分数与聚山梨酯-80添加质量分数交互作用,与方差分析结果一致。
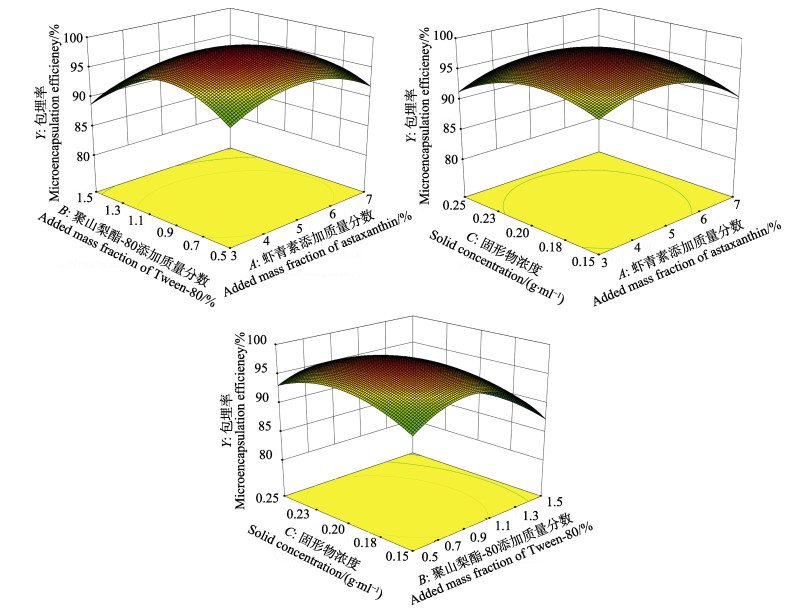
|
图 5 各因素交互作用对包埋率影响的响应面图 Fig.5 Response surface showing the effects of preparation conditions on the microencapsulation efficiency of quercetin microcapsules |
通过响应面软件分析,得出虾青素微胶囊化的最优工艺条件为A=4.76,B=0.87,C=0.20,即以m(麦芽糊精):m(HP-β-CD)=1:3为壁材、虾青素添加质量分数为4.76%、聚山梨酯-80添加质量分数为0.87%、固形物浓度为0.20 g/ml,当设置喷雾干燥机喷雾进风温度170℃、出口温度90℃时,虾青素微胶囊包埋率的理论值为99.15%。
为验证模型的准确性,以响应面软件分析得出的最优工艺进行重复实验,实验结果显示,得出虾青素微胶囊化包埋率实测值为98.77%,与理论值相对误差为0.38%,说明模型是准确有效的。
2.6 虾青素微胶囊产品的理化特性产品水分含量越低越有利于防止产品结块或霉变。休止角可反映粉体的流动性,休止角越小,摩擦力越小,流动性也越好(廖霞等, 2016),在该实验条件下制得的虾青素微胶囊产品水分含量、溶解度与休止角分别为(3.11±0.11)%、(94.32±0.08)%与(34.16± 0.24)°,休止角小于40°,说明具有较好的流动性,结构表面光滑紧致,无孔隙,有利于芯材的保留,虾青素微胶囊扫描电镜表面和内部结构如图 6所示。从图 6中微胶囊内部结构图可知,其组织细密,内有空腔,囊壁较薄,可使微胶囊产品复水时迅速崩解,使产品溶解性得到提高。

|
图 6 虾青素微胶囊扫描电镜表面和内部结构 Fig.6 Surface and internal structure of astaxanthin microencapsulation under SEM |
不同温度对虾青素保留率的影响见图 7。由图 7可知,在相同温度条件下,微胶囊化后的虾青素保留率均高于未微胶囊化的虾青素晶体,其中未经过微胶囊化的虾青素在温度超过40℃,其保留率便开始大幅度下降,而微胶囊化后的虾青素则表现出较为缓慢的下降趋势,由此可见,微胶囊化包埋可明显改善虾青素的热稳定性。在80℃下,微胶囊化后的虾青素产品出现明显下降的原因可能是由于高温导致了微胶囊囊壁的破裂,使虾青素暴露出来,从而导致了其保留率的下降。
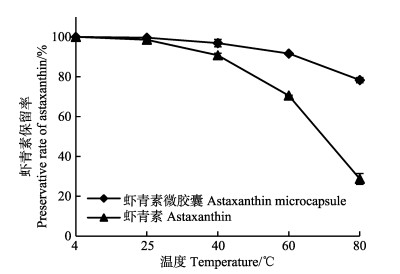
|
图 7 温度对虾青素保留率影响 Fig.7 Influence of temperature on preservative rate of astaxanthin |
自然光对虾青素保留率影响结果见图 8。由图 8可知,经过30 d的保存后,虾青素微胶囊中的虾青素保留率高于未微胶囊化的虾青素晶体。在前20 d的保存期间内,微胶囊化后的虾青素保留率依然在90%以上,而未微胶囊化的虾青素晶体在5 d后即呈现明显的下降趋势,这是因为微胶囊囊壁具有一定的光保护作用,可以防止虾青素因自然光而导致的降解。
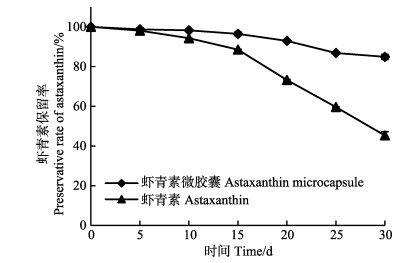
|
图 8 自然光对虾青素保留率影响 Fig.8 Influence of natural light on preservative rate of astaxanthin |
空气中氧气对虾青素保留率的影响结果见图 9。由图 9可知,经过30 d的保存后,未微胶囊化的虾青素晶体的保留率明显低于微胶囊化后的虾青素产品,这可能是因为虾青素微胶囊囊壁有隔绝空气的作用,故使其保留率的下降不明显。同时在有氧状态下,虾青素微胶囊也会吸收空气中的水分,造成虾青素微胶囊的部分溶解,导致虾青素溶出,从而使微胶囊化后产品中虾青素的保留率不断下降。
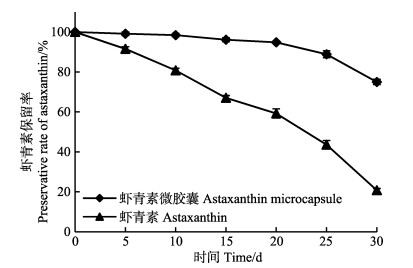
|
图 9 空气中氧气对虾青素保留率影响 Fig.9 Influence of oxygen in air on preservative rate of astaxanthin |
本研究以虾青素微胶囊化包埋率为指标,通过单因素实验和Box-Behnken响应面优化实验确定虾青素微胶囊化的最佳工艺条件为m(麦芽糊精):m(HP-β-CD)=1:3为壁材、虾青素添加质量分数为4.76%、聚山梨酯-80添加质量分数为0.87%、固形物浓度为0.20 g/ml、喷雾进风温度170℃、出口温度90℃时,虾青素微胶囊包埋率的理论值为99.15%,实测值为98.77%,与理论值相对误差约为0.38%,说明模型是准确有效的。经理化特性检测表明,所制虾青素微胶囊产品具有较好的流动性和溶解性。通过温度、自然光和空气中氧气对虾青素微胶囊及未微胶囊化的虾青素晶体稳定性影响的结果可知,与未微胶囊化的虾青素晶体相比,虾青素微胶囊在高温条件下,虾青素的保留率由28.72%提高到78.32%;在30 d的保存期后,在自然光条件下,虾青素的保留率由45.27%提高到84.88%;在有氧条件下,虾青素的保留率由20.76%提高到74.97%。可见微胶囊化可明显改善虾青素对光、热和氧的敏感性,同时也说明虾青素微胶囊产品应当尽量低温、避光密封保存,以防止其吸湿溶胀,导致稳定性下降。
Abdelzaher LA, Imaizumi T, Suzuki T, et al. Astaxanthin alleviates oxidative stress insults-related derangements in human vascular endothelial cells exposed to glucose fluctuations. Life Sciences, 2016, 150(1): 24-31 |
Al-Amin M, Rahman M, Khan FR, et al. Astaxanthin improves behavioural disorder and oxidative stress in prenatal valproic acid-induced mice model of autism. Behavioural Brain Research, 2015, 286: 112-121 DOI:10.1016/j.bbr.2015.02.041 |
Chen LM, Liu XM, Li DM, et al. Preparation of stable microcapsules from disrupted cell of Haematococcus pluvialis by spray drying. International Journal of Food Science and Technology, 2016, 51(8): 1834-1843 DOI:10.1111/ijfs.13155 |
Fu LD, Liu D, Zhao XY, et al. Research progress on microencapsulation and stability of astaxanthin. Food Research and Development, 2016, 37(23): 197-201 [付力丹, 刘頔, 赵晓燕, 等. 虾青素微胶囊化及其稳定性的研究进展. 食品研究与开发, 2016, 37(23): 197-201 DOI:10.3969/j.issn.1005-6521.2016.23.046] |
Guerin M, Huntley ME, Olaizola M. Haematococcus astaxanthin: Applications for human health and nutrition. Trends in Biotechnology, 2003, 21(5): 210-216 DOI:10.1016/S0167-7799(03)00078-7 |
Hou HR, Sun ZY, Gong HK, et al. Optimization of the Procam barus clarkia shell astaxanthin microcapsules. Food Research and Development, 2015, 36(20): 74-79 [侯会绒, 孙兆远, 贡汉坤, 等. 克氏原螯虾壳虾青素微胶囊制备工艺的优化. 食品研究与开发, 2015, 36(20): 74-79 DOI:10.3969/j.issn.1005-6521.2015.20.021] |
Hu TT, Wang Y, Wu CY. Optimization of preparation process for microencapsulated astaxanthin with response surface methodology. Food Science, 2014, 35(12): 53-59 [胡婷婷, 王茵, 吴成业. 响应面法优化虾青素微胶囊制备工艺. 食品科学, 2014, 35(12): 53-59 DOI:10.7506/spkx1002-6630-201412010] |
Hu ZH, Zhao Y, Xia L, et al. Effect of different drying methods on angiotensin converting enzyme inhibitory activity of peptides from bovine casein hydrolysate. Food Science, 2016, 37(19): 204-210 [胡志和, 赵勇, 夏磊, 等. 不同干燥方法对乳源血管紧张素转化酶抑制肽活性的影响. 食品科学, 2016, 37(19): 204-210 DOI:10.7506/spkx1002-6630-201619034] |
Huang H, Li LH, Yang XQ, et al. Study of tilapia oil microcapsule by spray drying technology. South China Fisheries Science, 2009, 5(5): 19-23 [黄卉, 李来好, 杨贤庆, 等. 喷雾干燥微胶囊化罗非鱼油的研究. 南方水产科学, 2009, 5(5): 19-23 DOI:10.3969/j.issn.1673-2227.2009.05.004] |
Jiang M, Yang XQ, Li LH, et al. Application of endogenous enzymes in astaxanthin extraction from shrimp shell. South China Fisheries Science, 2011, 7(2): 55-60 [姜淼, 杨贤庆, 李来好, 等. 内源酶辅助提取虾壳虾青素的研究. 南方水产科学, 2011, 7(2): 55-60 DOI:10.3969/j.issn.2095-0780.2011.02.009] |
Kishimoto Y, Yoshida H, Kondo K. Potential anti-atherosclerotic properties of astaxanthin. Marine Drugs, 2016, 14(2): 35 DOI:10.3390/md14020035 |
Ko JC, Chen JC, Wang TJ, et al. Astaxanthin down-regulates Rad51 expression via inactivation of AKT kinase to enhance mitomycin C-induced cytotoxicity in human non-small cell lung cancer cells. Biochemical Pharmacology, 2016, 105: 91-100 DOI:10.1016/j.bcp.2016.02.016 |
Kong LX, Cui B. Advances in starch modified with octenylsuccinic acid. China Food Additives, 2010(2): 178-181, 187 [孔令晓, 崔波. 辛烯基琥珀酸淀粉酯的研究现状. 中国食品添加剂, 2010(2): 178-181, 187 DOI:10.3969/j.issn.1006-2513.2010.02.035] |
Liao X, Yang XL, Li Y, et al. Response surface optimization of preparation of microencapsulated quercetin using complex coacervation and its physicochemical properties. Food Science, 2016, 37(22): 20-27 [廖霞, 杨小兰, 李瑶, 等. 响应面试验优化复凝聚法制备槲皮素微胶囊工艺及其理化性质. 食品科学, 2016, 37(22): 20-27 DOI:10.7506/spkx1002-6630-201622004] |
Montero P, Calvo MM, Gómez-Guillén MC, et al. Microcapsules containing astaxanthin from shrimp waste as potential food coloring and functional ingredient: Characterization, stability, and bioaccessibility. LWT - Food Science and Technology, 2016, 70: 229-236 DOI:10.1016/j.lwt.2016.02.040 |
Nie YC, Zhang B, Zhao XY, et al. Seasonal variation in lipids and protein content of Antarctic krill (Euphausia superba). Progress in Fishery Sciences, 2016, 37(3): 1-8 [聂玉晨, 张波, 赵宪勇, 等. 南极磷虾(Euphausia superba)脂肪与蛋白含量的季节变化. 渔业科学进展, 2016, 37(3): 1-8] |
Tonon RV, Grosso CRF, Hubinger MD. Influence of emulsion composition and inlet air temperature on the microencapsulation of flaxseed oil by spray drying. Food Research International, 2011, 44(1): 282-289 DOI:10.1016/j.foodres.2010.10.018 |
Wang JQ, Fan YY, Xu ZX, et al. Effects of dietary β-carotene and astaxanthin levels on anti-oxidation in juvenile sea cucumber Apostichopus japonicus. Journal of Dalian Ocean University, 2012, 27(3): 215-220 [王吉桥, 樊莹莹, 徐振祥, 等. 饲料中β-胡萝卜素和虾青素添加量对仿刺参幼参生长及抗氧化能力的影响. 大连海洋大学学报, 2012, 27(3): 215-220 DOI:10.3969/j.issn.1000-9957.2012.03.005] |
Yamashita E. Astaxanthin as a medical food. Functional foods in health and disease, 2013, 3(7): 254-258 DOI:10.31989/ffhd.v3i7.49 |
Zhang XS, Zhang X, Wu Q, et al. Astaxanthin offers neuroprotection and reduces neuroinflammation in experimental subarachnoid hemorrhage. Journal of Surgical Research, 2014, 192(1): 206-213 DOI:10.1016/j.jss.2014.05.029 |
Zhao L, Cao R, Liu Q, et al. Antimicrobial activity of polypeptides from Antarctic krill. Progress in Fishery Sciences, 2011, 32(4): 112-116 [赵玲, 曹荣, 刘淇, 等. 南极磷虾酶解多肽的抑菌活性. 渔业科学进展, 2011, 32(4): 1-8 DOI:10.3969/j.issn.1000-7075.2011.04.001] |
Zhou QX, Yang L, Chen FT, et al. Study on preparation and stability of microcapsule containing esterified astaxanthins from Haematococcus pluvialis. China Food Additives, 2017(7): 131-139 [周庆新, 杨鲁, 陈芳甜, 等. 雨生红球藻虾青素酯微胶囊制备及其稳定特性研究. 中国食品添加剂, 2017(7): 131-139 DOI:10.3969/j.issn.1006-2513.2017.07.014] |



