2. 徐州一统食品工业有限公司江苏省博士后创新实践基地 徐州 221004
2. Jiangsu Postdoctoral Program, Yitong Co. Itd., Xuzhou 221004
暗纹东方鲀(Takifugu obscurus)又称河豚鱼、泡泡鱼、河豚和豪猪鱼,广泛分布于我国东海、黄海、渤海和长江流域,因其独特鲜美的味道而倍受消费者的青睐(Zhou et al, 2011)。与普通淡水鱼相比,河豚鱼肉蛋白质含量高,脂肪含量低,并富含必需氨基酸以及矿物质(Li et al, 2014)。新鲜的河豚鱼肉极容易腐烂,在冷藏条件(4℃)下,大约只有4 d的保质期,电解水结合壳聚糖综合处理保鲜也仅可以将保质期延长到6 d (Zhou et al, 2011)。为了满足暗纹东方鲀的长期稳定供应,需要选择冷冻保藏的方法。然而,鱼肉在冷冻和解冻过程中会出现质构软化、汁液流失加重、肉质口感变柴和腥味加重等不良现象,新鲜度和消费者接受程度下降。
国内文献对于河豚鱼肉的冷冻保藏主要集中在品质改善方面(陈依萍等, 2019),极少对冻藏鱼肉品质劣化原因进行深入系统分析,例如马妍等(2014; 2012b)采用降低冻藏温度的方式改善了冻藏河豚鱼鱼肉微观结构及品质;此外,马妍等(2012a)还采用ε-聚赖氨酸和海藻糖及多聚磷酸钠组成的复合抗冻剂降低了自由水含量,从而改善了河豚鱼肉品质。国外关于河豚鱼的冷冻保藏鲜有报道,主要研究对象集中在大西洋鲑鱼(Salmo salar) (Kaale et al, 2014)、金枪鱼(Kobayashi et al, 2015)、虹鳟鱼(Oncorhynchus mykiss) (Hafezparast-Moadab et al, 2018)等海水鱼,而淡水鱼在蛋白结构、水分含量、内源酶活性上与海水鱼有本质区别,不同的原料特性决定了在淡水鱼冻藏技术上还需开展大量研究,以提供实际应用的指导和基础。针对冻藏水产品品质劣化原因探究,综合国内外研究报道,品质下降的主要因素有以下3个方面:其一,冻结过程中冰晶生长产生的机械压力会对肌肉组织及细胞造成不可逆损伤(Cheng et al, 2017; Kaale et al, 2013);其二,鱼体死后细胞释放并活化的内源蛋白酶会破坏蛋白骨架结构,影响鱼肉质构特性,还会水解蛋白生成胺类前体物质,形成不良风味(Ge et al, 2016; Lu et al, 2015; Yang et al, 2015);其三,脂肪和蛋白氧化,不仅会使鱼肉色泽和风味劣化,还会由于不同类型脂肪及其氧化产物与肌原纤维蛋白相互作用、以及肌原纤维蛋白自身二级三级结构变化,而影响鱼肉质构特性和持水特性(Chan et al, 2011; Hong et al, 2013; Sebranek et al, 2005; Turgut et al, 2017)。目前,冻藏技术已初步应用到暗纹东方鲀保鲜上,但冻藏品质尚不理想,需要探究内在因素,为暗纹东方鲀冻藏方法的改良提供理论依据。
因此,本研究旨在分析冰晶、内源蛋白酶和氧化对冻藏暗纹东方鲀(-18±1)℃品质的影响,确定暗纹东方鲀冻藏品质劣化的关键因素。此研究对淡水鱼冻藏技术理论研究的完善具有一定学术意义和应用价值。
1 材料与方法 1.1 主要原料暗纹东方鲀:市售,尾重为(450±50) g,鲜活,由专业人员宰杀,去皮、内脏,加碎冰在1 h内运回实验室。
1.2 主要试剂和设备核苷酸标准品(ATP、ADP、AMP、IMP、Hx、HxR)购于美国Sigma公司,碘乙酸、茶多酚、抗坏血酸、MgO、H3BO3、HClO4、CH3OH、KH2PO4、K2HPO4、CaCl2、KCl、EDTA-2Na等均购自国药集团。
海尔冰箱,海尔集团;YSD-30L液氮罐,ZYB-8型自增压式液氮泵(成都金凤液氮容器有限公司);4K-15型高速冷冻离心机(Sigma Sartorius公司,美国);EL20型PH计(梅特勒托利多仪器有限公司,德国);UV1000紫外分光光度计(上海天美科学仪器有限公司);KDN-103F自动定氮仪(上海纤检仪器有限公司);TA-XT2i型物性测试仪(Stable Micro System公司,英国);NIKON ECLIPSE CI型正置光学显微镜(尼康NIKON公司,日本);Waters e269高效液相色谱仪(沃特世公司,美国);TP9000数字温度计(广州Toprie Electronic有限公司)。
1.3 实验内容及方法 1.3.1 鱼肉预处理河豚鱼肉用预冷的流动水清洗,去头、中间鱼骨,手工采取鱼肉,并将其切成2.0 cm×2.0 cm×1.5 cm块状,随机分为A、B、C、D四组。A组:去离子水1 : 10 (w/v)浸泡6 h (4℃),取出静置1 h (4℃),装入10 cm×7 cm PE自封袋中,冻藏于(-18±1)℃冰箱中,简称“空白组”;B组:去离子水1 : 10 (w/v)浸泡6 h (4℃),取出静置1 h (4℃),液氮浸渍冻结至中心温度为-18℃,取出装入10 cm×7 cm PE自封袋中,冻藏于(-18±1)℃冰箱中,简称“速冻组”;C组:1 mmol/L碘乙酸溶液1 : 10 (w/v)浸泡6 h (4℃),取出静置1 h (4℃),装入10 cm×7 cm PE自封袋中,冻藏于(-18±1)℃冰箱中,简称“内源酶抑制组”;D组:复合抗氧化剂溶液(0.6%茶多酚+0.2% Vc) 1 : 10 (w/v)浸泡6 h (4℃),取出静置1 h (4℃),装入10 cm×7 cm PE自封袋中,冻藏于(-18±1)℃冰箱中,简称“氧化抑制组”。
前期实验证实,采用液氮速冻、碘乙酸处理、复合抗氧化剂处理分别可以有效抑制大冰晶的生成、内源蛋白酶活性、蛋白氧化、脂肪氧化,因而可以区分3种因素对冻藏鱼肉品质的影响(受篇幅影响,不再列出具体图表数据)。
1.3.2 解冻方法将冻藏鱼肉置于4℃冰箱中解冻,解冻时间为10 h。
1.3.3 硬度测定参照宋敏等(2017)的方法并略有修改,取解冻后鱼肉切成1 cm×1 cm×1 cm方块,使用TA-XT2i型物性分析仪对河豚鱼肉质构进行测定。参数设置如下:使用圆柱形探头P5,起始触发力为5 g,测前速率、进刀速率和测后速率分别为2.0、5.0和1.0 mm/s,压缩形变为50%,每组样品平行测定5次。
1.3.4 解冻流失率测定参照Hafezparast-Moadab等(2018)的方法。
1.3.5 蒸煮损失率的测定参照Hong等(2013)的方法。
1.3.6 TVB-N含量测定参照Yu等(2017)的方法并略有修改,准确称取2 g解冻后鱼肉,加入18 ml预冷的去离子水,均质(5000 r/min, 1 min),离心(4℃, 10000 g, 10 min),取5 ml上清液与消化管中,加入5 ml 10 g/L氧化镁,迅速连接至凯氏定氮仪,开始蒸馏,蒸馏液用10 ml 20 g/L硼酸吸收,并用0.01 mol/L盐酸标准溶液进行滴定。
1.3.7 K值测定参照Yu等(2018a)的方法。HPLC条件:Waters 2998和Waters C18柱,样品室温和柱温分别为4℃和30℃,流动相为98%磷酸钾缓冲液(0.05 mol/L, pH 6.8)和2%的甲醇。
1.3.8 Ca2+-ATP酶活性测定肌原纤维蛋白的提取方法参照Yu等(2018b)的方法。酶活测定参照Kobayashi等(2017)的方法并略有修改,用0.6 mol/L KCl将肌原纤维蛋白溶液稀释到4.0 mg/ml,反应体系为0.5 ml 0.5 mol/L Tris-HCl缓冲液(pH 7.0)、0.5 ml 20 mmol/L ATP溶液(pH 7.0)、7.5 ml去离子水、0.5 ml 0.1 mol/L CaCl2溶液和1.0 ml肌原纤维蛋白溶液。25℃水浴10 min后,立刻加入3 ml预冷的15% TCA作为反应终止液,将混合物离心(4000 g, 5 min),空白组在混合反应体系中先加入3 ml预冷的15% TCA,其余步骤均同前,每个样品做3次平行。采用钼酸铵法测定离心上清液中的无机磷含量,Ca2+-ATP酶活性用每10 min每毫克肌原纤维蛋白所释放的无机磷的量来表示。
1.3.9 肌原纤维小片化指数(MFI)测定参照葛黎红(2017)的方法。
1.3.10 肌原纤维长度测定参照Zhou等(2011)的方法。
1.3.11 数据处理结果以平均值±标准差(Mean±SD)表示,采用SPSS 19.0软件进行差异显著性数据分析,以P < 0.05定义为具有显著性差异;采用Image-Pro-Plus 6.0分析肌纤维长度,至少随机选取100条以上样本进行测定,取其平均值;采用Origin 8.6软件作图。
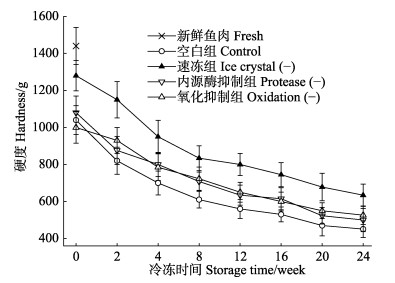
2 结果 2.1 硬度由图 1可知,新鲜河豚鱼肉的硬度值最大,为(1440±105) g,随冻藏时间的不断增加,不同处理组河豚鱼片的硬度值呈现不同程度的下降。冻藏0 d后解冻,鱼片的硬度较新鲜鱼肉下降显著(P < 0.05),到第8周后,硬度分别下降了57.6% (空白组)、42.1% (速冻组)、50.8% (内源酶抑制组)和49.2% (氧化抑制组),冻藏24周后,鱼肉硬度分别下降了68.7% (空白组)、55.8% (速冻组)、65.2% (内源酶抑制组)和63.3% (氧化抑制组)。此下降趋势与Barraza等(2015)研究大西洋鲑鱼在冻藏期间质构的变化趋势相类似。相比空白组,各处理组硬度值在冻藏过程中下降较为缓慢,尤其是速冻组,在冻藏24周后,其硬度较内源酶抑制组和氧化抑制组,分别增加了26.8%和20.5%。冻藏期间,鱼肉质构的劣化是多种因素综合作用的结果,鱼肉在冻结过程中会有冰晶生成,冰晶的大小、形状以及分布直接影响鱼肉内部肌纤维以及肌细胞的完整性。相比于其余各组,液氮冻结可以控制生成细小且均匀分布的冰晶,能最大程度的减少冰晶对肌肉组织造成的机械损伤,从而能够更好的延缓冻藏过程中发生的质构劣化现象。Hafezparast-Moadab等(2018)在研究射频辅助冷冻对虹鳟鱼片微观组织和品质的影响时也发现,生成的冰晶大小与鱼片的质构有着密切的关系。
|
图 1 新鲜和不同处理组鱼片在(-18±1)℃冻藏过程中的硬度 Fig.1 Hardness of fresh pufferfish fillet and pufferfish fillets by different treatments during frozen storage at (–18±1)℃ |
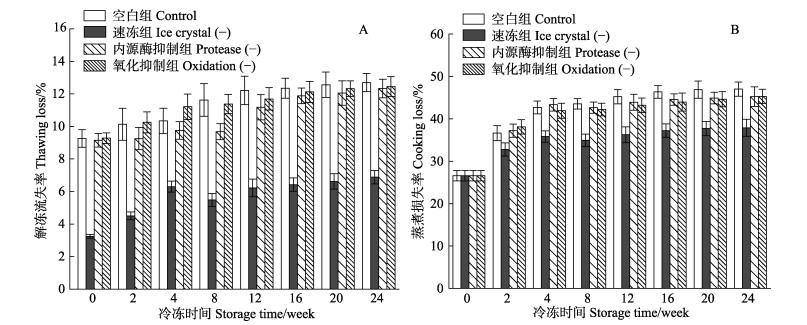
肌肉的持水能力直接影响鱼肉的嫩度、多汁性以及色香味等食用品质,与质构、营养以及风味等密切相关。其中,解冻流失率以及蒸煮损失率是评价鱼肉持水性能的2项重要指标,实验结果如图 2所示。
|
图 2 不同处理组鱼片在(-18±1)℃冻藏过程中的解冻流失率(A)和蒸煮损失率(B) Fig.2 Thawing loss(A) and cooking loss(B) of pufferfish fillets by different treatments during frozen storage at (-18±1)℃ |
图 2A为不同处理组对冻藏过程中暗纹东方鲀解冻流失率的影响。由图 2A可知,在整个冻藏过程中,速冻组的解冻流失率最低,在第0周,约为其他组的35%。随着冻藏时间的延长,解冻流失率呈现缓慢增加的变化趋势。在冻藏24周后,空白组、内源酶抑制组和氧化抑制组的解冻流失率分别较速冻组增加了84%、79%和81%。空白组、内源酶抑制组和氧化抑制组的解冻流失率在冻藏24周后无显著性差异(P > 0.05)。Cai等(2014)研究不同的冻结方式对鲈鱼片持水力的影响时也得到了相似的实验结果。鱼肉在解冻的过程中,汁液流失涉及到水分从肌原纤维内部向细胞外空间的转移,并且会受到肌肉组织内部结构变化的影响(Bertram et al, 2002)。而汁液流失主要是由于冰晶的形成所导致的,在冻藏过程中,冰晶的形成会破坏细胞的完整性,并且增加了细胞外空间的水量。随着冻藏时间的增加,由于温度波动,鱼肉内部的冰晶体积会进一步变大,机械破坏作用增强(Kaale et al, 2013)。速冻组的解冻流失率远小于其余组,可能是因为液氮冻结速度快,可以快速通过最大冰晶生成带,生成细小冰晶,从而降低了解冻时汁液的流失。
图 2B表示不同处理对于暗纹东方鲀冻藏期间蒸煮损失率的影响。由图 2B可知,4组鱼肉在冻藏过程中蒸煮损失率的变化情况与解冻流失率相似,其中,速冻组的蒸煮损失率在同一冻藏期间都显著小于其他组,空白组、内源酶抑制组和氧化抑制组的蒸煮损失率在相同冻藏时间下无显著性差异,冻藏24周后,解冻流失率较速冻组增加了约25%。较高的蒸煮损失率可以归因为冻藏过程生成的大冰晶对肌肉组织的破坏作用。
2.3 TVB-N淡水鱼在冻藏期间,挥发性盐基氮是指鱼肉在酶和微生物的共同作用下,使得蛋白质和其余的含氮化合物分解而产生的具有挥发性的氨及胺类等含氮物质,常用来评价淡水鱼在贮藏期间鱼肉的新鲜度。
冻藏期间,不同处理组对暗纹东方鲀鱼片TVB-N含量的影响如图 3所示。新鲜鱼片的TVB-N值为(7.95±0.21) mg/100 g,随着冻藏时间的延长,各组鱼片的TVB- N含量均呈现逐渐上升的变化趋势。-18℃冻藏24周后,空白组、速冻组、内源酶抑制组和氧化抑制组的鱼片,TVB-N值分别达到(14.8±0.41)、(10.5±0.28)、(13.7±0.37)和(13.2±0.31) mg/100g。He等(2015)研究也发现了相似的实验结果,在冻藏过程中罗非鱼(Oreochromis)的TVB-N含量也随冻藏时间的

|
图 3 新鲜和不同处理组鱼片在(-18±1)℃冻藏过程中的挥发性盐基氮含量 Fig.3 TVB-N of fresh pufferfish fillet and pufferfish fillets by different treatments during frozen storage at (-18±1)℃ |
延长而不断上升。宋敏等(2017)研究发现鮰鱼片在-18℃下冻藏16周,TVB-N值即达到18.98 mg/100 g,显著高于本实验结果,可能是因为鱼种的差异所导致。冻藏8周后,TVB-N值表现为空白组 > 内源酶抑制组 > 氧化抑制组 > 速冻组。导致这一结果的原因可能是由于液氮的温度极低(-196℃),会导致部分不耐低温的微生物死亡,从而降低了冻藏过程中微生物的数量(Naher et al, 2005)。此外,冻结过程生成的细小冰晶可以有效的延缓细胞破裂,进而延缓了细胞内酶与胞外物质发生的生化反应,从而使鱼片在冻藏过程中腐败变质的速度变慢。
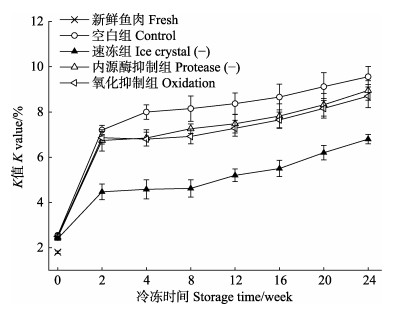
2.4 K值据文献报道,K值主要是由于内源性生物化学变化使得核苷酸降解,在近年来,也被广泛用作评价水产品新鲜度的重要指标之一(Yu et al, 2017),图 4为不同处理对暗纹东方鲀在冻藏过程中K值的影响。
|
图 4 新鲜和不同处理组鱼片在(-18±1)℃冻藏条件下的K值 Fig.4 K value of fresh pufferfish fillet and pufferfish fillets by different treatments during frozen storage at (-18±1)℃ |
由图 4可知,新鲜鱼肉的K值为(1.8±0.06)%,冻藏第2周,鱼肉K值迅速增加。空白组、速冻组、内源酶抑制组和氧化抑制组分别是新鲜样品的530%、370%、500%和480%。第2周后,各处理组K值缓慢增加,在冻藏末期,空白组、速冻组、内源酶抑制组和氧化抑制组K值分别达到(9.6±0.31)%、(6.8±0.21)%、(9.0± 0.35)%和(8.7±0.25)%。在冻藏前期,K值迅速上升,主要归因于在冻结过程中生成冰晶,对肌肉组织以及肌细胞造成不可逆的机械损伤,使得细胞的内容物外流,加剧了未冻结组织液的酶活反应,从而导致冻藏前期K值迅速增加。而速冻组采用液氮冻结,在冻结过程中生成的冰晶体积较小,从而在最大程度上保持了细胞的完整性,有效的抑制了ATP的降解过程,更好的保持了鱼肉在冻藏期间的新鲜度。
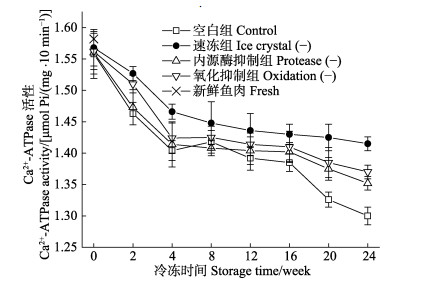
2.5 Ca2+-ATPase活性Ca2+-ATPase活性源于肌球蛋白的球状头部结构,其活性与头部区域完整性密切相关,广泛用于判断冻藏期间,肌原纤维结构特别是肌球蛋白头部结构变化的较为灵敏的指标。
如图 5所示,随冻藏时间的延长,不同处理品的Ca2+- ATPase活性呈现逐渐下降的变化趋势。冻藏4周后,空白组、速冻组、内源酶抑制组和氧化抑制组Ca2+- ATPase活性分别约为1.39、1.47、1.41和1.42 μmol Pi/mg/ 10 min。在16周后,空白组Ca2+-ATPase活性迅速下降,24周时达到1.3 μmol Pi/mg protein/10min。相比于新鲜鱼肉肌原纤维蛋白Ca2+-ATPase活性,在冻藏末期,空白组、速冻组、内源酶抑制组和氧化抑制组分别降低了21.7%、10.9%、17.1%和15.7%,在整个冻藏过程中,速冻组Ca2+-ATPase活性在相同冻藏周期都显著高于其他组。Ca2+-ATPase活性在冷冻保藏期间的下降主要归因于肌球蛋白球状头部构象的变化以及蛋白发生的聚集和交联作用(Benjakul et al, 1997),速冻组在冻藏过程中,由于细胞结构相比于其余组较为完整,在一定程度上抑制了蛋白的聚集、交联,进而抑制了肌原纤维蛋白冷冻变性,保护了肌球蛋白的球状结构,从而在冻藏过程中具有更高的Ca2+-ATPase活性。
|
图 5 新鲜和不同处理组鱼片在(-18±1)℃冻藏条件下的Ca2+-ATPase活性 Fig.5 Ca2+-ATPase activity of fresh pufferfish fillet and pufferfish fillets by different treatments during frozen storage at (-18±1)℃ |
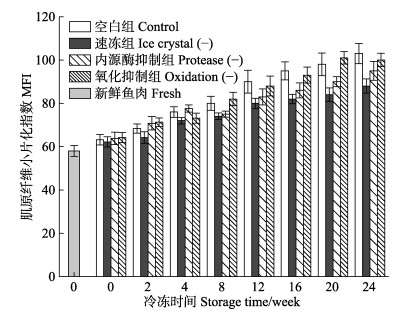
肌原纤维小片化指数是指1~4个肌节的肌原纤维在总肌原纤维片段数中所占的比例,反映了肌原纤维以及骨架蛋白的完整性。MFI越大,说明肌原纤维内部的完整性受到破坏的程度越大(郑海波, 2008),此指标可以从宏观上反应鱼肉在冻藏过程中肌原纤维蛋白的降解情况,是反映肉制品品质的重要指标。
不同处理组暗纹东方鲀在冻藏过程中MFI的变化情况如图 6所示。由图 6可知,新鲜鱼肉的MFI值最小,为58±3.6,随着冻藏时间的延长,所有组MFI值都呈现不断上升的变化趋势,当冻藏时间达到第8周时,空白组、速冻组、内源酶抑制组和氧化抑制组较新鲜鱼肉MFI值分别增加了37.9%、27.6%、31.2%和38.1%。在冻藏24周后,空白组、速冻组、内源酶抑制组和氧化抑制组MFI值分别约为103、88、95和100。在相同冻藏周期,空白组和氧化抑制组MFI值之间无显著性差异,而内源酶抑制组和速冻组的MFI值显著低于其余2组。内源酶抑制组之所以会有较低的MFI值,是因为在低温条件下,内源蛋白酶仍然发挥着降解肌原纤维的作用,抑制内源蛋白酶后肌原纤维蛋白降解程度便会下降。而速冻组由于生成细小、均匀分布的冰晶,可以有效的延缓肌原纤维蛋白的碎片化,更好的维持肌原纤维蛋白的结构完整性,这也是速冻组具有较好的质构特性和持水性的原因之一。Tironi等(2010)研究鲈鱼在冻藏过程中微观结构的变化时,也发现了肌纤维出现碎片化,且冻结速率越慢,碎片化程度越明显。
|
图 6 新鲜和不同处理组鱼片在(-18±1)℃冻藏条件下肌原纤维小片化指数 Fig.6 MFI of fresh pufferfish fillet and pufferfish fillets during by different treatments frozen storage at (-18±1)℃ |
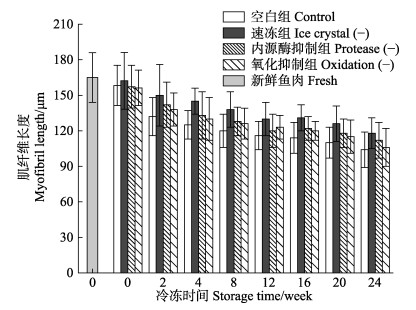
不同处理组暗纹东方鲀在冻藏过程中肌纤维长度的变化如图 7所示,新鲜鱼肉具有最大肌纤维长度,达到(165±32) μm,随着冻藏时间的延长,各处理组肌纤维长度逐渐下降,在冻藏24周后,较新鲜鱼肉样品的肌纤维长度,空白组、速冻组、内源酶抑制组和氧化抑制组分别下降了37.1%、28.5、32.1%和35.8%。Zhou等(2011)也报道过相似的变化情况,在冷藏条件下,暗纹东方鲀冷藏6 d后空白组肌纤维长度下降了42.6%。在同一冻藏周期,内源酶抑制组和氧化抑制组的肌纤维长度无显著性差异,而速冻组的肌纤维长度显著高于其他组。鱼死后鱼肉会经历如下过程:尸僵、解僵、自溶和细菌性腐败,在这一过程中会伴随蛋白的降解以及肌纤维超微结构的解体和I带的断裂,出现这一结果可以归因于各种酶,如钙蛋白酶、胰蛋白酶和脂肪酶等的综合作用,使得鱼肉肌纤维长度在死后储藏过程中不断缩短(Taylor et al, 1998)。鱼肉在冻藏过程中,由于冰晶的存在,破坏了细胞的完整性以及对肌纤维产生的机械损伤作用,使得鱼肉在冻藏过程中肌纤维长度不断下降。液氮快速冻结,生成细小冰晶,一方面减弱了对肌纤维的破坏作用,另一方面有效延缓了细胞的破裂,与MFI测定结果相一致。
|
图 7 新鲜和不同处理组鱼片在(-18±1)℃冻藏条件下的肌纤维长度 Fig.7 Myofibril length of fresh pufferfish fillet and pufferfish fillets by different treatments during frozen storage at (-18±1)℃ |
随着河豚鱼控毒以及养殖技术的发展,其安全性和营养性逐步得到了消费者的认可,但由于其上市时间高度集中,鲜销有限,通常采用冻藏方式进行长期保存已备后续加工。但冻藏暗纹东方鲀品质劣化的问题成为困扰相关加工企业的技术难题。
在冻藏过程中,低温虽然可以抑制内源蛋白酶的活性,但并不能使酶完全失活。随冻藏周期的延长,冰晶对肌肉组织和细胞的机械破坏作用不断增加以及细胞液的浓缩作用,使得内源蛋白酶在冻藏过程中缓慢的发挥着作用。从上述结果可以看出,在冻藏过程中通过抑制内源蛋白酶的活性可以在一定程度上延缓蛋白质的降解,进而延缓冻藏过程中质构的劣化,同时对于冻藏过程鲜度的保持也有一定的作用,但对鱼肉的持水特性无显著影响。冻藏过程发生的脂肪氧化和蛋白氧化不仅影响了水产品解冻后的风味,而且一些氧化产物会和蛋白质反应,进一步加剧了质构的劣化。在实验结果中可以看到,当氧化作用被抑制时,河豚鱼肉的质构劣化程度被延缓,持水性能相较于空白组也有所提高,在一定程度上也抑制了蛋白质的冷冻变性以及降解。
水产品一般水分含量较高,在冻结过程中,除部分紧密结合水外,90%以上的水都会被冻结,进而生成冰晶。在冻藏过程中,由于温度波动,细小的冰晶会融化进入大冰晶中,冰晶的体积不断增加,鱼肉组织以及细胞受到的不可逆机械损伤也进一步增强。使得细胞内溶物外流,加剧了冻藏过程中发生的生化反应,导致了鱼肉在冻藏过程中品质下降。冷冻过程中冰晶、内源蛋白酶以及氧化对于暗纹东方鲀在冻藏过程中品质劣化都有贡献作用,且品质劣化过程主要发生在冻藏前期,在冻藏后期,品质变化较为缓慢。相比于冻藏过程中发生的氧化作用以及内源蛋白酶这2个因素,在初始冻结过程中生成的冰晶的性质是影响暗纹东方鲀在冻藏过程中品质变化的最主要影响因素。
此研究有助于明确暗纹东方鲀在冻藏过程中品质劣化的机理,从而为高品质暗纹东方鲀的工业化生产提供理论指导,进而促进水产加工业的健康长远发展,对于暗纹东方鲀养殖业的发展也有积极的带动作用。
Barraza FAA, Leon RAQ, Alvarez PXL. Kinetics of protein and textural changes in Atlantic salmon under frozen storage. Food Chemistry, 2015, 182: 120-127 DOI:10.1016/j.foodchem.2015.02.055 |
Benjakul S, Seymour TA, Morrissey MT. Physicochemical changes in Pacific whiting muscle proteins during iced storage. Journal of Food Science, 1997, 62(4): 729-733 DOI:10.1111/j.1365-2621.1997.tb15445.x |
Bertram HC, Purslow PP, Andersen HJ. Relationship between meat structure, water mobility, and distribution: A low-field nuclear magnetic resonance study. Journal of Agricultural and Food Chemistry, 2002, 50(4): 824-829 DOI:10.1021/jf010738f |
Cai LY, Wu XS, Li XX, et al. Effects of different freezing treatments on physicochemical responses and microbial characteristics of Japanese sea bass (Lateolabrax japonicas) fillets during refrigerated storage. LWT - Food Science and Technology, 2014, 59(1): 122-129 DOI:10.1016/j.lwt.2014.04.062 |
Chan JTY, Omana DA, Betti M. Effect of ultimate pH and freezing on the biochemical properties of proteins in turkey breast meat. Food Chemistry, 2011, 127(1): 109-117 DOI:10.1016/j.foodchem.2010.12.095 |
Chen YP, Cui WX, Gao RC, et al. Changes in quality of sturgeon fillet during 4℃ and -3℃ partial freezing storage. Progress in Fishery Sciences, 2019 [陈依萍, 崔文萱, 高瑞昌, 等. 冷藏与微冻贮藏过程中鲟鱼肉品质变化. 渔业科学进展, 2019 DOI:10.19663/j.issn2095-9869.20181017001] |
Cheng L, Sun DW, Zhu Z, et al. Emerging techniques for assisting and accelerating food freezing processes: A review of recent research progresses. Critical Reviews in Food Science and Nutrition, 2017, 57(4): 769-781 DOI:10.1080/10408398.2015.1004569 |
Ge LH, Xu YS, Xia WS, et al. Differential role of endogenous cathepsin and microorganism in texture softening of ice- stored grass carp (Ctenopharyngodon idella) fillets. Journal of the Science of Food and Agriculture, 2016, 96(9): 3233-3239 DOI:10.1002/jsfa.7506 |
Hafezparast-Moadab N, Hamdami N, Dalvi-Isfahan M, et al. Effects of radiofrequency-assisted freezing on microstructure and quality of rainbow trout (Oncorhynchus mykiss) fillet. Innovative Food Science and Emerging Technologies, 2018, 47: 81-87 DOI:10.1016/j.ifset.2017.12.012 |
He Q, Zhu L, Shen Y, et al. Evaluation of the effects of frozen storage on the microstructure of tilapia (Perciformes: Cichlidae) through fractal dimension method. LWT - Food Science and Technology, 2015, 64(2): 1283-1288 DOI:10.1016/j.lwt.2015.07.036 |
Hong H, Luo YK, Zhou ZY, et al. Effects of different freezing treatments on the biogenic amine and quality changes of bighead carp (Aristichthys nobilis) heads during ice storage. Food Chemisty, 2013, 138(2-3): 1476-1482 DOI:10.1016/j.foodchem.2012.11.031 |
Kaale LD, Eikevik TM, Bardal T, et al. The effect of cooling rates on the ice crystal growth in air-packed salmon fillets during superchilling and superchilled storage. International Journal of Refrigeration, 2013, 36(1): 110-119 DOI:10.1016/j.ijrefrig.2012.09.006 |
Kaale LD, Eikevik TM, Rustad T, et al. Changes in water holding capacity and drip loss of Atlantic salmon (Salmo salar) muscle during superchilled storage. LWT - Food Science and Technology, 2014, 55(2): 528-535 DOI:10.1016/j.lwt.2013.10.021 |
Kobayashi Y, Park JW. Biochemical and physical characterizations of fish protein isolate and surimi prepared from fresh and frozen whole fish. LWT - Food Science and Technology, 2017, 77: 200-207 DOI:10.1016/j.lwt.2016.11.027 |
Ge LH. Study on contribution of endogenous proteases with texture deterioration of grass carp (Ctenopharyngodon idella) during chilled storage and quality control. Doctoral Dissertation of Jiangnan University, 2017, 1-113 [葛黎红.内源蛋白酶在低温保鲜草鱼质构劣化中的作用与控制研究.江南大学博士研究生学位论文, 2017, 1-113] http://cdmd.cnki.com.cn/Article/CDMD-10295-1017273069.htm
|
Li YQ, Wang LY, Tao NP. Analysis and evaluation of nutritional composition of farmed male pufferfish (Takifugu obscurus). SHS Web of Conferences, 2014, 6: 130-147 |
Lu H, Liu XC, Zhang YM, et al. Effects of chilling and partial freezing on rigor mortis changes of bighead carp (Aristichthys nobilis) fillets: Cathepsin activity, protein degradation and microstructure of myofibrils. Journal of Food Science, 2015, 80(12): 2725-2731 DOI:10.1111/1750-3841.13134 |
Ma Y, Xie J, Zhou R, et al. Application of complex cryoprotectant on Takifugu obscures during frozen storage. Journal of Food Science and Biotechnology, 2012a, 31(5): 101-106 [马妍, 谢晶, 周然, 等. 复合抗冻剂在暗纹东方鲀冻藏过程中的应用. 食品与生物技术学报, 2012a, 31(5): 101-106] |
Ma Y, Xie J, Zhou R, et al. Effects of frozen storage temperature on ultrastructure and biochemical properties of Takifugu obscures. Journal of Northwest A and F University, 2014, 42(5): 141-146 [马妍, 谢晶, 周然, 等. 冻藏温度对河豚鱼鱼肉微观结构及生化指标的影响. 西北农林科技大学学报, 2014, 42(5): 141-146] |
Ma Y, Xie J, Zhou R, et al. Quailty degradation kinetics of Takifugu obscures at different storage temperatures. Journal of China Agricultural University, 2012b, 17(1): 138-142 [马妍, 谢晶, 周然, 等. 暗纹东方鲀在不同冻藏温度下品质变化的动力学研究. 中国农业大学学报, 2012b, 17(1): 138-142] |
Naher S, Ali Y, Alam MI. Quality changes in Pangus (Pang- asius hypopthalamus) in relation to size and season during storage in ice. Pakistan Journal of Biological Science, 2005, 8: 4-7 |
Kobayashi R, Kimizuka N, Watanabe M, et al. The effect of supercooling on ice structure in tuna meat observed by using X-ray computed tomography. International Journal of Refrigeration, 2015, 60: 270-277 DOI:10.1016/j.ijrefrig.2015.07.011 |
Sebranek JG, Sewalt VJH, Robbins KL, et al. Comparison of a natural rosemary extract and BHA/BHT for relative antioxidant effectiveness in pork sausage. Meat Science, 2005, 69(2): 289-296 DOI:10.1016/j.meatsci.2004.07.010 |
Song M, Xu YS, Xia WS, et al. Effects of different freezing methods on the quality of channel catfish fillets. Food Science and Technology, 2017, 42(8): 154-159 [宋敏, 许艳顺, 夏文水, 等. 冻结方式对鮰鱼片品质的影响. 食品科技, 2017, 42(8): 154-159] |
Taylor RG, Koohmaraie M. Effects of postmortem storage on the ultrastructure of the endomysium and myofibrils in normal and callipyge longissimus. Journal of Animal Science, 1998, 76(11): 2811-2817 DOI:10.2527/1998.76112811x |
Tironi V, de Lamballerie M, Le-Bail A. Quality changes during the frozen storage of sea bass (Dicentrarchus labrax) muscle after pressure shift freezing and pressure assisted thawing. Innovative Food Science and Emerging Technologies, 2010, 11(4): 565-573 DOI:10.1016/j.ifset.2010.05.001 |
Turgut SS, Isikci F, Soyer A. Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage. Meat Science, 2017, 129: 111-119 DOI:10.1016/j.meatsci.2017.02.019 |
Yang F, Rustad T, Xu YS, et al. Endogenous proteolytic enzymes-A study of their impact on cod (Gadus morhua) muscle proteins and textural properties in a fermented product. Food Chemistry, 2015, 172: 551-558 DOI:10.1016/j.foodchem.2014.09.086 |
Yu DW, Jiang QX, Xu YS, et al. The shelf life extension of refrigerated grass carp (Ctenopharyngodon idellus) fillets by chitosan coating combined with glycerol monolaurate. International Journal of Biological Macromolecules, 2017, 101: 448-454 DOI:10.1016/j.ijbiomac.2017.03.038 |
Yu DW, Regenstein JM, Zang JH, et al. Inhibitory effects of chitosan-based coatings on endogenous enzyme activities, proteolytic degradation and texture softening of grass carp (Ctenopharyngodon idellus) fillets stored at 4 ℃. Food Chemistry, 2018a, 262: 1-6 DOI:10.1016/j.foodchem.2018.04.070 |
Yu DW, Xu YS, Regenstein JM, et al. The effects of edible chitosan-based coatings on flavor quality of raw grass carp (Ctenopharyngodon idellus) fillets during refrigerated storage. Food Chemistry, 2018b, 242: 412-420 DOI:10.1016/j.foodchem.2017.09.037 |
Zhou R, Liu Y, Xie J, et al. Effects of combined treatment of electrolysed water and chitosan on the quality attributes and myofibril degradation in farmed obscure puffer fish (Takifugu obscurus) during refrigerated storage. Food Chemistry, 2011, 129(4): 1660-1666 DOI:10.1016/j.foodchem.2011.06.028 |
Zheng HB. Analysis and comparison of the quality of Chinese mitten crab. Master′s Thesis of Jiangnan University, 2008, 1-67 [郑海波.中华绒螯蟹的品质分析与比较.江南大学硕士研究生学位论文, 2008, 1-67] http://d.wanfangdata.com.cn/Thesis/Y1397801
|



