2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Shandong Provincial Key Laboratory of Fishery Resources and Eco-Environment, Qingdao 266071
耳石(Otolith)是位于硬骨鱼类内耳膜迷路内的一种碳酸钙结晶体,主要成分为碳酸钙和有机质。鱼类耳石中碳、氧稳定同位素(δ13C和δ18O)成分具有独特的性质,真实记录了鱼类所经历的生态环境的变化(Gao et al, 2003;高永文等, 2004)。其中,δ13C被证实与饵料的关系较为密切(Schwarcz et al, 1998),而δ18O则被证实为与水温关系十分密切(Hoie et al, 2004;姜涛等, 2015;高永文等, 2011)。近年来,稳定同位素应用于鱼类研究中颇多,如鱼类的种群鉴别(Gao et al, 2010)和产卵场(Shiao et al, 2010)、索饵场的划分(Rooker et al, 2008),以及深海鱼垂直迁移路径(Longmore et al, 2011; Lin et al, 2012)等。Gao等(1999)利用大马哈鱼(Oncorhynchus nerka)耳石中碳氧稳定同位素特征作为栖息地的指标来辨别鱼类种群。Thorrold等(2001)通过对不同海域的犬牙石鱼(Cynoscion regalis)耳石中稳定性同位素δ13C和δ18O的分析,确定了5个不同海域的犬牙石鱼出生地和资源群单元的差异,判别成功率达60%~81%。研究发现,加勒比海和地中海大西洋黑鲔(Thunnus thynnus)全耳石的δ18O有明显差异,地中海的大西洋黑鲔的耳石δ18O介于–1.08%与–1.30%之间,而加勒比海的大西洋黑鲔个体的耳石介于–2.09%与–2.39%之间,其判别率高达98%(Rooker et al, 2004)。因此,耳石中δ13C和δ18O可以反映鱼类的环境生活史,可以作为自然标记物探索鱼类种群的连通性和差异性,识别鱼类种群。
小黄鱼(Larimichthys polyactis)属硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、石首鱼科(Sciaendae)、黄鱼属(Larimichthys),广泛分布于中国渤海、黄海和东海以及朝鲜半岛西岸海域,通常栖息于水域近底层,水深不超过100 m,具有明显的垂直移动现象(李建生等, 2009),对温度和盐度适应范围较广(谢立峰等, 2006)。关于小黄鱼种群划分问题,从20世纪50年代至今一直存在争议,熊瑛等(2018)总结了鱼类种群划分方法在小黄鱼种群研究上的应用,并探讨了这些方法各自的可靠性和局限性。以往的研究中,一些学者将我国近海小黄鱼划分为3个种群,即黄渤海种群、南黄海种群和东海种群(林新濯等, 1965;张秋华等, 2007;毛锡林等, 1987;叶昌臣, 1991;俞连福等, 2003;严利平等, 2014);而另一些学者则认为东、黄、渤海小黄鱼还存在第4个种群,即黄海中部种群(刘效舜, 1990;赵传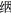 , 1990;金显仕等, 2005;唐启升, 2012)。徐兆礼等(2010)在前人研究的基础上,重新审视了我国近海小黄鱼种群的划分问题,提出中国近海小黄鱼仅存在2个种群,即黄海南部和东海小黄鱼种群及渤海和黄海北部小黄鱼种群;此外,王玉堃等(2016)对不同采样站位小黄鱼耳石元素含量进行分析,将黄、渤海小黄鱼早期补充群体划分为渤海种群、黄海中部种群和南黄海种群。
, 1990;金显仕等, 2005;唐启升, 2012)。徐兆礼等(2010)在前人研究的基础上,重新审视了我国近海小黄鱼种群的划分问题,提出中国近海小黄鱼仅存在2个种群,即黄海南部和东海小黄鱼种群及渤海和黄海北部小黄鱼种群;此外,王玉堃等(2016)对不同采样站位小黄鱼耳石元素含量进行分析,将黄、渤海小黄鱼早期补充群体划分为渤海种群、黄海中部种群和南黄海种群。
本研究对黄、渤海秋季小黄鱼补充群体耳石中δ13C和δ18O的值进行分析,探讨了我国黄、渤海小黄鱼的种群划分问题,以及其可能的生态学意义,以期为小黄鱼资源的保护和科学管理提供基础。
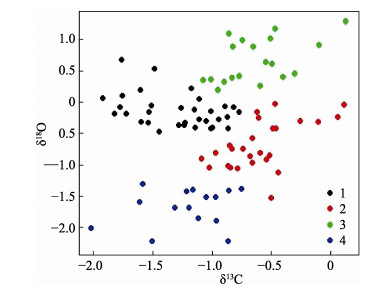
1 材料与方法 1.1 实验材料本研究的样品来自2006年9~10月中国水产科学研究院黄海水产研究所进行的秋季连续航次黄、渤海渔业资源底拖网调查,调查范围为119.39°~ 124.22°E、31.30°~39.06°N。本研究采用的小黄鱼样品共92尾,体长平均值为(120.14±18.02) mm,耳石重平均值为(73.45±24.92) mg,结合张国政等(2010)研究中当年生幼鱼体长体重关系,可以确定本研究所用小黄鱼样品均为当年生个体。样品共19个站位,如图 1所示。由于耳石保存时间较久,用30%双氧水浸泡2遍,再用刷子将耳石附着的有机组织清洗干净,最后用蒸馏水冲洗数遍,烘干称重,研磨成粉末,保存于离心管待后续测定。

|
图 1 小黄鱼样本采集站位 Fig.1 Sampling sites of L. polyactis |
每个耳石称取2 mg样品于顶空瓶中,用带硅胶隔垫的盖子密封,通过离线吹扫用氦气排空反应瓶中的空气,消除其对δ13C、δ18O分析结果的影响。经吹扫处理后,通过向反应瓶中加入7滴浓磷酸,在72℃条件下反应1 h,磷酸与碳酸盐反应释放出的CO2在高纯氦气的带动下在线除水,通过30 m的Poraplot Q色谱柱与其他杂质气体分离,分离后的CO2直接进入Delta Plus稳定同位素质谱仪(Finnigan公司生产)进行δ13C、δ18O测定。碳氧稳定同位素比值用国际通用的δ值表示,按以下公式计算:
| $ {\rm{\delta }}X\left( ‰ \right) = \left( {{R_{样品}} - {R_{标准}}} \right)/{R_{标准}} \times 1000 $ |
式中,X为13C或者18O,R(以国际标准的V-PDB为基准)为13C/12C或18O/16O者的比值。为保证实验结果的精度和准确度,将CO2标准气体作为参考气。标准物质采用NBS19(δ13C:1.95‰;δ18O:–2.20‰)和IAEA-CO-8(δ13C:–5.80‰;δ18O:–22.70‰)。其中,碳氧的精确度分别为0.10‰和0.20‰。
1.3 数据分析以耳石中δ13C和δ18O为指标,对各站位每尾小黄鱼进行聚类分析。聚类方法为系统聚类法(Hierarchical Cluster),以聚类分析的结果对其进行判别分析,得出其判别成功率。对各种群之间小黄鱼耳石中δ13C和δ18O比值进行单因素方差分析(One-way ANOVA),采用SNK (Student-Newman-Keuls)检验,分析种群之间是否存在显著性差异(P < 0.05)。所有数据分析均采用SPSS 21.0完成。
2 结果 2.1 不同站位小黄鱼耳石δ13C和δ18O的聚类结果和判别分析以各站位每尾小黄鱼左矢耳石中δ13C和δ18O的值作为变量,对全部92尾小黄鱼进行系统聚类,得出树状图(图 2)。92尾小黄鱼被分成4类,树状图从左到右的4类记为1、2、3和4类。其中,聚类结果显示,92尾小黄鱼先单独聚类出第4类,且显示与其他类没有站位交叉现象,接着又聚类出第3类,最后聚类出第1类和第2类,总体聚类结果明显。
|
图 2 小黄鱼耳石δ13C和δ18O的聚类分析 Fig.2 Cluster analysis tree diagram of δ13C and δ18O in otolith of L. polyactis |
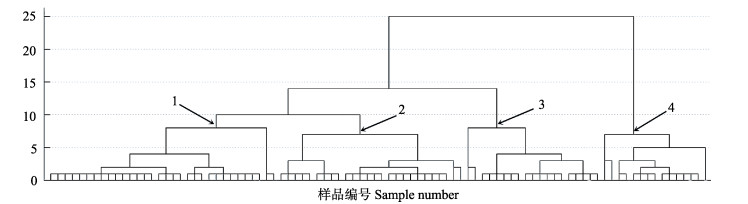
根据该聚类结果,基于92尾小黄鱼耳石δ13C和δ18O指标绘制散点分布图。由图 3可知,92尾小黄鱼被分成明显的4类。其中,第1类包含主要站位为S1、S2、S3、S4和S5;第2类包含主要站位为S6、S7、S8、S9和S10;第3类包含主要站位为S11、S13、S14、S15和S16;第4类只包含站位S12、S17、S18和S19。结果显示,第4类与其他3类没有显著的站位交叉现象。
|
图 3 基于δ13C和δ18O指标对所有小黄鱼的聚类分析 Fig.3 Cluster analysis of all L. polyactis based on δ13C and δ18O 1:主要站位S1、S2、S3、S4和S5;2:主要站位 S6、S7、S8、S9和S10;3:主要站位S11、S13、S14、S15和S16;4:站位S12、S17、S18和S19 1: Main sites: S1, S2, S3 and S4, S5; 2: Main sites: S6, S7, S8 and S9, S10; 3: Main sites: S11, S13, S14, S15 and S16; 4: Sites: S12, S17, S18 and S19 |
对聚类结果进行判别分析,结果如表 1所示。由表 1可知,种群1共29尾小黄鱼,其中22尾进行正确聚类,其判别成功率为75.9%;种群2共20尾小黄鱼,其中16尾进行正确聚类,其判别成功率为80.0%;种群3共21尾小黄鱼,其中17尾进行正确聚类,其判别成功率为81.0%;种群4共22尾小黄鱼,其中21尾进行正确聚类,其判别成功率为95.5%。总体的判别成功率为82.6%。
|
|
表 1 不同种群小黄鱼的判别结果 Tab.1 The classification results of different populations of L. polyactis |
根据聚类结果,对小黄鱼耳石中δ13C和δ18O的值采用SNK(Student-Newman-Keuls)方法进行单因素方差分析(表 2和表 3)。结果显示,第1类和第4类的δ13C没有显著性差异(P > 0.05),第3类与第2类的δ13C也没有显著性差异(P > 0.05),但前2类的δ13C与后2类之间存在显著性差异(P < 0.05);而4个类别的δ18O相互之间存在显著性差异(P < 0.05)。由此可见,耳石中δ18O比δ13C具有更高的辨识度。
|
|
表 2 不同种群小黄鱼δ13C的差异 Tab.2 The δ13C difference of different populations of L. polyactis |
|
|
表 3 不同种群小黄鱼δ18O的差异 Tab.3 The δ18O difference of different populations of L. polyactis |
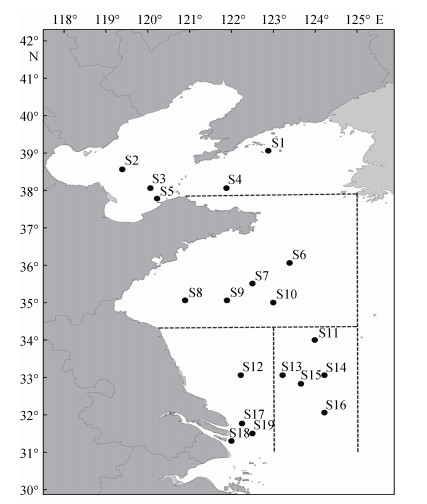
根据聚类结果,对19个站位划分出来的4个种群绘制种群划分区域图(图 4)。由图 4可知,S1、S2、S3、S4和S5站位聚为一类,该类位于渤海与黄海北部,将其定义为渤海黄海北部种群;S6、S7、S8、S9和S10站位聚为一类,该类位于黄海中部,将其定义为黄海中部种群;S11、S13、S14、S15和S16站位聚为一类,该类位于黄海南部深海区,且离陆地较远,将其定义为黄海南部离岸种群;S12、S17、S18和S19站位聚为一类,该类位于黄海南部沿岸海域,将其定义为黄海南部沿岸种群。黄海南部2个种群进行聚类分析时,2个种群间没有站位交叉现象。
|
图 4 不同站位小黄鱼种群划分区域 Fig.4 The population division of L. polyactis at different sites |
鱼类耳石中δ13C受多种因素的影响,如食物来源、新陈代谢速率和溶解的无机碳(DIC)等。食物中δ13C主要与捕获物中δ13C有关,随着捕获物的年龄不同,不同生长阶段的代谢速率和温度不同,其δ13C也相对变化(Jamieson et al, 2004; Sherwood et al, 2003)。研究表明,盐度和δ13C之间存在显著的正相关关系(Bastow et al, 2002; Richard et al, 2012)。Gao等(1999)研究发现,随着大马哈鱼从淡水迁移到海水中,从耳石核心到边缘处,δ13C逐渐增加。本研究结果中,δ13C比值黄海南部离岸种群最高,渤海黄海北部种群最低。渤海黄海北部种群的站位多数位于沿岸和捕捞区,由于人类活动对沿岸海域鱼类的过度捕捞和环境污染,导致沿岸小黄鱼食物链破坏和物种丰富度降低,故渤海与黄海北部的δ13C低;黄海南部离岸种群的站位位于外海,受人类活动干扰小,可能富含DIC或者食物种类丰富,故其δ13C高。而S17、S18和S19站位位于长江口附近,由于长江口冲淡水的作用,内陆淡水汇入外海海区,造成低盐环境,因此,位于长江口附近的黄海南部沿岸种群δ13C比值不高,与前人研究结果相一致(Bastow et al, 2002)。因此,随着不同地理区域的水文特征和食物来源的不同,根据δ13C进行种群划分的方法是可行的。鱼类耳石中δ18O与周围水体环境相平衡,可以反映水体环境的温度变化(Hoie et al, 2004;姜涛等, 2015;高永文等, 2011)。本研究采用的是全耳石,反映的是鱼类整个生命周期的生境信息,而鱼类整个生命周期的温度变化则可以通过耳石核心到边缘处的δ18O分布情况来反映。本研究将黄、渤海19个站位的小黄鱼划分为4个种群,倘若邻近站位的δ18O相似,并不能直接证明这些站位之间鱼类存在混合,也有可能这些站位本身就具有相似的理化环境;相反,倘若不同站位的δ18O不同,则可认为这些站位的鱼类经历了不同的生活环境,不存在充分的混合现象。如图 3所示,不同地理种群的小黄鱼δ18O不同且存在显著性(P < 0.05)差异,说明δ18O指示其特定的生活环境没有混合现象。
研究发现,耳石中δ13C和δ18O的关联分析能有效区分四川裂腹鱼不同养殖年龄群体,可作为一种识别淡水鱼类养殖群体的手段(何勇凤等, 2017);高永文等(2011)以海鱼和洄游鱼的具体研究为例,也说明了δ13C和δ18O的关联分析在鱼群识别方面发挥着独特的作用;Wang等(2016)应用不同站位小黄鱼耳石中δ13C和δ18O比值差异,将黄、渤海小黄鱼种群划分为渤海种群、黄海中部种群和黄海南部种群。故本研究基于耳石δ13C和δ18O划分黄、渤海秋季小黄鱼补充群体的方法是可行的,而且本研究中对每尾小黄鱼样品进行了分类,实验操作简洁有效,所得结果也更详细说明了种群划分的问题,对海洋鱼类种群划分方法加以完善。
3.2 小黄鱼早期补充群体的划分关于我国近海小黄鱼种群的划分一直存在较大分歧,然而,不同种群之间由于生物遗传、进化和种间关系彼此分离,形成生殖隔离和地理隔离,只有了解种群结构才有利于鱼类资源的合理利用和渔业的可持续发展。对于海洋鱼类而言,其并非均匀地分布在物种分布区,而是形成一些被隔离的、相对独立的群体,这种群体是鱼类生存和活动的单位,即种群(Shen et al, 2002)。叶昌臣(1991)研究发现,小黄鱼产卵后分散在渤海、黄海及东海北部各个索饵场进行索饵,且8~11月渤海与黄海小黄鱼饵料组成丰富,摄食强度较高。本研究所取用的19个站位小黄鱼样品处于索饵阶段,且均为当年生个体,分析了各站位每尾小黄鱼左矢耳石中δ13C和δ18O的值,根据其差异性将黄、渤海秋季小黄鱼早期补充群体划分为4个种群,即渤海黄海北部种群、黄海中部种群、黄海南部离岸种群和黄海南部沿岸种群,此结果与以往研究有所差异。王玉堃等(2016)对不同采样站位小黄鱼耳石元素含量的平均值进行聚类分析,将黄、渤海小黄鱼早期补充群体划分为渤海种群、黄海中部种群和南黄海种群。可以看出,本研究通过对每个站位每尾小黄鱼耳石样品中δ13C和δ18O的值进行聚类分析,结果显示,王玉堃等(2016)研究中的南黄海种群在本研究中被进一步细分为黄海南部离岸种群和黄海南部沿岸种群,这也进一步证明了本研究方法更加详细、精确。本研究中由图 2聚类的先后顺序,把黄、渤海19个站位的小黄鱼划分为了黄海南部沿岸种群、黄海南部离岸种群、黄海中部种群和渤海黄海北部种群,且4个种群聚类结果明显,黄海南部2个种群之间没有站位交叉现象。根据种群划分结果,绘制了如图 4的种群划分区域图。除了图 4中划分的4个区域外,其他海域也可能有小黄鱼出现的情况。由于在出海资源调查时,可能因为某些因素没有捕到或者记录在案,导致后面数据统计时,以为这部分海域没有小黄鱼,例如:S11、S13、S14、S15、S16站位所属的黄海南部离岸种群,该海域北部一些海域显示没有小黄鱼,但实际情况可能该海域有小黄鱼出现的站位,只是调查时没有捕到,所以在图 4中没有对该海域进行特定划分。
综上所述,本研究将黄、渤海秋季小黄鱼早期补充群体划分为渤海黄海北部种群、黄海中部种群、黄海南部离岸种群和黄海南部沿岸种群,首次把黄海南部小黄鱼群体细分为了黄海南部离岸种群和黄海南部沿岸种群,且2种群之间很少有站位交叉现象。
Bastow TP, Jackson G, Edmonds JS. Elevated salinity and isotopic composition of fish otolith carbonate: Stock delineation of pink snapper, Pagras auratus, in Shark Bay, Western Australia. Marine Biology, 2002, 141(5): 801-806 DOI:10.1007/s00227-002-0884-8 |
Gao YW, Beamish RJ. Isotopic composition of otoliths as a chemical tracer in population identification of sockeye salmon (Oncorhynchus nerka). Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(11): 2062-2068 |
Gao YW, Beamish RJ. Stable isotopic composition of otoliths from tagged pacific halibut, Hippoglossus stenolepis. Environmental Biology of Fishes, 2003, 67(3): 253-261 DOI:10.1023/A:1025874110893 |
Gao YW, Dettman DL, Piner KR, et al. Isotopic correlation (δ18O versus δ13C) of otoliths in identification of groundfish stocks. Transactions of the American Fisheries Society, 2010, 139(2): 491-501 DOI:10.1577/T09-057.1 |
Gao YW, Lu AH, Song YG. Study on the stable isotope composition of carbon and oxygen in fish otoliths. Progress in Natural Science, 2004(3): 268-272 [高永文, 鲁安怀, 宋玉国. 鱼耳石的碳、氧稳定同位素成分研究. 自然科学进展, 2004(3): 268-272 DOI:10.3321/j.issn:1002-008X.2004.03.005] |
Gao YW, Lu AH, Wang QY, et al. Oxygen and carbon stable isotope methods for fish population identification. Bulletin of Mineralogy Petrology, 2011, 30(3): 270-276 [高永文, 鲁安怀, 王清印, 等. 鱼群识别的氧、碳稳定同位素方法. 矿物岩石地球化学通报, 2011, 30(3): 270-276 DOI:10.3969/j.issn.1007-2802.2011.03.005] |
He YF, Wu XB, Wang XG, et al. Study on the carbon and oxygen stable isotope characteristics of the otoliths from the scutellariae of Sichuan. Chinese Journal of Applied Ecology, 2017, 28(7): 2339-2343 [何勇凤, 吴兴兵, 王旭歌, 等. 四川裂腹鱼耳石碳、氧稳定同位素特征. 应用生态学报, 2017, 28(7): 2339-2343] |
Hoie H, Otterlei E, Folkvord A. Temperature-dependent fractionation of stable oxygen isotopes in otoliths of juvenile cod (Gadus morhua L.). ICES Journal of Marine Science, 2004, 61(2): 243-251 DOI:10.1016/j.icesjms.2003.11.006 |
Jamieson RE, Schwartz HP, Brattey J. Carbon isotopic records from the otoliths of Atlantic cod (Gadus morhua) from eastern Newfoundland, Canada. Fisheries Research, 2004, 68(1-3): 83-97 DOI:10.1016/j.fishres.2004.02.009 |
Jiang T, Liu HB, Yang J. Preliminary report on carbon and oxygen isotope characteristics of otoliths in juveniles of the Yangtze River Estuary. Marine Sciences, 2015, 39(6): 48-53 [姜涛, 刘洪波, 杨健. 长江口刀鲚幼鱼耳石碳、氧同位素特征初报. 海洋科学, 2015, 39(6): 48-53] |
Jin XS, Zhao XY, Meng TX, et al. Small yellow croaker biological resource and habitation environment of the Bohai and Yellow Sea. Beijing: Science Press, 2005: 308-321 [金显仕, 赵宪勇, 孟田湘, 等. 黄渤海生物资源与栖息环境. 北京: 科学出版社, 2005: 308-321]
|
Li JS, Lin LS, Cheng JH. Distribution characteristics of small yellow croaker in autumn in northern East China Sea and its relationship with bottom temperature and salinity. Journal of Fishery Sciences of China, 2009, 16(3): 348-356 [李建生, 林龙山, 程家骅. 东海北部秋季小黄鱼分布特征及其与底层温度和盐度的关系. 中国水产科学, 2009, 16(3): 348-356 DOI:10.3321/j.issn:1005-8737.2009.03.006] |
Lin HY, Shiao JC, Chen YG, Iizuka Y. Ontogenetic vertical migration of grenadiers revealed by otolith microstructures and stable isotopic composition. Deep Sea Research, Part Ⅰ: Oceanographic Research Papers, 2012(61): 123-130 |
Lin XZ, Deng SM, Huang ZY. Study of population on biometrics of small yellow croaker (Pseudosciaena ployactis Bleeker). Collections of marine fishery resource. Beijing: China Agriculture Press, 1965, 84–108 [林新濯, 邓思明, 黄正一.小黄鱼种族生物测定学的研究.见: 海洋渔业资源论文选集.北京: 农业出版社, 1965: 84–108]
|
Liu XS. Small yellow croaker. Fishery Bereau of Ministry of Agriculture, ed. Investigation and division of fisheries resource of the Bohai and Yellow Sea. Beijing: Ocean Press, 1990: 191–200 [刘效舜.小黄鱼.农牧渔业部水产局, 农业部黄海区渔业指挥部.黄渤海区渔业资源调查与区划.北京: 海洋出版社, 1990: 191–200]
|
Longmore C, Trueman CN, Neat F, et al. Otolith geochemistry indicates life-long spatial population structuring in a deep-sea fish, Coryphaenoides rupestris. Marine Ecology Progress, 2011, 435(8): 209-224 |
Richard J, Pruell, Bryan K, et al. Spatial and temporal trends in stable carbon and oxygen isotope ratios of juvenile winter flounder otoliths. Environmental Biology of Fishes, 2012, 93(1): 61-71 DOI:10.1007/s10641-011-9890-3 |
Rooker JR, Secor DH. Stock structure and mixing of Atlantic Bluefin tuna: Evidence from stable δ13C and δ18O isotopes in otolith. Collective Volume of Scientific Papers, 2004, 56(3): 1115-1120 |
Rooker JR, Secor DH, De MG, et al. Natal homing and connectivity in Atlantic bluefin tuna populations. Science, 2008, 322(5902): 742-744 DOI:10.1126/science.1161473 |
Schwarcz HP, Gao Y, Campana S, et al. Stable carbon isotope variations in otoliths of Atlantic cod (Gadus morhua). Canadian Journal of Fisheries and Aquatic Sciences, 1998, 55(8): 1798-1806 DOI:10.1139/f98-053 |
Shen GY, Shi BZ. Marine ecology. Beijing: Science Press, 2002 [沈国英, 施并章. 海洋生态学. 北京: 科学出版社, 2002]
|
Sherwood GD, Rose GA. Influence of swimming form on otolith delta C-13 in marine fish. Marine Ecology Progress Series, 2003(258): 283-289 |
Shiao JC, Wang SW, Yokawa K, et al. Natal origin of Pacific bluefin tuna Thunnus orientalis inferred from otolith oxygen isotope composition. Marine Ecology Progress Series, 2010, 420(6): 207-219 |
Tang QS. Regional Oceangraphy of China Seas-Fisheries Oceanography. Beijing: Ocean Press, 2012: 176-182 [唐启升. 中国区域海洋学—渔业海洋学. 北京: 海洋出版社, 2012: 176-182]
|
Thorrold SR, Latkoczy C, Swart PK, et al. Natal homing in a marine fish metapopulation. Science, 2001, 291(5502): 297-299 DOI:10.1126/science.291.5502.297 |
Wang YK, Huang JS, Dai FQ, et al. Insights into population structure of juvenile small yellow croaker (Larimichthys polyactis) in the Yellow Sea and the Bohai Sea from otolith elemental fingerprints. Acta Oceanologica Sinica, 2016, 38(6): 32-40 [王玉堃, 黄建生, 戴芳群, 等. 黄、渤海小黄鱼耳石元素指纹分析及其在种群补充群体识别中的应用. 海洋学报, 2016, 38(6): 32-40 DOI:10.3969/j.issn.0253-4193.2016.06.004] |
Wang YK, Huang JS, Tang XX, et al. Stable isotopic composition of otoliths in identification of stock structure of small yellow croaker (Larimichthys polyactis) in China. Acta Oceanologica Sinica, 2016, 35(6): 29-33 DOI:10.1007/s13131-016-0868-z |
Xie LF, Fu XK. Parent breeding technology of small yellow croaker. China Fisheries, 2006(1): 50-51 [谢立峰, 付贤康. 小黄鱼亲体培育技术. 中国水产, 2006(1): 50-51 DOI:10.3969/j.issn.1002-6681.2006.01.029] |
Xiong Y, Zheng YJ, Tang JH, et al. Advances in survey methods for population identification in marine fishes and their application to small yellow croaker (Larimichthys polyactis). Marine Fisheries, 2018(1): 117-128 [熊瑛, 郑元甲, 汤建华, 等. 海洋鱼类种群划分的研究方法及其在小黄鱼上的应用进展. 海洋渔业, 2018(1): 117-128 DOI:10.3969/j.issn.1004-2490.2018.01.013] |
Xu ZL, Chen JJ. Discuss the problem of population division of small yellow croaker off the coast of China. Chinese Journal of Applied Ecology, 2010, 21(11): 2856-2864 [徐兆礼, 陈佳杰. 再议中国近海小黄鱼种群的划分问题. 应用生态学报, 2010, 21(11): 2856-2864] |
Yan LP, Liu ZL, Zhang H, et al. On the evolution of biological characteristics and resources of small yellow croaker. Marine Fisheries, 2014, 36(6): 481-488 [严利平, 刘尊雷, 张辉, 等. 小黄鱼生物学特征与资源数量的演变. 海洋渔业, 2014, 36(6): 481-488 DOI:10.3969/j.issn.1004-2490.2014.06.001] |
Ye CC. Small yellow croaker. Marine fishery biology. Beijing: China Agricultural Press, 1991: 164-200 [叶昌臣. 海洋渔业生物学. 北京: 农业出版社, 1991: 164-200]
|
Yu LF, Cheng JH. Small yellow croaker. The biological resources and environment in continental shelf of the East China Sea. Shanghai: Shanghai Science and Technology Press, 2003: 472-488 [俞连福, 程家骅. 小黄鱼.东海大陆架生物资源与环境. 上海: 上海科学技术出版社, 2003: 472-488]
|
Zheng YJ, Chen XZ, Cheng JH, et al. The biological resources and environment in continental shelf of the East China Sea. Shanghai: Shanghai Science and Technology Press, 2003: 472-488 [郑元甲, 陈雪忠, 程家骅, 等. 东海大陆架生物资源与环境. 上海: 上海科学技术出版社, 2003: 472-488]
|
Zhang GZ, Li XS, Zhu JC, et al. study on the growth characteristics of juvenile yellow croakers in the Middle and southern Yellow Sea. Progress in Fishery Sciences, 2010, 31(3): 15-22 [张国政, 李显森, 朱建成, 等. 黄海中南部小黄鱼当年幼鱼生长特征的研究. 渔业科学进展, 2010, 31(3): 15-22 DOI:10.3969/j.issn.1000-7075.2010.03.003] |
Zhang QH, Cheng JH, Xu HX, et al. Sustainable utilization of fishery resource in the East China Sea. Shanghai: Fudan University Press, 2007: 170-182 [张秋华, 程家骅, 徐汉祥, 等. 东海区渔业资源及其可持续利用. 上海: 复旦大学出版社, 2007: 170-182]
|
Zhao CY. Marine fishery resource in China. Hangzhou: Zhejiang Science and Technology Press, 1990, 45–48 [赵传  .中国海洋渔业资源.杭州: 浙江科学技术出版社, 1990, 45–48] .中国海洋渔业资源.杭州: 浙江科学技术出版社, 1990, 45–48]
|



