海藻与细菌间关系复杂,既相互利用(Berg et al, 2002; Hodson et al, 2007; Amin et al, 2015),又相互制约(Manage et al, 2001; 林伟等, 2000)。有相当一部分的海洋藻类在合成生长所必需的维生素B12时,需要通过细菌提供一种辅酶(Croft et al, 2005),但在海洋环境中某些营养物质缺乏时,细菌又会成为藻类的营养竞争者,进而抑制藻类生长(Rier et al, 2002)。大型海藻与附生菌之间的关系平衡对于大型海藻的健康生长至关重要,平衡一旦被打破,会影响到海藻的正常生长发育,有时也会产生病害(沈梅丽等, 2013)。人工养殖的海带表面附生的褐藻酸降解菌,在水温升高或海带养殖密度过高时大量繁殖,造成海带发生病烂(陈騳等, 1979、1981、1984)。因此,分析海带附生菌的群落结构,对防止海带病害的发生,确保产量具有重要的意义。
海带主要用于食品、保健品、工业原料及生物饵料等(张杰, 2016),其生活史由大型叶状孢子体(2n)和微型丝状配子体(n)组成(李静, 2015)。弧菌属(Vibrio)、盐单胞菌属(Halomonas)、假交替单胞菌属(Pseudoalteromonas)、芽孢杆菌属(Bacillus)等被发现存在于海带表面,部分种类与海带病烂有关,不同海域的海带附生菌群结构存在差异(Duan et al, 1995; Wang et al, 2008; Sun et al, 2017; Wang et al, 2017)。近年来,随着二代测序技术应用于海洋微生物群落的分析,可有效、快捷地进行其分型和丰度分析(孙超等, 2014; 李俊峰, 2015; 刘文亮等, 2017)。本研究基于第二代测序技术,研究海带孢子体、配子体附生菌的群落结构,旨在为海带苗种繁育与养殖提供监测数据,也为海带病害的预防提供理论依据。
1 材料与方法 1.1 实验样本采集和前处理海带样本为福建传统养殖品系,2016年4月采自福建霞浦县下浒镇池澳村的海带养殖筏架,并于室内留种室培养至孢子囊成熟(图 1a)。雌、雄配子体由种海带放散游孢子后获得,分离并保存于实验室内(图 1b)。海带幼孢子体由雌配子体卵细胞与雄配子体放散的精子经过受精作用产生(图 1c)。养殖区海带大孢子体是由幼孢子体下海养殖至次年4月的厚成期健康叶状体(图 1d)。各生活史阶段的样本及处理方法如表 1所示,除配子体用无菌海水保存外,其余样本处理前均经灭菌海水清洗数遍去除表面杂质。

|
图 1 不同生活史阶段的藻体样本
Fig.1 Samples collected in deferent growth environment
A、B、C和D分别为种海带(S1)、配子体(S2)、幼孢子体(S3)和大孢子体(S4)
A, B, C, and D showing the samples of mature sporophytes (S1), gametophytes (S2), sporelings (S3) and big sporophytes (S4), respectively |
|
|
表 1 样本类型、来源、环境温度及前处理方法 Tab.1 The types, source, environmental temperature and pre-processing methods of samples |
按照基因组DNA提取试剂盒(QIAamp DNA Mini Kit)说明书要求,提取保存的海带基因组DNA,以制备基因组DNA为模板,使用16S rRNA通用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3')扩增目标DNA片段(Xu et al, 2016)。使用低循环数扩增,并保证每个样本扩增的循环数一致。20 μl PCR扩增体系的反应条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,共27个循环;72℃后延伸10 min。每个样本设3个生物学重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖电泳检测后,收集、纯化,在上海美吉生物医药科技有限公司进行测序分析。
1.3 数据分析用Mothur软件和Excel软件进行数据统计与分析。以97%相似性为标准划分操作分类单元(Operational Taxonomic Unit, OTU)。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,统计各样本的群落组成,并基于OTU结果计算样品的Alpha多样性,包括香农指数(Shannon index)、辛普森指数(Simpson index)、物种丰富度指数(Abundance based coverage, ACE)等(许燕等, 2018)。
2 结果 2.1 PCR产物质量检测用海带制备基因组DNA,以16S rRNA通用引物扩增后,PCR产物经2%琼脂糖凝胶电泳检测,结果如图 2所示,条带清晰明亮,可用于后续的测序分析。
|
图 2 PCR产物2%琼脂糖凝胶电泳检测结果 Fig.2 The results of PCR products examined by 2% agarose electrophoresis 1、2、3和4:S1、S2、S3和S4样本;CK:空白对照组;M:Marker 2000 1, 2, 3, and 4: S1, S2, S3, and S4 samples, respectively; CK: Control check; M: 2000 DL Marker |
海带4个样本经高通量测序及序列优化后,共获得156950条有效序列,平均长度为442 bp,绝大部分的有效序列长度为421~460 bp,占99.96%。各样本合计识别出244种OTU,对测序覆盖度进行统计,结果显示,各样本OTU观察数已达到饱和(Goodxs coverage > 0.999),该测序深度能够较全面地反映海带在不同生活史阶段附生菌的生物群落结构(表 2)。
|
|
表 2 各样本测序结果统计 Tab.2 Statistics of the sequencing results of samples |
将海带4种孢子体、配子体样本的16S rRNA测序结果,与Silva数据库上的参考序列比对注释,统计不同OTU所对应的门、属及其相对丰度,共识别出23门156属。其中,变形菌门(Proteobacteria)在各生活史阶段的群落中均占据优势,在S1、S2、S3和S4样本中分别占53%、94.3%、77.2%和36.7%(表 3),而拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)及疣微菌门(Verrucomicrobia)在整个群落结构中的比例,在海带孢子体、配子体中有较大差异。S1样本中拟杆菌门占40.0%,S4样本中则只有1.9%;蓝细菌门和疣微菌门在S4样本中分别占43.8%和16.5%,但在S2样本中并没有识别出来。除了这4个相对丰度较高的细菌门类以外,酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)等多种门类的细菌也被识别到,但相对丰度极低。
|
|
表 3 海带不同生活史阶段附生菌中优势细菌门类及相对丰度 Tab.3 Dominant bacterial phyla and the relative abundance of bacterial communities at different stages of life cycle in Saccharina japonica |
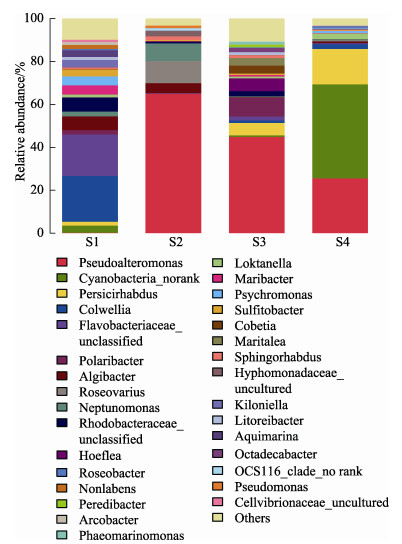
在属水平上对各样本附生菌群落结构及相对丰度进行统计分析(图 3),结果显示,4个样本间的附生菌群落结构及相对丰度存在较大差异。在S1样本中,细菌属类丰富,并未存在绝对优势的细菌属,丰度最高的为科尔韦尔氏菌属(Colwellia),占21.28%,其次是黄杆菌科(Flavobacteriaceae)中的未鉴定属,为19.37%,而有16个属的细菌丰度在1%~10%之间,假交替单胞菌属(Pseudoalteromonas)的相对丰度为0.18%;S2样本附生菌种类相对单一,假交替单胞菌属以65.00%的相对丰度占据了绝对优势,其次为Roseovarius属,占10.32%,剩下各属中只有6个的相对丰度 > 1%;在S3样本中,假交替单胞菌属依然为优势群体,占44.88%,其次为多毛杆菌属(Polaribacter),为8.71%,其余各属中有12个类群相对丰度在1%~10%之间。S4样本,蓝细菌中的未分类属为优势类群,占43.80%,其次为假交替单胞菌属,为25.57%,之后为Persicirhabdus属,占16.49%,其余各属中只有3个属的相对丰度超过1%。
|
图 3 海带不同生活史阶段附生菌中属水平种群结构及相对丰度 Fig.3 Bacterial communities and relative abundance of bacterial communities at the genus level during the different stages of life cycle in Saccharina japonica |
为探究海带不同生活史阶段附生菌群落结构丰富度和多样性的差异,基于测序数据,统计了ACE、Chao、Shannon和Simpson指数(表 4)。结果显示,在S1与S3样本中,无论是物种丰富度还是物种多样性,均呈现出较高的水平,S1样本代表物种丰富度的ACE和Chao指数分别为164和145,代表物种多样性的Shannon和Simpson指数分别为3.35和0.058;S3样本中这4个指数分别为190、189、2.81和0.194。S2样本物种丰富度和多样性则相对较低,其ACE、Chao、Shannon和Simpson指数分别为64、63、1.65和0.378;在S4样本中,代表物种丰富度的ACE和Chao指数均较大,分别为172与172,然而,代表物种多样性的Shannon和Simpson指数则表现为Shannon指数较小(1.9)、Simpson指数较大(0.271),呈现出菌群种类丰富但菌种间分布上的不均匀性。
|
|
表 4 海带不同生活史阶段附生菌群落的Alpha多样性 Tab.4 Alpha diversity of bacterial communities during different life stages in Saccharina japonica |
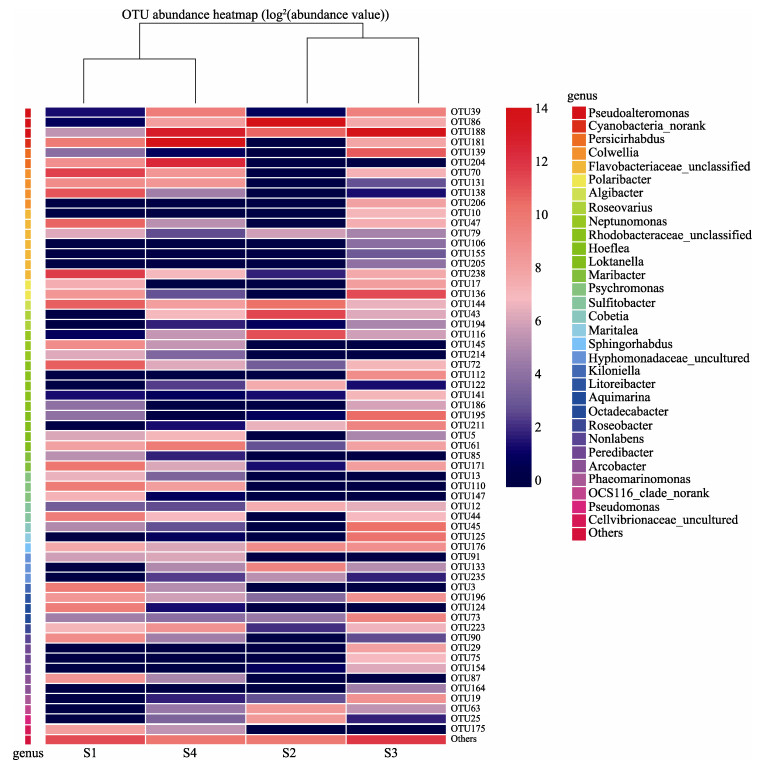
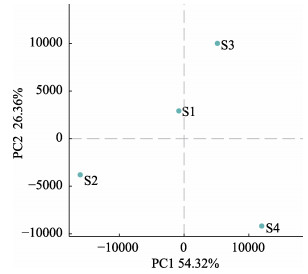
进一步筛选各样品中相对丰度大于1%的31个属所包含的62个OTU,构建了包含样本聚类关系树的热图。如图 4所示,不同的颜色代表不同的相对丰度,顶端为样本聚类关系树。S1与S4样本聚为一类,S2和S3样本聚为一类。同时,根据OTU组成,对各样本间附生菌群落差异和距离进行主成分分析,结果如图 5所示。PC1轴对样本的贡献率为54.32%,PC2轴对样本的贡献率为26.36%,4个样本分别落在图中4个不同的象限上,各样品间表现出较大的差异性。
|
图 4 各样品中相对丰度高于1%的属的OTU分布热图 Fig.4 Heatmap analysis of the OTUs that belong to the genus with relative abundance over 1% in samples |
|
图 5 不同样本的主成分分析 Fig.5 Sorting analysis of different samples |
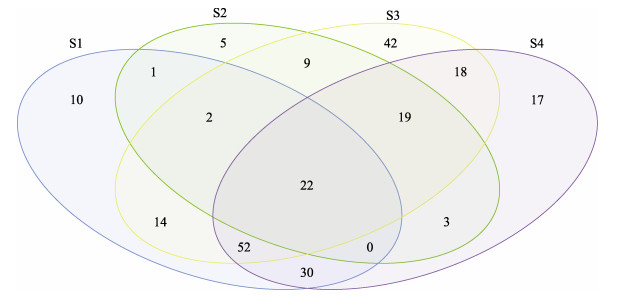
选取各样本OTU的并集,根据样本间附生菌群落结构多样性的相互关系,绘制Venn图(图 6)。结果显示,在这4个样品中,分别有131、61、178和161个OTU被识别出来,配子体阶段样本要少于孢子体阶段样本。其中,有22个OTU在4个样品中均存在,并分别占各样品OTU总数的16.8%、36.1%、12.4%和13.7%。在孢子体阶段(S1、S3和S4),有52个OTU普遍存在,分别占到S1、S3和S4样本中OTU总数的39.7%、29.2%和32.3%,且在配子体(S2)样本中未被检测到;5个OTU为配子体阶段特有,占S2样本中OTU总数的8.2%。
|
图 6 各样品中附生菌多样性的相关性分析 Fig.6 The similarity analysis of bacteria diversity among different samples |
本研究针对海带、配子体、幼孢子体及大孢子体4个不同阶段样本,进行附生菌群落结构分析,证实在海带生活史的不同阶段,附生菌群落结构有一定差异。变形菌门在种海带、配子体、幼孢子体的时候均占主导地位,表现出超过50%的丰度,但在大孢子体中,丰度最高的则是蓝细菌门。在配子体中,细菌种类少且属间分布不均匀,这可能与海带配子体在低温、低光强及封闭培养条件下有关,种海带、幼孢子体和大孢子体则处于开放的海水环境,表现出丰富的细菌种类。但养殖条件下的大孢子体的附生菌群多样性水平较低。
褐藻酸降解菌是一类在海带养殖过程中广泛分布于养殖水体及藻体表面的具有降解褐藻酸能力的细菌,主要有假交替单胞菌属、交替单胞菌属(Alteromonas)、弧菌属(Vibrio)、糖噬胞菌(Saccharophagus)、黄杆菌属(Flavobacterium)中的许多种类(Li et al, 2011; Wang et al, 2008; 侯士昌等, 2014; 傅晓妍等, 2007)。这些褐藻酸降解菌是条件致病菌,通常情况下并不引起病害,但若养殖环境恶化,细菌侵入并大量繁殖,则可致病(陈騳等, 1981)。本研究中,假交替单胞菌属相对丰度高,且在不同生活史阶段差异极大。配子体阶段与幼孢子体阶段其相对丰度分别为65.00%和44.88%,海区养殖的大孢子体中,其相对丰度为25.57%,而在种海带阶段,则只有0.18%,这可能与种海带入库前经清洗并切除常发病害的梢部和边缘部而只保留中带部有关。幼孢子体阶段是海带夏苗培育的关键期,苗过密、高温等均能引发假交替单胞菌属的大量繁殖,从而导致烂苗、掉苗等(陈騳等, 1984)。因此,严格挑选、处理种海带,处理育苗冷水,控制育苗密度,及时清理脱落幼孢子体,对减少育苗中有害细菌的大量增殖具有重要意义。
本研究中,蓝细菌门仅检测到一个未知种类的OTU信息。这个OTU在配子体阶段未被检测到,幼孢子体时期开始出现一定的丰度,海区养殖大孢子体的相对丰度很高,并成为优势菌群,而进入成熟期形成种海带后,丰度又逐渐降低。推测该OTU的相对丰度在各生活史阶段可能与海带的生物量积累速度有关联。在种海带与大孢子体中,该OTU相对丰度差异很大,且在配子体阶段并未检测到丰度,该OTU信息很有可能来自于某种未知的共生型蓝细菌,且在较低的温度条件下,其生长会受到抑制(Gerard et al, 1990)。这里所检测出的蓝细菌门种类在与海带的共生关系中究竟起着怎样的作用,有待深入研究。
Amin SA, Hmelo LR, Vantol HM, et al. Interaction and signaling between a cosmopolitan phytoplankton and associated bacteria. Nature, 2015, 522(7554): 98-101 DOI:10.1038/nature14488 |
Berg GM, Repeta DJ, Laroche J. Dissolved organic nitrogen hydrolysis rates in axenic cultures of Aureococcus anophagefferens (Pelagophyceae) comparison with heterotrophic bacteria. Applied and Environmental Microbiology, 2002, 68(1): 401-404 DOI:10.1128/AEM.68.1.401-404.2002 |
Chen D, Lin GH, Shen SZ. Studies on alginic acid decomposing bacteria Ⅰ. Action of alginic acid decomposing bacteria and alginase on Laminaria japonica. Oceanologia et Limnologia Sinica, 1979, 10(4): 329-333, 402 [陈騳, 林光恒, 沈世泽. 褐藻酸降解菌的研究Ⅰ.褐藻酸降解菌与褐藻酸酶对海带藻体的作用. 海洋与湖沼, 1979, 10(4): 329-333, 402] |
Chen D, Lin GH, Shen SZ. Studies on alginic acid decomposing bacteria Ⅱ. Rot disease of Laminaria summer sporelings caused by alginic acid decomposing bacteria. Oceanologia et Limnologia Sinica, 1981, 12(2): 133-137 [陈騳, 林光恒, 沈世泽. 褐藻酸降解菌的研究Ⅱ.海带夏苗培育中褐藻酸降解菌与烂苗的关系. 海洋与湖沼, 1981, 12(2): 133-137] |
Chen D, Liu XY, Liu XZ, et al. Studies on alginic acid decomposing bacteria Ⅲ. The cause of the rot disease and detaching of Laminaria sporophytes in sporeling culture stations and their preventive measures. Oceanologia et Limnologia Sinica, 1984, 15(6): 581-589 [陈騳, 刘秀云, 刘秀珍, 等. 褐藻酸降解菌的研究Ⅲ海带育苗系统中脱苗和烂苗原因分析及其预防措施. 海洋与湖沼, 1984, 15(6): 581-589] |
Croft MT, Lawrence AD, Raux-Deery E, et al. Algae acquire vitamin B12 through a symbiotic relationship with bacteria. Nature, 2005, 438(7064): 90-93 DOI:10.1038/nature04056 |
Duan D, Xu L, Fei X, et al. Marine organisms attached to seaweed surfaces in Jiaozhou Bay, China. World Journal of Microbiology and Biotechnology, 1995, 11(3): 351-352 DOI:10.1007/BF00367118 |
Fu XY, Li JB, Han F, et al. Studies on Vibro sp. QY102 fermentation processes for alginate lyase production. Periodical of Ocean University of China (Natural Science), 2007, 37(3): 432-436 [傅晓妍, 李京宝, 韩峰, 等. 褐藻胶裂解酶产生菌Vibro sp.QY102的发酵条件优化. 中国海洋大学学报(自然科学版), 2007, 37(3): 432-436] |
Gerard VA, Dunham SE, Rosenberg G. Nitrogen-fixation by cyanobacteria associated with Codium fragile (Chlorophyta):Environmental effects and transfer of fixed nitrogen. Marine Biology, 1990, 105(1): 1-8 |
Hodson M, Crofte E, Deery A, et al. Algae acquire vitamin B12 through a symbiotic relationship with bacteria. Comparative Biochemistry and Physiology Part A:Molecular and Integrative Physiology, 2007, 146(4): 215-223 |
Hou SC, Wen SH, Tang ZH, et al. The screening, identification of alginate degrading bacteria and optimization of fermentation conditions. Marine Sciences, 2014, 38(7): 20-26 [侯士昌, 温少红, 唐志红, 等. 一株高效褐藻酸降解菌的筛选、鉴定及其发酵条件的优化. 海洋科学, 2014, 38(7): 20-26] |
Li J. Basic and applied study on reproduction biology of the economic seaweeds Saccharina japonica, Undaria pinnatifida and Sargassum horneri. Doctoral Dissertation of Chinese Academy of Sciences (Institute of Oceanology), 2015 [李静.海带、裙带菜和铜藻的基础繁育生物学研究及产业化应用.中国科学院研究生院(海洋研究所)博士研究生学位论文, 2015]
|
Li JF. Microbial diversity research based on high-throughput sequencing data of 16S rRNA and metagenome. Master's Thesis of Tsinghua University, 2015 [李俊锋.基于16S rRNA和宏基因组高通量测序的微生物多样性研究.清华大学硕士研究生学位论文, 2015] http://cdmd.cnki.com.cn/Article/CDMD-10003-1016712741.htm
|
Li JW, Dong S, Song J, et al. Purification and characterization of a bifunctional alginate lyase from Pseudoalteromonas sp. SM0524. Marine Drugs, 2011, 9(1): 109-123 DOI:10.3390/md9010109 |
Lin W, Chen Y, Liu XY. Marine microalgal axenation and comparison of growth characteristics between natural and axenic marine microalgae. Oceanologia et Limnologia Sinica, 2000, 31(6): 647-652 [林伟, 陈驭, 刘秀云. 海洋微藻除菌及除菌与自然带菌微藻生长特点的比较. 海洋与湖沼, 2000, 31(6): 647-652 DOI:10.3321/j.issn:0029-814X.2000.06.010] |
Liu WL, Xu H, Tang Y, et al. The effect of diet with Bacillus cereus biofilm on the growth rate, disease resistance and intestinal microflora of Litopenaeus vannamei. Progress in Fishery Sciences, 2017, 38(4): 87-95 [刘文亮, 许华, 唐杨, 等. 饲料中补充蜡样芽孢杆菌(Bacillus cereus)生物膜对凡纳滨对虾(Litopenaeus vannamei)生长、抗病力及其肠道微生物组成的影响. 渔业科学进展, 2017, 38(4): 87-95] |
Manage PM, Kawabata Z, Nakano S. Dynamics of cyanophagelike particles and algicidal bacteria causing Microcystis aeruginosa mortality. Limnology, 2001, 2(2): 73-78 DOI:10.1007/s102010170002 |
Rier ST, Stevenson RJ. Effects of light, dissolved organic carbon, and inorganic nutrients[2pt] on the relationship between algae and heterotrophic bacteria instream periphyton. Hydrobiologia, 2002, 489(1): 179-184 |
Shen ML, Yang R, Luo QJ, et al. Microbial diversity of Pyropia haitanensis phycosphere during cultivation. Acta Microbiologica Sinica, 2013, 53(10): 1087-1102 [沈梅丽, 杨锐, 骆其君, 等. 坛紫菜养殖周期中的藻际微生物多样性. 微生物学报, 2013, 53(10): 1087-1102] |
Sun C, Zhu L, Mao YZ, et al. The structures of sediment microbial communities in different mariculture models at Xiangshan Bay of China. Progress in Fishery Sciences, 2014, 35(4): 13-21 [孙超, 朱玲, 毛玉泽, 等. 象山港南沙岛不同养殖模式沉积物微生物群落结构分析. 渔业科学进展, 2014, 35(4): 13-21] |
Sun PH, Qian K, Li XL, et al. Characterization of bacterial community structure on surface of kelp Saccharina japonica by high-throughput sequencing. Journal of Dalian Ocean University, 2017, 32(1): 7-12 [孙丕海, 钱坤, 李晓丽, 等. 基于高通量测序分析海带表面细菌群落结构. 大连海洋大学学报, 2017, 32(1): 7-12] |
Wang GG, Shuai L, Li Y, et al. Phylogenetic analysis of epiphytic marine bacteria on Hole-Rotten diseased sporophytes of Laminaria japonica. Journal of Applied Phycology, 2008, 20(4): 403-409 DOI:10.1007/s10811-007-9274-4 |
Wang WW, Wang N, Zhang ZZ, et al. Quantity and composition of alginic acid decomposing bacterial community in summer seedling system of kelp Saccharina japonica. Journal of Dalian Ocean University, 2017, 32(1): 26-32 [王伟伟, 王娜, 张壮志, 等. 海带夏季育苗系统褐藻酸降解菌数量组成分析. 大连海洋大学学报, 2017, 32(1): 26-32] |
Xu N, Tan GC, Wang HY, et al. Effect of biochar additions to soil on nitrogen leaching, microbialbiomass and bacterial community structure. European Journal of Soil Biology, 2016, 74: 1-8 DOI:10.1016/j.ejsobi.2016.02.004 |
Xu Y, Wang YG, Zhang Z, et al. Variance analysis of bacterial community in the intestine of cultured spotted knifejaw (Oplegnathus punctatus) at different healthy levels and intervened with florfenicol. Journal of Fisheries of China, 2018, 42(3): 388-398 [许燕, 王印庚, 张正, 等. 不同健康程度和抗生素氟苯尼考干预下斑石鲷肠道菌群的结构差异. 水产学报, 2018, 42(3): 388-398] |
Zhang J. Population genetics and phylogeography of Saccharina japonica in Northwestern Pacific Ocean. Doctoral Dissertation of Chinese Academy of Sciences (Institute of Oceanology), 2016 [张杰.西北太平洋地区海带种群遗传及分子系统地理学研究.中国科学院研究生院(海洋研究所)博士研究生学位论文, 2016] http://cdmd.cnki.com.cn/Article/CDMD-80068-1016205742.htm
|



