支持细胞作为睾丸中的一种重要组成细胞,在研究有关雄性生殖系统疾病的发病机制以及外源性物质对雄性生殖系统的作用机理时,不可避免地要涉及到支持细胞(Edelsztein et al, 2018)。近年来对支持细胞的研究表明,支持细胞合成分泌SCF、FGF、TGF和IGF等生长因子(Jiang et al, 2013),对精原干细胞增殖有促进作用,支持细胞与原始生殖细胞、精原干细胞等联合培养,可促进共培养细胞的生长增殖(Regueira et al, 2014)。
支持细胞具有免疫抑制功能,可以用于在睾丸以外的部位为移植细胞提供免疫豁免的环境(Koji et al, 2001; Luca et al, 2018)。Willing等(1999)将睾丸支持细胞和胚胎中脑细胞共同培养后移植入帕金森病动物模型脑中,7 d后移植部位酪氨酸羟化酶阳性神经元数量显著增加,而且神经元胞体的大小和突起均有增加。而这些都要以支持细胞的体外培养为基础,有关支持细胞的体外分离、纯化及培养的研究,国内外均有报道(滕琰等, 2005; Sakai, 2002),分离纯度达到90%,并建立了一些支持细胞株,但大多都集中在哺乳动物,对鱼类支持细胞体外培养的研究极少(Ghaem Maghami et al, 2018)。
尼罗罗非鱼(Oreochromis niloticus)属于鲈形目丽鱼科,原产于坦噶尼喀湖,是罗非鱼中最大型的品种(党广成等, 2011;赵丽慧等, 2014)。本研究以尼罗罗非鱼为对象,研究尼罗罗非鱼精巢支持细胞分离、纯化和体外培养的生物学特性,建立并优化尼罗罗非鱼精巢支持细胞分离培养体系,以期为鱼类支持细胞体外培养建系提供参考和依据。
1 材料与方法 1.1 实验动物雄性尼罗罗非鱼购自湛江国联水产开发股份有限公司吴川基地,自然生长且无生殖系统疾病,体长为(9.5±0.5) cm、精巢发育至第Ⅲ期。饲养于1.2 m×1.0 m的孵化桶,每隔3 d换水1次,每天早晚各饲喂1次。实验前,将罗非鱼在0.1%高锰酸钾中浸泡30 min。
1.2 支持细胞的分离培养 1.2.1 胰蛋白酶消化法无菌条件下取罗非鱼两侧精巢,放入含有双抗的PBS中漂洗5~10 min,除去粘膜及杂质,最后用L-15培养液(Gibco)洗1遍。用手术剪将其剪成1 mm3左右的小块,用200目滤网过滤,除去大部分游离的精子细胞和其他细胞,用含有双抗的PBS清洗滤网上的组织块2次后,收集精巢组织块,加入4 ml 0.25%胰蛋白酶+0.04% EDTA的消化液,26℃消化5~10 min,倒置显微镜(OLYMPUS IX53)下见组织结构消失,细胞游离分散,立即加4 ml含10%犊牛血清(NBS, 四季青生物工程材料有限公司)的培养液终止消化,用移液枪吹打,使细胞尽量游离。用200目滤网过滤未完全消化的组织块,过滤细胞悬液经1000 r/min离心5 min,去除上清液,加入新鲜培养液重悬。取少许细胞悬液,台盼蓝染色,测定死细胞比率。
采用差速贴壁法(利用支持细胞可以牢固贴壁生长,而体外培养的生殖细胞往往贴壁能力弱,需要贴附于饲养层细胞生长的特点)将支持细胞和生殖细胞分离纯化,即将上步获得细胞悬液调整到1×106个/ml后,种植到铺有明胶的培养瓶,置于26℃、无CO2饱和湿度恒温培养箱(上海迅博)中培养24 h。然后,用移液枪轻轻吹洗贴壁细胞,使未贴壁的生殖细胞浮起,弃去培养液,更换新鲜培养液继续培养贴壁的细胞,每3天换液1次。
1.2.2 组织块贴壁法无菌条件下取罗非鱼两侧精巢,放入含有双抗的PBS中漂洗5~10 min,除去粘膜及杂质,最后用培养液L-15清洗1遍。用手术剪将其剪成1 mm3左右的小块,组织块间以5 mm间距均匀摆放入培养瓶中,置于26℃、无CO2饱和湿度恒温培养箱中培养。过12 h后加入新鲜培养液,置于26℃、无CO2饱和湿度恒温培养箱中培养,培养1 d后换液,之后,每3 d换液1次。待细胞连接成片后,移去组织块。
1.3 支持细胞的继代培养支持细胞1~5代传代采用原瓶传代,待贴壁细胞密度达70%以上时进行传代。用PBS清洗1~2次后,加消化液(0.25%胰蛋白酶+0.04% EDTA) 2 ml,消化2~5 min,培养基终止消化并吹打悬浮贴壁细胞。细胞悬液1000 r/min离心5 min,去除上清液,培养液重悬细胞,调整细胞密度至1×106个/ml,接种到新的培养瓶中,置于26℃、无CO2饱和湿度恒温培养箱中培养。3 d后换液,除去死细胞,此后,每24 h观察,每3 d换液2/3,长满单层后可继续传代培养。
1.4 支持细胞生长特性观察和鉴定对贴壁的单层细胞用碱性磷酸酶(AKP)试剂盒(南京建成生物工程研究所)染色,检测支持细胞纯度,观察有无混在其中的精原干细胞,然后甲基绿复染检测支持细胞。倒置显微镜观察细胞形态及染色情况。
1.5 不同基础培养液对支持细胞生长增殖的影响用0.25%胰蛋白酶消化生长状态良好的第2~5代尼罗罗非鱼支持细胞,分装在3支不同的离心管中,1000 r/min离心5 min,除去上清液,分别使用L-15、F12(Gibco)、M199培养液(Gibco)重悬细胞(在此基础上添加10% NBS+1 mmol/L丙酮酸钠、2 mmol/L谷氨酰胺、100 IU/ml青霉素、100 IU/ml链霉素、15 mmol/L HEPES,均购置于碧云天生物公司),取少许台盼蓝染色,计算细胞存活率。
1.6 血清对支持细胞生长增殖的影响方法同1.5。基础培养液:L-15+1 mmol/L丙酮酸钠+2 mmol/L谷氨酰胺+100 IU/ml青霉素+100 IU/ml链霉素+15 mmol/L HEPES。在此基础上,分别添加5%、10%和15%的NBS;探讨不同浓度NBS对尼罗罗非鱼支持细胞生长增殖的影响。在基础培养液+10% NBS的基础上添加1%罗非鱼血清,研究罗非鱼血清对支持细胞生长增殖的影响。
1.7 生长曲线的绘制采用细胞计数法绘制生长曲线。调整细胞悬液密度约为105个/ml,少许台盼蓝染色,计算细胞存活率。将其余细胞悬液接种于96孔板中,置于26℃、无CO2饱和湿度恒温培养箱中培养。每2 d取出3孔细胞消化计数,用台盼蓝染色,同时计算细胞存活率。共观察12 d,每3 d换液1次。以细胞培养时间为横轴,细胞数为纵轴,绘制生长曲线。
1.8 统计方法所有数据采用随机分组设计原理,采用SPSS 11.0软件进行单因素方差分析(One-way ANOVA),各组间采用LSD法进行多重比较,以P < 0.05为差异显著,P < 0.01为差异极显著,数据表示为平均值±标准误(Mean±SE)。
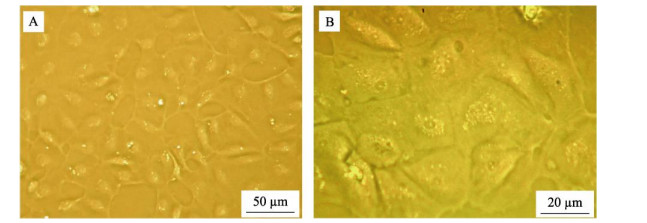
2 结果 2.1 胰蛋白酶消化法与组织块培养法分离、培养支持细胞的生长特性 2.1.1 胰蛋白酶消化法分离、培养支持细胞的生长特性用0.25%胰蛋白酶+0.04% EDTA消化分离,得到尼罗罗非鱼精巢细胞,在26℃、无CO2饱和湿度恒温培养箱中培养。1 d后,支持细胞贴壁并极化,胞体多呈长柱状,两侧大多有突起,折光性较强,数量约占90%。培养3 d后,成簇的支持细胞开始生长,支持细胞胞体增大,呈膜状铺在培养瓶壁上,形成细胞单层(图 1A)。培养10 d后,细胞增殖速度减慢,70%~80%细胞融合形成非常牢固的细胞间连接,胞核清晰可见(图 1B)。
|
图 1 支持细胞的胰蛋白酶分离、纯化后的培养结果 Fig.1 The cultured Sertoli cells after separation and purification A:体外培养3 d的原代细胞;B:体外培养10 d的原代细胞 A: Primary cells cultured for 3 days in vitro; B: Primary cells cultured for 10 days in vitro |
采用组织块培养法培养第2天时,可见从组织块周围游离出少量细胞,细胞形态不一,有呈圆形的细胞;有呈梭形的细胞,为成纤维细胞;支持细胞呈不规则多边形的,胞体较大,胞体内可见吞噬的小颗粒状物质。第3天开始,游离出的细胞生长增快,组织块周围生成致密的细胞层(图 2A)。培养第7天,部分组织块脱离培养瓶壁,游离出的细胞已成簇生长。取出组织块后,随着培养时间的增加,成簇生长的细胞逐渐连接成片,形成细胞单层。但混杂许多成纤维样细胞,细胞层上粘附有大量的生殖细胞(图 2B)。

|
图 2 支持细胞的组织块培养 Fig.2 Sertoli cells cultured in tissue A:体外培养3 d的原代细胞;B:体外培养7 d的原代细胞 A: Primary cells cultured for 3 days in vitro; B: Primary cells cultured for 7 days in vitro |
支持细胞开始贴壁生长时呈长柱状或三角形,当单独存在的支持细胞伸展铺开后,其胞质铺展得很大,呈不规则的多边形,可见胞质中吞噬的小颗粒状物质和空泡。体外培养支持细胞,细胞的突起相互连接,呈单层膜状。AKP染色结果发现,大部分细胞不着色,为AKP阴性(图 3A);甲基绿染色显示,胞质中可见多量大小不一的未染色空泡状结构。这些空泡状的结构是脂质小滴,大小不一,呈圆形或卵圆形,悬浮状存在,聚集于支持细胞胞质的两极或散布于核的四周(图 3B)。

|
图 3 支持细胞形态学鉴定 Fig.3 Morphology identification of Sertoli cells A:AKP染色后的支持细胞;B:甲基绿染色后的支持细胞 A: Sertoli cells after AKP staining; B: Sertoli cells after methyl green dyeing |
用含10% NBS的L-15、F12和M199基础培养液,在26℃、无CO2饱和湿度条件下培养尼罗罗非鱼支持细胞。用F12和M199培养的支持细胞不易贴壁,细胞未能铺满50%皿底已停止生长,而用L-15培养液培养的支持细胞贴壁良好,活力较强,生长旺盛。培养4 d后细胞保持较快增殖速度,8~10 d即可形成细胞单层。第8天后,F12和M199培养液中的支持细胞停止生长,逐渐老化脱落,随换液而丢失。培养第10天后,F12和M199培养液中已贴壁的支持细胞逐渐回缩,开始大量脱落;L-15中的细胞此时已连接成片,但细胞生长增殖开始变慢。在整个培养过程中,用细胞计数法检测支持细胞在L-15、F12和M199培养液中的生长增殖情况,支持细胞在3种培养液中的生长曲线见图 4。

|
图 4 罗非鱼支持细胞在不同基础培养液中的生长曲线 Fig.4 Growth curve of tilapia Sertoli cells in different medium 同一时间标注不同大写字母表示差异极显著(P < 0.01),相同字母表示差异不显著(P > 0.05)。生物学重复n=3,下同 Different letters marked on the data at the same time mean the difference was highly significant (P < 0.01), the same letters mean no significant difference (P > 0.05). Biological repeats n=3, the same as below |
如图 4所示,L-15培养液中的细胞增殖明显快于F12和M199组(P < 0.01)。L-15组中,第4天后支持细胞的数量明显多于F12和M199组(P < 0.01),结果表明,L-15培养基更有助于尼罗罗非鱼支持细胞的生长增殖。
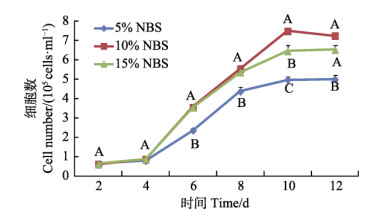
2.4 犊牛血清对支持细胞体外增殖的影响以L-15为基础培养液,其中分别添加5%、10%和15% NBS,培养尼罗罗非鱼支持细胞,各实验组贴壁都较好,5% NBS形成的细胞单层面积略小,培养5 d后,5% NBS组细胞增殖相对变慢,可见许多单个支持细胞胞体增大,呈膜状铺在培养瓶壁上。而10%和15% NBS组,细胞生长致密,细胞之间的连接非常牢固。培养5 d后,10%和15% NBS组中一些细胞集落成簇生长。细胞计数法检测支持细胞的生长增殖状况,生长曲线见图 5。
|
图 5 添加不同浓度犊牛血清时尼罗罗非鱼支持细胞的生长曲线 Fig.5 The cell growth curves of tilapia Sertoli cells cultured with medium containing different concentrations of NBS |
如图 5所示,15% NBS组细胞生长增殖显著快于5% NBS组(P < 0.05);10% NBS组细胞增殖极显著快于5% NBS组(P < 0.01)。在培养第8天时,15% NBS组中的细胞数量显著多于5% NBS组(P < 0.05);在第6天、第10天和第12天,15% NBS组中的细胞数量极显著多于5% NBS组(P < 0.01);培养第6~12天时,10% NBS组细胞数量极显著多于5% NBS组(P < 0.01);培养第8天时,10% NBS组中的细胞数量显著多于15% NBS组(P < 0.05);培养第10天时,10% NBS组中的细胞数量极显著多于15% NBS组(P < 0.01)。结果表明,添加10% NBS更有利于支持细胞的生长增殖。
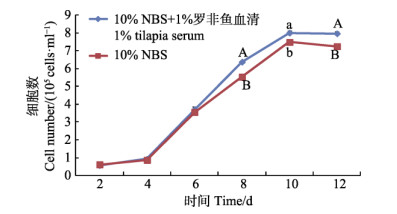
2.5 罗非鱼血清对支持细胞的影响以L-15+10% NBS为基础培养液,添加1%的罗非鱼血清,培养尼罗罗非鱼支持细胞。结果显示,在培养前8天,与对照组相比,支持细胞生长增殖无明显差别,支持细胞贴壁良好、成簇生长。第8天后,添加罗非鱼血清组,支持细胞连接紧密,形成的细胞单层面积比对照组明显增大。在培养第10天,1%罗非鱼血清组细胞数量显著多于对照组(P < 0.05);在第8天和第12天时,添加1%罗非鱼血清组细胞数量极显著多于对照组(P < 0.01)。结果表明,添加1%罗非鱼血清更有助于支持细胞的生长增殖。细胞计数法检测支持细胞的生长增殖状况,生长曲线见图 6。
|
图 6 添加罗非鱼血清时支持细胞的生长曲线
Fig.6 Growth curve of Sertoli cells with addition of tilapia serum
同一时间标注不同小写字母表示差异显著(P < 0.05);不同大写字母表示差异极显著(P < 0.01),生物学重复n=3
The different lowercase letters marked on the data at the same time mean difference was significant (P < 0.05), different capital letters mean difference was highly significant (P < 0.01). Biological repeats n=3 |
罗非鱼的精巢为小叶型,由结缔组织分隔形成小叶,每个小叶周边由支持细胞与分隔的结缔组织构成,支持细胞从小叶间获得营养供小叶内生殖细胞生长分化,保证精子发育。选用发育到Ⅲ期的罗非鱼精巢以期分离原代支持细胞,其精巢中主要为生殖细胞、支持细胞、精子以及少量的成纤维细胞和血细胞。原代细胞分离纯化的方法常用胰蛋白酶消化法和组织块法。本研究中,胰蛋白酶消化法分离、培养得到的支持细胞纯度较高,基本没有混杂的生殖细胞,而组织块培养法培养精巢组织时,组织块中游离出大量的生殖细胞,粘附在组织块周围的细胞层上,杂细胞较多,不利于支持细胞的纯化。已报道的哺乳动物支持细胞分离纯化的文献,也大多采用胰酶消化法和差速贴壁的方法来获得高纯度的支持细胞。采克俊等(2008)在分离鸡睾丸支持细胞时,首先用10倍于组织块体积的1 mg/ml胶原酶消化,在37℃作用30 min, 期间每隔5 min混匀1次,之后用0.25%胰蛋白酶-EDTA消化5 min,300目不锈钢网筛过滤,差速贴壁法去除大部分生殖细胞,支持细胞得到纯化。Syed等(2001)采用20 mmol/L Tris-HCl对培养中的支持细胞进行低渗处理,可有效去除生殖细胞,而不会影响支持细胞的生长。采克俊等(2008)发现,鸡睾丸支持细胞和生殖细胞贴壁都较快,贴壁的时间差较小,要经低渗处理去除生殖细胞,才能获得较纯的支持细胞。
本研究所用方法与已报道的动物支持细胞分离、纯化方法有所不同。在本研究中,并未进行低渗处理,直接使用0.25%胰蛋白酶消化尼罗罗非鱼精巢组织,分离的细胞可以达到90%的存活率。将分离得到的细胞接种后,用倒置显微镜观察发现,支持细胞的游离期一般为12~24 h,24 h后部分支持细胞贴壁,胞质开始铺展、伸出突起。本研究在纯化支持细胞的过程中,当支持细胞贴壁有小部分胞质开始铺展、少量支持细胞伸出突起时,即用移液枪吸取培养液轻轻吹打培养瓶瓶壁,然后吸去瓶内含有生殖细胞的培养液,PBS清洗2遍后,换新鲜培养液,基本上无生殖细胞,从而使支持细胞得到纯化。本研究并未进行低渗处理,而是通过缩短贴壁时间和吹洗支持细胞的方法,这样操作虽然会使获得的支持细胞总数减少,但会降低低渗方法对细胞造成的伤害,并且同样保证了支持细胞的纯度。结果显示,这种方法对尼罗罗非鱼支持细胞的纯化简单有效,获得了90%纯度的支持细胞。
3.2 支持细胞的鉴定支持细胞的鉴定,一般有细胞形态学鉴定、细胞染色鉴定等方法(Ghaem Maghami et al, 2018;胡晓鹏等, 2015;于磊等, 2013)。支持细胞体外培养特性表现为贴壁生长的多边形上皮样细胞,本研究分离培养的细胞形态也主要是贴壁的多角形上皮样细胞,与已报道的其他物种的支持细胞形态一致。张学明等(2001)采用油红O染色法,镜检发现,支持细胞的细胞质中,在细胞两极有许多被染成红色或红褐色大小不一的圆形小泡,结果证实为HE染色中所观察到的空泡,其实质是支持细胞胞质中的微小脂滴。本研究中,培养细胞甲基绿染色后,可以明显看到支持细胞的细胞核着色,而许多胞质中未染色的空泡样结构,为支持细胞胞质中的脂滴。本研究根据前人对支持细胞形态学特征的研究报道,结合细胞染色,观察了尼罗罗非鱼支持细胞的一般形态特征,对其作了初步鉴定。差速贴壁法分离纯化的贴壁支持细胞纯度较高,但其中依然会有生殖细胞混杂,而AKP活性染色是检测生殖细胞的一个重要指标。利用AKP染色可以检测在培养的支持细胞中有无生殖细胞混杂。染色结果发现,大部分细胞不着色,为AKP阴性,只有少数不规则组织样的细胞团被染上黑色,为AKP阳性,未见生殖细胞,表明本研究所使用的纯化方法效果较好;而根据国内外的AKP鉴定结果发现,管周细胞能被AKP染色标记上,为AKP阳性,支持细胞不能被标记,为AKP阴性(Chapin et al, 1987),证明本研究采用的分离、纯化支持细胞的方法是有效的,获得了高纯度的支持细胞。
3.3 基础培养基的影响基础培养液有MEM、DMEM、F-12、M199和L-15等(Sakai, 2002;上官芳芳等, 2003)。周元陵等(2005)培养睾丸支持细胞采用的培养液是DMEM/F-12,其中添加维生素A和维生素E、胰岛素、卵泡刺激素、睾酮和抗生素等。Matsui等(1991)用高糖DMEM作为基础培养液培养支持细胞,取得较为理想的结果。在以上的研究中,体外培养细胞都是生长在5% CO2的环境中。而鱼类体外细胞培养有些是在5% CO2的环境中培养,也有在大气环境中培养。因此,对于不同动物的不同细胞,应根据培养环境和需要,选择不同的基础培养液。
HEPES作为缓冲剂可用来代替碳酸氢盐,以解除需要高浓度CO2培养环境的限制。本研究采用HEPES作为缓冲剂,保持培养液pH值稳定在7.0~7.2范围内,在大气环境中培养支持细胞。实验发现,即使用HEPES作为缓冲剂,M199与F12培养液pH值变化也较大,长时间培养细胞,培养液pH值显著升高,而支持细胞在pH值较高的环境下,贴壁困难,不利于细胞的生长。Leibovizxs L-15培养液可用来在大气环境中使神经细胞生长,该培养基采用了与众不同的BSS作基础,含有高浓度的氨基酸来提高缓冲能力,培养基中使用半乳糖作碳源,以阻止培养液中乳酸形成,少量溶解的CO2由丙酮酸代谢产生。L-15培养基的优点明显,特别是在保持较高CO2浓度时,因此在大气环境下培养支持细胞,L-15有其不可替代的优点。Sakai(2002)用L-15基础培养液在大气环境中成功培养了斑马鱼(Danio rerio)精原干细胞及支持细胞。本研究表明,与F12和M199相比,用L-15基础培养液培养尼罗罗非鱼支持细胞,细胞贴壁良好,生长迅速,更有助于尼罗罗非鱼支持细胞的生长增殖,证实在大气环境中,L-15培养液较适合培养支持细胞。
3.4 血清对支持细胞生长增殖的影响支持细胞体外培养的研究中,常添加10%~15%的胎牛血清或10%~15%犊牛血清(NBS)作为对基础培养基的补充。在本研究中,分别用添加5%、10%和15% NBS的培养液培养尼罗罗非鱼支持细胞,探讨了NBS对尼罗罗非鱼支持细胞生长增殖的影响。并在添加10% NBS基础上再添加1%罗非鱼血清,探讨了罗非鱼血清对支持细胞生长增殖的影响。结果发现,15% NBS使支持细胞不易贴壁,但贴壁的细胞生长特性无明显变化;与添加5%和15% NBS相比,10% NBS极显著促进尼罗罗非鱼支持细胞生长增殖的影响(P < 0.01)。与对照组相比,在添加10% NBS基础上再添加1%罗非鱼血清能显著促进支持细胞的生长增殖(P < 0.05)。
Cai KJ, Liu L, Ding HL, et al. Isolation, purification and characterization of sertoli cells from embryonic chickens. Chinese Journal of Cell Biology, 2008, 30(6): 791-797 [采克俊, 刘莉, 丁海雷, 等. 鸡胚睾丸支持细胞的分离、纯化与鉴定. 细胞生物学杂志, 2008, 30(6): 791-797] |
Chapin RE, Phelps JL, Miller BE, et al. Alkaline phosphatase histochemistry discriminates peritubular cells in primary rat testicular cell culture. Journal of Andrology, 1987, 8(3): 155-161 DOI:10.1002/j.1939-4640.1987.tb02427.x |
Dang GC, Liu YQ, Fu PS, et al. Effect of high temperature treatment on sex differentiation and growth in Nile tilapia Oreochromis niloticus. Progress in Fishery Sciences, 2011, 32(5): 32-37 [党广成, 刘羽清, 付佩胜, 等. 高温诱导对尼罗罗非鱼性别分化及生长的影响. 渔业科学进展, 2011, 32(5): 32-37 DOI:10.3969/j.issn.1000-7075.2011.05.005] |
Edelsztein NY, Racine C, di Clemente N, et al. Androgens downregulate anti-Müllerian hormone promoter activity in the Sertoli cell through the androgen receptor and intact steroidogenic factor 1 sites. Biology of Reproduction, 2018, 99(6): 1303-1312 DOI:10.1093/biolre/ioy152 |
Ghaem Maghami R, Mirzapour T, Bayrami A. Differentiation of mesenchymal stem cells to germ-like cells under induction of Sertoli cell-conditioned medium and retinoic acid. Andrologia, 2018, 50(3): e12887 DOI:10.1111/and.12887 |
Hu XP, Yang F, Lv ZX, et al. Investigations on the expression of protein markers in Sertoli cells. Reproduction and Contraception, 2015, 35(8): 509-516 [胡晓鹏, 杨凡, 吕忠显. 小鼠睾丸支持细胞标志蛋白表达的研究. 生殖与避孕, 2015, 35(8): 509-516] |
Jiang J, Zhang N, Shiba H, et al. Spermatogenesis associated 4 promotes Sertoli cell proliferation modulated negatively by regulatory factor X1. PLoS One, 2013, 8(10): e75933 DOI:10.1371/journal.pone.0075933 |
Koji T, Hishikawa Y, Ando H, et al. Expression of Fas and Fas ligand in normal and ischemia-reperfusion testes: Involvement of the Fas system in the induction of germ cell apoptosis in the damaged mouse testis. Biology of Reproduction, 2001, 64(3): 946-954 |
Luca G, Baroni T, Arato I, et al. Role of Sertoli cell proteins in immunomodulation. Protein and Peptide Letters, 2018, 25(5): 440-445 DOI:10.2174/0929866525666180412163151 |
Matsui Y, Toksoz D, Nishikawa S, et al. Effect of steel factor and leukaemia inhibitory factor on murine primordial germ cells in culture. Nature, 1991, 353(6346): 750-752 DOI:10.1038/353750a0 |
Regueira M, Riera MF, Galardo MN, et al. Activation of PPAR α and PPAR β/δ regulates Sertoli cell metabolism. Molecular and Cellular Endocrinology, 2014, 382(1): 271-281 DOI:10.1016/j.mce.2013.10.006 |
Sakai N. Transmeiotic differentiation of zebrafish germ cells into functional sperm in culture. Development, 2002, 129(14): 3359-3365 |
Shangguan FF, Shi XL. The promotive effect of Sertoli cell on neurons in vitro. Acta Anatomica Sinica, 2003, 34(5): 510-513 [上官芳芳, 史小林. 睾丸支持细胞促进体外培养神经元生长的研究. 解剖学报, 2003, 34(5): 510-513 DOI:10.3321/j.issn:0529-1356.2003.05.015] |
Syed V, Hecht NB. Selective loss of Sertoli cell and germ cell function leads to a disruption in Sertoli cell-germ cell communication during aging in the brown Norway rat. Biology of Reproduction, 2001, 64(1): 107-112 |
Teng Y, Xue WJ, Feng XS, et al. The isolation and culture of Sertoli cells from adult testis and their immune privilege mechanism. Chinese Journal of Cellular and Molecular Immunology, 2005, 21(5): 643-645 [滕琰, 薛武军, 冯新顺, 等. 成人睾丸支持细胞的分离培养及其免疫豁免机制. 细胞与分子免疫学杂志, 2005, 21(5): 643-645 DOI:10.3321/j.issn:1007-8738.2005.05.032] |
Willing AE, Othberg AI, Saporta S, et al. Sertoli cells enhance the survival of co-transplanted dopamine neurons. Brain Research, 1999, 822(1-2): 246-250 DOI:10.1016/S0006-8993(99)01128-2 |
Yu L, Zheng P, Rong EG, et al. Culture and identification of testis Sertoli cells in calf in vitro. Journal of Jilin Agricultural University, 2013, 35(1): 63-66 [于磊, 郑鹏, 荣恩光, 等. 新生牛睾丸支持细胞的体外培养及鉴定分析. 吉林农业大学学报, 2013, 35(1): 63-66] |
Zhang XM, Li ZY, Lai LX, et al. Effects of several factors on mouse spermatogonial stem cells cultured in vitro. Chinese Journal of Veterinary Science, 2001, 21(5): 497-500 [张学明, 李子义, 赖良学, 等. 几种因素对培养小鼠精原干细胞的影响. 中国兽医学报, 2001, 21(5): 497-500 DOI:10.3969/j.issn.1005-4545.2001.05.021] |
Zhao LH, Jia JH, Zhang YH, et al. The tolerance and growth of three strains of Oreochromis niloticus in salinity-alkalinity water. Progress in Fishery Sciences, 2014, 35(5): 26-32 [赵丽慧, 筴金华, 张艳红, 等. 3种品系尼罗罗非鱼(Oreochromis niloticus)盐碱耐受性和生长比较. 渔业科学进展, 2014, 35(5): 26-32] |
Zhou YL, Zhong XJ, Wu X, et al. Establishment of dual-chamber model for rat Setoli cells primary culture. Journal of Environmental and Occupational Medicine, 2005, 22(3): 208-211 [周元陵, 钟先玖, 吴鑫, 等. 原代睾丸支持细胞分离纯化及双室培养模型的建立. 环境与职业医学, 2005, 22(3): 208-211] |



