2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛 266071
2. Pilot National Laboratory for Marine Science and Technology Qingdao, Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao 266071;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs, Qingdao 266071
浮游动物(Zooplankton)指营浮游生活的水生动物。个体一般都很微小,无论种类还是数量都十分庞大,从单细胞原生动物到高等多细胞的脊索动物,有些水生动物的幼虫也属于浮游动物的范畴。但在养殖业和生态系统结构、功能和生物生产力研究中占有重要地位的浮游动物一般有原生动物(Protozoa)、轮虫(Rotifera)、枝角类(Cladocera)和桡足类(Copepoda)四大类。浮游动物作为水域生态系统中的重要一环,既通过摄食影响浮游微藻和微生物群落结构,又可以作为许多经济鱼、虾类的优质天然饵料,在渔业生产中占有举足轻重的地位(Maberly et al, 2002; Boudreau et al, 2011;孙濡泳, 1992)。同时,浮游动物还是养殖水体生态系统中物质循环和能量流动的重要环节,其种类组成、数量的分布和变动与养殖水体的水质、系统内的物流、能流密切相关,它直接或间接影响着系统的生产性能(Pinel-Alloul et al, 1991;罗冬莲, 2004)。一个适宜且稳定的浮游动物群落对保证虾池的高效产出起到积极作用,尤其能够在一定程度上代表着浮游动物群落结构特征的优势种,其发生发展会给对虾的生长造成一定的影响。
对虾工厂化养殖是在封闭、半封闭水体中进行的高密度集约化养殖,在中国兴起于20世纪90年代。目前,国内关于凡纳滨对虾(Litopenaeus vannamei)工厂化养殖系统的研究多集中于养殖技术与环境因子等方面(董杨等, 2018;葛红星, 2014;李玉全, 2006),迄今为止,关于凡纳滨对虾工厂化养殖水体中浮游动物的群落结构特征未见系统地研究报告。对虾工厂化养殖作为一种新的养殖模式,虾池水体中浮游动物群落的结构特征必然区别于其他养殖模式。在该养殖模式下,养殖水体中浮游动物群落结构的变动规律及影响因素是不明确的。因此,本研究分析了凡纳滨对虾工厂化养殖水体中浮游动物群落结构变化规律,及其与弧菌、浮游微藻和理化因子的关系,以期为对虾工厂化健康养殖与管理提供参考。
1 材料与方法 1.1 采样地点与养殖情况本研究在青岛超一水产养殖有限公司进行采样。养殖用水为地下井水直接引入室外蓄水池,充分曝气后作为养殖用水,盐度为21。养殖车间为钢架结构搭建的大棚,养殖虾池(6 m×6 m×1.5 m)用EVA辅助材料的“篷布”围成,水深为1 m。
实验所用凡纳滨对虾虾苗购自广东湛江腾飞实业有限公司,规格为0.5 cm,2017年8月17日放苗,暂养30 d后分苗,养殖密度为250尾/m2,养殖77 d。
日常管理:每天按照对虾体重的6%投喂粗蛋白含量为42%的配合颗粒饲料(正大),分4次投喂,投喂2 h后,底部中央排污,养殖初期(1~30 d)每天排污5%~10%,养殖中期(31~50 d)每天排污20%~30%,养殖后期(50 d以后),每天排污50%~60%。排污后加注新水。
1.2 样品的采集与处理2017年8月25日~10月30日,每隔7 d,上午10:00对1口虾池进行采样处理。
定性样品:采样时,于虾池四周和中心分别采集水样,充分混匀后,取1 L装入聚乙烯瓶,回实验室后立即镜检。浮游动物定性参照赵文(2005)。
定量样品:采样时,在虾池的四周及中央使用有机玻璃采水器分别采集水样,充分混合,取1 L于聚乙烯瓶中,滴加5%的鲁哥氏液(Lugol’s solution)固定,经24 h沉淀后,浓缩至30 ml,用于浮游微藻、原生动物和轮虫的定量样品; 量取10 L水样,经孔径为64 μm的25号浮游生物网过滤,滴加4%福尔马林固定,作为甲壳动物的定量样品。计数方法是将1 L沉淀的浓缩样品摇匀,取0.1 ml计数原生动物,取1 ml计数轮虫; 甲壳动物则用10 L过滤样品全部计数(吴振斌等, 2007)。每个样本计数3次,取其平均值。
温度(T)、盐度(S)、pH和溶解氧(DO)采用YSI水质检测仪现场测定,另取1 L过滤水样于聚乙烯瓶中,4℃冰箱保存,用于测定总氨氮(NH3-NH4+-N)、亚硝态氮(NO2--N)、硝态氮(NO3--N)、活性磷(PO43--P)。测定方法及依据见表 1。
|
|
表 1 环境因子测定方法及依据 Tab.1 Measuring methods and bases for environmental factors |
水体中弧菌的计数:采集水样100 ml,于250 ml无菌玻璃瓶中,4℃低温保存,2 h内涂布于弧菌选择性固体培养基TCBS,用于检测弧菌数量。
1.3 数据处理与分析生物量测算方法:原生动物和轮虫根据体积法估算生物体积并假定比重为1,获得生物量。甲壳动物则根据体长–体重回归方程由体长(mm)求得体重(mg)。
浮游动物多样性指数(H')的计算采用Shannon-Wiener多样性指数,即:
| $ {H^\prime } = -\sum\limits_1^n {{P_i}} \ln {P_i} $ |
式中,H'为浮游动物的多样性指数; n为浮游动物的种数; Pi为第i种浮游动物在其总数中的相对数量。
优势种是根据物种的出现频率及个体数量来确定,用优势度来表示。优势度(Y)计算公式:
| $ Y=P_{i} \times f_{i} $ |
式中,Y是优势度,fi是第i物种的出现频率,Pi是第i物种个体数量占总个体数量的比例,当Y > 0.02时,确定为优势种。
相关分析用Pearson相关系数,在SPSS 19.0软件中完成。通过典范对应分析(CCA)探讨浮游动物与环境因子的相互关系,分析在软件Canoco4.5中完成,分析过程中数据经过y=log(x+1)转换,显著性水平为P < 0.05。
2 结果与分析 2.1 虾池基本情况和理化因子状况实验期间,温度、盐度、pH和溶解氧基本变化情况如图 1所示。整个养殖期间,水温为18.30℃~31.30℃,且养殖期间持续下降,盐度为20.83~22.51,pH为8.20~8.42,溶解氧为6.81~8.63 mg/L。实验期间,总氨氮、亚硝态氮、硝态氮和活性磷变化情况如图 2所示。总氨氮为0.02~1.53 mg/L,一直维持在较低水平。亚硝态氮为0.05~10.90 mg/L,养殖前期处于较低水平,中期迅速上升,后期稳定在较高水平。硝态氮为0.61~18.13 mg/L,随着养殖的进行,硝态氮的浓度逐渐升高。活性磷为0.02~1.59 mg/L,随养殖的进行,其浓度一直维持在较低水平。
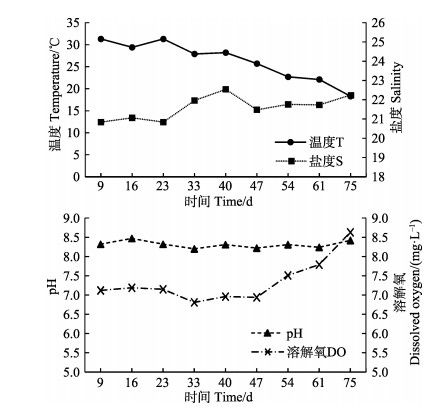
|
图 1 虾池养殖水体温度、盐度、pH和溶解氧变化 Fig.1 Changes of temperature, salinity, pH and dissolved oxygen in shrimp ponds |

|
图 2 虾池养殖水体总氨氮、亚硝态氮、硝态氮和活性磷的变化 Fig.2 Changes of total ammonia nitrogen, nitrite nitrogen, nitrate nitrogen, and active phosphorus in shrimp ponds |
对虾不同养殖阶段浮游微藻总数量动态见图 3。从图 3可以看出,浮游微藻整个养殖期的总密度约为5.26×107 cell/L,平均密度约为5.84×106 cell/L,在第23天达到密度最大值(1.99×107 cell/L)。第47天到达密度的第2次高峰(1.25×107 cell/L)。
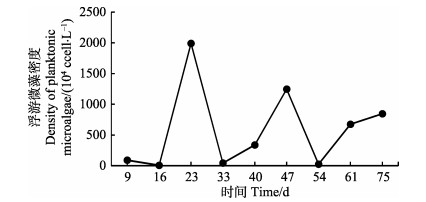
|
图 3 对虾不同养殖阶段浮游微藻总数量 Fig.3 Total number of planktonic microalgae in different culture stages of prawn |
实验期间,虾池养殖水体中的弧菌浓度变化见图 4,在前23 d中弧菌浓度先上升后下降,在16 d时,弧菌浓度达到最大值(5.2×103 CFU/ml),之后呈缓慢下降趋势,整个养殖过程中,弧菌浓度处于较低水平。
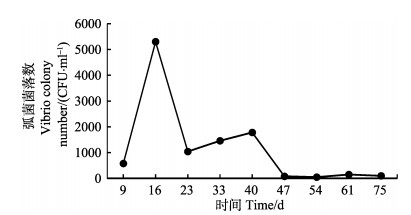
|
图 4 虾池养殖水体的弧菌浓度变化 Fig.4 Changes of vibrio concentration in shrimp ponds |
养殖过程中,共检出浮游动物21种,主要由原生动物、轮虫、枝角类和桡足类4类浮游动物组成,结果见表 2。种类最多的为原生动物,共13种,占种类总数的61.9%,其次为轮虫和桡足类,均为3种,均占种类总数的14.3%,枝角类最少,占种类总数的5%。
|
|
表 2 浮游动物的种类组成及丰富度分布 Tab.2 Species composition and abundance of zooplankton |
对虾不同养殖阶段浮游动物总数量、总生物量动态如图 5和图 6所示。浮游动物整个养殖期的总密度为6.41×103 ind./L左右,平均密度为0.71×103 ind./L,浮游动物总生物量为105.60 mg/L左右,平均生物量为11.7 mg/L。由图 5和图 6可知,在整个养殖过程中,不管是浮游动物的数量还是生物量都是由高到低变化。

|
图 5 对虾不同养殖阶段浮游动物总数量 Fig.5 Total number of zooplankton in different culture stages of prawn |
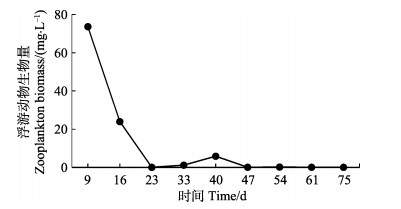
|
图 6 对虾不同养殖阶段浮游动物总生物量 Fig.6 Total biomass of zooplankton in different culture stages of prawn |
该虾池优势种有11种,分别为原生动物门的旋回侠盗虫(Strobidium gyrans)、恩茨筒壳虫(Tintinnidium entzii)、麻玲虫(Leprotintinnus)、棘尾虫(Stylonychia)、拟铃壳虫(Tintinnopsia)、长圆砂壳虫(Difflugia oblonga)、毛板壳虫(Coleps hirtus)和钟虫(Vorticella); 轮虫动物门的褶皱臂尾轮虫(Brachionus plicatilis); 节肢动物门桡足类中的广布中剑水蚤(Cyclopidae leuckarti)和桡足类幼虫。
养殖前期,以原生动物门的旋回侠盗虫、恩茨筒壳虫、麻玲虫、棘尾虫、拟铃壳虫和长圆砂壳虫,轮虫动物门的褶皱臂尾轮虫,节肢动物门的广布中剑水蚤和桡足幼体为优势种。随着养殖期的延长,优势种逐渐演变为原生动物门的长圆砂壳虫、拟铃壳虫、麻玲虫,轮虫动物门的褶皱臂尾轮虫和节肢动物门的桡足幼虫。后期养殖温度过低,主要以原生动物门的钟虫、长圆砂壳虫、毛板壳虫、旋回侠盗虫、拟玲壳虫、恩茨筒壳虫为优势种。在整个养殖过程中,枝角类只在1次取样中出现过1次。
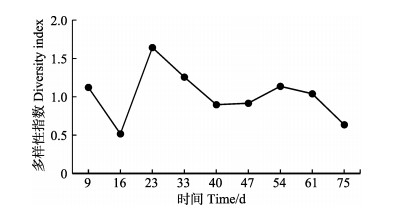
对虾工厂化养殖中,浮游动物多样性指数H′变化情况如图 7,变化范围为0.52~1.64。前期先降低后升高再降低,23 d时到达最高值(1.64),中后期逐渐下降。
|
图 7 虾池浮游动物多样性指数变化 Fig.7 Variations in diversity index of zooplankton in shrimp ponds |
浮游微藻和弧菌与浮游动物相关性系数见表 3。从整个养殖过程来看,浮游微藻数量与浮游动物数量显著负相关(P < 0.05);浮游微藻数量与浮游动物生物量负相关,但不显著(P > 0.05);弧菌数量与浮游动物数量和生物量正相关,但不显著(P > 0.05)。
|
|
表 3 浮游微藻和弧菌与浮游动物的Pearson相关系数 Tab.3 Pearson correlation coefficient of vibrio and planktonic with zooplankton |
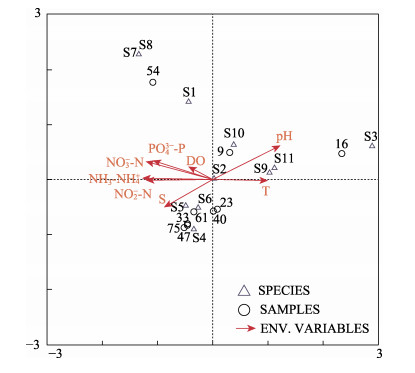
选取11种浮游动物优势种进行DCA分析,浮游动物代码见表 3。结果显示,最大的梯度长度为4.116,大于4,因此,选择对物种数据与环境因子数据作CCA分析,即选取8个水质理化因子及11种浮游动物优势种数量数据,研究浮游动物与环境因子间的关系。结果显示,前2个轴的特征值分别为0.656和0.604,分别解释了浮游动物群落变异程度的32.1%和29.6%,物种和环境因子相关系数都达到1,表明排序能够很好地反映浮游动物与水质因子间的关系。
CCA分析排序(图 8)显示,排序轴1与pH的正相关性最大,相关系数为0.6783,其次是温度,相关系数为0.5354,排序轴1与总氨氮(NH3-NH4+-N)的负相关性最大,相关系数为-0.7011,其次是硝态氮(NO3--N)、亚硝态氮(NO2--N)和活性磷(PO43--P),相关系数分别为-0.6646、-0.6604和-0.5901;排序轴2与pH正相关性最大(0.3480),而与盐度呈负相关(-0.2758)。浮游动物优势种与水环境因子的CCA分析结果见图 8,CCA分析结果显示,影响浮游动物优势种的主要驱动因子为NH3-NH4+、pH、DO、PO43--P、NO2--N、T、NO3--N。
|
图 8 浮游动物优势种与环境因子的CCA分析 Fig.8 Canonical correspondence analysis of the dominant zooplankton species-environmental relationship in the industrial shrimp farming ponds T:水温; DO:溶解氧; S:盐度; pH:酸碱度; NH3-NH4+-N:总氨氮; NO2--N:亚硝态氮; NO3--N:硝态氮; PO43--P:活性磷; S1:旋回侠盗虫; S2:恩茨筒壳虫; S3:棘尾虫; S4:拟铃壳虫; S5:长圆砂壳虫; S6:麻玲虫; S7:毛板壳虫; S8:钟虫; S9:褶皱臂尾轮虫; S10:广布中剑水蚤; S11:挠足幼虫; SAMPLES代表第几天取样 T: Temperature; DO: Dissolved oxygen; S: Salinity; NH3-NH4+-N: Total ammonia nitrogen; NO2--N: Nitrite nitrogen; NO3--N: Nitrate nitrogen; PO43--P: Active phosphorus; S1: S. gyrans; S2: T. entzii; S3: Stylonychia; S4: Tintinnopsia; S5: D. oblonga; S6: Leprotintinnus; S7: C. hirtus; S8: Vorticella; S9: B. plicatilis; S10: C. leuckarti; S11: Copepoda larva; SAMPLES denoted sample day |
本研究表明,凡纳滨对虾工厂化养殖池塘水体的pH、盐度、溶解氧基本稳定。由于本研究调查取样的养殖车间为钢架结构搭建的大棚,养殖虾池用篷布围成,保温性能较差,从放苗开始温度一直在持续下降,因此,发现篷布养虾存在保温难的问题。总氨氮(NH3-NH4+-N)、亚硝态氮(NO2--N)、硝态氮(NO3--N)、活性磷(PO43--P)含量均随养殖时间的延长而增加,在实验中后期已超出渔业水质标准GB11607-89的基本要求。通常养殖水体由于磷的不足而使浮游植物生长受到限制,Reynolds(1984)认为,N/P > 15时,浮游植物生长受营养盐磷的限制。本研究中,虾池的N/P值的变化范围为10.22~76.60,远远大于15,因此,磷成为本研究浮游微藻生长的单一限制因子。
3.2 凡纳滨对虾工厂化养殖水体中浮游动物群落结构及多样性对虾工厂化养殖模式是在小水体中进行的高密度集约化养殖,该模式以人工投饵为主、养殖密度高、投饵量大为特点,在养殖过程中会产生大量的残饵粪便,尤其是在中后期养成阶段,随着对虾的生长,上述现象更为明显,水体自身污染会更加严重。同时,养殖池中物质循环存在明显的不平衡,水体中浮游动物群落特征必然区别于其他养殖模式(孟庆武等, 2008)。浮游动物种类组成是鉴别不同群落类型的重要参考依据。魏小岚等(2013)在对虾高位池循环水养殖水体中检出浮游动物61种,主要由原生动物、轮虫、枝角类和桡足类4类浮游动物组成。本研究中,共检出浮游动21种,主要由原生动物、轮虫、枝角类和桡足类4类浮游动物组成,从浮游动物门水平的种类构成来看,与高位池精养模式差异不大,浮游动物总种类数远远低于高位池养殖模式。
魏小岚等(2013)在对虾高位池循环水养殖水体的研究结果显示,浮游动物平均密度为307.16 ind./L。实验虾池浮游动物平均生物量为2.69 mg/L。本研究中,实验塘中浮游动物整个养殖期的总密度为6.41× 103 ind./L左右,平均密度为0.71×103 ind./L,浮游动物总生物量为105.60 mg/L左右,平均生物量为11.7 mg/L。平均密度和生物量高于高位池循环水养殖模式,这是由于工厂化养殖自身特点造成的,工厂化养殖模式密度大、投料多、换水频率高,富营养化程度相对较高,造成水体生态环境不同。同时,由于对虾工厂化养殖多位于中国北方,而高位池多位于南方,地域差异也是造成二者水体生态环境不同的原因。另外,从图 5和图 6可以看出,整个养殖过程中,浮游动物的数量和生物量都由高到低变化,这可能与后期养殖水体温度低有关,不同温度对浮游动物生活史的影响研究显示,低温不利于浮游动物的生理发育(Bottrell, 1975; Orcutt et al, 1983、1984; Giebelhausen et al, 2010)。
生物多样性指数是指某一区域内各种生物个体数量的出现概率之和,主要与数量有关,由于生物多样性特点与生物种类组成和数量的变化有关(刘建康, 1999),因此,多样性指数常被用来评价水域生物种类组成的多样性水平。浮游动物多样性指数越低,则虾池水环境中浮游动物群落结构越简单,优势种越单一,演替速度越快,群落越不稳定(孙耀等, 1998),此现象是由该养殖模式自身的特点所决定。魏小岚等(2013)在对虾高位池循环水养殖水体多样性的调查显示,循环塘浮游动物多样性指数在1.01~2.08之间波动,并呈上升趋势。本研究中,浮游动物多样性指数变化范围为0.52~1.64。总体趋势是浮游动物多样性指数养殖前期先降低后升高,中期较高,后期再次逐渐降低,与高位池循环水养殖模式有所不同。养殖前期,因为采用地下海水养殖及滤网过滤,造成虾池中浮游动物的种类和数量较少,导致多样性指数偏低。随着养殖的进行,养殖中期,生态系统逐步稳定,多样性指数相应增加,到了养殖后期,篷布养虾保温性差以及营养盐的累积,优势种类向单一方向发展,表现为浮游动物多样性指数逐渐降低,此时的虾池生态系统稳定性较差。
3.3 凡纳滨对虾工厂化养殖水体中浮游动物与浮游微藻的关系大量研究表明,典型湖泊的食物网主要是由上行效应控制,即资源可获得性的驱动作用。如浮游植物被营养盐和光所控制,浮游动物被浮游植物控制,食浮游动物鱼类被浮游动物所控制等(Mcqueen et al, 1989)。研究表明,食物网结构可能同时受到下行效应的控制,如食浮游动物鱼类控制浮游动物、浮游动物控制浮游植物等(Carpenter et al, 1985)。此外,1975年Shapiro等提出了生物操纵(Biomanipulation)的概念,即通过对水生生物群及其栖息地的一系列调节,以增强其中的某些相互作用,促使浮游植物生物量下降。这2种观点的本质是从食物链的角度说明了浮游动物对浮游微藻数量的一种控制作用。陈济丁等(1995)研究发现,大型浮游动物对浮游植物的控制作用是明显的,从群落水平上看,大型溞等大型植食性浮游动物能把藻类生物量控制在极低的水平。利用大型浮游动物是控制浮游植物过量生长的一种有效方法。卢静等(2000)研究发现,浮游动物的摄食可能对浮游植物产生影响,二者数量的消长在大多数围隔都呈负相关。本研究中,浮游动物数量和浮游微藻数量为负相关,相关系数R= -0.728(P < 0.05);浮游动物总生物量和浮游微藻总生物量为负相关,相关系数R= -0.302(P > 0.05)。可以认为本研究验证了以上观点。在对虾工厂化养殖中,理论上可以利用添加或去除浮游动物的方式达到控藻的效果,使对虾养殖水体拥有良好的藻相,进而净化水质。
3.4 凡纳滨对虾工厂化养殖水体中浮游动物与弧菌的关系大量资料表明,在细菌取食有机碎屑和形成菌膜过程中,接着出现藻类和真菌,直至发生原生动物。除此之外,有人发现在水生生态系统中,虽然细菌生长很快,但数量一直维持在一个较低的水平上,这是与异养鞭毛虫、纤毛虫的大量捕食有关。韩士群等(2006)在固定化微生物对养殖水体浮游生物的影响及生物除氮的研究中发现,固定化微生物处理后,水体中浮游动物种类和生物量增加,进而浮游动物的群落组成发生了变化。本研究发现,养殖期间弧菌数量与浮游动物的总数量存在正相关关系,相关系数R=0.655;养殖期间,弧菌数量与浮游动物的总生物量存在正相关关系,相关系数R=0.176。研究表明,微藻对对虾养殖环境中的弧菌具有一定的抑制作用(林伟等, 2000、2001; Ohta et al, 1993),海洋微藻与异养细菌之间存在密切关系(Jones, 1982)。本研究中,浮游动物数量与浮游微藻数量显著负相关(P < 0.05),可能是因为浮游动物对浮游微藻的大量捕食,导致浮游微藻对海洋弧菌的抑制作用减弱。浮游动物对弧菌的直接作用仍需进一步研究。
3.5 凡纳滨对虾工厂化养殖水体中浮游动物优势种及与环境因子的关系浮游动物在数量和生物量上一般都占有较高比例的为优势种,优势种在一定程度上代表浮游动物群落特征。凡纳滨对虾工厂化养殖水体中的浮游动物种类组成中,原生动物占绝对优势,轮虫和桡足类次之,而枝角类几乎没有。在对虾养殖的各个时期,原生动物始终为优势种,轮虫和桡足类只在前、中期为优势种,说明原生动物对环境的适应性更强,相对于普通高位池和循环水高位池多出现的常见种(魏小岚等, 2013;李由明等, 2013),工厂化养殖模式多出现原生动物的种类,种类呈现小型化现象。除了优势种之外,虾池中也出现了个别富营养化水体的指示种,钟虫、聚缩虫(Zoothamnium)、阔口游仆虫(Euplotes eurystomu)等。
大量研究发现,水温是影响浮游动物生长繁殖、群落组成、数量变化和时空分布等的重要环境因子之一(Dumont, 1983; Dussart et al, 1984;陈光荣等, 2008)。本研究中,虾池浮游动物的种类数、密度和生物量随养殖水温的下降而逐步减少,同时,CCA分析也显示,多种优势种与水温呈正相关关系。水体中的NH3和NH+-N处于动态平衡,当温度和pH增大时,离子氨(NH4+-N)向非离子氨(NH3)转化,而非离子氨对水生生物是有害的(Yu et al, 1986; Jana et al, 1993; Monda et al, 1995)。Arauzo(2003)研究发现,当非离子氨的浓度大于2.5 mg/L时,浮游动物的生物量将有所减少。本研究中随着养殖的进行,营养盐浓度逐渐升高,浮游动物的数量有一定程度的减少。同时,随着水体中营养盐的增加,浮游动物的群落结构由大型浮游动物占优势转变为小型浮游动物占优势,小型浮游动物的生物量占总生物量的50%~90%,而且,这种相关性在小型浮游动物(如纤毛虫)中变现的更为明显(Blancher, 1984; Bays et al, 1983; Pace, 1986)。本研究CCA分析中,大部分的原生动物与营养盐呈正相关关系,表明其喜富营养化的水环境,而褶皱臂尾轮虫、广布中剑水蚤和桡足类幼虫与营养盐呈负相关,表明其更喜营养程度低的水体,也验证了此观点。养殖水体pH对浮游动物也具有重要影响,不同种类的浮游动物,其适宜生长的pH不同。CCA分析显示,不同优势种与pH相关性不同,棘尾虫、褶皱臂尾轮虫、广布中剑水蚤和桡足类幼虫相对拟铃壳虫、长圆砂壳虫、麻玲虫等更喜欢pH稍高的水体。这与其自身的环境适应性有关。CCA分析排序图既能较好地反应物种与环境因子之间的关系,又能反映出不同物种在生态位上的差异。如褶皱臂尾轮虫、桡足类幼虫在排序图中的位置比较接近,表明它们在生态位上较为类似; 而同一物种不同生长期的浮游动物对环境资源依赖程度也可能存在一定差异,如桡足类的广布中剑水蚤与其幼虫在排序图中位置较远,表现出对环境资源要求不同。
Arauzo M. Harmful effects of un-ionised ammonia on the zooplankton community in a deep waste treatment pond. Water Research, 2003, 37(5): 1048-1054 DOI:10.1016/S0043-1354(02)00454-2 |
Bays JS, Crisman TL. Zooplankton and trophic state relationships in Florida Lakes. Canadian Journal of Fisheries and Aquatic Sciences, 1983, 40(10): 1813-1819 DOI:10.1139/f83-210 |
Blancher EC. Zooplankton-trophic state relationships in some north and central Florida lakes. Hydrobiologia, 1984, 109(3): 251-263 DOI:10.1007/BF00007743 |
Bottrell HH. The relationship between temperature and duration of egg development in some epiphytic Cladocera and Copepoda from the River Thames, reading, with a discussion of temperature functions. Oecologia, 1975, 18(1): 63-84 DOI:10.1007/BF00350636 |
Boudreau PR, Dickie LM. Biomass spectra of aquatic ecosystems in relation to fisheries yield. Canadian Journal of Fisheries and Aquatic Sciences, 2011, 49(8): 1528-1538 |
Carpenter SR, Kitchell JF, Hodgson JR. Cascading trophic interactions and lake productivity. BioScience, 1985, 35(10): 634-639 DOI:10.2307/1309989 |
Chen GR, Zhong P, Zhang XF, et al. Zooplankton and its relationship with water quality in Huizhou West Lake. Journal of Lake Sciences, 2008, 20(3): 351-356 [陈光荣, 钟萍, 张修峰, 等. 惠州西湖浮游动物及其与水质的关系. 湖泊科学, 2008, 20(3): 351-356 DOI:10.3321/j.issn:1003-5427.2008.03.014] |
Chen JD, Ren JC, Cai XM, et al. Studies on control of excessive phytoplankton growth by macrozooplankton. Acta Scientiarum Naturalium Universitatis Pekinensis, 1995, 31(3): 373-382 [陈济丁, 任久长, 蔡晓明, 等. 利用大型浮游动物控制浮游植物过量生长的研究. 北京大学学报(自然科学版), 1995, 31(3): 373-382 DOI:10.3321/j.issn:0479-8023.1995.03.001] |
Dong Y, Fu SY, Meng AY, et al. Experiment on application of bio-floc technology in industrial aquaculture of Litopenaeus vannamei. Fishery Modernization, 2018, 45(6): 26-31 [董杨, 符书源, 蒙爱云, 等. 生物絮团技术在凡纳滨对虾工厂化养殖中的应用试验. 渔业现代化, 2018, 45(6): 26-31 DOI:10.3969/j.issn.1007-9580.2018.06.005] |
Dumont HJ. Biogeography of rotifers. Hydrobiologia, 1983, 104(1): 19-30 DOI:10.1007/BF00045948 |
Dussart BH, Fernando CH, Matsumura-Tundisi T, et al. A review of systematics, distribution and ecology of tropical freshwater zooplankton. Hydrobiologia, 1984, 113(1): 77-91 DOI:10.1007/BF00026594 |
Ge HX. Effects of two main inorganic nitrogen on the immune response of Litopenaeus vannamei and its susceptibility to Vibrio parahemolyticus. Masterxs Thesis of Shanghai Ocean University, 2014 [葛红星.两种主要无机氮胁迫下凡纳滨对虾免疫因子变化及其对副溶血弧菌易感性的研究.上海海洋大学硕士研究生学位论文, 2014]
|
Giebelhausen B, Lampert W. Temperature reaction norms of Daphnia magna: The effect of food concentration. Freshwater Biology, 2010, 46(3): 281-289 |
Han SQ, Fan CX, Yan SH. Effect of immobilized microbes on plankton and biodenitrification in aquiculture water. Chinese Journal of Applied and Environmental Biology, 2006, 12(2): 251-254 [韩士群, 范成新, 严少华. 固定化微生物对养殖水体浮游生物的影响及生物除氮研究. 应用与环境生物学报, 2006, 12(2): 251-254 DOI:10.3321/j.issn:1006-687X.2006.02.024] |
Jana BB, Chakrabarti R. Life table responses of zooplankton (Moina micrura Kurz and Daphnia carinata King) to manure application in a culture system. Aquaculture, 1993, 117(3-4): 273-285 DOI:10.1016/0044-8486(93)90325-S |
Jones AK. The interaction of algae and bacteria. In: Bull AT, Slater JH (eds). Microbial interactions and communities. London: Academic Press, 1982, 189–227
|
Li YM, Huang XH. Analysis of plankton community diversity of culturing pond for Litopenaeus vannamei. Science and Technology Innovation Herald, 2013(1): 9-11 [李由明, 黄翔鹄. 凡纳滨对虾养殖水体中浮游生物群落的多样性分析研究. 科技创新导报, 2013(1): 9-11 DOI:10.3969/j.issn.1674-098X.2013.01.004] |
Li YQ. Analysis on farming system of super-intensive and effect of main factors on growth, immunity and nutrient budgets in shrimp. Master's Thesis of Ocean University of China, 2006 [李玉全.工厂化养殖系统分析及主要养殖因子对对虾生长、免疫及氮磷收支的影响.中国海洋大学硕士研究生学位论文, 2006]
|
Lin W, Chen D, Liu XY. The antivibrio mechanism of microalgae cultivation system. Oceanologia et Limnologia Sinica, 2000, 31(4): 398-403 [林伟, 陈騳, 刘秀云. 饵料微藻培育系统内海洋弧菌生长特点. 海洋与湖沼, 2000, 31(4): 398-403 DOI:10.3321/j.issn:0029-814X.2000.04.009] |
Lin W, Chen D, Liu XY. Growth feature of Vibrios in microalgae cultural systems. Oceanologia et Limnologia Sinica, 2001, 32(1): 7-14 [林伟, 陈騳, 刘秀云. 海洋微藻培育系统抗弧菌作用机理. 海洋与湖沼, 2001, 32(1): 7-14 DOI:10.3321/j.issn:0029-814X.2001.01.002] |
Liu JK. Advanced aquatic biology. Beijing: Science Press, 1999 [刘建康. 高级水生生物学. 北京: 科学出版社, 1999]
|
Lu J, Li DS, Dong SL. The impact of stocking density on plankton community in shrimp pond. Journal of Fisheries of China, 2000, 24(3): 240-246 [卢静, 李德尚, 董双林. 对虾池的放养密度对浮游生物群落的影响. 水产学报, 2000, 24(3): 240-246] |
Luo DL. Quantitative distribution characteristics of zooplankton from three important mariculture areas of Xiamen. Journal of Oceanography in Taiwan Strait, 2004, 23(4): 458-468 [罗冬莲. 厦门三个重要养殖水域浮游动物的数量分布特征. 台湾海峡, 2004, 23(4): 458-468 DOI:10.3969/j.issn.1000-8160.2004.04.010] |
Maberly SC, King L, Dent MM, et al. Nutrient limitation of phytoplankton and periphyton growth in upland lakes. Freshwater Biology, 2002, 47(11): 2136-2152 DOI:10.1046/j.1365-2427.2002.00962.x |
Mcqueen DJ, Johannes MRS, Post JR, et al. Bottom-up and top-down impacts on freshwater pelagic community structure. Ecological Monographs, 1989, 59(3): 289-309 DOI:10.2307/1942603 |
Meng QW, Wang S, Zhao YJ, et al. Characteristics of industrialized culture of shrimp and its development and prospects in China. Ocean Development and Management, 2008, 25(3): 124-127 [孟庆武, 王圣, 赵玉洁, 等. 我国对虾工厂化养殖的特点、发展趋势及前景. 海洋开发与管理, 2008, 25(3): 124-127 DOI:10.3969/j.issn.1005-9857.2008.03.028] |
Monda DP, Galat DL, Finger SE. Evaluating ammonia toxicity in sewage effluent to stream macroinvertebrates: Ⅰ. A multi-level approach. Archives of Environmental Contamination and Toxicology, 1995, 28(3): 378-384 |
Ohta S, Chang T, Ikegami N, et al. Antibiotic substance produced by a newly isolated marine microalga, Chlorococcum HS-101. Bulletin of Environmental Contamination and Toxicology, 1993, 50(2): 171-178 |
Orcutt JD, Porter KG. Diel vertical migration by zooplankton: Constant and fluctuating temperature effects on life history parameters of Daphnia. Limnology and Oceanography, 1983, 28(4): 720-730 DOI:10.4319/lo.1983.28.4.0720 |
Pace ML. An empirical analysis of zooplankton community size structure across lake trophic gradients. Limnology and Oceanography, 1986, 31(1): 45-55 DOI:10.4319/lo.1986.31.1.0045 |
Pinel-Alloul B, Pont D. Spatial distribution patterns in freshwater macrozooplankton: Variation with scale. Canadian Journal of Zoology, 1991, 69(6): 1557-1570 DOI:10.1139/z91-219 |
Reynolds CS. The ecology of freshwater phytoplankton. London: Cambridge University Press, 1984
|
State Oceanic Administration. The specification for marine monitoring—Part 4:Seawater analysis. Beijing: Standards Press of China, 2007 [国家海洋局. 海洋监测规范—第四部分:海水分析. 北京: 中国标准出版社, 2007]
|
Sun RY. Principle of animal ecology. Third edition. Beijing: Beijing Normal University Press, 2006 [孙濡泳. 动物生态学原理. 第3版. 北京: 北京师范大学出版社, 2006]
|
Sun Y, Li Y, Li J, et al. Phytoplankton community characterics and their relationship with nutrient salts in shrimp ponds. Marine Fisheries Research, 1998, 19(2): 45-51 [孙耀, 李锋, 李健, 等. 虾塘水体中浮游植物群落特征及其与营养状况的关系. 海洋水产研究, 1998, 19(2): 45-51] |
Wei XL, Li CH, Jie XY. Ecological characteristics of zooplankton in the higher place pond of shrimp recirculating aquaculture system. Journal of Agro-Environment Science, 2013, 32(1): 141-152 [魏小岚, 李纯厚, 颉晓勇, 等. 对虾高位池循环水养殖水体浮游动物生态特征研究. 农业环境科学学报, 2013, 32(1): 141-152] |
Wu ZB, Liu AF, Wu XH, et al. Dynamics of zooplankton in fish-culturing ponds with water circled by integrated vertical-flow constructed wetland. Chinese Journal of Applied and Environmental Biology, 2007, 13(5): 668-673 [吴振斌, 刘爱芬, 吴晓辉, 等. 人工湿地循环处理的养殖水体中浮游动物动态变化. 应用与环境生物学报, 2007, 13(5): 668-673 DOI:10.3321/j.issn:1006-687x.2007.05.013] |
Yu JP, Hirayama K. The effect of un-ionized ammonia on the population-growth of the rotifer in mass-culture. Bulletion of the Japanese Society of Scientific Fisheries, 1986, 9(52): 1509-1513 |
Zhao W. Advanced aquatic biology. Beijing: China Agriculture Press, 2005 [赵文. 水生生物学. 北京: 中国农业出版社, 2005]
|



