2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266071;
3. University of Chinese Academy of Sciences, Beijing 100049;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071
耳石是硬骨鱼类在生长过程中沉积在内耳中的结石,主要起声音接收和平衡调节作用(Kalish, 1989; 窦硕增, 2007)。在鱼类生长过程中,水环境中的化学元素通过鱼类鳃呼吸等方式进入血液循环,经细胞传输进入内淋巴,结晶后沉积在耳石中。由于耳石的非细胞性及代谢惰性,沉积在耳石中的微量元素不会出现分解或重吸收现象,能够指示鱼类从出生到被捕获生活过程中所经历的水化学环境变化(Campana, 1999; Walther et al, 2006)。随着元素分析技术的发展,自20世纪80年代以来,通过分析耳石全区或特定区的微化学组成,揭示鱼类生活史或特定生活阶段所经历的水环境特征的耳石微化学分析及其应用研究逐渐兴起。目前,该方法已被广泛应用于鱼类生态学及渔业资源研究中,包括重建生活史(Elsdon et al, 2002; Wells et al, 2003)、产卵场溯源(Tanner et al, 2012)、洄游(Dou et al, 2012a; Walther et al, 2012; Hagerstrand et al, 2017)和鱼类种群判别(Dou et al, 2012b; Hayden et al, 2013; Higgins et al, 2013)等。
耳石微化学分析需基于明确的耳石微化学元素沉积机制,即耳石中微量元素沉积变化能够客观地反映鱼类生活史中所经历的水环境特征的地域性差异。由于耳石并不与外界水环境直接接触,微量元素在耳石中的沉积不仅与水化学相关,更受传输过程中所经过的鳃、内耳膜等组织结构的生理功能调控(Campana, 1999; Bath et al, 2000; Izzo et al, 2018)。环境因素的变化及鱼体生长差异也可通过调节鱼类生长发育影响微量元素在耳石中的沉积。例如,水温能够通过影响血液与内淋巴系统的pH值而影响其传输能力,调控微量元素在耳石中的沉积(Mazloumi et al, 2017)。在近岸生态系统特别是河口区,淡海水的交汇程度差异使得近海水环境呈现出显著的复杂多变性,例如,水体中元素浓度、水温和盐度等环境因子具有显著的地域差异性(Nelson et al, 2018)。因此,耳石中的元素沉积是否能够客观地反映水化学元素浓度、水温变化等环境因子的效应,是耳石微化学分析能否科学地重新构建鱼类生活史的关键因素。
耳石中微量元素沉积量和水环境元素浓度的关系因元素种类不同而异(Campana, 1999; Miller, 2009)。Sr在海水、河口和淡水水域中元素浓度及其在耳石中组成的地域性差异显著,因而被作为重要的元素指纹广泛应用于鱼类生态学研究。而作为影响耳石元素沉积的重要因子,水温对耳石中Sr沉积的影响也成为国内外耳石微化学研究的热点之一(Mazloumi et al, 2017; Nelson et al, 2018)。研究表明,温度对耳石微化学组成的影响具有鱼种特异性。例如,水温升高能促进Sr在狼鲈(Dicentrarchus labrax) (Reis-Santos et al, 2013)和黄尾平口石首鱼(Leiostomus xanthurus) (Bath et al, 2000; Martin et al, 2004)等鱼类耳石中的沉积,或抑制其在太平洋鳕(Gadus macrocephalus) (DiMaria et al, 2010)、大西洋鳕(Gadus morhua) (Townsend et al, 1992)等鱼类耳石中的沉积,但对其在大鳞油鲱(Brevoortia patronus) (Chesney et al, 1998)和斑拟(Sillaginodes punctatus)(Mazloumi et al, 2017)等鱼类耳石中的沉积无显著影响。鱼类的个体发育、生长和耳石的形成过程对水环境温度的敏感度和生理响应不同,导致水温对耳石中微量元素沉积的影响存在显著的种间差异。研究水环境因子(如元素浓度和水温)对耳石微量元素沉积的影响有助于提高耳石微化学分析在鱼类生活史重建中的应用能力。
褐牙鲆(Paralichthys olivaceus)是我国近海重要的经济鱼种(陈大刚, 1991)。在其生活史中,褐牙鲆产卵群体在春季洄游至近岸、海湾或河口水域产卵孵化,仔鱼在表层水域完成变态成为稚鱼后着底,开始在近岸育幼场营底栖生活,秋季水温下降后进入深水越冬,直至翌年春季开始产卵洄游。褐牙鲆在早期生活阶段经历剧烈变态发育等生理变化、从浮游至底栖的生态习性转变以及多变的近岸、河口和深水区迁移履历,其耳石中Sr沉积易受到水温和水化学组成变化的影响,是探讨耳石微量元素沉积机制的理想实验物种。同时,褐牙鲆的人工孵化和饲育技术成熟,成活率高,为开展本实验研究提供了支持。
本研究以褐牙鲆仔稚鱼为研究对象,开展不同水温和不同元素浓度下耳石中Sr沉积差异实验,探讨耳石元素指纹技术在重建鱼类生活史中的一些技术问题,既可丰富耳石沉积机制研究,又为基于耳石微化学分析解决鱼类群体识别、洄游履历和环境史等生态学难点问题提供科学参考。
1 材料与方法 1.1 褐牙鲆孵化与饲育实验活体材料取自褐牙鲆自然产卵、孵化的仔鱼。将取自同批次的受精卵置于1000 L (50粒卵/L)室内水槽中孵化、饲育。孵化过程中微充气,水温为(16.8±0.5)℃,光照周期为13 L:11 D。受精卵在受精后48 h (hpf)开始孵化,72 hpf之内完成孵化。死亡鱼卵沉入底部,发育正常的受精卵则漂浮在海水表面,孵化率约为92%。
仔鱼约在孵化后2 d(dph)开口摄食。参照常规的饲育管理,对开口仔鱼投喂轮虫,每天投喂2次。轮虫在21℃~23℃下培养,投喂小球藻。孵化3 d后每天换水50%。15 dph仔鱼的摄食、存活等趋于稳定,开始用于实验。其他饲育条件与孵化过程一致。
1.2 实验设计实验从15 dph仔鱼开始持续到93 dph。参考褐牙鲆仔稚鱼在自然水域中可能经历的水温变化及Sr浓度变化,本研究设置3个实验温度梯度(16℃、19℃和22℃),与3个Sr元素浓度梯度(1×、2×和3×;6.5 mg/L)正交实验,研究温度和元素浓度对耳石中Sr沉积的影响。实验共设置9个处理水平,每个处理水平下设置2个重复。每个实验水槽的水体(过滤自然海水)体积为40 L,光照条件为13 L:11 D,微充气。从孵化培育水槽中随机取出50尾15 dph仔鱼(全长为7.9 mm)置于每个实验水槽。精密控温仪(温控范围:0℃~90℃,感温灵敏度:0.1℃,A-MI 211H)和钛加热棒(100~2000 W, Armaturenbau)调节控制水温;利用SrCl2×6H2O和过滤后的自然海水配制各Sr元素浓度的实验水体。
在实验过程中,随着仔稚鱼的生长发育,调整饵料和换水量。在仔鱼阶段(15~35 dph),每日换水约50%,并在换水后投喂轮虫及卤虫;从着底稚鱼(36 dph)至56 dph,每日完全换水1次,投喂卤虫及人工饵料;从57 dph到实验结束,每日完全换水2次,投喂人工饵料。实验期间,每6 h检查清理死亡个体。实验过程中,各实验水槽中的个体死亡率为14%~25%。
1.3 样品采集及分析 1.3.1 水样采集实验开始后,每隔7 d在各处理组取样50 ml,取得的水样经0.45 μm孔径滤膜过滤后,用2%的稀硝酸固定,存储在酸洗过的聚丙烯瓶中,保存在4℃下用于化学元素测定分析。
1.3.2 耳石样品采集与处理实验结束后,从每个水槽中随机选取8个鱼类个体。样品选取完成后,测量每条鱼体的体长和体重,然后,提取鱼体内的矢耳石,耳石经蒸馏水清洗后风干,存放于2 ml离心管内,用于化学元素测定。
1.3.3 耳石微化学分析耳石样品采用酸溶ICP-MS(Elan DRC II)方法测定分析其Sr和Ca含量。耳石样品制备和元素测定分析方法参照Bailey等(2015)和Higgins等(2013)。首先,将耳石用去离子水结合超声波清洗5 min以剔除耳石表面附着物。然后,用3%的H2O2浸泡耳石约10 min进一步消解其表面可能存在的残留物,再用去离子水清洗干净后置于通风橱内风干。干燥后的耳石用精密天平(Discovery DV215CD, 0.01 mg)称重后再用去离子水清洗除污。除污后的耳石样品在酸洗过的聚丙烯管内进行酸溶处理。耳石样品完全酸溶后,用去离子水按10:1比例进一步稀释使最终浓度达到0.1% w/v。样品制备完成后随机分批进行ICP-MS分析,测定耳石中的Ca和Sr含量,计算其Sr:Ca比。
将水样用2%的稀硝酸稀释(1 v/99 v,水样体积/稀硝酸体积),然后,用ICP-AES (IRIS Intrepid Ⅱ XSP)测定水样中的Ca浓度,用ICP-MS (Elan DRC Ⅱ)测定水样中的Sr浓度,计算其Sr:Ca比。
1.4 数据统计与处理各实验水槽中水体和耳石中的Sr:Ca比以平均值±标准差(Mean±SD)表示。Sr的元素分配系数(DSr)指耳石中Sr:CaOtolith与水体中的Sr:CaWater的比值(Sr:CaOtolith/Sr:CaWater),用以表征水体中Sr在耳石中的沉积效率。正态分布检验(Shapiro-Wilk normality test)及方差齐性检验(Levene test)发现部分Sr:Ca原始数据未完全满足2个假设条件,因此,对所有原始数据进行ln(x+1)转化后,开展双因素方差分析(Two- way ANOVA),检验温度和水体中元素浓度对耳石中Sr沉积的影响,并对组间差异进行多重比较分析(Duncan test)。在各水温下对Sr:CaOtolith与Sr:CaWater数据进行回归分析,检验二者的线性关系。
相关统计分析均在SPSS 22.0上运行,差异显著性水平设置为P < 0.05。
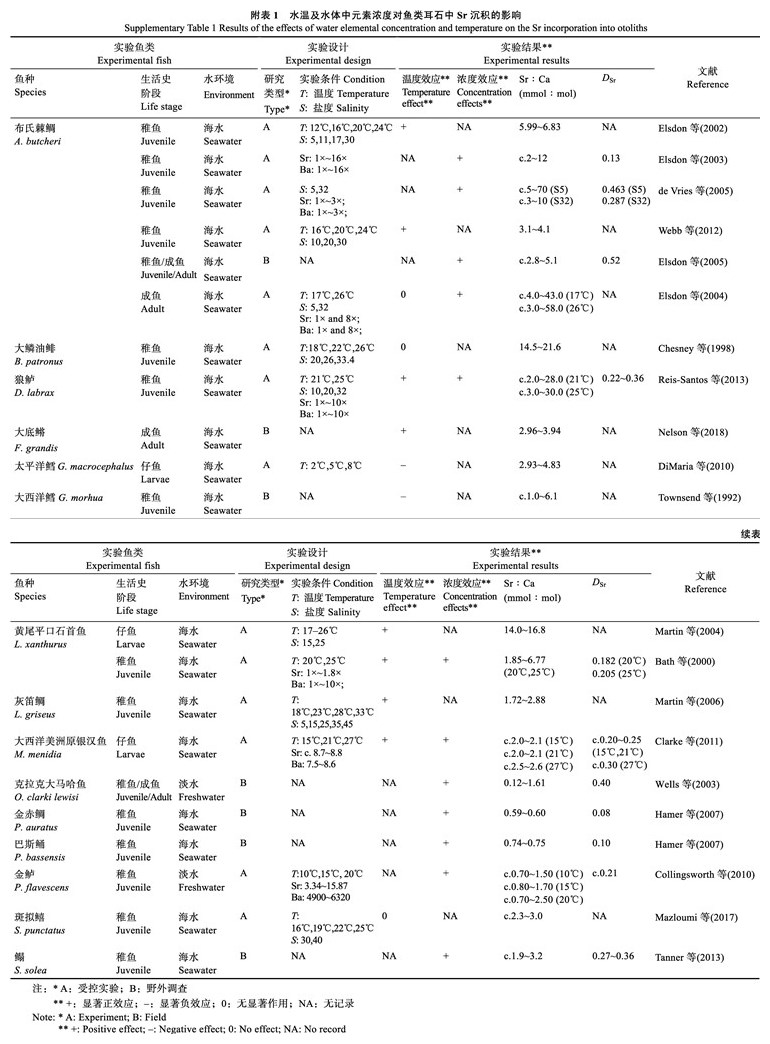
2 结果 2.1 水化学浓度差异对耳石中Sr沉积的影响实验过程中,1×Sr浓度组、2×Sr浓度组和3×Sr浓度组的实测水体Sr浓度(Sr:CaWater)分别为7.76~ 7.95、15.38~15.93和22.45~23.02 mmol/mol,与各标定Sr浓度梯度基本一致。在同一Sr浓度下,各温度组之间Sr:CaWater均无显著差异(图 1A~图 1C;P> 0.05)。
|
图 1 各实验组实测水体Sr浓度(Sr:CaWater;A~C)及耳石Sr浓度(Sr:CaOtolith;D~F)不同字母表示各温度水平之间的差异显著(P < 0.05) Fig.1 Sr concentrations in water (Sr:CaWater; A~C) and otoliths (Sr:CaOtolith; D~F) across treatments. Values with different letters differ significantly between treatments (P < 0.05) |
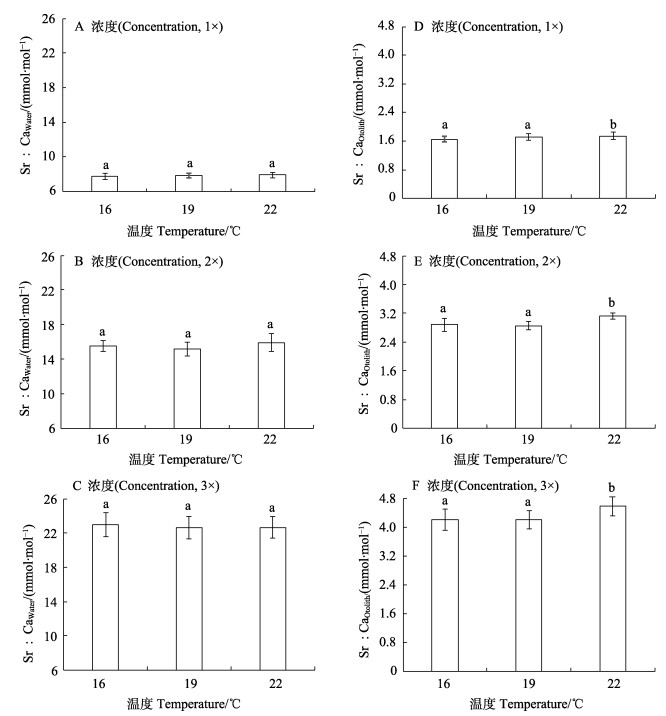
水体中Sr浓度的升高显著促进耳石中Sr的沉积(Sr:CaOtolith;表 1,图 1D~图 1F;P < 0.05)。在各温度下,Sr:CaOtolith与Sr:CaWater均呈线性正相关(图 2;P < 0.05,r2>0.96)。在不同的Sr浓度下,Sr:CaOtolith均随水温变化而波动。其中,在1×Sr、2×Sr和3×Sr浓度组的Sr:CaOtolith的变化范围分别为1.60~1.75、2.82~3.15和4.11~4.69 mmol/mol。在不同水温条件下,3×Sr浓度组的Sr:CaOtolith均显著高于1×Sr和2×Sr浓度组的Sr:CaOtolith(P < 0.05)。
|
图 2 不同水温下耳石中Sr浓度(Sr:CaOtolith)与水体中Sr浓度(Sr:CaWater)的关系 Fig.2 Relationship between Sr concentrations in otoliths (Sr:CaOtolith) and in water (Sr:CaOtolith) at different temperatures |
|
|
表 1 温度和元素浓度(Sr:CaWater)对耳石中Sr沉积的(Sr:CaOtolith)影响(ANOVA, P < 0.05) Tab.1 Effects of water Sr concentration (Sr:CaWater) and temperature on Sr concentration in otoliths (Sr:CaOtolith) of the larval-juvenile flounder (ANOVA, P < 0.05) |
在不同温度下,1×Sr浓度组中的DSr明显高于2× Sr和3×Sr浓度下的DSr。总体而言,DSr随Sr:CaWater的升高而降低,当Sr:CaWater上升到一定水平后,DSr趋于稳定值(图 3)。在1×Sr、2×Sr和3×Sr浓度组的DSr变化范围分别为0.21~0.22、0.18~0.20和0.18~ 0.20。

|
图 3 不同温度下DSr与水体中Sr浓度(Sr:CaWater)之间的关系 Fig.3 Plots of mean DSr and Sr:CaWater at different temperatures |
温度对耳石中Sr沉积(Sr:CaOtolith)具有显著影响(表 1;P < 0.05)。在不同Sr浓度下,较低水温(16℃和19℃)对Sr:CaOtolith的影响不显著(P>0.05);但较高温度(22℃)能够显著地促进Sr:CaOtolith增长(P < 0.05)。Sr:CaOtolith在16℃、19℃和22℃下的变化范围分别为1.60~4.24、1.65~4.29和1.73~4.69 mmol/mol (图 1D~图 1F)。
类似地,在不同Sr浓度下,DSr在22℃下均高于16℃和19℃下的值,即在较高水温下耳石中的Sr的沉积效率明显升高。DSr在16℃、19℃和22℃下的变化范围分别为0.18~0.21、0.18~0.21和0.19~0.22 (图 3)。
3 讨论本研究发现,不同的水温条件下水体中Sr浓度的升高均能够显著促进褐牙鲆仔稚鱼耳石中Sr沉积,即耳石中Sr沉积与水环境中Sr浓度密切相关,能客观表征鱼类所经历的水化学环境变化。这一现象在其他硬骨鱼类的耳石微化学研究中也得以证实,如鳎(Solea solea) (Tanner et al, 2013)、布氏棘鲷(Acanthopagrus butcheri) (Elsdon et al, 2003)、克拉克大马哈鱼(Oncorhynchus clarki) (Wells et al, 2003)、巴斯鲬(Platycephalus bassensis) (Hamer et al, 2007)、金赤鲷(Pagrus auratus) (Hamer et al, 2007)、金鲈(Perca flavescens) (Collingsworth et al, 2010;附表 1)等。本研究中,褐牙鲆仔稚鱼耳石中的Sr:Ca比为1.60~ 4.69 mmol/mol,处于实验条件下海洋鱼类耳石中Sr:Ca比(约为0.59~8.00 mmol/mol, 附表 1)范围之内。尽管耳石中Sr的沉积量存在种间差别,但耳石中Sr的沉积均随水体中Sr浓度的升高而增加(de Vries et al, 2005; Dorval et al, 2007)。对比分析不同鱼种耳石中Sr沉积的分配系数DSr可进一步发现,各鱼种的耳石对水环境Sr的沉积效率具有相似性。褐牙鲆仔稚鱼的DSr范围为0.18~0.22,处于室内实验获取的其他海洋鱼类的DSr (约0.13~0.40)范围之内。就鱼种而言,褐牙鲆仔稚鱼的DSr略低于银汉鱼(Menidia menidia) (0.20~0.25,15℃~21℃; Clarke et al, 2011)和欧洲鲈(0.22~0.36; Reis-Santos et al, 2013),与金鲈相近(0.21; Collingsworth et al, 2010),但高于布氏棘鲷的(0.13; Elsdon et al, 2003)。不同鱼种的耳石中Sr沉积与水体中Sr浓度的均存在显著正相关关系,且各物种之间的沉积效率差异较小,基本处在一定范围内,表明各种鱼类的耳石在形成和生长过程中均能以较稳定的效率从水环境中沉积微量的Sr元素。
|
|
表 S1 水温及水体中元素浓度对鱼类耳石中Sr沉积的影响 Tab.S1 Supplementary Table 1 Results of the effects of water elemental concentration and temperature on the Sr incorporation into otoliths |
水温对耳石中Sr沉积的作用因鱼种而异。本研究发现,水温升高能促进褐牙鲆仔稚鱼耳石中Sr沉积,即耳石中Sr沉积与其所经历的温度密切相关。类似结果也曾发现于其他海洋鱼类如黄尾平口石首鱼(Bath et al, 2000; Martin et al, 2004)、大西洋美洲原银汉鱼(Clarke et al, 2011)、灰笛鲷(Lutjanus griseus) (Martin et al, 2006)、大底鳉(Fundulus grandis) (Nelson et al, 2018)等。相反,在太平洋鳕鱼(DiMaria et al, 2010)及大西洋鳕鱼(Townsend et al, 1992)中,水温抑制了其耳石中Sr沉积。而在布氏棘鲷成鱼(Elsdon et al, 2004)和大鳞油鲱(Chesney et al, 1998)中,耳石中Sr沉积与水温变化无显著相关性。鱼类耳石中Sr的沉积与水温之间的关系具有显著的种间差异性,不同鱼种耳石的Sr沉积往往因其本身遗传特性差异及所处水环境差异而对水温变化表现出不同响应(Izzo et al, 2018; Mazloumi et al, 2017)。同一种鱼在不同的生活史阶段对水温变化的响应也可能不同,如布氏棘鲷的成鱼耳石中Sr的沉积基本不受水温变化影响,而水温升高能够显著促进其稚鱼耳石中Sr的沉积(Elsdon et al, 2004; Webb et al, 2012)。换言之,水温对耳石中Sr沉积的作用与鱼种、鱼类发育生长密切相关,不同鱼种或同种鱼的不同生活史阶段对水温变化的敏感程度和响应方式不同(Elsdon et al, 2002; Webb et al, 2012; Reis-Santos et al, 2013),因此,相关研究在水温对耳石中Sr沉积影响这一问题上无法得出一致性的结论。
探讨不同鱼种、不同发育阶段鱼类耳石中微量元素沉积与水环境因子的关系是基于耳石微化学方法重新构建鱼类生活史及反演其所经历的环境履历的前提。本研究主要探讨了水温及水体中Sr浓度对褐牙鲆仔稚鱼耳石中Sr元素沉积的作用。研究发现,耳石中Sr沉积与水体中Sr浓度呈显著正相关关系,即耳石中Sr沉积能够反映鱼类所经历的水环境中的Sr浓度变化;水温升高能够显著促进褐牙鲆仔稚鱼耳石中Sr的沉积,表明耳石中Sr沉积可用于表征其在生活过程中所经历的水温变化,从而为重建其生活史提供科学参考。另外,在耳石微化学分析及其应用研究中,其他微量元素(Ba、Mg和Mn等)在耳石中的沉积也与水体中的元素浓度密切相关。例如,Miller (2009)发现,水温升高能够促进美洲平鲉(Sebastes melanops)耳石中Mn沉积,但抑制Mg沉积。但总体看来,对这些耳石微量元素的沉积机制及其与环境因子关系的探索尚处于起步阶段,相关科学问题有待于进一步深入研究。
Bailey DS, Fairchild EA, Kalnejais LH. Microchemical signatures in juvenile winter flounder otoliths provide identification of natal urseries. Transactions of the American Fisheries Society, 2015, 144(1): 173-183 DOI:10.1080/00028487.2014.982259 |
Bath GE, Thorrold SR, Jones CM, et al. Strontium and barium uptake in aragonitic otoliths of marine fish. Geochimica et Cosmochimica Acta, 2000, 64(10): 1705-1714 DOI:10.1016/S0016-7037(99)00419-6 |
Campana SE. Chemistry and composition of fish otoliths:Pathways, mechanisms and applications. Marine Ecology Progress Series, 1999, 188(1): 263-297 |
Chen DG. Fisheries ecology of Yellow Sea and Bohai Sea. Beijing: China Ocean Press, 1991, 478-480 [陈大刚.黄渤海渔业生态学.北京: 海洋出版社, 1991, 478-480]
|
Chesney EJ, McKee BM, Blanchard T, et al. Chemistry of otoliths from juvenile menhaden Brevoortia patronus:Evaluating strontium, strontium:Calcium and strontium isotope ratios as environmental indicators. Marine Ecology Progress Series, 1998, 171: 261-273 DOI:10.3354/meps171261 |
Clarke LM, Thorrold SR, Conover DO. Population differences in otolith chemistry have a genetic basis in Menidia menidia. Canadian Journal of Fisheries and Aquatic Science, 2011, 68(1): 105-114 DOI:10.1139/F10-147 |
Collingsworth PD, van Tassell JJ, Olesik JW, et al. Effects of temperature and elemental concentration on the chemical composition of juvenile yellow perch (Perca flavescens) otoliths. Canadian Journal of Fisheries and Aquatic Science, 2010, 67(7): 1187-1196 DOI:10.1139/F10-050 |
de Vries MC, Gillanders BM, Elsdon TS. Facilitation of barium uptake into fish otoliths:Influence of strontium concentration and salinity. Geochimica et Cosmochimica Acta, 2005, 69(16): 4061-4072 |
DiMaria RA, Miller JA, Hurst TP. Temperature and growth effects on otolith elemental chemistry of larval Pacific cod, Gadus macrocephalus. Environmental Biology of Fishes, 2010, 89(3-4): 453-462 DOI:10.1007/s10641-010-9665-2 |
Dorval E, Jones CM, Hannigan R, et al. Relating otolith chemistry to surface water chemistry in a coastal plain estuary. Canadian Journal of Fisheries and Aquatic Sciences, 2007, 64(3): 411-424 DOI:10.1139/f07-015 |
Dou SZ. An introduction to fish otolith research:Techniques and applications. Marine Science Series, 2007, 48: 93-113 [窦硕增. 鱼类的耳石信息分析及生活史重建——理论、方法与应用. 海洋科学集刊, 2007, 48: 93-113] |
Dou SZ, Yokouchi K, Yu X, et al. The migratory history of anadromous and non-anadromous tapertail anchovy Coilia nasus in the Yangtze River Estuary by the otolith Sr:Ca ratio. Environmental Biology of Fisheries, 2012a, 95(4): 481-490 DOI:10.1007/s10641-012-0042-1 |
Dou SZ, Amano Y, Yu X, et al. Elemental signature in otolith nuclei for stock delineation of anadromous tapertail anchovy (Coilia nasus) using laser ablation ICPMS. Environmental Biology of Fishes, 2012b, 95(4): 431-443 DOI:10.1007/s10641-012-0032-3 |
Elsdon TS, Gillanders BM. Interactive effects of temperature and salinity on otolith chemistry:Challenges for determining environmental histories of fish. Canadian Journal of Fisheries and Aquatic Sciences, 2002, 59(11): 1796-1808 DOI:10.1139/f02-154 |
Elsdon TS, Gillanders BM. Relationship between water and otolith elemental concentrations in juvenile black bream Acanthopagrus butcheri. Marine Ecology Progress Series, 2003, 260: 263-272 DOI:10.3354/meps260263 |
Hagerstrand H, Heimbrand Y, von Numers M, et al. Whole otolith elemental analysis reveals feeding migration patterns causing growth rate differences in anadromous whitefish from the Baltic Sea. Ecology of Freshwater Fish, 2017, 26(3): 456-461 DOI:10.1111/eff.12289 |
Hamer PA, Jenkins GP. Comparison of spatial variation in otolith chemistry of two fish species and relationships with water chemistry and otolith growth. Journal of Fish Biology, 2007, 71(4): 1035-1055 DOI:10.1111/j.1095-8649.2007.01570.x |
Hayden TA, Limburg KE, Pine WE. Using otolith chemistry tags and growth patterns to distinguish movements and provenance of native fish in the Grand Canyon. River Research and Application., 2013, 29(10): 1318-1329 DOI:10.1002/rra.2627 |
Higgins R, Isidro E, Menezes G, et al. Otolith elemental signatures indicate population separation in deep-sea rockfish, Helicolenus dactylopterus and Pontinus kuhlii, from the Azores. Journal of Sea Research, 2013, 83: 202-208 DOI:10.1016/j.seares.2013.05.014 |
Izzo C, Reis-Santos P, Gillanders BM. Otolith chemistry does not just reflect environmental conditions:A meta-analytic evaluation. Fish and Fisheries, 2018, 19(3): 441-454 DOI:10.1111/faf.12264 |
Kalish JM. Otolith microchemistry:Validation of the effects of physiology, age and environment on otolith composition. Journal of Experimental Marine Biology and Ecology, 1989, 132(3): 151-178 DOI:10.1016/0022-0981(89)90126-3 |
Martin GB, Thorrold SR, Jones CM. Temperature and salinity effects on strontium incorporation in otoliths of larval spot (Leiostomus xanthurus). Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(1): 34-42 DOI:10.1139/f03-143 |
Martin GB, Wuenschel MJ. Effect of temperature and salinity on otolith element incorporation in juvenile gray snapper Lutjanus griseus. Marine Ecology Progress Series, 2006, 324: 229-239 DOI:10.3354/meps324229 |
Mazloumi N, Doubleday ZA, Gillanders BM. The effects of temperature and salinity on otolith chemistry of King George whiting. Fisheries Research, 2017, 196: 66-74 DOI:10.1016/j.fishres.2017.08.010 |
Miller JA. The effects of temperature and water concentration on the otolith incorporation of barium and manganese in black rockfish Sebastes melanops. Journal of Fish Biology, 2009, 75(1): 39-60 DOI:10.1111/j.1095-8649.2009.02262.x |
Nelson TR, DeVries DR, Wright RA. Salinity and temperature effects on elemental incorporation of Gulf Killifish Fundulus grandis otoliths. Estuaries and Coasts, 2018, 41(4): 1164-1177 DOI:10.1007/s12237-017-0341-z |
Reis-Santos P, Tanner SE, Elsdon TS, et al. Effects of temperature, salinity and water composition on otolith elemental incorporation of Dicentrarchus labrax. Journal of Experimental Marine Biology and Ecology, 2013, 446: 245-252 DOI:10.1016/j.jembe.2013.05.027 |
Tanner SE, Reis-Santos P, Vasconcelos RP, et al. Otolith geochemistry discriminates among estuarine nursery areas of Solea solea and S. senegalensis over time. Marine Ecology Progress Series, 2012, 452: 193-203 DOI:10.3354/meps09621 |
Tanner SE, Reis-Santos P, Vasconcelos RP, et al. Does otolith geochemistry record ambient environmental conditions in a temperate tidal estuary. Journal of Experimental Marine Biology and Ecology, 2013, 441: 7-15 DOI:10.1016/j.jembe.2013.01.009 |
Townsend DW, Radtke RL, Corwin S, et al. Strontium:Calcium ratios in juvenile Atlantic herring Clupea harengus L.otoliths as a function of water temperature. Journal of Experimental Marine Biology and Ecology, 1992, 160(1): 131-140 DOI:10.1016/0022-0981(92)90115-Q |
Walther BD, Limburg KE. The use of otolith chemistry to characterize diadromous migrations. Journal of Fish Biology, 2012, 81(2): 796-825 DOI:10.1111/j.1095-8649.2012.03371.x |
Walther BD, Thorrold SR. Water, not food, contributes the majority of strontium and barium deposited in the otoliths of a marine fish. Marine Ecology Progress Series, 2006, 311: 125-130 DOI:10.3354/meps311125 |
Webb SD, Woodcock SH, Gillanders BM. Sources of otolith barium and strontium in estuarine fish and the influence of salinity and temperature. Marine Ecology Progress Series, 2012, 453: 189-199 DOI:10.3354/meps09653 |
Wells BK, Rieman BE, Clayton JL, et al. Relationships between water, otolith, and scale chemistries of westslope cutthroat trout from the Coeur d'Alene River, Idaho:The potential application of hard-part chemistry to describe movements in freshwater. Transactions of the American Fisheries Society, 2003, 132(3): 409-424 DOI:10.1577/1548-8659(2003)132<0409:RBWOAS>2.0.CO;2 |