2. 上海海洋大学食品学院 上海 201306
2. College of Food Sciences and Technology, Shanghai Ocean University, Shanghai 201306
鱼鳔作为一种高蛋白、低脂肪且含有较丰富矿物质的重要水产食品资源,素有“海洋人参”的美誉,具有很好的滋补作用与药用价值(张宝等, 2010; Onouma et al, 2015;刘姝等, 2009),但目前对鱼鳔开发利用十分有限,大量的鱼鳔常常被作为下脚料舍弃(Onouma et al, 2014)。大西洋鳕鱼(Gadus morhua)年产量较大(孙晓飞等, 2017),据FAO最新统计,2016年大西洋鳕鱼的全球捕捞量达1, 329, 450 t,而其鱼鳔的质量约占鱼体质量的1%,可见大西洋鳕鱼鱼鳔的年产量也达13, 295 t。目前,对大西洋鳕鱼鱼鳔的开发利用较少,多为冻鲜品直接销售或作为副产物生产鱼粉。因此,当下以鳕鱼鱼鳔为原料,研究开发高值化利用新途径显得十分迫切。
研究发现,人体内氧自由基的产生与消除失去平衡时,多余的氧自由基会导致细胞损伤,引起衰老、癌症等疾病(Rahman et al, 2018; Wu et al, 2018; Gallego et al, 2018)。已有大量研究表明,通过酶解得到的介于一定分子量范围的多肽,具有很好的抗氧化活性,能有效清除体内多余自由基(赵玲等, 2013),且与传统的化学合成物作为主要来源的抗氧化剂相比,海洋生物来源的抗氧化肽具有较好抗氧化活性且对人体无害,更有益于人体健康。天然多肽将会成为越来越多消费者的选择(Atef et al, 2017; Shavandi et al, 2017)。本研究以鳕鱼鱼鳔为原料,采用酶解法与响应面优化法获得鳕鱼鱼鳔抗氧化肽制备工艺参数,验证其酶解产物的体外抗氧化活性及体外胃肠模拟消化的稳定性,建立酶解制备抗氧化肽的最佳工艺技术。
1 材料与方法 1.1 材料与仪器大西洋鳕鱼鱼鳔(冻鲜品)平均质量为10.44 g/只,由山东省青岛海洋兄弟食品有限公司提供。1, 1-二苯基-2-苦基苯肼(DPPH)购于上海如吉生物公司; 酸性蛋白酶(50 U/mg)、中性蛋白酶(60 U/mg)和木瓜蛋白酶(500 U/mg)购于北京博奥拓达科技有限公司,复合蛋白酶(100 U/mg)、胃蛋白酶(500 U/mg)和胰蛋白酶(250 U/mg)购于北京索莱宝科技有限公司; 可见分光光度计购于上海元析仪器有限公司; pH计购于梅特勒-托利多(上海)有限公司。
1.2 基本营养成分测定采用国标方法对鳕鱼鱼鳔原材料进行基本营养成分测定,具体参照:水分GB 5009.3-2016;脂肪GB 5009.6-2016;粗蛋白含量GB 5009.5-2016;灰分GB 5009.4-2016;总糖含量GB/T 9695.31-2008。
1.3 鳕鱼鱼鳔抗氧化肽的制备 1.3.1 鳕鱼鱼鳔预处理将鳕鱼鱼鳔清洗后剪成约为0.5 cm×0.5 cm的小块,加入10倍体积的0.1 mol/L NaOH溶液搅拌浸泡24 h,然后,用蒸馏水洗至中性; 再加入10倍体积的10%正丁醇溶液搅拌浸泡24 h进行脱脂,然后用蒸馏水冲洗干净。将预处理好的鳕鱼鱼鳔加入10倍体积的蒸馏水进行匀浆备用(Liu et al, 2014)。
1.3.2 蛋白酶的筛选分别选用酸性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶、复合蛋白酶和胰蛋白酶6种蛋白酶,同时以单纯的热水抽提作对照,以酶解液对DPPH自由基的清除率为主要指标,水解度(DH)为辅助指标选择最佳提取剂。查阅文献确定各种酶的最适酶解条件(表 1),根据纯度与酶活,选定加酶量为100 U/ml。
|
|
表 1 鳕鱼鱼鳔酶解条件 Tab.1 Parameters for enzymatic hydrolysis of cod swimming bladder |
筛选出最佳蛋白酶后,对酶解时间、pH、温度与酶的浓度进行单因素实验,以酶解液对DPPH的清除率为确定指标,以确定单因素的水平范围。
1.3.4 DPPH自由基清除率测定2 ml鳕鱼鱼鳔抗氧化肽(SWP)水溶液加入2 ml 0.5 mmol/L DPPH的乙醇溶液混合摇匀后,暗处反映30 min,于波长517 nm下检测其吸光度。以0.1、0.25、0.5、1.0和2.0 mg/ml GSH水溶液做阳性对照,空白对照组以2 ml蒸馏水代替试样溶液,每个浓度均做3个重复(Takaidza et al, 2018)。清除率用下式计算:
| $ 清除率(\%)=\left[1-\left(A_{\text {sample }}-A_{\text {blank }}\right) / A_{\text {control }}\right] \times 100 \% $ |
式中,Asample为试样平均吸光度,Acontrol对照的平均吸光度(蒸馏水代替样品),Ablank空白的平均吸光度(乙醇代替DPPH溶液)。
1.3.5 水解度测定采用甲醛滴定法对蛋白质的水解度进行测量。取10 ml的酶解液加入等体积的去离子水,调节溶液PH至7.0后,加入10 ml 38%的甲醛溶液,混合均匀。用0.1 mol/L的NaOH溶液滴定至PH 9.5,记录消耗的NaOH溶液体积,同时用去离子水代替酶解液做对照,记录NaOH溶液体积(杨文博等, 2014)。水解度按下式计算:
| $ \mathrm{DH}=\left[\begin{array}{c} -\mathrm{NH}_{2} 含量 \underline{\mathrm{s}}\left(\frac{\mu \mathrm{mol}}{\mathrm{ml}}\right) \\ 6.38 \times N\left(\frac{\mathrm{mg}}{\mathrm{ml}}\right) \end{array}\right] / h_{\mathrm{tot}} \times 100 \% $ |
式中,-NH2含量根据滴定消耗的NaOH的量即可换算出; N为凯氏定氮所测值; u为原料中游离-NH2含量; htot为每1 g鳕鱼鱼鳔肽中肽链当量数,经氨基酸含量测定后计算为9.48 mmol/g。
1.3.6 响应面优化实验在单因素实验基础上,应用Design-expert 8.0软件Box-behnken中心组合实验设计原理,设计4因素3水平的响应面优化实验(表 2),根据实验结果确定复合蛋白酶酶解法提取鳕鱼鱼鳔肽的最佳提取工艺参数(陈晓彤等, 2018)。
|
|
表 2 响应面因素及水平表 Tab.2 Factor and levels of response surface methodology |
将酶解产物的冻干品进行体外清除自由基实验,包括羟基自由基清除实验、超氧阴离子自由基清除实验、总还原能力测定与铁离子结合实验,以检测鳕鱼鱼鳔肽的体外抗氧化活性,同时,以谷胱甘肽(GSH)作为阳性对照。
1.4.1 羟基自由基清除率测定2 ml SWP水溶液加入1 ml 1.5 mmol/L FeSO4, 0.7 ml 6 mmol/L H2O2, 0.3 ml 225 mmol/L水杨酸。37℃水浴加热1 h后,于562 nm下测定吸光度值(Liu et al, 2018)。清除率用下式计算:
| $ 清除率(\%)=\left[1-\left(A_{\text {sample }}-A_{\text {blank }}\right) / A_{\text {control }}\right] \times 100 \% $ |
式中,Asample为试样平均吸光度,Acontrol对照的平均吸光度(蒸馏水代替样品),Ablank空白的平均吸光度(蒸馏水代替H2O2溶液)。
1.4.2 超氧阴离子自由基清除率测定1 ml SWP水溶液加入1.25 ml 50 mmol/L Tris-HCl (pH=8.2)。25℃孵育20 min后,加入0.5 ml 25 mmol/L邻苯三酚溶液,5 min后,加入0.2 ml 10 mol/L HCl,于320 nm下测定吸光度(Li et al, 2016)。
清除率用下式计算:
| $ 清除率(\%)=\left[1-\left(A_{\text {sample }}-A_{\text {blank }}\right) / A_{\text {control }}\right] \times 100 \% $ |
式中,Asample为试样平均吸光度,Acontrol对照的平均吸光度(蒸馏水代替样品),Ablank空白的平均吸光度(蒸馏水代替邻苯三酚溶液);
1.4.3 亚铁离子螯合能力测定样品用MES溶液(10 mmol/L, pH=5.5)配制0.25、0.5、1.0、2.0、5.0、10.0和20.0 mg/ml的浓度,取不同浓度的样品溶液1.96 ml,加入0.28 ml的0.2 mmol/L FeSO4·7H2O溶液,混合后37℃水浴3 h,后加入0.56 ml菲咯嗪溶液(5 mmol/L),在室温下放置10 min,于562 nm处检测吸光度值(Zhang et al, 2018a)。
| $ 螯合率(\%) = \left[ {1 -\left({{A_{{\rm{sample }}}} -{A_{{\rm{blank }}}}} \right)/{A_{{\rm{control }}}}} \right] \times 100\% $ |
式中,Asample为试样平均吸光度,Acontrol对照的平均吸光度(蒸馏水代替样品),Ablank空白的平均吸光度(蒸馏水代替FeSO4·7H2O溶液)。
1.5 体外模拟消化活性变化食物从口腔进入人体后,先后在胃与肠道中被消化,通过参照Zhu等(2014)可构建体外模拟胃肠消化环境,检测鳕鱼鱼鳔肽被人体摄入后的稳定性变化。
1.5.1 体外模拟胃消化将SWP按照10 mg/ml溶解在蒸馏水中,用0.5 mol/L的HCl调节pH至2.0,37℃水浴20 min,按酶与底物1:40的比例加入胃蛋白酶,37℃水浴搅拌20 min后胃消化阶段结束。用0.5 mol/L NaOH溶液调节pH至7.5终止胃蛋白酶反应。并取出部分溶液冻干,以备后续实验使用。
1.5.2 体外模拟肠消化将胃消化阶段剩余液体37℃预热15 min,酶与底物按照1:25的比例加入胰酶,继续37℃条件下反应120 min,反应结束后,将样品加热到100℃持续10 min灭活酶、终止反应,冻干后贮存备用。
1.5.3 体外模拟胃肠消化产物抗氧化活性变化对胃消化与肠消化产物的冻干品进行水解度测定与体外清除自由基能力测定,比较模拟消化前后鳕鱼鱼鳔肽的抗氧化活性变化情况。
1.6 数据处理与分析采用Design-expert 8.0.6和Excel 2007软件进行数据处理与分析,以平均值±标准差(Mean±SD)表示。
2 结果 2.1 基本营养成分组成分析鳕鱼鱼鳔基本营养成分组成如表 3所示,其鲜品中水分含量较高,约为76%;脂肪含量与总糖含量较低,分别为0.55%与1.02%,主要营养成分为蛋白质,占样品鲜重的22.08% (占干重达91%),表明鳕鱼鱼鳔是一种低脂肪高蛋白食品原料。
|
|
表 3 鳕鱼鱼鳔基本营养成分 Tab.3 Essential nutrient of cod swimming bladder |
对蛋白酶的筛选,本研究选用了6种酶与单纯的热水抽提进行比较。经查阅文献确定各种酶的最适温度与最适pH,100 U/ml的加酶量条件下水解4 h,选用了DPPH自由基清除率与水解度作为评价指标。实验结果如图 1显示,复合蛋白酶水解液的DPPH自由基清除率与水解度都是最高的,且在酶解后对酶解液进行过滤过程中,复合蛋白酶组的酶解液滤过速度最快,可判断复合蛋白酶的酶解效果更佳,因此,选用的蛋白酶为复合蛋白酶。
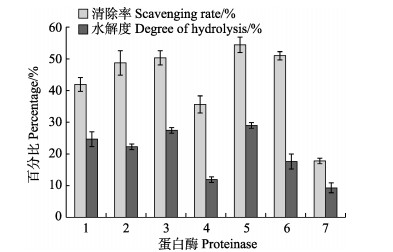
|
图 1 蛋白酶筛选 Fig.1 Proteinase selection 1:酸性蛋白酶; 2:中性蛋白酶; 3:胃蛋白酶; 4:木瓜蛋白酶; 5:复合蛋白酶; 6:胰酶; 7:热水(对照) 1: Acid proteinase; 2: Dispase; 3: Pepsin; 4: Papain; 5: Compound proteinase; 6: Trpsin; 7: Hot water (Control) |
单因素实验结果见图 2,结果显示,酶解时间、pH、温度与酶的浓度均对酶解液清除DPPH自由基的能力有较大影响。鳕鱼鱼鳔酶解液对DPPH自由基的清除能力随酶解时间的增加而增大,酶解5 h之后趋于平缓; 随pH与酶解温度的升高呈先增大后减小的趋势,且在pH为7、温度为55℃时清除能力最强,可见pH和温度过高或者过低均会影响酶活性,甚至使酶失活; 酶浓度对酶解液清除DPPH自由基的影响是随浓度的增大呈正相关的。因此,单因素实验结果确定了响应面实验中4个因素的水平范围。
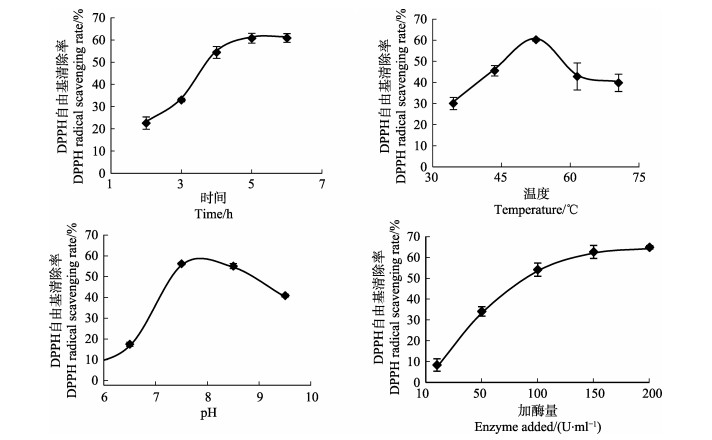
|
图 2 单因素实验 Fig.2 Single factor test |
通过Design-expert 8.0软件对表 4的数据进行分析,得到结果表 5所示。时间(P < 0.01)和酶添加量(P < 0.01)对抗氧化肽提取影响显著。以DPPH自由基清除率为响应值,经回归拟合后,得到回归方程:
| $ \begin{aligned} &\text { DPPH 清除率} =-941.15-21.58 A+213.49 B+7.38 C+\\ &0.46 D-2.37 A B+0.32 A C-0.004 A D-0.32 B C-0.03 B D+\\ &0.0008 C D+2.57 A^{2}-11.99 B^{2}-0.06 C^{2}-0.06 D^{2} \end{aligned} $ |
|
|
表 4 复合蛋白酶响应面设计及结果 Tab.4 Response surface design and values |
|
|
表 5 回归模型方差分析 Tab.5 ANOVA for response surface quadratic model |
经方差分析结果,上述回归方程与响应面值之间的关系模型中P < 0.01是显著的,失拟项F=0.5084不显著,表明模型充分拟合实验数据,所以,可以利用此回归方程确定最佳制备工艺。软件分析确定的最佳条件值为:酶解时间为6 h、pH为7.21、温度为58.56℃、酶添加量为200 U/ml; 理论值为62.0%,验证实验结果为61.1%,测定值稳定、偏差小,证明该结果合理可靠。
2.5 酶解产物体外清除自由基能力测定按照最佳制备工艺条件酶解,并进行冷冻干燥,获得鳕鱼鱼鳔肽SWP,检测其体外清除自由基能力与亚铁离子螯合能力。从图 3可以看出,SWP对DPPH自由基与超氧阴离子自由基具有一定的清除能力,最大清除率分别能到达71.4%和63.6%,IC50分别为8.29和5.03 mg/ml; 通过Fenton反应,SWP显示出良好的羟基自由基清除能力,并具有良好的浓度依赖线性关系,IC50为5.43 mg/ml。SWP与亚铁离子螯合能力的结果显示,鳕鱼鱼鳔肽具有很好的亚铁离子螯合能力,在浓度为2 mg/ml时,几乎可达到与乙二胺四乙酸二钠相近的螯合性,接近100%,IC50为1.35 mg/ml。
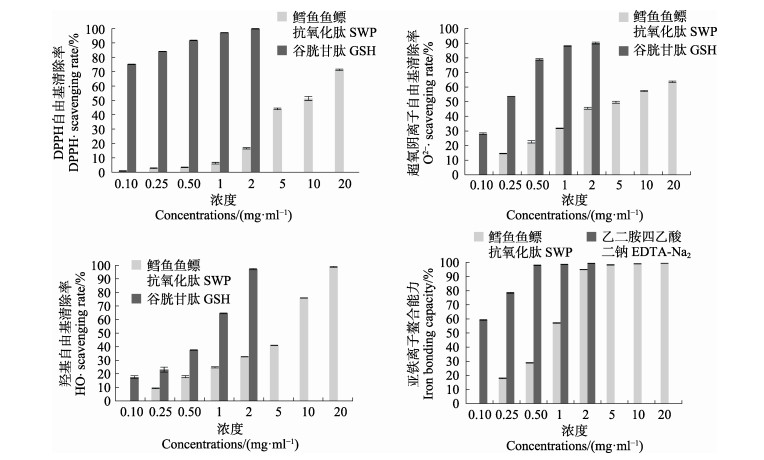
|
图 3 体外自由基清除能力 Fig.3 Antioxidant activity in vitro |
经体外模拟胃肠消化后,鳕鱼鱼鳔肽的水解度变化与抗氧化能力变化如图 4和图 5所示。从图 4中可以看出,体外模拟胃消化与肠消化均可使酶解产物的水解度增加,说明胃肠消化过程中的胃蛋白酶与胰酶使酶解产物进一步水解,生成更多的游离氨基。接下来对模拟消化产物进行体外自由基清除实验,结果显示与原酶解产物相比,胃消化液与肠消化液对DPPH自由基、羟基自由基、超氧阴离子自由基的清除能力与对铁离子的结合能力并无提升(图 5)。
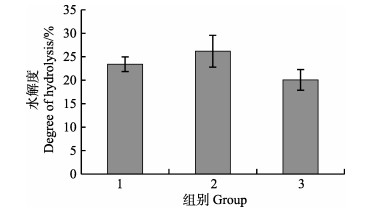
|
图 4 体外模拟消化产物水解度 Fig.4 Degree of hydrolysis after vitro digestion 1:胃消化液; 2:肠消化液; 3: SWP 1: Stomach digestive juices; 2: Intestinal digestive juices; 3: SWP |
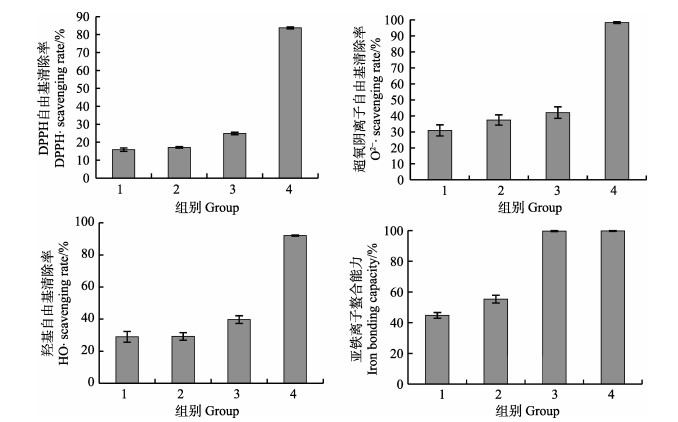
|
图 5 体外模拟消化产物清除自由基能力 Fig.5 Antioxidant activity after in vitro digestion 1: 2 mg/ml胃消化液Stomach digestive juices; 2: 2 mg/ml肠消化液Intestinal digestive juices; 3: 2 mg/ml SWP; 4: 1 mg/ml GSH |
工艺优化实验中选用DPPH自由基清除率作为评价指标,通过单因素实验与响应面优化法,确定了酶解鳕鱼鱼鳔获取多肽的最佳提取工艺,酶解时间为6 h,pH为7.21,温度为58.56℃,酶添加量为200 U/ml,所得酶解液的DPPH自由基清除率可达61.1%。向泽敏等(2017)使用复合蛋白酶对鲣鱼(Katsuwonus pelamis)鳔进行酶解,以DPPH自由基清除率为参考指标,通过单因素实验与响应面优化法获得最佳工艺参数:加酶量为8.53 U/mg,酶解pH为5.54,酶解温度为50.03℃,酶解时间为5.07 h。此结果与本研究结果一致的是复合蛋白酶都是最优蛋白酶,因为复合蛋白酶具有多个酶切位点,因此,可以获得更多种类的肽端游离氨基,使其具有更好的自由基清除能力; 同时也有一定程度的差异,其可能原因为复合蛋白酶组成酶种类与配比各不相同,导致其最佳最适酶解温度与最适pH的不同。
羟基自由基与超氧阴离子自由基等活性氧自由基能损伤DNA、蛋白质等大分子,引发机体衰老或发生病变(Zhang et al, 2018b)。抗氧化体外清除自由基实验,显示了本实验制备的抗氧化肽对DPPH自由基、羟基自由基和超氧阴离子自由基有一定的清除能力,并有较好的亚铁离子螯合能力,且自由基清除能力与SWP浓度呈正相关。涂宗财等(2017)以草鱼(Ctenopharyngodon idellus)鱼鳔为原料,通过酶解制备抗氧化多肽,对DPPH自由基与羟基自由基等均具有较好的清除能力,其IC50分别为8.05和3.54 mg/ml。本研究结果显示,鳕鱼鱼鳔抗氧化肽的活性与草鱼鱼鳔抗氧化肽接近,且本研究对鳕鱼鱼鳔抗氧化肽清除超氧阴离子自由基与螯合亚铁离子能力进行了测定,更全面的反映了鳕鱼鱼鳔肽的体外抗氧化活性。且研究结果显示,鳕鱼鱼鳔肽具备很好的亚铁离子螯合能力,后期研究可利用此性质制备肽-铁螯合物,为新型的有机铁元素补充剂提供原料来源。
体外模拟胃肠消化实验中,获得了模拟胃消化与模拟肠消化的酶解产物,进而检测水解度与体外清除自由基的能力的变化,结果发现,经模拟胃肠消化后,酶解产物的水解度是进一步增大的,但其体外清除自由基能力与亚铁离子结合能力均有一定程度的下降。此结果与蛋白酶筛选中的二者关系趋势并不一致,在文献中也有过相同情况的报道(杨文博等, 2014;杜芬等, 2016),分析其可能原因为,在模拟胃肠消化过程中,因反应条件的变化,如pH值的改变对多肽的组成及结构产生一定的影响,进而改变了多肽的生物活性,具体的变化有待进一步实验验证。
本研究通过酶解方法制备了具有一定抗氧化活性的鳕鱼鱼鳔肽,与传统发酵制备方法相比,该法提取效率高,反应时间短,条件温和且所制备的酶解产物抗氧化活性更高。因此,本研究所制备的鳕鱼鱼鳔肽可作为抗氧化活性肽资源,为开辟鱼鳔资源的综合开发与高值化利用提供了理论及技术支撑。
Atef M, Ojagh SM. Health benefits and food applications of bioactive compounds from fish byproducts: A review. Journal of Functional Foods, 2017, 35: 673-681 DOI:10.1016/j.jff.2017.06.034 |
Chen XT, Huang LP, Sun M, et al. Optimization of conversion process of α-cyclodextrin with enzyme using response surface methodology. Progress in Fishery Sciences, 2018, 39(5): 143-151 [陈晓彤, 黄立萍, 孙谧, 等. 响应面分析法优化α-环糊精的酶转化工艺. 渔业科学进展, 2018, 39(5): 143-151] |
Du F, Hou H, Zhao YR, et al. Stability of Alaska Pollock-derived metal chelating peptide during in vitro gastrointestinal digestion. Modern Food Science and Technology, 2016, 32(7): 33-38 [杜芬, 侯虎, 赵玉然, 等. 鳕鱼源金属螯合肽体外模拟胃肠消化稳定性研究. 现代食品科技, 2016, 32(7): 33-38] |
Gallego M, Mora L, Toldrá F. Characterisation of the antioxidant peptide AEEEYPDL and its quantification in Spanish dry-cured ham. Food Chemistry, 2018, 258: 8-15 DOI:10.1016/j.foodchem.2018.03.035 |
Li N, Shen XR, Liu YM, et al. Isolation, characterization, and radiation protection of Sipunculus nudus L. polysaccharide. International Journal of Biological Macromolecules, 2016, 83: 288-296 DOI:10.1016/j.ijbiomac.2015.11.071 |
Liu DS, Liang L, Regenstein JM, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis). Food Chemistry, 2014, 133(4): 1441-1448 |
Liu S, Yu B. Peptides from variegated carp (Aristichthys nobilyis) swim bladder: Fermentation production and assessment of antioxidant properties. Food Science, 2009, 30(21): 58-62 [刘姝, 余勃. 发酵法制备鱼鳔多肽及其抗氧化活性研究. 食品科学, 2009, 30(21): 58-62] |
Liu Y, Sun YY, Huang GL. Preparation and antioxidant activities of important traditional plant polysaccharides. International Journal of Biological Macromolecules, 2018, 111: 780-786 DOI:10.1016/j.ijbiomac.2018.01.086 |
Onouma K, Scoottawat B. Effect of ethanolic extract of coconut husk on gel properties of gelatin from swim bladder of yellowfin tuna. LWT-Food Science and Technology, 2015, 62(2): 955-961 |
Onouma K, Soottawat B, Thammarat K, et al. Characteristics of collagens from the swim bladders of yellowfin tuna (Thunnus albacares). Food Chemistry, 2014, 155: 264-270 DOI:10.1016/j.foodchem.2014.01.076 |
Rahman MS, Choi YH, Choi YS, et al. A novel antioxidant peptide, purified from Bacillus amyloliquefaciens, showed strong antioxidant potential via Nrf-2 mediated heme oxygenase-1 expression. Food Chemistry, 2018, 239: 502-510 DOI:10.1016/j.foodchem.2017.06.106 |
Shavandi A, Hu ZH, Teh SS, et al. Antioxidant and functional properties of protein hydrolysates obtained from squid pen chtosan extraction effluent. Food Chemistry, 2017, 227: 194-201 DOI:10.1016/j.foodchem.2017.01.099 |
Wu RB, Wu CL, Liu D, et al. Antioxidant and anti-freezing peptides from salmon collagen hydrolysate prepared by bacterial extracellular protease. Food Chemistry, 2018, 248: 346-352 DOI:10.1016/j.foodchem.2017.12.035 |
Sun XF, Jiang D, Wan C, et al. A new SYBR Green fluorescent PCR method for rapid identification of Gadus morhua and its products. Journal of Northeast Normal University (Natural Science), 2017, 49(3): 127-130 [孙晓飞, 蒋丹, 万超, 等. 建立一种快速鉴定大西洋鳕鱼及其制品的SYBR Green荧光PCR方法. 东北师大学报(自然科学版), 2017, 49(3): 127-130] |
Takaidza S, Mtunzi F, Pillay M. Analysis of the phytochemical contents and antioxidant activities of crude extracts from Tulbaghia species. Journal of Traditional Chinese Medicine,, 2018, 38(2): 272-279 DOI:10.1016/j.jtcm.2018.04.005 |
Tu ZC, Tang PP, Zheng TT, et al. Optimization of swimming bladder collagen peptide preparation using response surface methodology and its antioxidant activity research. Food and Fermentation Industries, 2017, 43(5): 160-166 [涂宗财, 唐平平, 郑婷婷, 等. 响应面优化鱼鳔胶原肽制备工艺及其抗氧化活性研究. 食品与发酵工业, 2017, 43(5): 160-166] |
Xiang ZM, Qiu XT, Lou YJ, et al. Methodology of the preparation of enzymatic hydrolysates with antioxidant activity of skipjack tuna (Katsuwonus pelamis) swim bladder protein. Journal of Fisheries of China, 2017, 41(6): 962-970 [向泽敏, 邱晓挺, 娄永江, 等. 鲣鳔蛋白抗氧化酶解物制备工艺. 水产学报, 2017, 41(6): 962-970] |
Yang WB, Zhang YH. Study on the determination methods for hydrolysis degree of protein. China Condiment, 2014, 39(3): 88-90 [杨文博, 张英华. 蛋白质水解度的测定方法研究. 中国调味品, 2014, 39(3): 88-90 DOI:10.3969/j.issn.1000-9973.2014.03.022] |
Zhang B, Chen YZ, Xu Y, et al. Characterization of collagens from swim bladders of grass carp. Food Science, 2010, 31(1): 58-62 [张宝, 陈运中, 徐颖. 等. 草鱼鱼鳔胶原性质的研究.食品科学, 2010, 31(1): 58-62] |
Zhang L, Hu Y, Duan XY, et al. Characterization and antioxidant activities of polysaccharides from thirteen boletus mushrooms. International Journal of Biological Macromolecules, 2018a, 113: 1-7 DOI:10.1016/j.ijbiomac.2018.02.084 |
Zhang ZS, Wang XM, Su HL, et al. Effect of sulfated galactan from Porphyra haitanensis on H2O2-induced premature senescence in WI-38 cells. International Journal of Biological Macromolecules, 2018b, 106: 1235-1239 DOI:10.1016/j.ijbiomac.2017.08.123 |
Zhao L, Geng XX, Liu Q, et al. Antioxidant activity of polypeptide from sea cucumber cooking water. Progress in Fishery Sciences, 2013, 34(5): 69-73 [赵玲, 耿晓晓, 刘淇, 等. 海参水煮液酶解多肽的抗氧化活性. 渔业科学进展, 2013, 34(5): 69-73 DOI:10.3969/j.issn.1000-7075.2013.05.011] |
Zhu CZ, Zhang WG, Kang ZL, et al. Stability of an antioxidant peptide extracted from Jinhua ham. Meat Science, 2014, 96(2): 783-789 DOI:10.1016/j.meatsci.2013.09.004 |




