2. 中国科学院青岛生物能源与过程研究所 中国科学院生物燃料重点实验室 山东省能源生物遗传资源重点实验室 青岛 266101
2. Key Laboratory of Biofuels, Shandong Provincial Key Laboratory of Energy Genetics, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101
2007年以来,中国黄海连续13年暴发以浒苔(Ulva prolifera)为肇事藻种的绿潮灾害,对该海域和沿岸地区的生态环境、滨海景观、旅游和海水养殖业造成了严重影响(Li et al, 2017; Liu et al, 2016; Zhou et al, 2015)。尽管浒苔藻体自身对于人和海洋动物是无毒的,但浒苔大面积覆盖在沿岸表层水体会阻碍光照并且消耗水中的氧气,对水质和当地的生态系统造成恶劣影响,尤其对底栖生物群落(Liu et al, 2010; Zhang et al, 2017; 夏斌等, 2009)。
王宗灵等(2018)研究表明,每年暴发的浒苔并不能全部被打捞起来(),均有超过百万吨的浒苔来不及打捞而沉降到海平面以下(Zhou et al, 2015)。在绿潮消亡阶段,来不及打捞的浒苔在微生物降解作用下,向海水中释放大量的溶解有机物(DOM)(Zhang et al, 2017)。Duarte等(2017)研究表明,大藻降解是近海DOM的重要来源之一。温度是控制河口植物和海洋藻类降解的重要因素(Lemley et al, 2014; Carpenter et al, 1979; Best et al, 1990; Kotta et al, 2010)。Valiela等(1985)指出,水温显著影响盐沼泽生态系统的降解过程;Lønborg等(2018)指出,海洋温度的升高将会影响生物可利用性较低的溶解有机碳(DOC)的微生物降解。
近年来,科研人员对浒苔绿潮的成因和起源、发生发展过程以及浒苔的生理生态特点等进行了广泛研究(Li et al, 2016、2017; Wang et al, 2015),但针对浒苔在微生物作用下降解释放有机碳、氮的动态变化以及DOM组成的研究相对较少。本研究针对浒苔衰亡过程,研究不同温度对浒苔降解释放DOC、氮及其组成的影响,以期初步反映浒苔释放DOC、溶解有机氮(DON)动态变化过程以及温度对荧光溶解有机物(FDOM)组成的影响,为绿潮的治理和受绿潮影响海域的生态修复提供理论依据。
1 材料与方法 1.1 实验材料实验所用浒苔于2017年7月采自山东青岛沿岸海域,现场用海水冲洗数遍,带回实验室储存于4℃冰箱。实验前用高压灭菌后的海水清洗浒苔,然后加入0.5 mg/ml的二氧化锗溶液抑制硅藻的生长,并加入0.5%卡那霉素杀菌(Li et al, 2016)。处理之后的浒苔仍呈鲜绿色,此时浒苔仍然存活。
1.2 实验设计将0.2 g处理后的浒苔(湿重)加入3 L玻璃烧瓶中,然后加入2 L过滤(2 μm)海水,密封瓶口,置于3个不同温度(15℃、20℃和25℃)的光照培养箱中,每个温度条件设置2个平行样,黑暗条件培养30 d。于第0、1、3、5、7、15、20、25、30天取样。衰亡的浒苔在海流作用下经历不同水温的海层进而沉入海底,浒苔绿潮在7~8月开始消亡也即是水温较高的夏季,一直持续到每年的11~12月也即是水温较低的秋季,对浒苔大量聚集海域的影响时间会更长(丁月旻, 2014)。搜集文献资料(辛明, 2011; 胡莹英, 2013; 孙涛, 2014)总结出,南黄海夏季和秋季表、底的水温分别约为25℃(表层)、14℃(底层)和18℃(表层)、14℃(底层),因此,本研究设置15℃、20℃和25℃共3个温度。
取样前充分摇匀玻璃烧瓶,静置约5 min后,用移液管移取上层水样于小烧杯中,充分摇匀。取1.8 ml未过滤水样用于微生物丰度分析,加入戊二醛固定(终浓度为0.5%),液氮中冷冻,最后储存于-80℃冰箱中(Brussaard, 2004)。水样用预烧过的(450℃, 5 h) 0.7 μm GF/F膜过滤,滤液分别转移至15 ml灭菌离心管,40 ml、20 ml预烧过的(450℃, 5 h)棕色玻璃瓶分别用于营养盐、DOC、FDOM分析,样品储存于-20℃。
1.3 样品分析用于微生物丰度分析的样品于37℃水浴中解冻,用SYBR GreenⅠ荧光染料在室温下黑暗静置染色15 min,向染色好的样品中加入标准荧光小球作为内参,采用流式细胞仪(BD FACSAriaⅡ)进行检测,具体方法参照Marie等(1999)方法。
用带有ASI-L自动进样器的岛津总有机碳分析仪TOC-LCPH测定DOC浓度,以邻苯二甲酸氢钾(KHP)为标准溶液,采用高温催化氧化的方法进行测定。检出限为4 µg/L,重现性CV在1.5%以内。
水样充分解冻并在室温下平衡后用营养盐自动分析仪(BRAN and LUEBBE QuAAtro, 德国)测定营养盐NO3--N、NO2--N和NH4+-N的浓度,溶解无机氮(DIN)浓度为NO3-、NO2-和NH4+浓度之和。用过硫盐氧化法测定总溶解氮(TDN)浓度(Valderrama, 1981),DON为TDN减去DIN。
三维荧光光谱结合平行因子分析(EEMs- PARAFAC)技术表征浒苔降解过程中释放FDOM的化学组成以及荧光特性。水样避光解冻并在室温下平衡后,通过0.22 μm聚醚砜膜滤膜过滤。滤液用Hitachi F-4600荧光分光光度计测定FDOM的激发-发射矩阵光谱(EEM)。激发波长设为200~480 nm,发射波长设为250~650 nm,间隔为5 nm,扫描速率为1200 nm/min,积分时间为0.05 s。
进行平行因子分析前,需扣除拉曼散射和瑞利散射的影响,运用MATLAB和Statistics Toolbox结合DOM Fluor toolbox (R2016a; The MathWorks, Inc., 美国)进行平行因子分析辨别荧光组分(Stedmon et al, 2008)。通过平行因子分析可以得到每种组分的相对荧光强度,每种组分的荧光强度In按照下式计算:
| $ {{I}_{n}}=Scor{{e}_{n}}\times E{{x}_{n}}\left({{\lambda }_{\mathit{max}}} \right)\times E{{m}_{n}}\left({{\lambda }_{\mathit{max}}} \right) $ |
式中,Scoren代表第n种成分的相对荧光强度,Exn(λmax)代表第n种成分激发负载的最大值,Emn(λmax)代表第n种成分发射负载的最大值。总荧光强度ITOT和各组分的相对含量Pn计算公式如下:
| $ \begin{matrix} {{I}_{TOT}}=\sum\limits_{1}^{n}{{{I}_{n}}} \\ {{P}_{n}}={{I}_{n}}/{{I}_{TOT}} \\ \end{matrix} $ |
各组分的百分贡献率表示FDOM的组成、性质变化(Kowalczuk et al, 2005)。
1.4 统计分析利用双因素方差(Two-way ANOVA)分析实验数据,其中,DOC、DON数据分为0~7 d和7~30 d 2个时间段进行分析。2个因素分别为培养时间和温度。用Spearman相关分析成对的变量间是否存在显著的单调关系。用SigmaPlot 12.0软件进行统计分析,显著性水平为0.05。
2 结果与讨论 2.1 不同温度下溶解有机物的动态变化不同温度下浒苔降解过程中DOC浓度变化特征如图 1所示。3个温度下的DOC浓度在前7 d呈现先增加后减少的趋势,7 d之后维持相对稳定(图 1)。DOC最快的释放速率出现在前24 h,分别为1.13 (15℃)、3.31(20℃)和0.94 µmol/h(25℃)。在前7 d 20℃条件下,DOC浓度显著高于15℃和25℃(P < 0.05),而7~30 d 3个温度下DOC浓度没有显著性差异(P > 0.05)。培养时间对DOC浓度也有显著影响(P < 0.05)。
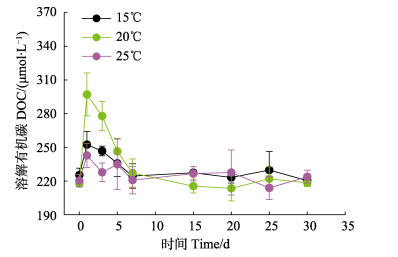
|
图 1 不同温度下溶解有机碳浓度变化 Fig.1 Concentration changes of dissolved organic carbon (DOC) at different temperatures |
不同温度下浒苔降解过程中溶解态氮浓度变化趋势与DOC不同(图 2)。3个温度下的DON浓度随着培养时间的增长而增加,至第7天达到最高值(图 2a)。此时,DON的释放速率分别为3.64(15℃)、4.22(20℃)和3.48 µmol/d (25℃)。之后,DON浓度开始减少。0~7 d 3个温度下DON浓度没有显著差异(P > 0.05),而7 d之后,25℃条件下DON浓度明显低于15℃和20℃(P < 0.05)。培养时间对DON浓度也有显著影响(P < 0.05)。DIN浓度分别在第20天(15℃)、第15天(20℃)和第7天(25℃)开始明显增加,直到实验末期均保持增加趋势(图 2b)。培养实验结束时,3个温度下DIN的释放速率分别为0.49(15℃)、1.68(20℃)和3.55 µmol/d (25℃)。温度对DIN释放有显著影响(P < 0.05)。总的来看,25℃条件下的DIN浓度明显高于20℃和15℃,20℃条件下的DIN浓度明显高于15℃(P < 0.05),随着温度升高,DIN浓度显著增加。培养时间对DIN浓度也有显著影响(P < 0.05)。3个温度下的DIN浓度与培养时间存在显著正相关关系(R15℃=0.883、R20℃=0.950、R25℃= 0.983,P < 0.05)。
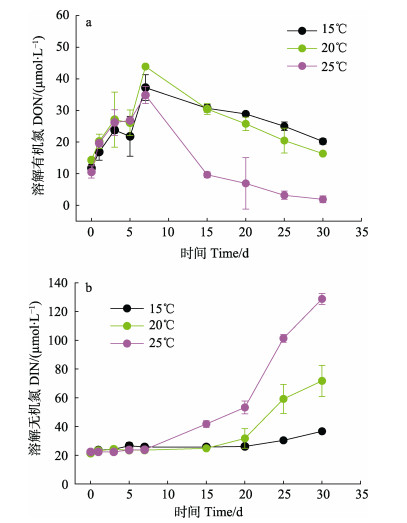
|
图 2 不同温度下溶解有机氮(a)和溶解无机氮(b)浓度变化 Fig.2 Concentration changes of dissolved organic nitrogen (DON) (a) and dissolved inorganic nitrogen (DIN) (b) at different temperatures |
不同温度下,浒苔降解过程中微生物丰度变化特征如图 3所示。在整个实验过程中,15℃条件下的微生物丰度呈现小幅度波动变化。对于20℃和25℃而言,微生物丰度在前3 d小幅度减少,之后呈现先增加后减少的趋势,15 d之后呈现小幅度波动变化,第0天和第30天的微生物丰度分别为2.36×105(20℃)、2.42×105(20℃)和2.83×105(25℃)、2.85×105 cells/ml (25℃)。总的来看,25℃条件下的微生物丰度明显高于20℃和15℃(P < 0.05)。培养时间对微生物丰度也有显著影响(P < 0.05)。

|
图 3 不同温度下微生物丰度的变化 Fig.3 Microorganism abundance changes at different temperatures |
早期的研究指出,盐沼植物DOM的释放和降解可以分为3个阶段(Hicks et al, 1991; Valiela et al, 1985; White et al, 1994):第一阶段是溶解有机物质在数天内释放;第二阶段是微生物作用下生物高分子在数月内发生降解,进一步释放溶解有机物;第三阶段经历的时间更长,需要数年,只有像纤维素和木质素这类的惰性物质未被完全降解。
本研究结果显示,DOM的释放是一个快速的过程。3个温度下DOC最快的释放速率出现在前24 h,DON在前7 d快速释放。Litz(2006)在以新鲜的Spartina茎和叶为研究对象的实验中, 于实验前24 h也发现了DOC的快速释放。Zhang等(2017)指出,DOC的快速释放可能是由化学过程(比如水解和溶解作用)控制的,之后化学作用减弱,细菌起着重要的作用。微生物丰度(图 3)以及DOC的结果显示,释放的DOC在第1天之后被微生物快速消耗之后维持相对稳定,这表明微生物选择性利用活性有机物,惰性有机物以更慢的速率发生降解。2.2章节中的荧光结果也能说明此问题。
Wang等(1995)研究指出,脂肪族甲胺,比如一甲胺(MMA)、二甲胺(DMA)和三甲胺(TMA)是互花米草(Spartina alterniflora)释放到海水中主要的含氮有机物。在有氧条件下,狐米草(Spartina patens)和宽叶香蒲(Typha latifolia)在前几天快速释放胺类化合物,然后被微生物所利用(Wang et al, 2007)。微生物在降解DOM过程中会把一些有机形式的氮转化为无机形式的氮,在7~30 d减少的DON和增加的DIN表明有机氮转变为无机形式(图 2a和图 2b)。温度对该过程具有显著影响:25℃条件下DON浓度明显低于15℃和20℃(P < 0.05),可能是由于25℃条件下微生物丰度呈现显著高值(P < 0.05)(图 3)。15 d之后DON减少的趋势变缓(尤其是25℃),可能是由于此时体系处于缺氧状态,降解作用较慢(Wang et al, 2007)。DIN结果显示,浒苔降解向海水中释放大量的无机营养盐,与Lemley等(2014)针对Great Brak Estuary 3种大型植物分解过程的研究结果相似。在生长阶段,大型海藻吸收利用溶解无机氮,在降解过程中,氮被释放并参与循环(Wang et al, 2012)。结果显示,温度对大型海藻降解过程中的DOM起着重要作用。
2.2 不同温度下荧光溶解有机物荧光强度以及组分特征变化典型的PARAFAC模型能将EEMs中复杂的混合物分解为单个的荧光组分(Osburn et al, 2015)。如表 1所示,利用PARAFAC鉴别出3个荧光组分:C1和C2为类色氨酸组分(也称为类蛋白组分),C3为类腐殖质组分。类腐殖质荧光组分不易被生物或微生物利用而被认为是水体中惰性溶解有机物(RDOC)的重要组成部分,通常作为海水中RDOC的指示剂(Murphy et al, 2008; Zhao et al, 2017)。不同温度下组分C1、C2和C3的相对含量P1、P2和P3随时间变化的特征如图 4a~图 4c所示。其中,P1和P2均于第20天达到最值。3个温度下,P3在0~20 d均呈现先增加后减少的趋势,在实验后期有所增加。不同温度下的P1、P2和P3均无显著差异(P > 0.05),表明温度对FDOM组成并没有显著影响。图 4d~图 4f分别为3个组分在不同温度下的荧光强度变化图。3个温度下类蛋白组分C1和C2的荧光强度I1和I2呈现相似的变化特征:整体来看实验前期呈现减少的趋势,之后逐渐增加,分别在第20天(15℃)、第20天(20℃)和第15天(25℃)达到最大值,在实验后期,荧光强度有所减少(图 4d~图 4e)。如图 4f所示,15℃下类腐殖质组分C3的荧光强度I3在0~20 d呈,增加趋势,20 d后开始减少。20℃和25℃时的变化趋势相似:在0~20 d I3呈现先增加后减少的趋势,20 d之后,I3逐渐增加。温度对I2和I3具有显著影响(P < 0.05):25℃条件下,I2和I3明显大于15℃,可能是由于温度较高条件下微生物的分解速率较快,导致FDOM含量增加进而引起荧光强度值增大,而温度未显著影响同样是类蛋白组分C1的荧光强度。培养时间对C2和C3组分的荧光强度也有显著影响(P < 0.05)。
|
|
表 1 PARAFAC鉴别出的3个FDOM荧光组分及其特征 Tab.1 Fluorescent component characteristics of FDOM |
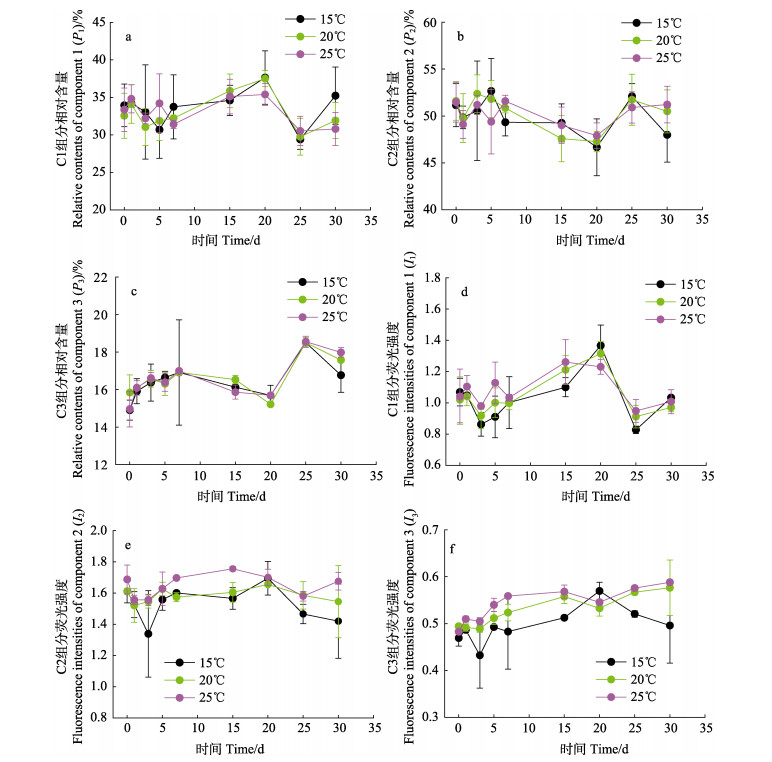
|
图 4 不同温度下各组分相对含量和荧光强度变化 Fig.4 Relative contents and fluorescence intensity changes of three organic components at different temperatures |
温度在调节DOM的荧光特性方面起着重要作用。在高温下,浒苔降解过程中的类蛋白组分和类腐殖质组分更多。20 d后,类蛋白组分荧光强度的减少以及类腐殖质组分荧光强度的增加,表明在浒苔的微生物降解过程中,微生物选择性利用活性有机物,以更低的速率降解惰性有机物。这些荧光数据结果也支持前面讨论的DOC结果。而温度对FDOM的组成并没有显著影响。
3 结论通过研究不同温度下浒苔降解过程中DOC、DON和FDOM的动态变化特征,指出温度对浒苔降解过程中的DOM起到重要作用。温度显著影响前7 d DOC的释放:20℃条件下DOC浓度明显高于15℃和25℃。微生物在降解DOM过程中把部分有机氮转变为无机氮,温度对此过程有显著影响:25℃条件下DON浓度明显低于15℃和20℃。3个组分的相对含量在不同温度条件下并没有显著差异,表明温度并未显著影响FDOM的组成,而较高温度下(如25℃),类蛋白组分C2、类腐殖质组分C3的荧光强度表现出显著高值,可能是由于温度升高加快微生物的分解速率进而导致FDOM含量的增加。
Best EPH, Dassen JHA, Boon JJ, et al. Studies on decomposition of Ceratophyllum demersum litter under laboratory and field conditions: Losses of dry mass and nutrients, qualitative changes in organic compounds and consequences for ambient water and sediments. Hydrobiologia, 1990, 194(2): 91-114 DOI:10.1007/BF00028411 |
Brussaard CP. Optimization of procedures for counting viruses by flow cytometry. Applied and Environmental Microbiology, 2004, 70(3): 1506-1513 DOI:10.1128/AEM.70.3.1506-1513.2004 |
Carpenter SR, Adams MS. Effects of nutrients and temperature on decomposition of Myriophyllum spicatum L. in a hard-water eutrophic lake. Limnology and Oceanography, 1979, 24(3): 520-528 |
Coble PG. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy. Marine Chemistry, 1996, 51(4): 325-346 DOI:10.1016/0304-4203(95)00062-3 |
Ding YM. Impacts of Ulva (Enteromorpha) prolifera in the green tide on the Yellow Sea ecological environment-Implications from migration and transformation of biogenic elements. Doctoral Dissertation of University of Chinese Academy of Sciences, Institute of Oceanology, 2014 [丁月旻.黄海浒苔绿潮中生源要素的迁移转化及对生态环境的影响.中国科学院研究生院(海洋研究所)博士研究生学位论文, 2014] http://cdmd.cnki.com.cn/Article/CDMD-80068-1014308948.htm
|
Duarte CM, Wu J, Xiao X, et al. Can seaweed farming play a role in climate change mitigation and adaptation?. Frontiers in Marine Science, 2017, 4 DOI:10.3384/fmars.2017.00100 |
Hicks RE, Lee C, Marinucci AC. Loss and recycling of amino acids and protein from smooth cordgrass (Spartina alterniflora) litter. Estuaries, 1991, 14(4): 430-439 DOI:10.2307/1352267 |
Hu YY. Seasonal and interannual variations of the water temperature in the Yellow Sea and East China Sea. Masterxs Thesis of Ocean University of China, 2013 [胡莹英.黄、东海水温季节和年际变化特征分析.中国海洋大学硕士研究生学位论文, 2013] http://d.wanfangdata.com.cn/Thesis/D326335
|
Kotta J, Orav-Kotta H, Paalme T. In situ evidence on the role of benthic invertebrates on the decomposition of drifting algal mats in a brackish water ecosystem. International Conference on Biosciences, IEEE, 2010
|
Kowalczuk P, Stonegiert J, Cooper WJ, et al. Characterization of chromophoric dissolved organic matter (CDOM) in the Baltic Sea by excitation emission matrix fluorescence spectroscopy. Marine Chemistry, 2005, 96(3): 273-292 |
Lemley DA, Snow GC, Human LRD. The decomposition of estuarine macrophytes under different temperature regimes. Water SA, 2014, 40(1): 117 |
Li HM, Zhang YY, Han XR, et al. Growth responses of Ulva prolifera to inorganic and organic nutrients: Implications for macroalgal blooms in the southern Yellow Sea, China. Scientific Reports, 2016, 6: 26498 DOI:10.1038/srep26498 |
Li HM, Zhang YY, Liang YT, et al. Impacts of maricultural activities on characteristics of dissolved organic carbon and nutrients in a typical raft-culture area of the Yellow Sea, North China. Marine Pollution Bulletin, 2018, 137: 456-464 DOI:10.1016/j.marpolbul.2018.10.048 |
Li HM, Zhang YY, Tang HJ, et al. Spatiotemporal variations of inorganic nutrients along the Jiangsu coast, China, and the occurrence of macroalgal blooms (green tides) in the southern Yellow Sea. Harmful Algae, 2017, 63: 164-172 DOI:10.1016/j.hal.2017.02.006 |
Litz L. CDOM and DOC production by the salt marsh cordgrass Spartina alterniflora. University of Massachusetts Boston, 2006
|
Liu DY, Keesing JK, Dong ZJ, et al. Recurrence of the world's largest green-tide in 2009 in Yellow Sea, China: Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms. Marine Pollution Bulletin, 2010, 60(9): 1423-1432 DOI:10.1016/j.marpolbul.2010.05.015 |
Liu XQ, Wang ZL. A review of the green tides in the Yellow Sea, China. Marine Environmental Research, 2016, 119: 189-196 DOI:10.1016/j.marenvres.2016.06.004 |
Lønborg C, Álvarez-Salgado XA, Letscher RT, et al. Large stimulation of recalcitrant dissolved organic carbon degradation by increasing ocean temperatures. Frontiers in Marine Science, 2018, 4: 436 DOI:10.3389/fmars.2017.00436 |
Marie D, Partensky F, Vaulot D, et al. Enumeration of phytoplankton, bacteria, and viruses in marine samples. Current Protocols in Cytometry, 1999, 11: 1-15 |
Murphy KR, Stedmon CA, Waite TD, et al. Distinguishing between terrestrial and autochthonous organic matter sources in marine environments using fluorescence spectroscopy. Marine Chemistry, 2008, 108(1-2): 40-58 DOI:10.1016/j.marchem.2007.10.003 |
Osburn CL, Mikan MP, Etheridge JR, et al. Seasonal variation in the quality of dissolved and particulate organic matter exchanged between a salt marsh and its adjacent estuary. Journal of Geophysical Research Biogeosciences, 2015, 120(7): 1430-1449 DOI:10.1002/2014JG002897 |
Stedmon CA, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: A tutorial. Limnology and Oceanography Methods, 2008, 6(11): 572-579 DOI:10.4319/lom.2008.6.572 |
Stedmon CA, Markager S. Resolving the variability of dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis. Limnology and Oceanography, 2005, 50(2): 686-697 DOI:10.4319/lo.2005.50.2.0686 |
Sun T. Distribution characteristics of silica in Bohai and Yellow Seas. Masterxs Thesis of the First Institute of Oceanography, State Oceanic Administration, 2014 [孙涛.渤海与黄海水体和沉积物中硅的分布特征与影响因素.国家海洋局第一海洋研究所硕士研究生学位论文, 2014]
|
Valderrama JC. The simultaneous analysis of total nitrogen and total phosphorus in natural waters. Marine Chemistry, 1981, 10(2): 109-122 |
Valiela I, Teal JM, Allen SD, et al. Decomposition in salt marsh ecosystems: The phases and major factors affecting disappearance of above-ground organic matter. Journal of Experimental Marine Biology and Ecology, 1985, 89(1): 29-54 DOI:10.1016/0022-0981(85)90080-2 |
Wang C, Yu RC, Zhou MJ. Effects of the decomposing green macroalga Ulva (Enteromorpha) prolifera on the growth of four red-tide species. Harmful Algae, 2012, 16: 12-19 DOI:10.1016/j.hal.2011.12.007 |
Wang XC, Lee C. Decomposition of aliphatic amines and amino acids in anoxic salt marsh sediment. Geochimica et Cosmochimica Acta, 1995, 59(59): 1787-1797 |
Wang XC, Litz L, Chen RF, et al. Release of dissolved organic matter during oxic and anoxic decomposition of salt marsh cordgrass. Marine Chemistry, 2007, 105(3-4): 309-321 DOI:10.1016/j.marchem.2007.03.005 |
Wang ZL, Fu MZ, Xiao J, et al. Progress on the study of the Yellow Sea green tides caused by Ulva prolifera. Haiyang Xuebao, 2018, 40(2): 1-13 [王宗灵, 傅明珠, 肖洁, 等. 黄海浒苔绿潮研究进展. 海洋学报, 2018, 40(2): 1-13] |
Wang ZL, Xiao J, Fan SL, et al. Who made the world's largest green tide in China?-An integrated study on the initiation and early development of the green tide in Yellow Sea. Limnology and Oceanography, 2015, 60(4): 1105-1117 DOI:10.1002/lno.10083 |
White DS, Howes BL. Long-term 15N-nitrogen retention in the vegetated sediments of a New England salt marsh. Limnology and Oceanography, 1994, 39: 1878-1892 DOI:10.4319/lo.1994.39.8.1878 |
Xia B, Ma SS, Cui Y, et al. Distribution of temperature, salinity, dissolved oxygen, nutrients and their relationships with green tide in Enteromorpha prolifera outbreak area of the Yellow Sea. Progress in Fishery Sciences, 2009, 30(5): 94-101 [夏斌, 马绍赛, 崔毅, 等. 黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系. 渔业科学进展, 2009, 30(5): 94-101 DOI:10.3969/j.issn.1000-7075.2009.05.016] |
Xin M. Distribution characteristics of biogenic elements in the Yellow Sea and comparison of properties between the southern and northern Yellow Sea cold water masses. Masterxs Thesis of the First Institute of Oceanography, State Oceanic Administration, 2011 [辛明.黄海生源要素的分布特征及南、北黄海冷水团性质比较.国家海洋局第一海洋研究所硕士研究生学位论文, 2011] http://cdmd.cnki.com.cn/Article/CDMD-85301-1011153868.htm
|
Zhang T, Wang XC. Release and microbial degradation of dissolved organic matter (DOM) from the macroalgae Ulva prolifera. Marine Pollution Bulletin, 2017, 125(1-2): 192-198 DOI:10.1016/j.marpolbul.2017.08.029 |
Zhang YL, Gao G, Shi K, et al. Absorption and fluorescence characteristics of rainwater CDOM and contribution to Lake Taihu, China. Atmospheric Environment, 2014, 98: 483-491 DOI:10.1016/j.atmosenv.2014.09.038 |
Zhao Z, Gonsior M, Luek J, et al. Picocyanobacteria and deep-ocean fluorescent dissolved organic matter share similar optical properties. Nature Communications, 2017, 8: 15284 DOI:10.1038/ncomms15284 |
Zhou MJ, Liu DY, Anderson DM, et al. Introduction to the special issue on green tides in the Yellow Sea. Estuarine Coastal and Shelf Science, 2015, 163(2015): 3-8 |



