2. 中国水产科学研究院黄海水产研究所 农业农村部海水 养殖病害防治重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs, Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology Qingdao, Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity, Qingdao 266071
自20世纪90年代以来,随着贝类养殖业的迅速发展,牡蛎疱疹病毒(Ostreid herpesvirus 1, OsHV-1)感染引起的人工养殖贝类大面积死亡在世界范围内频繁发生,OsHV-1已成为影响贝类养殖业健康发展的重要病原微生物之一(Comps et al, 1977; Renault et al, 1994a、1994b、1995、1998)。OsHV-1具有典型的疱疹样病毒粒子特征,由双链DNA构成的核心由内至外分别由衣壳、被膜(Tegument)及囊膜包裹。OsHV-1基因组DNA大小约200 kbp; 衣壳具有正二十面体结构(T=16);被膜由位于核衣壳与囊膜之间的基质蛋白组成; 囊膜来源于宿主细胞(磷脂层和膜蛋白),同时含有病毒编码的糖蛋白。OsHV-1是Ostreavirus属(Herpesvirales目, Malacoherpesviridae科)下的唯一种; 也是最早被发现可以感染无脊椎动物的疱疹病毒种(Ren et al, 2013; Renault et al, 2000; Le Deuff et al, 1999; Arzul et al, 2001; Davidon et al, 2005)。与脊椎动物疱疹病毒的宿主特异性较高不同,OsHV-1表现出跨种属感染和流行的致病特点。OsHV-1可以感染多种双壳贝类,如牡蛎、扇贝、蚶和蛤等,对贝类幼虫及稚贝的致死率高达40%~100% (Renault, 2011; Renault et al, 2012;张福绥等, 1999;王运涛等, 1999;宋微波等, 2001)。2012和2013年春季,山东多个地区人工养殖的魁蚶(Scapharca broughtonii)亲贝出现大量死亡,通过电镜在死亡魁蚶中观察到疱疹样病毒粒子,后经分子生物学检测及感染实验,确定魁蚶种贝的大规模死亡与牡蛎疱疹病毒感染密切相关,这也是全球首例在蚶科贝类中发现的疱疹样病毒感染(Bai et al, 2016)。对魁蚶中病毒粒子进行纯化、基因组测序和序列比对分析,发现死亡魁蚶中存在的病毒是牡蛎疱疹病毒的新变异株,命名为牡蛎疱疹病毒魁蚶株,简称OsHV-1-SB(夏俊洋, 2015)。
对OsHV-1基因组序列进行生物信息学预测显示,OsHV-1编码124个开放阅读框(Open reading frame, ORF),其中,38个ORF编码膜蛋白。但由于缺乏细胞系,还难以对上述预测结果进行验证。目前,对OsHV-1预测ORF的真实性及其生物学功能的了解很有限。贾志磊等(2011)和张帅等(2014)仅针对牡蛎疱疹病毒的功能蛋白开展过功能预测、克隆和原核表达等研究工作,国际上也仅有1例有关OsHV-1膜蛋白结构和功能方面的研究(Martenot et al, 2019)。根据对脊椎动物疱疹病毒的研究显示,疱疹病毒囊膜蛋白具有多种生物学功能(杨金华等, 2009),是宿主细胞进行免疫识别的重要抗原表位,也是设计和制备抗病毒药物及疫苗的关键靶标(He et al, 2006)。研究病毒囊膜蛋白对揭示病毒与宿主细胞的相互作用机制和开发抗病毒药物等具有重要的作用。本研究根据已报道的牡蛎疱疹病毒及其魁蚶株全基因组序列,成功克隆了预测为囊膜蛋白的orf111基因全长序列,并利用生物信息学方法分析了其编码蛋白的基本结构特征。最后,经原核表达成功得到了orf111基因编码的蛋白产物,为进一步制备ORF111单克隆抗体及研究其功能奠定了基础。
1 材料与方法 1.1 实验材料病料来源于2012年5月23日采集自山东省长岛某贝类育苗场的魁蚶种贝,暂养过程中出现双壳闭合不全、反应迟钝、内脏团发白,出现症状后1周内全部死亡。经实时定量PCR检测,这批魁蚶病料中OsHV-1-SB的DNA载量约为106 copies/ng总DNA。组织病料在-80℃超低温冰箱保存备用。
1.2 总DNA的提取将1.1中OsHV-1-SB呈阳性的组织样品从冰箱中取出后,置于4℃冰箱,过夜解冻,剪取外套膜30 mg,根据海洋动物总DNA提取试剂盒(天根生化科技公司)说明书上的方法提取总DNA。
1.3 PCR引物设计根据本实验室测定完成的OsHV-1-SB全基因组序列,以及其他已公布的OsHV-1变异株基因组序列中orf111的基因序列,使用Premier 5.0软件设计上下游引物:上游引物orf111-F:5′-CCGCTCGAGATGATTGGTCCGATTGTGGTACTAC-3′,其中划线部分为添加的XhoⅠ酶切位点; 下游引物orf111-R:5′-CGC GGATCCTTATACAATTGGCAGCCATCTTCCT-3′,其中划线部分为添加的BamHⅠ酶切位点。引物由生工生物工程(上海)股份有限公司合成。
1.4 orf111基因的扩增以提取的总DNA为模板,用高保真酶(东洋纺)进行PCR扩增,反应体系:10×PCR Buffer for KOD-Plus-Neo 2.5 μl,dNTPs (2 mmol/L) 2.5 μl,MgSO4(25 mmol/L) 1.5 μl,上、下游引物(10 μmol/L)各0.75 μl,KOD-Plus-NEO (1 U/μl) 0.5 μl,灭菌水14.5 μl,总体积为25 μl。PCR扩增的反应条件:94℃预变性2 min; 98℃ 10 s,55℃ 30 s,68℃ 30 s,进行35个循环; 最后,72℃延伸10 min; PCR产物置于4℃保存。用1%的琼脂糖凝胶电泳检验得到的PCR产物。将扩增出的约870 bp的目的片段用DNA琼脂糖凝胶电泳回收试剂盒(天根生化科技公司)纯化回收,并送至金唯智(中国)生物科技有限公司进行测序。
1.5 生物信息学分析用Gene tool软件预测牡蛎疱疹病毒orf111基因的氨基酸序列; 用NCBI中BLAST工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列比对和相似性分析; 用ProtParam (http://web.expasy.org/protparam/)工具对该蛋白质的理化性质进行预测和分析; 采用SignalP 5.0 (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测; 使用TMHMM5.0(http://www.cbs.dtu.dk/services/TMHMM/)在线预测牡蛎疱疹病毒orf111基因所编码蛋白质的跨膜区。采用在线软件Predicting Antigenic Peptides (http://imed.med.ucm.es/Tools/antigenic.pl)及ABCpred(http://www.imtech.res.in/raghava/abcpred)进行蛋白抗原特性分析。
1.6 重组表达载体的构建用限制性核酸内切酶BamHⅠ(NEB)和XhoⅠ(NEB)对纯化后的目的片段orf111和原核表达载体pET28a(+)分别进行双酶切,酶切体系为20 μl:orf111及pET28a(+)各10 μl,BamHⅠ1 μl,XhoⅠ1 μl,Buffer 2 μl, 灭菌水6 μl,37℃酶切过夜,1%琼脂糖凝胶电泳检验双酶切结果,并切胶回收。将双酶切后的orf111目的片段和原核表达载体pET28a(+)经T4 DNA连接酶(NEB)连接,得到重组表达载体pET28a-orf111。连接体系为:orf111酶切产物3 μl,pET28a(+)酶切产物9 μl,T4 DNA连接酶1 μl,Buffer 2 μl,灭菌水5 μl,总体积20 μl,4℃连接过夜。
将重组表达载体转化至DH5α感受态细胞(天根生化科技公司)中,经含卡那霉素(Kan+, 50 μg/μl)的LB固体培养基筛选,得到转化成功的表达菌株,挑取单菌落,进行菌落PCR验证。使用质粒小量提取试剂盒(天根生化科技公司)提取质粒并进行双酶切验证,同时,将重组表达载体送至金唯智(中国)生物科技股份有限公司进行测序。将测序正确的重组表达菌株置于20%甘油,-80℃保存。
1.7 重组表达载体pET28a-orf111的诱导表达将重组表达载体pET28a-orf111接种于LB液体培养基(Kan+, 50 μg/μl),37℃,200 r/min,恒温振荡培养过夜,制备种子液; 第2天,按1:100接种到100 ml LB液体培养基(Kan+, 50 μg/μl),37℃,200 r/min,摇床培养至OD600 nm≈0.5~0.6时,取30 ml作为对照进行培养(不进行诱导),其余菌液加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为1 mmol/L,37℃诱导表达4 h左右,收集菌液,10000×g离心3 min,弃上清液,沉淀中加入1×PBS超声破碎,10000×g,4℃离心10 min,对照组按照上述方法进行破碎; 分别收集上清液和沉淀,进行SDS-PAGE分析。上样前,分别在上清液和沉淀中加入4×SDS上样缓冲液,金属浴100℃,5 min,12% SDS-PAGE电泳观察蛋白表达情况。
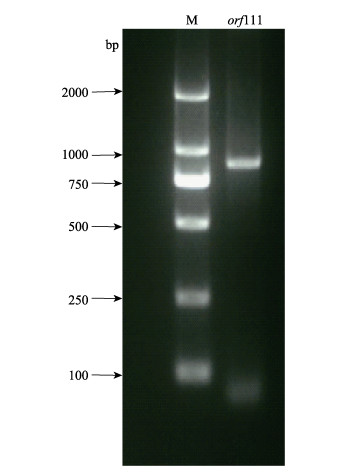
2 结果 2.1 orf111基因PCR扩增及鉴定以提取的总DNA作为模板,经过PCR扩增获得相应的基因片段,PCR产物使用1%琼脂糖凝胶电泳检测,在750~1000 bp之间出现了1条特异性条带,与orf111基因预期的目的条带870 bp大小相符(图 1)。目的条带测序结果证实PCR扩增的特异性条带为目的条带。
|
图 1 牡蛎疱疹病毒魁蚶株orf111基因扩增 Fig.1 Amplification of the orf111 gene in Ostreid herpesvirus 1 SB strain M:DNA marker; orf111:目的基因Target gene |
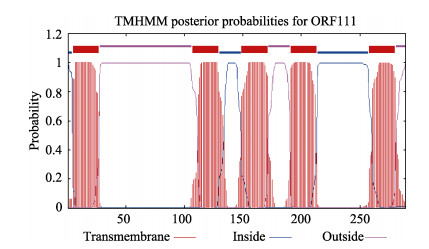
氨基酸序列分析,结果显示,牡蛎疱疹病毒魁蚶株的orf111基因序列中含有1个精氨酰-甘氨酰-天冬氨酸(Arg-Gly-Asp, RGD)序列(图 2);经SignalP 5.0 Server软件分析,该氨基酸序列无信号肽; 通过TMMHM 5.0在线工具对orf111基因编码的蛋白结构进行分析,结果显示,该蛋白在5~27、107~129、149~ 171、191~213和258~280氨基酸残基处存在5个跨膜区域(图 3)。

|
图 2 牡蛎疱疹病毒魁蚶株orf111基因序列及推导的氨基酸序列 Fig.2 Nucleotide and deduced amino acid sequence of the orf111 gene in Ostreid herpesvirus 1 SB strain 方框所示序列为RGD三肽 Boxed sequence is the RGD tripeptide |
|
图 3 牡蛎疱疹病毒魁蚶株orf111基因编码蛋白跨膜区预测 Fig.3 Transmembrane domain prediction of the ORF111 protein in Ostreid herpesvirus 1 SB strain |
根据ProtParam预测结果,orf111基因编码的蛋白质分子质量为32.41 kDa,理论等电点为7.00。基因编码的289个氨基酸中,带正电荷的碱性氨基酸精氨酸(Arg)和赖氨酸(Lys)共26个,带负电荷的酸性氨基酸天冬氨酸(Asp)和谷氨酸(Glu)共26个。该蛋白质的不稳定系数和亲水性总平均值分别为37.46和0.421,是一种稳定的疏水性蛋白质。
2.3.2 高级结构预测蛋白质主链通过不同的折叠方式产生由氢键维系的蛋白质二级结构,并由此进一步折叠成球形。根据目前相关研究,认为驱动蛋白质主链折叠形成二级结构的动力主要是疏水效应。通过SOPMA在线预测软件对orf111基因编码的蛋白质二级结构进行预测,结果显示,蛋白质主要由4种二级结构元件组成,其中,α螺旋占38.41%,β转角占4.15%,延伸链占26.30%,无规则卷曲占31.14%。
经在线工具Predicting Antigenic Peptides分析发现,orf111基因编码的蛋白质有9处抗原决定簇,分别为4~33、63~76、79~89、102~134、145~177、179~ 189、191~211、222~228、250~280氨基酸残基,且在63~76、79~89、102~134、145~177区域及附近存在B细胞抗原表位的可能性较高,易于与抗体嵌合(张昱等, 2008;王笑英等, 2010)。
2.4 序列相似性分析通过NCBI中的BLAST工具进行DNA序列相似性分析,结果表明,牡蛎疱疹病毒魁蚶株orf111基因与牡蛎疱疹病毒参考株(OsHV-1, AVC68720.1)、急性病毒性坏死病毒(Chlamys acute necrobiotic virus, AVNV, ADD24836.1)、鲍疱疹病毒(Haliotid herpesvirus 1, HaHV-1, YP_006908732)等病毒的orf111基因有序列相似性。此外,将克隆得到的基因片段翻译成氨基酸序列,进行BLAST后发现,该蛋白质与牡蛎疱疹病毒参考株(OsHV-1)、急性病毒性坏死病毒(AVNV)、鲍疱疹病毒(HaHV-1)也具有序列相似性。其中,orf111基因的氨基酸序列与牡蛎疱疹病毒orf111基因的氨基酸序列相似性为99.65%,与急性病毒性坏死病毒ORF111相似性为99.31%,与鲍疱疹病毒ORF80相似性为32.20%。
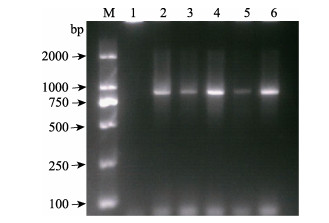
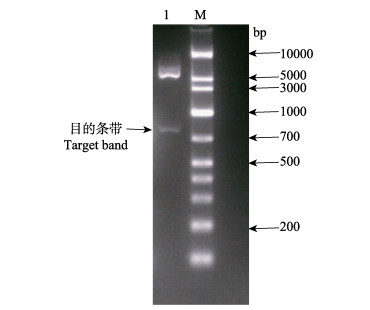
2.5 重组质粒pET28a-orf111菌落PCR和双酶切鉴定挑取5~7个单菌落,分别接种于3 ml不含卡那霉素的LB新鲜液体培养基中,37℃,摇床振荡培养12 h,以菌液作为模板,进行菌落PCR,使用1%琼脂糖凝胶电泳检测PCR产物,结果显示,在750~1000 bp之间靠近1000 bp处出现了特异性条带,与orf111基因的大小相符(图 4)。挑取鉴定为阳性的pET28a-orf111重组菌提取质粒,使用XhoⅠ及BamHⅠ限制性核酸内切酶,对重组质粒进行双酶切鉴定,使用1%琼脂糖凝胶电泳对双酶切产物进行检测,结果与预期大小相符(图 5)。重组质粒测序结果显示:目的基因与牡蛎疱疹病毒魁蚶株orf111基因的DNA序列同源性高达100%,且所有碱基无缺失、突变。以上结果表明,重组表达载体构建成功。
|
图 4 重组表达载体pET28a-orf111菌落PCR鉴定 Fig.4 Bacterial colony PCR of recombinant pET28a-orf111 M:DNA marker; 1~6:重组质粒pET28a-orf111菌落 Recombinant pET28a-orf111 bacterial colony |
|
图 5 重组表达载体pET28a-orf111双酶切鉴定 Fig.5 Double enzyme digestion of recombinant pET28a-orf111 M:DNA marker; 1:XhoⅠ与BamHⅠ双酶切产物 pET28a-orf111 digested with XhoⅠand BamHⅠ |
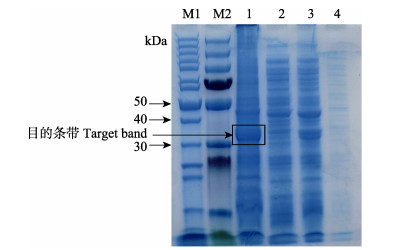
在诱导温度为37℃、IPTG终浓度为1 mmol/L、诱导培养时间为4 h情况下,诱导重组表达载体pET28a-orf111蛋白表达。将诱导表达的pET28a-orf111超声破碎后,进行SDS-PAGE凝胶电泳,其中沉淀中在30~40 kDa明显的出现了1条清晰的特异性条带,约为32 kDa,与目的蛋白大小相符,实验中未诱导的重组菌上清液、沉淀和诱导的重组菌上清液均无目的条带(图 6),SDS-PAGE电泳结果显示,重组蛋白主要以包涵体形式存在于沉淀中。
|
图 6 重组表达载体pET28a-orf111诱导表达蛋白的SDS-PAGE Fig.6 SDS-PAGE of induced recombinant pET28a-orf111 M1、M2:蛋白Marker; 1、2:分别为IPTG诱导的重组表达载体沉淀和上清液; 3、4:分别为未诱导重组表达载体沉淀和上清液 M1, M2: Protein marker; 1: Precipitate protein of recombinant strain induced by IPTG; 2: Supernatant of recombinant strain induced by IPTG; 3: Precipitate of recombinant strain; 4: Supernatant of recombinant strain |
疱疹病毒侵入宿主细胞是一个高度复杂的过程,涉及镶嵌在病毒粒子脂质双层结构中的多种囊膜蛋白和糖蛋白,以及位于宿主细胞表面的受体分子。对脊椎动物疱疹病毒感染过程的研究结果显示,其侵入过程首先是从病毒与宿主分子或者细胞的特异性粘附开始,之后,病毒粒子囊膜与宿主细胞膜融合,使病毒衣壳穿透宿主细胞(Spear et al, 2003; Spear, 2004; Agelidis et al, 2015)。对牡蛎疱疹病毒魁蚶株基因组进行的生物信息学分析,结果显示,牡蛎疱疹病毒魁蚶株orf111基因的胞外结构域中存在1个RGD结构域。RGD结构域不仅是细胞与基质黏附作用和细胞生长、生存的生理基础,在介导病毒与细胞间的黏附过程中也至关重要(张光辉等, 2010)。内源性RGD结构域主要存在于粘附蛋白中,如铁蛋白、玻连蛋白、血管性血友病因子(von Willebrand factor, vWF)、纤维粘连蛋白等,其具有一定的生物活性,能与细胞表面的整合素受体特异性结合,是存在于细胞外基质中一段高度保守的结构域(朱丽红等, 2010;陈治宇等, 2003;柴宁莉等, 2012;张光辉等, 2010;侯瑞珍等, 2008;史嘉玮等, 2005; Kostetski et al, 2000)。对虾白斑综合征病毒(White spot syndrome virus, WSSV)膜蛋白相关研究表明,在WSSV病毒感染初期,含RGD结构域的膜蛋白介导了病毒对宿主细胞膜的粘附,病毒膜蛋白和细胞受体的粘附作用确实通过RGD结构域实现(刘庆慧等, 2005, 林兆宇, 2009;陈文博, 2009;唐小千, 2010;赵建梅, 2013)。王中一等(2018)研究发现,WSSV入侵凡纳滨对虾细胞时,是因为VP26和VP37与网格重链蛋白相互作用,从而介导WSSV进入宿主细胞中,并加快WSSV病毒在宿主体内的一系列活动。由此推测,囊膜蛋白ORF111中的RGD结构域在OsHV-1与宿主细胞膜上的特异性受体结合,在侵染宿主细胞的过程中都扮演着重要角色。ORF111也是首个被成功克隆和表达的含RGD结构域的OsHV-1结构蛋白,对该蛋白进行生物信息学分析和原核表达将有助于理解和研究OsHV-1的侵染机制。王中一等(2019)通过酵母双杂交技术筛选与wsv112互作的宿主蛋白,为研究wsv112的调控机制提供新的思路。这一研究成果将对研究膜蛋白ORF111的互作蛋白,及其在病毒侵染宿主过程中的作用机制提供参考。
在生物的生命活动中膜蛋白起着至关重要的作用,如能量转换、细胞增殖和分化、物质运输以及信号转导等,而膜蛋白的功能与其结构息息相关(Yildirim et al, 2007)。对病毒囊膜蛋白的序列和结构进行生物信息学预测,将为后续开展相关实验验证提供帮助。序列比对发现,牡蛎疱疹病毒魁蚶株orf111基因编码蛋白的氨基酸序列与数据库中牡蛎疱疹病毒参考株和急性病毒性坏死病毒的orf111基因编码蛋白的氨基酸序列相似度分别为99.89%和99.65%,并未发现其中的氨基酸序列有高变异区。上述结果显示,ORF111蛋白比较保守,这一特点有利于利用该蛋白制备适用于不同牡蛎疱疹病毒变异株的单克隆抗体。对ORF111蛋白的高级结构进行分析,发现其氨基酸序列的可变区存在大量的B细胞抗原优势表位,这一结果说明,ORF111蛋白可能具有较好的抗原性(王笑英等, 2010)。B细胞抗原优势表位与蛋白质高级结构有着紧密联系,但目前ORF111蛋白的结构及功能研究尚处于起步阶段,所以,本研究通过生物信息学方法预测得到的结果还有待进一步验证。
目前,国内外仅对OsHV-1功能蛋白开展过诱导表达和初步结构、功能研究。如开展了dUTPase基因及IAP-86基因的克隆、表达及功能相关研究(贾志磊等, 2011;张帅等, 2014),但对于贝类疱疹病毒囊膜蛋白结构和功能的研究工作较少,仅Martenot等(2019)对牡蛎疱疹病毒参考株开展了相关研究。Martenot等(2019)研究表明,牡蛎疱疹病毒参考株orf25基因编码的膜蛋白参与了OsHV-1与宿主细胞的相互作用,ORF25抗体对宿主抗病毒具有促进作用。同时,其研究还表明,病毒与宿主之间的相互作用需要orf72和orf41基因编码的膜蛋白共同参与。根据牡蛎疱疹病毒orf25、orf41和orf72基因的生物信息学分析,这3种基因编码的囊膜蛋白不含RGD结构域。本研究首次以含有RGD结构域的orf111基因为研究对象,经基因克隆、表达载体重组及诱导表达,成功得到32 kDa的目的蛋白,大小与目的基因orf111和pET28a(+)原核表达载体标签序列融合表达的重组蛋白预期一致。该结果为进一步研究囊膜蛋白ORF111的功能以及牡蛎疱疹病毒的致病机制奠定基础,为牡蛎疱疹病毒的防控工作提供新的思路。
Agelidis AM, Shukla D. Cell entry mechanisms of HSV: What we have learned in recent years. Future Virology, 2015, 10(10): 1145-1154 |
Arzul I, Nicolas JL, Davison AJ, et al. French scallops: A new host for Ostreid herpesvirus-1. Virology, 2001, 290: 342-349 |
Bai CM, Gao WH, Wang CM, et al. Identification and characterization of Ostreid herpesvirus 1 associated with massive mortalities of Scapharca broughtonii broodstocks in China. Diseases of Aquatic Organisms, 2016, 118: 65-75 |
Chai NL, Xu SP, Shi H, et al. Arginine-glycin-aspartic acid could enhance oxymatrine liposomes theraputic effect on hepatic fibrosis. Global Traditional Chinese Medicine, 2012, 5(9): 645-650 [柴宁莉, 徐世平, 石卉, 等. 精氨酸-甘氨酸-天冬氨酸对氧化苦参碱脂质体减轻肝纤维化的增强作用研究. 环球中医药, 2012, 5(9): 645-650] |
Chen WB. Design and evaluation a novel protein vaccine for the precaution of white spot syndrome virus (WSSV) infection. Masterxs Thesis of Liaoning Normal University, 2009 [陈文博.一种预防白斑综合症病毒的新型蛋白疫苗的设计和评估.辽宁师范大学硕士研究生学位论文, 2009]
|
Chen ZY, Hou J, Wang XF. Synthesis of peptides and analogues containing RGD domain. Journal of Chengde Medical College, 2003, 20(3): 246-247 [陈治宇, 厚今, 王兴发. 含RGD序列肽及类似物的合成. 承德医学院学报, 2003, 20(3): 246-247] |
Comps M, Bonami JR. Infection virale associe a des mortalites chez Ixhuire Crassostrea gigas. Comptes Rendus Hebdomadaires des Seances de L'academie des sciences., 1977, 285: 1139-1140 |
Davidon AJ, Trus BL, Cheng N, et al. A novel class of herpesvirus with bivalve hosts. Journal of General Virology, 2005, 86(1): 41-53 |
He JY, Hu HJ, Harrison R, et al. Transmembrane segments prediction and understanding using support vector machine and decision tree. Expert Systems with Applications, 2006, 30(1): 64-72 |
Hou RZ, Wang W, Li CR, et al. Studies on the effects of RGD peptide on the proliferation, adherence and motility of human fibrosarcoma cell HTl080. Journal of Northeast Normal University (Natural Science Edition), 2008, 40(1): 120-124 [侯瑞珍, 王巍, 李春蓉, 等. RGD对人纤维肉瘤细胞HT1080增殖、黏附及转移影响的研究. 东北师大学报(自然科学版), 2008, 40(1): 120-124] |
Jia ZL, Wang CM, Ren WC, et al. Cloning, expression of Chlamys farreri acute viral necrosis virus dUTPase gene and the determination of its enzymatic activity. Journal of Fisheries of China, 2011, 35(9): 1320-1326 [贾志磊, 王崇明, 任伟成, 等. 急性病毒性坏死病毒dUTPase基因的克隆、表达及其产物的酶学活性分析. 水产学报, 2011, 35(9): 1320-1326] |
Kostetski PV, Artemxev IV. A conformational analysis of biologically active RGD-containing cyclopeantapeptides. Bioorganicheskaya Khimiya, 2000, 26(4): 290-298 |
Le Deuff RM, Renault T. Purification and partial genome characterization of a herpes-like virus infecting the Japanese oyster, Crassostrea gigas. Journal of General Virology, 1999, 80(5): 1317-1322 |
Lin ZY. Characterization of an envelope protein (VP13A) of white spot syndrome virus and the research into the interaction between envelope proteins (VP31 and VP33) and host cells. Masterxs Thesis of Xiamen University, 2009 [林兆宇.对虾白斑综合症病毒(WSSV)膜蛋白VP13A的鉴定及VP31和VP33与宿主细胞互相作用的初步研究.厦门大学硕士研究生学位论文, 2009]
|
Liu QH, Huang J, Han WJ, et al. Clone and sequence analysis of white spot syndrome virus (WSSV)-VAP1 gene. Journal of Fishery Sciences of China, 2005, 12(3): 352-356 [刘庆慧, 黄倢, 韩文君, 等. WSSV-VAP1基因克隆与序列分析. 中国水产科学, 2005, 12(3): 352-356] |
Martenot C, Faury N, Morga B, et al. Exploring first interactions between Ostreid herpesvirus 1 (OsHV-1) and its host, Crassostrea gigas: Effects of specific antiviral antibodies and dextran sulfate. Frontiers in Microbiology, 2019, 10: 1128 |
Ren W, Chen H, Renault T, et al. Complete genome sequence of acute viral necrosis virus associated with massive mortality outbreaks in the Chinese scallop, Chlamys farreri. Virology Journal, 2013, 10: 110 |
Renault T, Cochennec N, Le Deuff RM, et al. Herpes-like virus infecting Japanese oyster (Crassostrea gigas) spat. Bulletin-European Association of Fish Pathologists, l994a, 14(2): 65-66 |
Renault T, Le Deuff RM, Chollet B, et al. Concomitant herpes-like virus infections in hatchery-reared larvae and nursery-cultured spat Crassostrea gigas and Ostrea edulis. Diseases of Aquatic Organisms, 2000, 42(3): 173-183 |
Renault T, Le Deuff RM, Cochennec N, et al. Herpes-like viruses associated with high mortality levels in larvae and spat of Pacific oysters, Crassostrea gigas: A comparative study, the thermal effects on virus detection in hatchery-reared larvae, reproduction of the disease in axenic larvae. Veterinary Research, 1995, 26(5-6): 539-543 |
Renault T, Le Deuff RM, Cochennec N, et al. Herpesviruses associated with mortalities among Pacific oyster, Crassostrea gigas, in France-comparative study. Revue de Médecine Vétérinaire, 1994b, 145(10): 735-742 |
Renault T, Lipart C. Diagnosis of herpes-like virus infections in oysters using molecular techniques. European Aquaculture Society Special Publication, 1998, 26: 235-236 |
Renault T, Moerau P, Faury N, et al. Analysis of clinical Ostreid herpesvirus 1 (Malacoherpesviridae) specimens by sequenc-ing amplified fragments from three virus genomes areas. Journal of Virology, 2012, 86(10): 5942-5947 |
Renault T. A review of mortality outbreaks in the Pacific oysters, Crassostrea gigas, reported since 2008 in various Eurpean members states. In: Renault T. The rehted implementation of council directive. Paris. The OIE and its partners, 2011, 5-9
|
Shi JW, Dong NG. Application of RGD peptide in tissue engineering. Chinese Journal of Experimental Surgery, 2005, 22(9): 1150-1152 [史嘉玮, 董念国. RGD肽在组织工程领域的应用. 中华实验外科杂志, 2005, 22(9): 1150-1152] |
Song WB, Wang CM, Wang XH, et al. New research progress on massive mortality of cultured scallop Chlamys farreri. Marine Sciences, 2001, 25(12): 23-26 [宋微波, 王崇明, 王秀华, 等. 栉孔扇贝大规模死亡的病原研究新进展. 海洋科学, 2001, 25(12): 23-26] |
Spear PG, Longnecker R. Herpesvirus entry: An update. Journal of Virology, 2003, 77(19): 10179-10185 |
Spear PG. Herpes simplex virus: Receptors and ligands for cell entry. Cellular Microbiology, 2004, 6(5): 401-410 |
Tang XQ. Study on the WSSV receptors in haemocytes of Fennropenaeus chinesis. Doctoral Dissertation of Ocean University of China, 2010 [唐小千.中国对虾白斑症病毒(WSSV)血细胞受体蛋白的研究.中国海洋大学博士研究生学位论文, 2010]
|
Wang XY, Du PG, Wu CF, et al. Bioinformatics analysis of OLFM1 epitope and preparation of polyclonal antibody. Chinese Journal of Immunology, 2010, 26(8): 721-723 [王笑英, 杜培革, 吴春风, 等. OLFM1蛋白的生物信息学分析及其多克隆抗体制备与鉴定. 中国免疫学杂志, 2010, 26(8): 721-723] |
Wang YT, Xiang JH. Studies on causation of the mass mortality of Chlamys farreri. Oceanologia et Limnologia Sinica, 1999, 30(6): 770-774 [王运涛, 相建海. 栉孔扇贝大规模死亡的原因探讨. 海洋与湖沼, 1999, 30(6): 770-774] |
Wang ZY, Liu QH, Huang J. In vitro interaction between domain of clathrin heavy chain in Litopenaeus vannamei and WSSV structural proteins. Progress in Fishery Sciences, 2018, 39(2): 138-145 [王中一, 刘庆慧, 黄倢. 凡纳滨对虾网格重链蛋白与WSSV结构蛋白在体外的相互作用. 渔业科学进展, 2018, 39(2): 138-145] |
Wang ZY, Liu QH, Lu CY, et al. Identification of the host interactors of wsv112 of WSSV by yeast two-hybrid. Progress in Fishery Sciences, 2019, 40(4): 156-162 [王中一, 刘庆慧, 卢翠玉, 等. 利用酵母双杂交技术筛选与wsv112互作的宿主蛋白. 渔业科学进展, 2019, 40(4): 156-162] |
Xia JY. Sequence and analysis of the genome of OsHV-1 Scapharca broughtonii stain. Masterxs Thesis of Ocean University of China, 2015, 1-2 [夏俊洋.牡蛎疱疹病毒魁蚶株基因组测定与分析.中国海洋大学硕士研究生学位论文, 2015, 1-2]
|
Yang JH, Ye R. Advances in the viral transmembrane proteins: Structure, function and antiviral drug design. Journal of Microbes and Infection, 2009, 4(4): 231-240 [杨金华, 叶荣. 病毒跨膜蛋白的结构功能与抗病毒药物设计. 微生物与感染, 2009, 4(4): 231-240] |
Yildirim MA, Goh KI, Cusick ME, et al. Drug-target network. Nature Biotechnology, 2007, 25(10): 1119-1126 |
Zhang FS, Yang HS. Analysis of the sauses of mass mortality of farming Chlamys farreri in summer in coastal areas of Shandong, China. Marine Sciences, 1999, 23(1): 44-47 [张福绥, 杨红生. 山东沿岸夏季栉孔扇贝大规模死亡原因分析. 海洋科学, 1999, 23(1): 44-47] |
Zhang GH, Yao W, Hao CF, et al. Inhibitory effect of RGD on silica-induced stimulation in rat lung fibroblast. Modern Preventive Medicine, 2010, 37(11): 2016-2018 [张光辉, 姚武, 郝长付, 等. RGD短肽对二氧化硅致肺成纤维细胞激活的抑制效应. 现代预防医学, 2010, 37(11): 2016-2018] |
Zhang S, Wang CM, Song XL, et al. Cloning, expression of acute viral necrosis virus IAP-86 gene and studies of its anti-apoptotic mechanism. Journal of Fisheries of China, 2014, 38(2): 274-281 [张帅, 王崇明, 宋晓玲, 等. 急性病毒性坏死病毒IAP-86基因的克隆、表达及抗凋亡研究. 水产学报, 2014, 38(2): 274-281] |
Zhang Y, Wang YL, Zhang YG, et al. Construction of VP1 and prediction of B cell epitopes from FMDV AF72. Biotechnology Bulletin, 2008(6): 158-163 [张昱, 王永录, 张永光, 等. 口蹄疫病毒株AF72 VP1的结构构建与B细胞表位预测. 生物技术通报, 2008(6): 158-163] |
Zhao JM. Identification and characterization of the binding proteins of VP31 and VP110 in Chinese shrimp, Fenneropenaeus chinensis. Doctoral Dissertation of Ocean University of China, 2013 [赵建梅.对虾白斑症病毒(WSSV)囊膜蛋白VP31、VP110在中国明对虾血细胞和鳃细胞中结合蛋白的研究.中国海洋大学博士研究生学位论文, 2013]
|
Zhu LH, Wu Y, Yuan L, et al. Effects of immobilized GRGDSPC peptides on proliferation of periodontal ligament fibroblasts on type-1 collagen. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2010, 39(6): 856-859 [朱丽红, 吴勇, 袁理, 等. RGD七肽固定胶原对人牙周膜成纤维细胞增殖的影响. 华中科技大学学报(医学版), 2010, 39(6): 856-859] |



