2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology Qingdao, Qingdao 266071;
3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
凡纳滨对虾(Litopenaeus vannamei)适应能力强,养殖范围分布广,是目前世界上养殖产量最高的三大优良品种之一,已经在30多个国家实现人工养殖,也是我国最重要的水产经济养殖品种之一(郜卫华等, 2013)。温度是养殖水环境中最重要环境因子之一,能直接影响养殖生物的存活、生长和代谢强度等。凡纳滨对虾属于变温动物,且对环境温度的依赖性较强,极易受到外界温度的影响。杨锋等(2001)报道,凡纳滨对虾生长的最适温度为28℃~32℃; Wyban等(1995)研究发现,凡纳滨对虾的适温范围为23℃~ 30℃; 当水温降至15℃~22℃或升至30℃~33℃时,就会受到来自环境的胁迫; 同时,凡纳滨对虾生长的最适温度受发育阶段影响,大于5 g对虾的最适温度为27℃左右,而小于5 g对虾的最适温度高于30℃。对虾流行性病毒病暴发具有明显的季节性,尤其在夏季高温的6~7月和9月上旬发病严重(丁志起等, 2005),一方面可能是病毒及对虾免疫力等共同作用的结果; 另一方面是天气和昼夜变化引起的温度变化,或者持续高温,造成对虾生理机能协调失常,免疫防御能力明显下降(Cheng et al, 2000)。对虾在高温季节的患病及死亡率明显增加,因此,深入研究凡纳滨对虾高温胁迫耐受性的分子机制,对培育温度抗逆型凡纳滨对虾新品种、促进对虾养殖业发展具有重要意义。
海藻糖(Trehalose)是一种非还原性双糖,由两分子葡萄糖单体以α, α-糖苷键连结而成(Elbein et al, 2003),广泛存在于各种生物体中,包括细菌、酵母、真菌、昆虫、无脊椎动物以及低等和高等植物(Elbein et al, 2003; Chung, 2008)。海藻糖可抵抗多种环境胁迫,如高温、低温、干旱、冰冻、氧化、高盐等,保护蛋白质、核酸、生物膜等生物活性物质和细胞结构(Mu et al, 2016; Tang et al, 2010、2018)。大量研究表明,某些物种对外界恶劣环境所表现出来的抗逆耐受力与它们体内存在的海藻糖有直接关系(聂凌鸿等, 2001)。昆虫和其他无脊椎动物中的海藻糖合成被认为通过6-磷酸海藻糖合成酶(Trehalose-6-phosphate synthase, TPS)和6-磷酸海藻糖酯酶(Trehalose-6-phosphate phosphatase, TPP)途径发生(Tang et al, 2018)。海藻糖在生物体中分布最广的合成途径是葡萄糖从UDP-葡萄糖转移到6-磷酸葡萄糖,然后通过6-磷酸海藻糖合成酶(TPS)形成6-磷酸海藻糖和UDP,再由6-磷酸海藻糖酯酶(Trehalose-6-phosphate phosphatase, TPP)催化合成海藻糖(Elbein et al, 2003)。
因此,TPS被认为是海藻糖生物合成途径的关键酶。为了更好地阐明TPS的结构和功能,目前已经从动物、植物和微生物中克隆了大量的TPS基因(Mu et al, 2016; Tang et al, 2010、2018;聂凌鸿等, 2001; Kwon et al, 2003; Jiang et al, 2010; Wang et al, 2010; Jiang et al, 2014; Uyar et al, 2016; Wu et al, 2018; Zhang et al, 2019a)。在动物中,TPS基因主要集中于节肢动物,尤其是昆虫。TPS基因在甲壳类动物中报道较少,目前在蓝蟹(Callinectes sapidus)、中国对虾(Fenneropenaeus chinensis)和脊尾白虾(Exopalaemon carinicauda)中有报道。研究发现,蓝蟹蜕皮过程中血细胞TPS活性与血淋巴海藻糖水平的相关性,并揭示了它在能量代谢和生理适应中的作用(Chung, 2008)。同时,在中国对虾和脊尾白虾的抗病毒实验中发现了TPS可能在虾的免疫过程中起重要作用。(Zhang et al, 2019a; Zhang et al, 2012)。本研究对凡纳滨对虾TPS基因在不同胁迫温度下以及不同组织中的应激表达特性进行分析,可为凡纳滨对虾应答高温胁迫提供一些基础数据。
1 材料与方法 1.1 凡纳滨对虾样品及胁迫处理实验材料均来自于2018年构建的同一个凡纳滨对虾家系,8月龄,平均体重为(8.0±0.5) g。实验在中国水产科学研究院黄海水产研究所遗传育种中心进行。设置5个实验组,分别为26℃常温组、32℃高温组、38℃高温组、32℃回温组和26℃回温组,每个实验组设置4个平行实验(其中,1个平行实验作为备份防止升降温过程中电器故障而造成实验失败),每个平行实验使用对虾10尾,放于(72 cm× 42 cm× 24 cm)泡沫箱中充气暂养。升降温操作方法如下:采用静水法,自动恒温加热器控温。26℃持续48 h之后,每12 h缓慢升温或降温1℃至实验温度。整个实验过程,从26℃先升温到32℃,再从32℃升温到38℃,再从38℃回温到32℃,再从32℃回温到26℃。到达实验温度后,维持水温12 h,从实验组每个平行实验中分别随机取3尾凡纳滨对虾,每尾虾取鳃、肝胰腺、眼柄、心脏、神经和肌肉6种组织,最后将每个平行实验的3尾虾的同一组织等量混合后保存于液氮中。用于后续的RNA提取和基因表达定量实验。
1.2 总RNA的提取通过TRIZOL法提取凡纳滨对虾6种组织的总RNA,并通过琼脂糖凝胶电泳检测RNA的质量以及完整性。使用NanoDrop 2000 UV/Vis分光光度计(Thermo Fisher Scientific)在260 nm和280 nm的波长下通过分光光度法定量总RNA。根据说明书,使用试剂盒HiScriptⅡ Q RT SuperMix for qPCR逆转录酶(Vazyme)和衔接子寡聚(dT)引物反转录获得cDNA。
1.3 引物的设计与筛选根据LvTPS的基因序列,利用Primer Premier 5.0软件结合DNAStar分析软件及BLAST程序,设计cDNA序列扩增、基因表达定量所用的引物,信息如表 1所示。引物由上海生工生物工程技术服务有限公司合成,用无菌水稀释到10 μmol/L,-20℃保存备用。
|
|
表 1 引物序列信息 Tab.1 Sequences of primers |
根据已有凡纳滨对虾转录组(未发表)中Unigene序列,设计序列扩增引物(表 1),以反转录获得的cDNA为模板,进行普通PCR扩增,将扩增产物进行切胶回收和测序,并将测序结果与转录组中Unigene序列比对,以确定LvTPS的cDNA序列。
1.5 LvTPS基因的生物信息学分析利用DNAMAN 8.0软件,根据获得的LvTPS的cDNA序列翻译获得氨基酸序列; 通过ExPASy-ProtParam tool (https://web.expasy.org/protparam/)预测蛋白质分子量、理论等电点、不稳定性指数等; 通过TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白质的跨膜区; 使用SignalP 4.0 (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测; NetNGlyc 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/)进行糖基化位点分析; NetPhos 2.0 Server (http://www.cbs.dtu.dk/services/NetPhos/)进行磷酸化位点分析; 氨基酸序列通过使用InterProScan (http://www.ebi.ac.uk/InterProScan/)进行蛋白质功能结构域预测分析; SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)进行二级结构预测; 基于BLAST搜索结果,对TPS在氨基酸水平上进行同源比较和进化树分析,使用DNAMAN 6.0进行同源多序列比对,MEGA 7.0邻接法(Neighbour-joining method, NJ)完成LvTPS基因进化树构建。
1.6 LvTPS的表达定量分析按照Thunderbird SYBR qPCR Mix的说明书,通过Real-time PCR分析TPS在6种组织中的表达水平,每个样品设置3个平行实验。Real-time PCR在10 μl反应体系中进行:5 μl Thunderbird SYBR qPCR Mix,0.2 μl 50×ROX reference,0.15 μl正向引物和0.15 μl反向引物,3.5 μl灭菌超纯水以及1 μl cDNA (100 ng)。反应条件:95℃初始变性60 s; 95℃变性15 s,60℃退火35 s,40个循环; 熔解曲线95℃ 15 s,55℃ 1 min,95℃ 15 s。
1.7 数据分析以凡纳滨对虾18S rRNA基因表达水平为内参,利用2-△△Ct法计算目的基因的相对表达量(Bai et al, 2012)。采用SPSS 17.0软件分析在不同温度下同一组织中差异表达的显著性,若P < 0.05,则认为差异显著; 利用OriginPro 9.1软件完成相关图表的制作。
2 结果与分析 2.1 LvTPS ORF序列的验证及特征分析结果利用RT-PCR技术获得的LvTPS cDNA序列与转录组测序获得的Unigene序列完全一致。LvTPS序列包含1个2529 bp的开放阅读框,可编码842个氨基酸,预测其带有负性电荷的氨基酸残基为102个(Asp+Glu),带有正电荷的氨基酸残基为89个(Lys+ Arg),分子量为95.4 kDa,等电点为6.17,不稳定系数为51.75,归类为不稳定蛋白,脂肪族指数为83.46,亲水性总平均值为-0.34;无跨膜蛋白和信号肽结构; 预测包含72个磷酸化位点和3个糖基化位点; 包含2个功能结构域,分别为Glyco-transf-20 domain和Trehalose_PPase domain (图 2);预测的二级结构中,α-螺旋(353个氨基酸)占41.92%,β-折叠(131个氨基酸)占15.56%,β-转角(43个氨基酸)占5.11%,无规卷曲(315个氨基酸)占37.41%,说明LvTPS基因编码的蛋白以α-螺旋和无规卷曲为主,含少量的β-折叠,间或有β-转角。
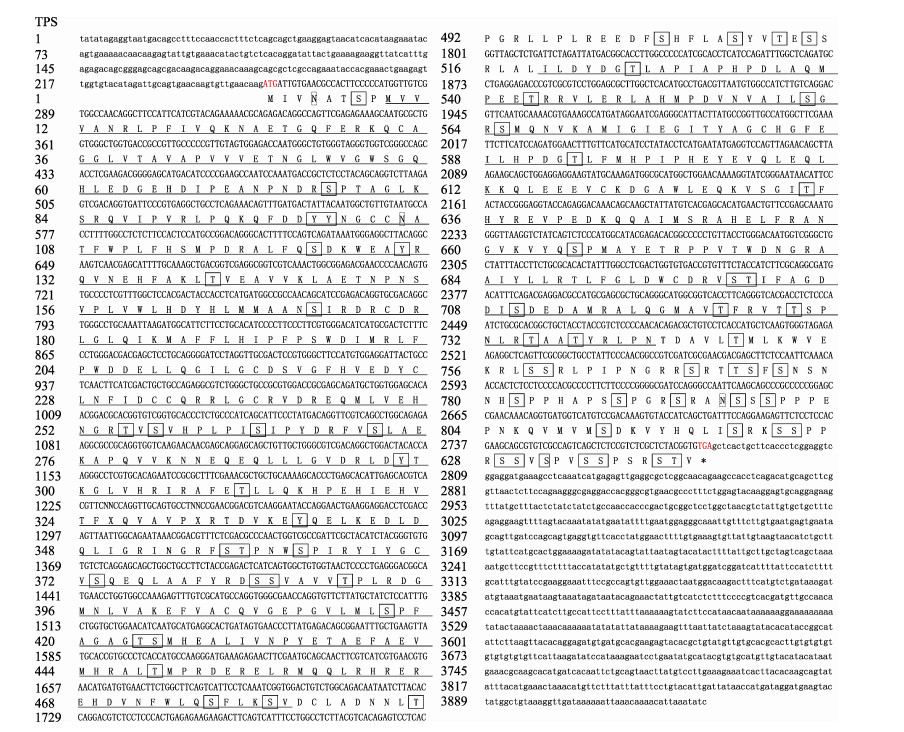
|
图 1 LvTPS基因cDNA序列和对应的氨基酸序列
Fig.1 cDNA and amino acid sequence of LvTPS

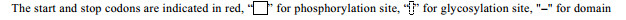
|

|
图 2 LvTPS的功能结构域 Fig.2 Functional domain of LvTPS |
利用NCBI BLASTP对LvTPS基因编码的氨基酸序列进行同源序列比对(图 3),发现LvTPS与其他甲壳动物如中国对虾、脊尾白虾、克氏原螯虾(Procambarus clarkia)、蓝蟹同源性较高,分别为63.73%、55.40%、55.40%和51.16%,与烟粉虱(Bemisia tabaci)、阿根廷蚁(Linepithema humile)、蜜蜂(Apis mellifera)、甜菜夜蛾(Spodoptera exigua)、棉铃虫(Helicoverpa armigera)、秀丽隐杆线虫(Caenorhabditis elegans)和大肠杆菌(Escherichia coli)同源性分别为38.91%、38.99%、38.43%、38.43%、26.34%、13.13%和12.81%。

|
图 3 TPS氨基酸序列比对 Fig.3 The alignment of TPS amino acid sequence TPS序列GenBank登录号:脊尾白虾(MK896805),克氏原螯虾(ASW35095.1),中国对虾(ACD74843.1),蓝蟹(ACL00655.1),烟粉虱(XP_018915964.1),阿根廷蚁(XP_012234592.1),蜜蜂(XP_026297280.1),秀丽隐杆线虫(AJ512333),大肠杆菌(EU070413),棉铃虫(DQ086235),甜菜夜蛾(EF051258) The GenBank accession numbers of TPS amino acid sequences are as follows: E. carinicauda (MK896805), P. clarkia (ASW35095.1), F. chinensis (ACD74843.1), C. sapidus (ACL00655.1), B. tabaci (XP_018915964.1), L. humile (XP_012234592.1), A. mellifera (XP_026297280.1), C. elegans (AJ512333), E. coli (EU070413)), H. armigera (DQ086235), S. exigua (EF051258) |
对TPS基因编码的蛋白序列进行系统进化分析结果显示(图 4),凡纳滨对虾与中国对虾亲缘关系最近,并与蓝蟹、脊尾白虾、克氏原螯虾等无脊椎动物聚为一支,脊椎动物单独聚为一支,符合系统进化学分类地位。

|
图 4 TPS系统进化发育树分析 Fig.4 The analysis of phylogenetic tree for TPS TPS序列GenBank登录号:阿根廷蚁(XP_012234592.1),蜜蜂(XP_026297280.1),棉铃虫(DQ086235),甜菜夜蛾(EF051258),烟粉虱(XP_018915964.1),秀丽隐杆线虫(AJ512333),大肠杆菌(EU070413),中国对虾(ACD74843.1),蓝蟹(ACL00655.1),脊尾白虾(MK896805),克氏原螯虾(ASW35095.1) The GenBank accession numbers of TPS amino acid sequences are as follows: L. humile (XP_012234592.1), A. mellifera (XP_026297280.1), H. armigera (DQ086235), S. exigua (EF051258), B. tabaci (XP_018915964.1), C. elegans (AJ512333), E. coli (EU070413), F. chinensis (ACD74843.1), C. sapidus (ACL00655.1), E. carinicauda (MK896805), P. clarkia (ASW35095.1) |
Real-time PCR分析显示,LvTPS在凡纳滨对虾的6种组织中均有表达,鳃和肌肉中的表达量基本相同,为最高; 眼柄、心脏和神经中次之,显著低于鳃和肌肉中的表达量(P < 0.05);肝胰腺中为最低,显著低于其他5种组织中的表达量(P < 0.05) (图 5)。

|
图 5 26℃时LvTPS在6种组织中的表达分布
Fig.5 Distribution of LvTPS in six tissues at 26℃
1:鳃; 2:肝胰腺; 3:眼柄; 4:心脏; 5:神经; 6:肌肉 标有不同字母的值之间差异显著(P < 0.05),下同 1: Gill; 2: Hepatopancreas; 3: Eye stalk; 4: Heart; 5: Nerve tissue; 6: Muscle Values marked with different letters are significantly different (P < 0.05). The same as below |
以26℃下的凡纳滨对虾为对照组,在不同温度胁迫下,LvTPS基因在凡纳滨对虾6种组织中的相对表达量见图 6。与对照组(26℃)下的凡纳滨对虾相比,水温升至32℃时,眼柄和心脏中的LvTPS基因显著上调表达(P < 0.05)。水温升至38℃时,鳃、肝胰腺、眼柄和心脏中LvTPS基因显著上调表达(P < 0.05),其中,在肝胰腺中表达量变化比较显著。之后随着温度的下降其表达量总体呈下调趋势。回温至32℃和26℃时,6种组织中LvTPS表达量与对照组均无显著性差异(P > 0.05)。在神经和肌肉中,不同温度胁迫下的LvTPS基因表达量没有显著变化(P > 0.05) (图 6)。

|
图 6 不同温度下LvTPS在6种组织中的表达分布 Fig.6 Distribution of LvTPS in six tissues at different temperatures |
研究表明,海藻糖由于其独特的化学性质,可以保护生物体免受不同的环境压力,包括高温、氧化、低温、缺氧或干燥(聂凌鸿等, 2001)。TPS是海藻糖生物合成途径的关键酶,生物在长期进化过程中,可通过提高海藻糖的含量来抵御逆境。本研究从凡纳滨对虾中获得TPS完整的ORF序列,预测的LvTPS氨基酸序列中有2个功能域(Glyco-transf-20和Trehalose_ PPase)。这不仅与中国对虾和脊尾白虾的预测结果相一致(Zhang et al, 2019a; Zhang et al, 2012),同时,与真核生物拟南芥(Arabidopsis thaliana)、黑腹果蝇(Drosophila melanogaster)、裂殖酵母(Schizosaccharomyces pombe)和水稻(Oryza sativa)的TPS功能域一致。而原核生物秀丽隐杆线虫和大肠杆菌只有1个功能域(Glyco-transf-20 domain) (张冰君等, 2008)。这可能与真核生物和原核生物在基因表达与调控时策略的不同有关。生物信息学分析表明,LvTPS具有糖基转移酶和海藻糖-磷酸酶活性,糖基转移酶的作用是合成双糖、寡糖和多糖。海藻糖-磷酸酶催化6-磷酸海藻糖去磷酸合成海藻糖和磷酸盐。
海藻糖广泛存在于低等植物、藻类、细菌、真菌、酵母、昆虫及无脊椎动物中,既是一种贮藏性糖类,又是应激代谢的重要产物(聂凌鸿等, 2001)。生物体对逆境胁迫的响应是一个非常复杂的生理生化过程,其中包括多种基因、多种生理机制的共同调控。海藻糖由于可与2个水分子结合形成玻璃态结构,具有很强的抗逆作用,在逆境条件下可稳定生物膜、蛋白质和核酸等细胞结构和生物大分子,显著提升生物的抗逆性,因此,近年来,成为了抗逆基因工程研究的重点。凡纳滨对虾是我国最重要的水产经济养殖品种之一。近年来,天气持续高温导致对虾患病及死亡率明显增加。TPS基因是凡纳滨对虾海藻糖合成过程的关键基因。摸清TPS基因在逆境胁迫条件下的表达水平变化,对于了解海藻糖在凡纳滨对虾逆境胁迫应答中的作用具有重要意义。本研究采用Real-time PCR技术检测了LvTPS基因在凡纳滨对虾温度胁迫时6种组织表达水平变化,结果表明,LvTPS在所有检测的组织中都有表达,表明这些组织都可以合成海藻糖,这与在蓝蟹、中国对虾和脊尾白虾中的发现一致(Chung, 2008; Zhang et al, 2019a; Zhang et al, 2012)。同时发现,温度升至38℃后,LvTPS在鳃、肝胰腺、眼柄和心脏4种组织中出现差异表达,说明LvTPS基因可能在对虾受到高温胁迫时发挥了应激调节作用。其中,在肝胰腺、眼柄和心脏中,LvTPS表达明显呈现出随温度变化先升高后降低的趋势,进一步证明,凡纳滨对虾LvTPS功能与温度胁迫过程密切相关。结果也表明,高温胁迫对LvTPS的诱导表达存在组织的特异性,这可能与不同组织的功能定位有关。其中,LvTPS在肝胰腺中的表达量变化最高,表明高温胁迫对凡纳滨对虾肝胰腺中的海藻糖合成水平影响较大,提示肝胰腺在对虾应对温度胁迫中发挥重要作用。另外,温度由26℃逐渐升温到32℃,表达水平没有发生显著变化的原因可能与32℃属于凡纳滨对虾自然海区水温有关,对凡纳滨对虾而言,这个温度改变构不成环境胁迫,不会启动应激响应机制。而在受到较高温度(38℃)胁迫时,TPS基因启动表达,应对环境胁迫。
近年来的研究发现,TPS表达水平的高低对生物体的抗逆能力和环境适应能力具有重要的影响。结合异色瓢虫(Harmonia axyridis)和德国小蠊(Blattella germanica)等昆虫的温度诱导研究结果发现,在低温或高温诱导情况下,TPS基因表达量均显著高于正常温度下的表达量(秦资等, 2012;陈静, 2015)。转染果蝇TPS基因的哺乳动物细胞海藻糖水平升高,以保护细胞免受缺氧损伤(Chen et al, 2002、2004; Chen et al, 2003)。在葱蝇(Delia antiqua)中,TPS基因表达量在滞育或打破滞育后的变化显著,滞育前期和后期的表达量较高,非滞育时期表达量较低(李源等, 2013),说明合成的海藻糖在协助昆虫抵御不良环境中发挥重要作用。近期,Zhang等(2019b)报道了家蝇(Musca domestica)TPS在受到大肠杆菌或金黄色葡萄球菌(Staphyloccocus aureus)侵袭后表达上调,推测TPS通过合成其产物海藻糖,参与家蝇的免疫防御。结合本研究中凡纳滨对虾受高温胁迫后组织中LvTPS表达明显升高,之后随温度降低,表达量又逐渐降低,再次说明LvTPS与凡纳滨对虾应对高温胁迫过程密切相关。但TPS表达量和海藻糖含量的相关性还有待于进一步研究,因为已有研究表明,TPS基因表达与海藻糖含量变化并不完全一致。例如,优雅蝈螽(Gampsocleis gratiosa)海藻糖合成酶基因GgTPS在15℃处理下表达量最高,而海藻糖含量在0℃处理下表达量最高(骞蕾阳等, 2017)。继续深入对LvTPS的研究,对凡纳滨对虾健康养殖和抗逆新品种选育具有一定意义。
Bai H, Du JF, Hu M, et al. Analysis of mechanisms of resistance and tolerance of Escherichia coli to enrofloxacin. Annals of Microbiology, 2012, 62(1): 293-298 |
Chen J, Zhang DW. Molecular cloning, tissue distribution and temperature-induced expression of two trehalose-6-phosphate synthase genes in Blattella germanica (Blattodea: Blattellidae). Acta Entomologica Sinica, 2015, 58(10): 1046-1053 [陈静, 张道伟. 德国小蠊两个海藻糖合成酶基因的克隆、组织分布及温度诱导表达分析. 昆虫学报, 2015, 58(10): 1046-1053] |
Chen Q, Behar KL, Tian X, et al. Expression of Drosophila trehalose-phosphate synthase in HEK-293 cells increases hypoxia tolerance. Journal of Biological Chemistry, 2003, 278(49): 49113-49118 DOI:10.1074/jbc.M308652200 |
Chen Q, Enbo M, Behar KL, et al. Role of trehalose phosphate synthase in anoxia tolerance and development in Drosophila melanogaster. Journal of Biological Chemistry, 2002, 277(5): 3274-3279 DOI:10.1074/jbc.M109479200 |
Chen Q, Haddad GG. Role of trehalose phosphate synthase and trehalose during hypoxia: From flies to mammals. Journal of Experimental Biology, 2004, 207(18): 3125 DOI:10.1242/jeb.01133 |
Cheng W, Chen JC. Effects of pH, temperature and salinity on immune parameters of the freshwater prawn Macrobrachium rosenbergii. Fish and Shellfish Immunology, 2000, 10(4): 387-391 DOI:10.1006/fsim.2000.0264 |
Chung JS. A trehalose 6-phosphate synthase gene of the hemocytes of the blue crab, Callinectes sapidus: Cloning, the expression, its enzyme activity and relationship to hemolymph trehalose levels. Saline Systems, 2008, 4(1): 18 DOI:10.1186/1746-1448-4-18 |
Ding ZQ, Feng YP. Discussion on the pathogenesis and prevention of prawn. Scientific Fish Farming, 2005(6): 64 [丁志起, 冯艳萍. 对虾发病规律与防治对策的探讨. 科学养鱼, 2005(6): 64] |
Elbein AD, Pan YT, Pastuszak I, et al. New insights on trehalose: A multifunctional molecule. Glycobiology, 2003, 13(4): 17-27 DOI:10.1093/glycob/cwg047 |
Gao WP, Tan BP, Mai KS, et al. Dentification of differentially expressed genes in hepatopancreas of white shrimp Litopenaeus vannamei induced by long-term low-salinity stress. Periodical of Ocean University of China (Natural Science), 2013, 43(9): 43-50 [郜卫华, 谭北平, 麦康森, 等. 长期低渗胁迫诱导凡纳滨对虾肝胰腺差异表达基因的研究. 中国海洋大学学报(自然科学版), 2013, 43(9): 43-50] |
Jiang T, Zhai H, Wang FB, et al. Cloning and characterization of a salt tolerance-associated gene encoding trehalose-6-phosphate synthase in sweet potato. Journal of Integrative Agriculture, 2014, 13(8): 1651-1661 DOI:10.1016/S2095-3119(13)60534-1 |
Jiang W, Fu FL, Zhang SZ, et al. Cloning and characterization of functional trehalose-6-phosphate synthase gene in Maize. Journal of Plant Biology, 2010, 53(2): 134-141 DOI:10.1007/s12374-010-9098-7 |
Kwon HB, Yeo ET, Hahn SE, et al. Cloning and characterization of genes encoding trehalose-6-phosphate synthase (TPS1) and trehalose-6-phosphate phosphatase (TPS2) from Zygosaccharomyces rouxii. FEMS Yeast Research, 2003, 3(4): 433-440 DOI:10.1016/S1567-1356(03)00035-7 |
Li Y, Hao YJ, Zhang YJ, et al. Cloning, bioinformatic analysis and diapauserelated expression of trehalose6-phosphate synthase gene from the onion maggot, Delia antiqua (Diptera: Anthomyiidae). Acta Entomologica Sinica, 2013, 56(4): 329-338 [李源, 赫友进, 张玉娟, 等. 葱蝇海藻糖6-磷酸合成酶基因的克隆、序列分析及滞育相关表达. 昆虫学报, 2013, 56(4): 329-338] |
Mu M, Lu XK, Wang JJ, et al. Erratum to: Genome-wide identification and analysis of the stress-resistance function of the TPS (Trehalose-6-Phosphate Synthase) gene family in cotton. BMC Genetics, 2016, 17(1): 1 DOI:10.1186/s12881-015-0265-z |
Nie LH, Ning ZX. Biological protection of trehalose. Chemistry of Life, 2001, 21(3): 206-209 [聂凌鸿, 宁正祥. 海藻糖的生物保护作用. 生命的化学, 2001, 21(3): 206-209 DOI:10.3969/j.issn.1000-1336.2001.03.017] |
Pan LQ. The effect of different acclimation temperatures on the prophenoloxidase system and other defence parameters in Litopenaeus vannamei. Fish and Shellfish Immunology, 2008, 25(1): 137-142 |
Qian LY, Kou XY, Dong ZH, et al. Effects of different temperature regimes on the expression of the trehalose-6-phosphate synthase gene and haemolymph sugar content in Gampsocleis gratiosa. Journal of Applied Entomology, 2017, 54(1): 56-67 [骞蕾阳, 寇晓艳, 董泽华, 等. 不同温度驯化策略诱导优雅蝈螽海藻糖合成酶基因表达及血淋巴糖类含量变化. 应用昆虫学报, 2017, 54(1): 56-67] |
Qin Z, Wang S, Wei P, et al. Molecular cloning and cold-induced expression of trehalose-6-phosphate synthase genes in Harmonia axyridis (Coleoptera: Coccinellidae). Acta Entomologica Sinica, 2012, 55(6): 651-658 [秦资, 王甦, 魏苹, 等. 异色瓢虫海藻糖合成酶基因的克隆及低温诱导表达分析. 昆虫学报, 2012, 55(6): 651-658] |
Tang B, Chen J, Yao Q, et al. Characterization of a trehalose-6-phosphate synthase gene from Spodoptera exigua and its function identification through RNA interference. Journal of Insect Physiology, 2010, 56(7): 813-821 DOI:10.1016/j.jinsphys.2010.02.009 |
Tang B, Wang S, Wang SG, et al. Invertebrate trehalose-6-phosphate synthase gene: Genetic architecture, biochemistry, physiological function, and potential applications. Frontiers in Physiology, 2018, 9: 30-30 DOI:10.3389/fphys.2018.00030 |
Uyar EO, Yücel M, Hamamcı H. Cloning and expression of trehalose-6-phosphate synthase 1 from Rhizopus oryzae. Journal of Basic Microbiology, 2015, 56(5): 459-468 |
Wang GL, Zhao G, Feng YB, et al. Cloning and comparative studies of seaweed trehalose-6-phosphate synthase genes. Marine Drugs, 2010, 8(7): 2065-2079 DOI:10.3390/md8072065 |
Wu X, Hou Z, Huang C, et al. Cloning, purification and characterization of trehalose-6-phosphate synthase from Pleurotus tuoliensis. PeerJ, 2018, 6(7): e5230 |
Wyban J, Walsh WA, Godin DM. Temperature effects on growth, feeding rate and feed conversion of the Pacific white shrimp (Penaeus vannamei). Aquaculture, 1995, 138(1): 267-279 |
Yang F, Cai Q, Ye FX, et al. A demonstration of closed-type ecological farming of Penaeus vannamei. Journal of Fisheries of China, 2001(11): 56-59 [杨锋, 蔡强, 叶妃轩, 等. 关于南美白对虾的养殖技术之一南美白对虾封闭式生态养殖试验示范. 中国水产, 2001(11): 56-59 DOI:10.3969/j.issn.1002-6681.2001.11.043] |
Zhang BJ, Xuan JS. Electron cloning of full-length cDNA of 6-phosphate trehalose synthase gene from seaweed. Bioinformatics, 2008(1): 8-10 [张冰君, 宣劲松. 条斑紫菜6-磷酸海藻糖合成酶基因全长cDNA的电子克隆. 生物信息学, 2008(1): 8-10] |
Zhang J, Li F, Sun Y, et al. A trehalose-6-phosphate synthase gene from Chinese shrimp, Fenneropenaeus chinensis. Molecular Biology Reports, 2012, 39(12): 10219-10225 DOI:10.1007/s11033-012-1897-0 |
Zhang J, Liu Y, Zhou Y, et al. Cloning of a trehalose-6-phosphate synthase gene from Exopalaemon carinicauda and its expression response to bacteria challenge. Fish and Shellfish Immunology, 2019a, 93: 387-394 DOI:10.1016/j.fsi.2019.07.046 |
Zhang Y, Wang F, Feng Q. Involvement of trehalose-6-phosphate synthase in innate immunity of Musca domestica. Developmental and Comparative Immunology, 2019b, 91: 85-92 DOI:10.1016/j.dci.2018.10.010 |




