细胞是生物体结构和功能的基本单位,由具有一定形态、在细胞内执行特定功能的亚细胞组分构成,包括细胞膜、细胞质、细胞器、细胞核等。亚细胞组分是细胞内生理代谢反应的主要场所,分布着许多重要的生化代谢酶。目前,关于亚细胞组分的生化组成、特定功能和超微结构等研究已成为热点(赵艳芳等, 2013; 陈扬等, 2017: Jadot et al, 2017),而亚细胞组分分离技术则是研究的前提与关键,主要的分离方法有超速离心、电泳(Heidrich et al, 1976; Islinger et al, 2011)、亲和纯化(Vitale et al, 1998; Takemoto et al, 2002; Merino et al, 2012)等,其中,超速离心是最常用的亚细胞组分分离技术(贺芳等, 2005)。在哺乳动物中,通过超速离心已能分离出细胞核、细胞膜、细胞质、线粒体、微粒体、溶酶体等多种亚细胞组分。同时,采用标志酶、蛋白质印迹、电镜观察等方法,建立了亚细胞组分种类鉴定、纯度分析的技术方法(Fleischer et al, 1974; Cooper et al, 2010; Lieb et al, 2010)。王伟等(2012)用超速离心法从新生大鼠(Rattus norvegicus)右侧大脑皮质组织中分离得到线粒体和胞浆2种亚细胞组分,并通过测定凋亡蛋白Smac、Diablo蛋白在其中的表达,探究大鼠H/I后神经元Smac/Diablo的亚细胞器转移与神经元凋亡的作用机制;Jiang等(2004)离心分离了大鼠肝脏粗制线粒体、纯化线粒体、胞质等亚细胞组分,通过亚细胞蛋白质组学分析,鉴定了共564个蛋白质,又根据物理化学特征和功能对其进行了详细的生物信息学注释;Kiri等(2005)通过蔗糖密度梯度离心得到高度富集的牛心脏线粒体,发现了来自不同年龄牛心脏的线粒体制剂的蛋白质谱存在显著差异。
目前,贝类亚细胞组分分离技术和功能研究也受到广泛关注。Keiichi等(2013)从长牡蛎(Crassostrea gigas)和日本蚬(Corbicula japonica)组织中离心分离了线粒体、微粒体,通过体外实验发现这2种亚细胞组分提取物在冈田酸酰化反应中起到关键作用;Livingstone等(1984)分离了紫贻贝(Mytilus edulis)微粒体、线粒体、细胞质等亚细胞组分,但仅在微粒体及线粒体中检测到混合功能氧化酶(MFO)及苯并[a]芘(BaP)代谢相关酶酶活性;Siebert等(2017)离心分离了牡蛎(Crassostrea brasiliana)鳃和消化盲囊的微粒体、细胞质,也仅在微粒体中检测到乙氧基脱嘌呤O-脱乙酰酶(EROD)的活性。目前,获得贝类亚细胞组分的方法仍主要参照哺乳动物亚细胞组分分离方法的研究,通过超速离心能够获得细胞核、细胞质、线粒体、微粒体等亚细胞组分中的1~2个组分,但之后极少有开展亚细胞组分种类鉴定及纯度分析的研究,因此分离效率低,准确性难以保证。
本研究以栉孔扇贝(Chlamys farreri)为对象,在已有的哺乳动物和贝类亚细胞组分分离技术的基础上,依据栉孔扇贝消化盲囊特有的组织细胞特征,开展组织匀浆液制备和检验技术的研究,探究贝类亚细胞组分超速离心分离与鉴定技术,不仅可为贝类亚细胞组分的生理功能研究提供技术支持,也可为贝类亚细胞组分标准化分离技术提供科学依据。
1 材料与方法 1.1 实验材料实验所用栉孔扇贝于2018年4月购自山东省青岛市崂山区沙子口养殖场,壳高为(6.15±0.50) cm。采用青岛近海自然海水暂养10 d,温度为(18±1)℃,海水盐度为31,pH为8.1,连续充气,日换水量为1/2,投喂螺旋藻粉,日投饵量为3 mg/L。
1.2 实验方法 1.2.1 消化盲囊组织匀浆液的制备配制匀浆缓冲液,A液:0.02 mol/L Tris、0.15 mol/L KCl、1 mmol/L DTT、0.5 mol/L蔗糖,pH调至7.7,于4℃保存;B液:150 mmol/L MgCl2,于4℃保存;C液:100 mmol/L PMSF,于-20℃保存。
选择健康、活力强的栉孔扇贝,解剖并称取消化盲囊组织2 g,剪碎后,放入预冷的玻璃匀浆器中,加入10 ml A液、100 μl B液和10 μl C液,4℃冰水浴下研磨,经预实验设置匀浆时间分别为2、3、4、5 min,然后采用医用纱布挤压过滤,滤液放入预冷的15 ml离心管中。
1.2.2 细胞裂解率检验取100 μl过滤液,用匀浆缓冲液A液稀释10倍。再取100 μl稀释后的过滤液,加入100 μl 10 μg/ml的Hoechst工作液,混匀,暗处理10 min,之后,取2.5 μl均匀涂片,在荧光显微镜(Nikon50i,蓝色滤光片,荧光激发光波长为346~ 352 nm,发射波长为460~461 nm)下观察细胞形态及大小,以匀浆2 min染色结果为对照组,其他匀浆时间与之比较,观察完整细胞形态并计数。
吸取2.5 μl上述稀释的匀浆液,滴于血球计数板上,在荧光显微镜光镜下(10×40倍)观察细胞形态并计数。细胞破碎率公式:破碎率(%)=1-实验组完整细胞个数/对照组完整细胞个数,当破碎率达90%以上时,视为匀浆质量良好,可用于亚细胞组分的分离实验。
1.2.3 消化盲囊亚细胞组分的分离参照Livingstone等(1984)和Song等(2006)的分离方法,并根据预实验情况对缓冲液和具体离心步骤进行调整和优化,所有分离过程温度均控制在0℃~4℃,具体操作步骤如图 1所示。
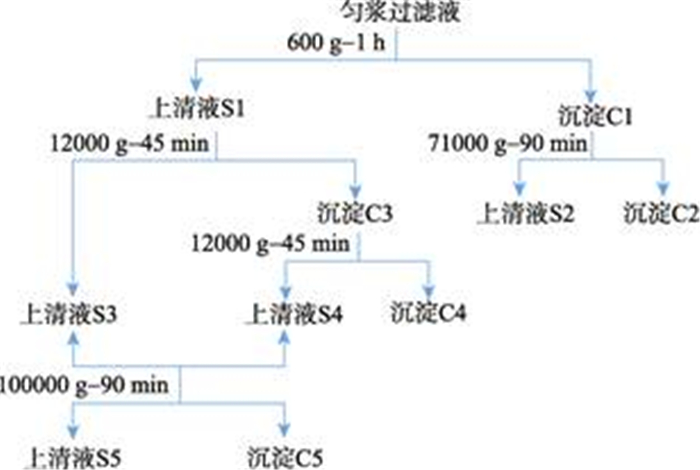
|
图 1 栉孔扇贝消化盲囊亚细胞组分分离流程 Fig.1 Subcellular fraction centrifugation process of digestive glands tissues ofC. farreri |
取匀浆质量良好的过滤液10 ml,加入10 μl C液,混匀,于600×g离心1 h,分离上清液S1和沉淀C1。C1中加入0.5 ml D液和4.5 ml E液重悬,重悬液于71000×g离心90 min,分离上清液S2和沉淀C2。S1于12000×g离心45 min,分离获得上清液S3和沉淀C3,C3加入2 ml匀浆缓冲液重悬,于12000×g离心45 min,分离获得沉淀C4和上清液S4,S4与S3合并后于100000×g下离心90 min,分离获得上清液S5和沉淀C5。沉淀C2、C4、C5中加入2 ml储备缓冲液F液和0.4 g储备缓冲液G液,悬浮沉淀,置于-80℃保存。
离心步骤中用到的缓冲液配方如下,D液:0.3 mol/L蔗糖溶液、50 mmol/L Tris、1.5 mmol/L MgCl2,pH 7.7;E液:1.98 mol/L蔗糖溶液、50 mmol/L Tris、1.5 mmol/L MgCl2,pH 7.7;F液:20 mmol/L Tris、1 mmol/L DTT,pH 7.7,均在4℃保存;G液:甘油。
1.2.4 细胞核纯度及活性检验取S2、C2、C4、S5和C5各100 μl,稀释10倍后,分别按1.2.2中步骤进行Hoechst染色,在荧光显微镜下观察细胞核形态和大小。
1.2.5 亚细胞组分标志酶的活性测定按照Beneking等(1978),测定细胞膜标志酶5'-核苷酸酶(5'-NT);参照Storrie等(1990),测定细胞质标志酶乳酸脱氢酶(LDH);依据Klaassen等(1969),测定微粒体标志酶葡萄糖-6-磷酸酶(G-6-Pase);采用南京建成试剂盒,测定线粒体标志酶琥珀酸脱氢酶(SDH)。蛋白质含量的测定按照Bradford(1976),以牛血清白蛋白(BSA)为标准蛋白。
1.3 数据处理与分析所有实验数据均以4个平行组数据的平均值±标准差(Means±SD)表示,采用SPSS 22.0软件进行单因素方差分析(One-way ANOVA)、差异显著性分析用Duncan检验法,以P < 0.05表示差异显著,P > 0.05表示差异不显著。
2 结果 2.1 栉孔扇贝消化盲囊组织细胞匀浆与检验技术由图 2可以看出,Hoechst 33258染色后,在荧光显微镜下,消化盲囊组织在匀浆后完整,细胞形态饱满,呈圆形或椭圆形,细胞膜完整,荧光强度较强;而破碎细胞形态较小,荧光强度弱,细胞轮廓模糊。在匀浆2 min对照组中,可以观察到大量完整的细胞,随着匀浆时间的增加,完整细胞个数减少,荧光强度弱的颗粒数增加,匀浆5 min实验组中基本没有完整细胞的存在。随着匀浆时间(2~5 min)的增加,栉孔扇贝消化盲囊组织细胞破碎率升高,以匀浆2 min为对照组,匀浆时间为5 min时,细胞破碎率达到94.24% (表 1)。

|
图 2 在不同匀浆时间下的栉孔扇贝消化盲囊细胞Hoechst 33258染色 Fig.2 Hoechst 33258 staining of digestive gland cells of C. farreri at different homogenization time |
|
|
表 1 栉孔扇贝消化盲囊在不同匀浆时间下细胞破碎率 Tab.1 Broken rate of digestive gland cells of C. farreri at different homogenization time |
将栉孔扇贝消化盲囊亚细胞分离组分(S2、C2、C4、S5和C5)进行Hoechst 33258染色,在荧光显微镜下观察,C2组分荧光强度最强,视野中荧光颗粒数多,颗粒间粘黏比例低,说明细胞核提纯质量较好(图 3);其他组分荧光强度弱,基本观察不到荧光颗粒。因此,细胞核主要存在于C2组分中,其他组分中不存在细胞核。

|
图 3 栉孔扇贝消化盲囊亚细胞组分的Hoechst 33258染色 Fig.3 Hoechst 33258 staining of digestive glands subcellular fractions of C. farreri A: S2; B: C2; C: C4; D: S5; E: C5 |
由表 2可知,细胞膜(5'-NT)、线粒体(SDH)、微粒体(G-6-Pase)和细胞质(LDH)标志酶在栉孔扇贝消化盲囊亚细胞组分(S2、C2、C4、S5和C5)中显示有不同的分布,其中,5'-NT、SDH、LDH和G-6-Pase分别在S2、C4、S5和C5组分中占有高比例(63.90%、64.89%、77.82%和67.55%)的标志酶活性(图 4),由此推测,S2、C4、S5和C5分离组分分别为细胞膜、细胞质、线粒体和微粒体。虽然4种亚细胞组分标志酶在C2中均有微量检出,但结合细胞核Hoechst 33258染色结果,确定为细胞核。综合标志酶检测和Hoechst 33258染色细胞核的结果,本实验得到的S2、C2、C4、S5和C5分别为细胞膜、细胞核、线粒体、细胞质和微粒体。
|
|
表 2 栉孔扇贝消化盲囊亚细胞组分标志酶分布 Tab.2 Distribution of marker enzymes in subcellular fractions of digestive glands of C.farreri |

|
图 4 栉孔扇贝消化盲囊的5种亚细胞组分中标志酶活性比例
Fig.4 Distribution of marker enzymes in five subcellular fractions of digestive glands tissues of C. farreri
以栉孔扇贝消化盲囊亚细胞各分离组分(S2、C2、C4、S5和C5)标记酶活性总和为参照,计算各分离组分所占标记酶活性的比例。同一颜色柱子标有不同上标字母表示差异显著(P < 0.05)
The total activity of marker enzymes in subcellular fractions (S2, C2, C4, S5, and C5) of digestive glands of C. farreri was used as a reference to calculated the proportions of the marker enzymes activity in each isolated fraction. Different letters in the column of the same color indicate significant differences (P < 0.05) |
动物组织细胞匀浆质量直接关系到亚细胞组分的充分释放和完整程度,实验材料处理方法、匀浆方法和匀浆介质等是影响组织匀浆质量的重要因素。新鲜动物肝脏是亚细胞组分分离的最佳材料(Mootha et al, 2003; Kikuchi et al, 2004; Li et al, 2004; Bagshaw et al, 2005),但有时因为实验条件限制,低温冷冻的实验材料也被用来离心分离亚细胞组分(Hoffmann et al, 2005)。Song等(2006)研究显示,小鼠(Mus musculus)冷冻肝脏制备的亚细胞组分回收率显著低于新鲜肝脏组和冷冻均质肝脏组。Nielsen等(2005)研究显示,冷冻处理导致细胞核破碎释放DNA,会引起其他膜系细胞器的聚集,不利于细胞膜和其他亚细胞组分的分离。因此,不建议冷冻肝脏用于亚细胞组分分离研究。此外,还应根据待均质化的组织类型和实验的具体目的,合理选择玻璃匀浆、过滤、研磨、超声处理、酶溶解等匀浆方法。本研究以新鲜栉孔扇贝消化盲囊组织作为实验材料,采用玻璃匀浆法研磨组织细胞,整个匀浆、分离过程严格控制实验温度在0℃~4℃,亚细胞组分分离效果好、损伤小。
动物组织匀浆介质的选择和制备要考虑渗透压、pH、蛋白质保护剂等条件,这对于亚细胞组分的分离及完整性至关重要。已有研究表明,在蔗糖溶液中加入低浓度的Ca2+或Mg2+可防止细胞核团簇(Anderson et al, 1951; Hogeboom et al, 1952),但Ca2+、Mg2+的存在对线粒体的功能有害(Graham et al, 2006);因而,在匀浆缓冲液中加入100 mmol/L KCl,或在细胞核分离步骤完成后,往上清液中加入EDTA,可平衡Ca2+、Mg2+等引起的核粘连以及核和其他碎片粘连(费一楠等, 2007)。本研究中,栉孔扇贝消化盲囊组织细胞匀浆缓冲液已经过预实验优化,结果显示,匀浆液中不加细胞核稳定剂MgCl2,会发生细胞核大面积团簇现象,而加入MgCl2的实验组,得到的细胞核分散、形态清晰、个体完整,这与上述一些研究结果类似。与Livingstone等(1984)在紫贻贝上和Siebert等(2017)在牡蛎上所用匀浆缓冲液相比,其优点在于能更好地保护膜蛋白,且协调了MgCl2能减少细胞核破裂、结块的优点和影响其他细胞器功能缺点之间的矛盾。
3.2 贝类组织细胞匀浆破碎率检验方法目前,动物组织细胞匀浆破碎率大多利用形态学手段如台盼蓝染色(Lepvrier et al, 2017)、相差显微镜观察(Huber et al, 2003)等方法检验,通过测定完整细胞的数量和观察细胞核的聚集情况,来评估均质化的质量,但这些方法存在观察结果模糊、对比不明显等缺点。Hoechst 33258是一种毒性较低的蓝色荧光染料,因其能穿透细胞膜与核酸结合,常用于细胞凋亡检测和活细胞标记(谢兴文等, 2012; 吴彪等, 2013; 王净等, 2015)。本研究利用Hoechst 33258染色的特性,通过该方法观察不同匀浆时间里的完整细胞数量,结果显示,经玻璃匀浆5 min时完整细胞数目最少,匀浆效果较好。同时,将Hoechst 33258染色结果与血球计数板计数结果进行比较,验证了Hoechst 33258染色法检验匀浆破碎率的可行性。由此,建立了栉孔扇贝(贝类)消化盲囊组织细胞匀浆破碎率Hoechst 33258染色检验方法。
3.3 贝类组织亚细胞组分鉴定与纯度分析亚细胞组分分离技术在过去的几十年中得到了很大完善,同时,也发展出了一系列提纯亚细胞组分的方法,如重复洗涤、密度梯度离心或其他蛋白质纯化程序(Pasquali et al, 1999),但要得到纯净的亚细胞组分仍然是现在细胞生物学中很难实现的目标。提纯亚细胞组分的每一步操作都以损失亚细胞组分的活性为代价,因此,分离纯化亚细胞组分的纯度只要达到实验要求即可。
标志酶、蛋白质印迹、电镜观察等方法是常用的动物组织细胞亚细胞组分鉴定与纯度分析方法(Fleischer et al, 1974; Cooper et al, 2010; Lieb et al, 2010),其中,标志酶法通过检测各个亚细胞分离组分的标志酶活性大小和酶活性贡献比率,获得亚细胞组分纯度和分布信息(Andreyev et al, 2010),如某一目标亚细胞组分中检测到有对应的标记酶以外的其他标志酶活性,则表明存在其他亚细胞组分,通过计算标记酶的酶活性贡献比率,可以得到亚细胞组分富集和分布情况。Siebert等(2017)未对牡蛎消化盲囊组织离心得到的微粒体和细胞质进行鉴定和纯度分析,难以保证实验精确性;Livingstone等(1984)利用琥珀酸脱氢酶(SDH)、葡萄糖-6-磷酸酶(G6PASE)、丙酮酸激酶(PK)对紫贻贝消化盲囊线粒体、细胞质、微粒体进行鉴定,且用标志酶活性大小表示它们的富集情况,结果显示,G6PASE酶活性在分离得到的其他几个组分中都有较高的检出,微粒体富集程度不理想。
本研究通过5'-核苷酸酶、琥珀酸脱氢酶、乳酸脱氢酶和葡萄糖-6-磷酸酶鉴定了细胞膜、线粒体、细胞质、微粒体4种亚细胞组分的种类,且通过标志酶活力大小和酶活性贡献比率显示4种标志酶分别在S2、C4、S5和C5组分中占有高比例(63.90%、64.89%、77.82%和67.55%)的标志酶活性。由此确定,S2、C2、C4、S5和C5组分分别为细胞膜、细胞核、细胞质、线粒体和微粒体。另外,本研究将分离组分(S2、C2、C4、S5和C5)用Hoechst 33258染色,镜检发现,C2组分荧光强度最强,荧光颗粒数目多,其他组分荧光强度微弱,荧光颗粒数目稀少,由此推出细胞核存在于C2组分中。由此说明,本研究不仅分离、鉴定出5个栉孔扇贝消化盲囊组织亚细胞组分,还获得了活性良好的细胞核,充分证明本研究建立的栉孔扇贝组织细胞亚细胞组分分离、鉴定方法是可行的,对于贝类组织细胞亚细胞组分分离鉴定和生理机制研究具有重要意义。
Anderson NG, Wilbur KM. Studies on isolated cell components: Ⅱ. The release of a nuclear gel by heparin. Journal of General Physiology, 1951, 34(5): 647-655 DOI:10.1085/jgp.34.5.647 |
Andreyev AY, Shen Z, Guan Z, et al. Application of proteomic marker ensembles to subcellular organelle identification. Molecular and Cellular Proteomics, 2010, 9(2): 388-402 DOI:10.1074/mcp.M900432-MCP200 |
Bagshaw RD, Mahuran DJ, Callahan JW. A proteomic analysis of lysosomal integral membrane proteins reveals the diverse composition of the organelle. Molecular and Cellular Proteomics, 2005, 4(2): 133-143 DOI:10.1074/mcp.M400128-MCP200 |
Beneking M, Schmidt H, Weiss G. Subcellular distribution of a factor inactivating tyrosine aminotransferase. FEBS Journal, 1978, 82(1): 235-243 |
Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1-2): 248-254 DOI:10.1016/0003-2697(76)90527-3 |
Chen Y, Yu L. Research progress of membranous organelles and their subcellular structures in China. Chinese Science Bulletin, 2017, 62(19): 2055-2062 DOI:10.1360/N972016-01068 |
陈扬, 俞立. 膜性细胞器及其亚结构的动态调控机制国内研究进展. 科学通报, 2017, 62(19): 2055-2062 |
Cooper S, Hare L, Campbell PG. Subcellular partitioning of cadmium in the freshwater bivalve, Pyganodon grandis, after separate short-term exposures to waterborne or diet- borne metal. Aquatic Toxicology, 2010, 100(4): 303-312 |
Fei YN, Zhang Z, Cao C, et al. The culture of tobacco suspension cells and the isolation of organelles. Journal of Capital Normal University (Natural Science), 2007, 28(2): 68-74 |
费一楠, 张钊, 曹聪, 等. 烟草悬浮系培养与细胞器的分离. 首都师范大学学报(自然科学版), 2007, 28(2): 68-74 DOI:10.3969/j.issn.1004-9398.2007.02.015 |
Fleischer S, Kervina M. Subcellular fractionation of rat liver. Methods in Enzymology, 1974, 31(Pt A): 6-41 |
Graham J, Harris JR. Isolation and functional analysis of organelles. Cell Biology Protocols. John Wiley and Sons, Ltd, 2006, 87-151 |
He F, He DC. The development of the techniques of subcellular isolation. Modern Instruments, 2005, 11(2): 1-5 |
贺芳, 何大澄. 亚细胞器分离纯化技术的发展. 现代仪器, 2005, 11(2): 1-5 DOI:10.3969/j.issn.1672-7916.2005.02.001 |
Heidrich HG, Dew ME. Preparative free-flow electrophoresis for the isolation of membrane, organelle and cell fractions from rabbit kidney cortex. Current Problems in Clinical Biochemistry, 1976, 6(S2): 108-112 |
Hoffmann K, Blaudszun J, Brunken C, et al. New application of a subcellular fractionation method to kidney and testis for the determination of conjugated linoleic acid in selected cell organelles of healthy and cancerous human tissues. Analytical and Bioanalytical Chemistry, 2005, 381(6): 1138-1144 DOI:10.1007/s00216-004-3009-z |
Hogeboom GH, Schneider WC, Striebich MJ. Cytochemical studies Ⅴ. On the isolation and biochemical properties of liver cell nuclei. Journal of Biological Chemistry, 1952, 196(196): 111-120 |
Huber LA, Pfaller K, Vietor I. Organelle proteomics: Implications for subcellular fractionation in proteomics. Circulation Research, 2003, 92(9): 962-968 DOI:10.1161/01.RES.0000071748.48338.25 |
Islinger M, Kirsch J, Angermüller S, et al. Subcellular fractionation of brain tissue using free-flow electrophoresis. Neuroproteomics, 2011 in Li K. (eds) Neuroproteomics. Neuromethods, vol 57. Humana Press, Totowa, NJ
|
Jadot M, Boonen M, Thirion J, et al. Accounting for protein subcellular localization: A compartmental map of the rat liver proteome. Molecular and Cellular Proteomics, 2017, 16(2): 194 DOI:10.1074/mcp.M116.064527 |
Jiang XS, Zhou H, Zhang L, et al. A high-throughput approach for subcellular proteome identification of rat liver proteins using subcellular fractionation coupled with two-dimensional liquid chromatography tandem mass spectrometry and bioinformatic analysis. Molecular and Cellular Proteomics, 2004, 3(5): 441 DOI:10.1074/mcp.M300117-MCP200 |
Keiichi K, Tatsuya O, Ryuichi W, et al. In vitro acylation of okadaic acid in the presence of various bivalves' extracts. Marine Drugs, 2013, 11(2): 300-315 |
Kikuchi M, Hatano N, Yokota S, et al. Proteomic analysis of rat liver peroxisome: Presence of peroxisome-specific isozyme of Lon protease. Journal of Biological Chemistry, 2004, 279(1): 421-428 DOI:10.1074/jbc.M305623200 |
Kiri AN, Tran HC, Drahos KL, et al. Proteomic changes in bovine heart mitochondria with age: Using a novel technique for organelle separation and enrichment. Journal of Biomolecular Techniques, 2005, 16(4): 371 |
Klaassen CD, Plaa GL. Comparison of the biochemical alterations elicited in livers from rats treated with carbon tetrachloride, chloroform, 1, 1, 2-trichloroethaneand 1, 1, 1-trichloroethane. Biochemical Pharmacology, 1969, 18(8): 2019-2027 DOI:10.1016/0006-2952(69)90299-8 |
Lepvrier E, Martin S, Collet B. Production of the non-apoptotic metalloprotease-cleaved CD95L and its cytotoxic recombinant counterpart designed Ig-CD95L. Methods in Molecular Biology, 2017, 1557: 1-10 |
Li KW, Hornshaw MP, van der Schors RC, et al. Proteomics analysis of rat brain postsynaptic density: Implications of the diverse protein functional groups for the integration of synaptic physiology. Journal of Biological Chemistry, 2004, 279(2): 987-1002 DOI:10.1074/jbc.M303116200 |
Lieb B, Gebauer W, Gatsogiannis C, et al. Molluscan mega- hemocyanin: An ancient oxygen carrier tuned by a 550 kDa polypeptide. Frontiers in Zoology, 2010, 7(1): 14 |
Livingstone DR, Farrar SV. Tissue and subcellular distribution of enzyme activities of mixed- function oxygenase and benzo [a] pyrene metabolism in the common mussel Mytilus edulis L. Science of the Total Environment, 1984, 39(3): 209-235 DOI:10.1016/0048-9697(84)90080-9 |
Merino V, Kumar NS. Isolation, affinity purification and biochemical characterization of a lysosomal cathepsin D from the deuterostome Asterias rubens. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2012, 161(3): 240-246 DOI:10.1016/j.cbpb.2011.11.013 |
Mootha VK, Bunkenborg J, Olsen JV, et al. Integrated analysis of protein composition, tissue diversity, and gene regulation in mouse mitochondria. Cell, 2003, 115(5): 629-640 DOI:10.1016/S0092-8674(03)00926-7 |
Nielsen PA, Olsen JV, Podtelejnikov AV, et al. Proteomic mapping of brain plasma membrane proteins. Molecular and Cellular Proteomics, 2005, 4(4): 402-408 DOI:10.1074/mcp.T500002-MCP200 |
Pasquali C, Fialka I, Huber LA. Subcellular fractionation, electromigration analysis and mapping of organelles. Journal of Chromatography B: Biomedical Sciences and Applications, 1999, 722(1-2): 89-102 DOI:10.1016/S0378-4347(98)00314-4 |
Siebert MN, Mattos JJ, Piazza CE, et al. Characterization of ethoxyresorufin O-deethylase activity (EROD) in oyster Crassostrea brasiliana. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2017, 203: 115-121 DOI:10.1016/j.cbpb.2016.10.002 |
Song Y, Hao Y, Sun A, et al. Sample preparation project for the subcellular proteome of mouse liver. Proteomics, 2006, 6(19): 5269-5277 DOI:10.1002/pmic.200500893 |
Storrie B, Amadden E. Isolation of subcellular organelles. Methods in Enzymology, 1990, 182: 203-225 DOI:10.1016/0076-6879(90)82018-W |
Takemoto M, Asker N, Gerhardt H, et al. A new method for large scale isolation of kidney glomeruli from mice. American Journal of Pathology, 2002, 161(3): 799-805 DOI:10.1016/S0002-9440(10)64239-3 |
Vitale N, Horiba K, Ferrans VJ, et al. Localization of ADP-ribosylation factor domain protein 1 (ARD1) in lysosomes and Golgi apparatus. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(15): 8613-8618 DOI:10.1073/pnas.95.15.8613 |
Wang J, Han YP, Yang RF, et al. Optimization of labeling and localizing bacterial membrane and nucleus with FM4-64 and Hoechst dyes. Acta microbiologica Sinica, 2015, 55(8): 1068-1073 |
王净, 韩延平, 杨瑞馥, 等. FM4-64和Hoechst染料在活细菌胞膜和拟核标记定位中的条件优化与应用. 微生物学报, 2015, 55(8): 1068-1073 |
Wang W, Wang J, Xue L. Expression of Smac/Diablo in neonatal rats with hypoxic-ischemic brain damage and protective mechanism of Shenfu injection. Apoplexy and Nervous Diseases, 2012, 29(9): 790-793 |
王伟, 王军, 薛莉. HIBD新生大鼠线粒体凋亡蛋白Smac/Diablo的亚细胞器表达及参附注射液的干预作用. 中风与神经疾病, 2012, 29(9): 790-793 |
Wu B, Yu T, Yang AG, et al. Cytological observations on fertilization of Scapharca broughtonii from China and Korea. Progress in Fishery Sciences, 2013, 34(5): 64-68 |
吴彪, 于涛, 杨爱国, 等. 不同地理群体魁蚶杂交受精过程的荧光观察. 渔业科学进展, 2013, 34(5): 64-68 DOI:10.3969/j.issn.1000-7075.2013.05.010 |
Xie XW, Hou FY, Li N, et al. Hoechst33342 for labeling rat bone marrow mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research, 2012(49): 9146-9151 |
谢兴文, 侯费祎, 李宁, 等. Hoechst33342对大鼠骨髓间充质干细胞的标记. 中国组织工程研究, 2012(49): 9146-9151 |
Zhao YF, Shang DR, Ning JS, et al. Subcellular distributions of trace metals in Sargassum fusiforme. Progress in Fishery Sciences, 2013, 34(6): 118-123 |
赵艳芳, 尚德荣, 宁劲松, 等. 羊栖菜中微量金属元素的亚细胞分区分布. 渔业科学进展, 2013, 34(6): 118-123 DOI:10.3969/j.issn.1000-7075.2013.06.018 |



