2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家 实验室海洋渔业科学与食物产出过程功能实验室 农业农村部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao); Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity, Qingdao 266071
致急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease, AHPND)是近5年来严重危害全球对虾养殖业发展的疫病之一,该病是由携带pirVP基因的弧菌引起的一类细菌性疾病。目前,已报道的致AHPND弧菌包括副溶血弧菌(Vibrio parahaemolyticus)、坎贝氏弧菌(V. campbelli)、欧文氏弧菌(V. owensii)等(贾丹等, 2018)。本研究所用副溶血弧菌为本实验室在2013年从广西患AHPND的凡纳滨对虾(Litopenaeus vannamei)中分离出1株致病性副溶血弧菌(AHPND-causing Vibrio parahaemolyticus, VpAHPND),编号为20130629002S01。该菌对卤虫无节幼体的半致死浓度(LD50)为2.58×105 CFU/ml(王娜等, 2016; 陈蒙蒙等, 2018)。
益生菌是指在一定浓度范围内能够提高机体健康的活性微生物制剂,作为抗生素及化学药剂的替代品,在医学、食品、养殖等领域已经得到了快速的发展(Balcázar et al, 2006)。益生菌在水产养殖过程中的作用机理有以下几个方面:一是通过细菌自身代谢分解食物或产生消化酶提高机体消化能力; 二是竞争性抑制,通过竞争营养、附着位点或合成、分泌抗菌活性因子等来抑制有害微生物的繁殖; 三是通过降低水体中的氨氮等有害物质改善养殖水环境; 四是通过增强机体免疫功能来提高抗病能力等(Thompson et al, 1999; Balcázar et al, 2006)。高戈等(2017)使用巨大芽孢杆菌(Bacillus magaterium)进行凡纳滨对虾生物絮团养殖实验,养殖结束时,添加巨大芽孢杆菌组的对虾体长、体重均显著高于其他2组。张盛静等(2015)研究发现,在饲料中添加单一益生菌或复合益生菌均可显著提高对虾抗副溶血弧菌感染的能力,且复合益生菌的保护效果更佳。
芽孢杆菌在水产养殖中的应用较为广泛。刘观斌等(2015)在养殖水体中泼洒适当浓度的枯草芽孢杆菌(B. subtilis)可以改善水质,提高罗非鱼机体的免疫力、抗氧化能力,进而提高罗非鱼抗无乳链球菌(Streptococcus agalactiae)病的能力。张欢欢等(2016)研究发现,生物絮团对虾养殖系统中添加菌株02,能改善菌群结构,抑制弧菌生长。作者在前期的研究工作发现,在凡纳滨对虾养殖水体中单独添加107 CFU/ml数量级的地衣芽孢杆菌(B. licheniformis)BL-9、枯草芽孢杆菌BS-12菌液后,使用副溶血弧菌进行攻毒,实验组相对于对照组均显著提高对虾的成活率。金丽假交替单胞菌(Pseudoalteromonas flavipulchra)CDM8具有突出的弧菌拮抗能力(Wang et al, 2018),在零交换水条件下,能显著提高凡纳滨对虾ZⅢ幼体和仔虾PL5的变态率和成活率(孙博超等, 2019)。因此,本研究选择上述3株菌组成复合益生菌添加到养殖水体中,评价其对养殖水体及凡纳滨对虾肠道菌群、抗副溶血弧菌感染能力、过氧化氢酶(CAT)活性、抗病基因表达水平的影响,以期为复合益生菌在凡纳滨对虾养殖中的应用提供参考。
1 材料与方法 1.1 对虾与益生菌 1.1.1 实验用凡纳滨对虾实验用凡纳滨对虾购自山东莱州单山水产养殖公司(体长为6.2~10.6 cm)。实验前参照OIE(2017)水生动物疾病诊断手册及Wang等(2018)中的PCR方法,进行AHPND病原的套式PCR检测,结果为阴性。投喂饲料为宁波天邦饲料有限公司生产的凡纳滨对虾全熟化颗粒饲料,对虾养殖容器为100 L的PC塑料桶,养殖有效水体为60 L的过滤海水。
1.1.2 实验用菌种及培养实验用菌株:金丽假交替单胞菌CDM8、地衣芽孢杆菌BL-9、枯草芽孢杆菌S-12、副溶血弧菌20130629002S01,均由本实验室分离、鉴定及保存。
菌液发酵采用2216E培养基,28℃恒温震荡培养,当菌液的OD580 nm≈1时(此时,细菌浓度约为2×109~3×109 CFU/ml),终止发酵,使用时通过稀释的方法调整细菌的水体添加浓度。
CDM8、BL-9、BS-12和副溶血弧菌在水体的添加浓度分别为2.24×107、2.93×107、2.77×107和2.13×105 CFU/ml。
1.2 实验期及实验分组实验分3个时期:暂养期、益生菌处理期、副溶血弧菌感染期。
暂养期:对虾不分组,共7 d。期间随机挑选12尾凡纳滨对虾进行病原检测,暂养第7天检测养殖水体及对虾肠道可培养细菌数量,采集对虾肝胰腺组织用于抗病基因表达及CAT酶活性检测。暂养稳定后,挑选630尾大小均匀、活力良好的对虾用于后续实验。
益生菌处理期:对虾分为实验组和对照组。每组7个平行,其中,3个用于统计死亡率,4个用于采样(对照组为2组,预先设置攻毒阶段的阴性和阳性对照组)。实验组养殖水体中添加复合益生菌,各菌以1:1:1比例添加,对照组不添加益生菌。实验周期为15 d,由于CDM8拮抗能力较强,所以益生菌添加采取交替添加的方式,即3 d为1个添加周期。第1天添加益生菌CDM8菌液,第2天添加BL-9和BS-12菌液,共5个添加周期。在益生菌处理期,第7天和第14天检测养殖水体及对虾肠道可培养细菌数量,采集对虾肝胰腺组织用于抗病基因表达及酶活性检测。
副溶血弧菌攻毒期:对虾分为3组,实验组、阳性对照组和阴性对照组,每组7个平行,其中,3个用于统计死亡率,4个用于采样。益生菌处理期,每桶包含对虾30尾,攻毒期调整为每桶25尾。实验组和阳性对照组使用副溶血弧菌浸浴攻毒,先将对虾于2.13×107 CFU/ml副溶血弧菌菌液中浸泡15 min,然后放回,向养殖水体中添加副溶血弧菌菌液使得水体中的弧菌浓度达到2.13×105 CFU/ml左右,阴性对照组使用无菌2216E培养基浸浴。副溶血弧菌攻毒期持续10 d,攻毒期间不添加益生菌。在攻毒的6、18、42、66、90 h采集对虾的肝胰腺组织进行实验相关指标的测量,并统计每天对虾的累积死亡率。
1.3 实验管理实验期间连续充气,水温控制在(28±1)℃。根据每天对虾桶内是否有残饵来调整投喂量,每天投喂2次。48 h换水1次,换水量为水体积的2/3。
1.4 样品及处理 1.4.1 水体和对虾肠道内可培养细菌计数水体及对虾肠道细菌计数采用2216E琼脂平板涂布计数的方式。对虾肠道活菌计数,先将对虾完整肠道加入无菌PBS缓冲液研磨,后进行活菌计数。
1.4.2 对虾肝胰腺样品采集及处理在各个取样时间点采集对虾肝胰腺,每桶取对虾2尾,每组3个平行,共6尾对虾。解剖采集的对虾肝胰腺经液氮迅速冷冻后,放置在–80℃超低温冰箱保存。
1.5 RNA提取及cDNA合成按TRIZOL Reagent (Invitrogen)说明书进行总RNA的抽提,用Nanodrop 2000c (Thermo)测定RNA浓度,1%琼脂糖凝胶电泳检测RNA的质量后,保存于–80℃备用。cDNA合成采用TaKaRa公司生产的反转录试剂盒进行,使用方式参考试剂盒说明书。
1.6 实时荧光定量PCR 1.6.1 实时荧光定量PCR及引物使用Fast Essential DNA Green Master荧光定量试剂盒(Roche, 瑞士)进行实时荧光定量PCR检测,方法参考试剂盒说明书。抗病相关基因的检测引物名称及序列见表 1。
|
|
表 1 实时荧光定量PCR所用的引物及序列 Tab.1 Primer sequences used in quantitive real-time PCR |
PCR反应体系包括SYBR Premix Ex TaqTM (2×) 12.5 µl,cDNA模板1 µl,上下游引物各0.5 µl (10 µmol/L),DEPC处理水10.5 µl。PCR反应条件:94℃,5 min; 94℃ 30 s,58℃ 30 s,72℃ 30 s,35个循环。每个组织的样品设3个重复。对实验结果采用2-ΔΔCt法进行相对定量分析(Livak et al, 2001)。
1.7 免疫酶活性检测对各组凡纳滨对虾肝胰腺组织进行CAT酶活测定,测定方法参照检测试剂盒(南京建成生物工程研究所)说明书进行。
1.8 数据分析与处理采用SPSS 16.0软件对实验数据进行单因素方差分析(One-way ANOVA),以Duncan’s多重比较进行不同处理间的显著性分析,P < 0.05为差异显著。
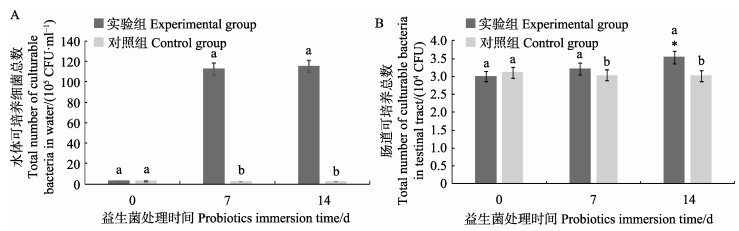
2 结果与分析 2.1 益生菌处理期养殖水体及对虾肠道可培养细菌数量养殖水体可培养细菌数量见图 1A,在添加益生菌前(0 d),各组水体可培养细菌数量处于105 CFU/ml数量级(P > 0.05)。益生菌处理阶段第7天和第14天实验组水体可培养细菌数量均处于107 CFU/ml数量级,显著高于对照组(P < 0.05)。对虾肠道可培养细菌数量见图 1B,在添加益生菌前(0 d)凡纳滨对虾肠道细菌总数在104 CFU数量级,添加益生菌后实验组对虾肠道内可培养细菌数量第7天(3.22×104 CFU),第14天(3.54×104 CFU)均显著高于对照组(第7天为3.04× 104 CFU, 第14天为3.03×104 CFU) (P < 0.05)。
|
图 1 养殖水体(A)及对虾肠道(B)可培养细菌总数 Fig.1 Total number of culturable bacteria in aquaculture water (A) and L. vannamei intestines(B) 不同字母代表同一时间点不同组之间存在显著差异,“*”代表同一组之间不同时间点存在显著差异。下同 Different letters in the same time mean significantly different at 0.05 level (P < 0.05), "*" means significantly different at 0.05 level in the same group (P < 0.05). The same as below |
副溶血弧菌攻毒后取实验组和阳性对照组濒死对虾肝胰腺组织,用TCBS平板涂布培养,长出大量绿色菌落,与攻毒所用副溶血弧菌菌落形态相同。实验组和阳性对照组的对虾均在第18小时开始出现死亡。攻毒后258 h时,实验组和阴性对照组对虾的累积存活率分别为73.33%和86.67%,而阳性对照组对虾的累积存活率为25.33%。实验组比阳性对照组累积存活率提高了48.00% (表 2)。
|
|
表 2 凡纳滨对虾感染副溶血弧菌后累积存活率 Tab.2 Accumulative survival rate of L. vannamei post V. parahaemolyticus challenge (%; n=3; x±SD) |
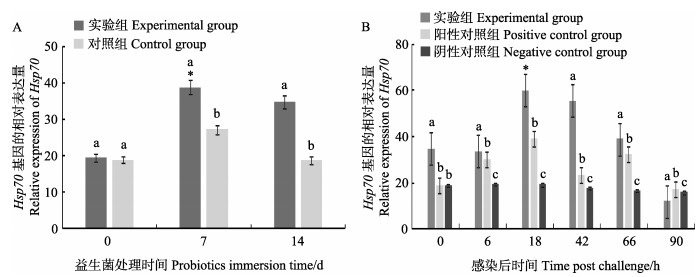
益生菌处理期,凡纳滨对虾肝胰腺Hsp70的相对表达量测定结果见图 2A。第7天和第14天实验组基因表达量显著高于对照组(P < 0.05)。攻毒期,凡纳滨对虾肝胰腺Hsp70的相对表达量测定结果见图 2B。实验组和阳性对照组Hsp70表达均呈现上升后下降的趋势,均在18 h达到最大值(P < 0.05)。
|
图 2 凡纳滨对虾肝胰腺中Hsp70基因的相对表达量 Fig.2 Relative expression of Hsp70 in the hepatopancreas of L. vannamei A:益生菌处理阶段; B:攻毒阶段 A: Probiotics immersion period; B: VpAHPND infection period |
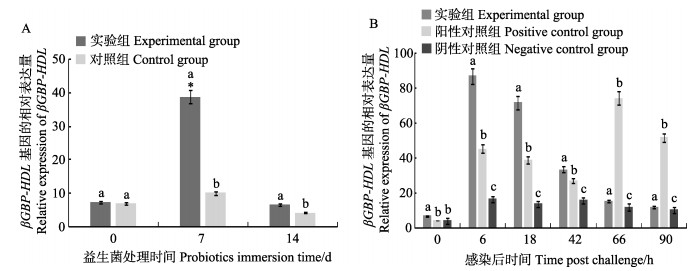
益生菌处理期,凡纳滨对虾肝胰腺βGBP-HDL的相对表达量测定结果见图 3A,第7天和第14天实验组基因表达量均显著高于对照组(P < 0.05)。攻毒期,凡纳滨对虾肝胰腺βGBP-HDL的相对表达量测定结果见图 3B,实验组对虾的βGBP-HDL的表达量呈先升高后下降趋势,而阳性对照组呈先升高再下降,再升高再下降的趋势; 实验组和阳性对照组基因的表达量分别在6和66 h达到最高(P < 0.05)。
|
图 3 凡纳滨对虾肝胰腺中βGBP-HDL基因的相对表达量 Fig.3 Relative expression of βGBP-HDL in the hepatopancreas of L. vannamei A:益生菌处理阶段; B:攻毒阶段 A: Probiotics immersion period; B: VpAHPND infection period |
益生菌处理期,凡纳滨对虾肝胰腺Crustin的相对表达量测定结果见图 4A。实验组基因表达量在第7天和第14天均显著高于对照组(P < 0.05)。攻毒期,凡纳滨对虾肝胰腺Crustin的相对表达量测定结果见图 4B。实验组和阳性对照组基因的表达均呈先升高后下降的趋势,实验组基因表达量在42 h达到最大值,阳性对照组中基因在18 h基因达到最大值。

|
图 4 凡纳滨对虾肝胰腺中Crustin基因的相对表达量 Fig.4 Relative expression of Crustin in the hepatopancreas of L. vannamei A:益生菌处理阶段; B:攻毒阶段 A: Probiotics immersion period; B: VpAHPND infection period |
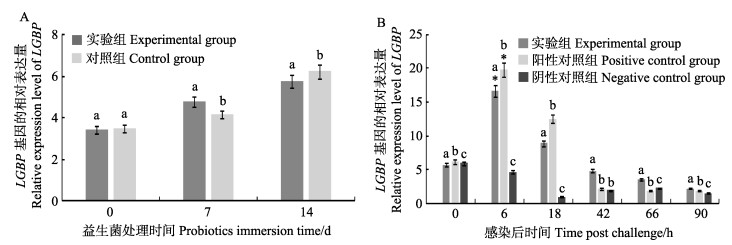
益生菌处理期,凡纳滨对虾肝胰腺LGBP的相对表达量测定结果见图 5A,实验组表达量在第7天显著高于对照组,而在第14天时表达量则低于对照组的(P < 0.05)。攻毒期,凡纳滨对虾肝胰腺LGBP的相对表达量测定结果见图 5B,实验组和阳性对照组基因的表达量均呈先升高后下降的趋势,攻毒42 h以后,实验组对虾LGBP的表达量高于阳性对照组(P < 0.05)。
|
图 5 凡纳滨对虾肝胰腺中LGBP的相对表达量 Fig.5 Relative expression of LGBP in the hepatopancreas of L. vannamei A:益生菌处理阶段; B:攻毒阶段 A: Probiotics immersion period; B: VpAHPND infection period |
益生菌处理期,凡纳滨对虾肝胰腺CAT活性的测定结果见图 6A,实验组CAT活性显著高于对照组的(P < 0.05),呈逐渐升高趋势。攻毒期,凡纳滨对虾肝胰腺CAT活性的测定结果见图 6B,实验组从第18小时开始呈逐渐升高的趋势,而阳性对照组呈先升高后下降、再升高再下降的趋势。
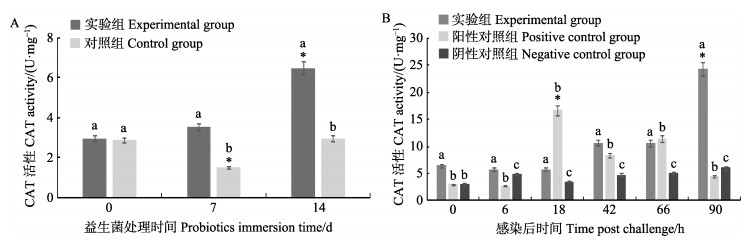
|
图 6 凡纳滨对虾肝胰腺CAT活性 Fig.6 CAT activity of L. vannamei hepatopancreas A:益生菌处理阶段; B:攻毒阶段 A: Probiotics immersion period; B: VpAHPND infection period |
Wu等(2008)研究表明,益生菌可以在对虾肠道内复杂的环境中竞争有限的生态位点,阻止致病微生物在该位点定植与繁殖。竞争性抑制是益生菌通过与肠道上皮细胞发生反应,与致病菌竞争肠道黏膜表面结合位点,进而抑制致病菌在肠道内的黏附和定植,是益生菌的益生机制之一(廖文艳等, 2011)。本研究中,实验组水体可培养细菌总数显著高于对照组,且实验组对虾肠道可培养细菌总数也显著高于对照组,说明添加益生菌不仅对养殖水体可培养细菌总数产生影响,同时,也影响对虾肠道可培养细菌总数。类似地,胡毅等(2008)研究发现,饲料中添加枯草芽孢杆菌能显著增加凡纳滨对虾肠道细菌总数,且与对照组相比饲料中添加益生菌在实验前期和末期均显著降低了对虾肠道的弧菌数量。刘文亮等(2017)在凡纳滨对虾养殖水体中投喂含有蜡样芽胞杆菌(Bacillus cereus)的饲料,用16S rDNA序列V3+V4区高通量测序方法检测对虾肠道内微生物群落的结构及变化,结果表明,饲料中添加蜡样芽孢杆菌投喂凡纳滨对虾后,可改变对虾肠道的微生物组成,提高凡纳滨对虾生长速度、增强抗病能力。本研究攻毒阶段实验组对虾相对于阳性对照组对虾累积存活率提高了48.00%,说明复合益生菌能够提高对虾抗副溶血弧菌感染能力,这可能与益生菌增加对虾肠道可培养细菌总数有关。由于本研究取样次数较多,导致每次取样的对虾样本量偏少,对虾肠道可培养细菌数量增多并不足以说明对虾肠道菌落结构的变化。益生菌是否在凡纳滨对虾体内定植还有待进一步探索。
LGBP作为一种模式识别受体能够识别革兰氏阴性菌和真菌细胞壁的脂多糖和β-1, 3-葡聚糖,并通过激活ProPO系统发挥作用,它是甲壳动物对抗副溶血弧菌感染的一个重要免疫因子(王锡波等, 2013); 与LGBP功能类似,βGBP-HDL在激活ProPO系统、凝结过程等方面起着重要作用(王春迪等, 2016)。本研究中,益生菌处理阶段LGBP,βGBP-HDL在第7天均出现不同程度上调,孙艳等(2012)研究也发现,凡纳滨对虾βGBP在含益生菌的饲料饲喂对虾过程中表达上调,并在72 h时达到最大值,与本研究结果类似。攻毒阶段,实验组的LGBP表达始终显著高于阴性对照组,阳性对照组的LGBP则在攻毒后第66小时低于阴性对照组,且攻毒42 h后,实验组LGBP表达始终高于阳性对照组; 而实验组的βGBP-HDL在攻毒后前42 h显著高于阳性对照组。分析实验结果,水体添加复合益生菌不同程度的促进了LGBP,βGBP-HDL表达,说明复合益生菌在凡纳滨对虾抵抗副溶血弧菌侵染的过程中发挥了积极的作用。
HSP作为一种对环境应激敏感的蛋白,在外界环境刺激下其表达量会明显增加,参与到细胞保护机制中,对保证正常的细胞结构,维持机体新陈代谢具有重要意义(明建华等, 2009)。本研究攻毒阶段,实验组和阳性对照组Hsp70表达均呈先上升后下降的趋势,但实验组基因表达量显著高于阳性对照组,说明养殖水体添加益生菌后,相比阳性对照组实验对虾抗应激反应能力更强。类似的研究,王春迪等(2016)在养殖水体中添加蜡样芽胞杆菌后,用WSSV感染凡纳滨对虾,实验组对虾Hsp70在第96小时表达量显著高于对照组。水体添加高浓度副溶血弧菌攻毒能引起对虾的应激反应,而本研究结果表明,副溶血弧菌攻毒时,复合益生菌能够提高凡纳滨对虾抗应激反应的能力。
抗菌肽(Antimicrobial peptides, AMPs)是一种原始的具有防御功能的生物分子,目前主要包括:ALFs、Crustins、Peneidins三大类以及一些血蓝蛋白、溶菌酶、C型外源凝集素等(Antony et al, 2011)。本实验中益生菌处理阶段,实验组Crustin在第7天和第14天的表达量均高于对照组,说明水体添加益生菌能促进Crustin表达。攻毒阶段,实验组和阳性对照组Crustin的表达均呈现先升高后下降的趋势,阳性对照组在第18小时达到最大,实验组在第42小时达到最大。赵伟等(2017)用副溶血弧菌攻毒发现,攻毒后的实验组对虾Crustin呈现先上升后下降的趋势,并在攻毒的第12小时达到最大,跟本研究阳性对照组实验结果类似。攻毒后,副溶血弧菌对对虾机体造成伤害,Crustin短时间内的迅速表达能够抵抗副溶血弧菌的入侵。研究表明,复合益生菌增强对虾抗副溶血弧菌入侵的能力,可能与攻毒后复合益生菌延缓对虾Crustin基因的表达有关。
氢氧自由基(OH-, ROS)是化学性质最活泼的活性氧,它几乎与细胞内的每一类有机物如糖、氨基酸、磷脂、核苷酸和有机酸发生反应,其破坏性极强(Liu et al, 2010)。当副溶血弧菌侵入凡纳滨对虾体内时,会激发对虾天然免疫系统,产生ROS以对抗弧菌的入侵,虽然释放ROS是甲壳动物对抗微生物感染的重要防御机制,产生过量同时会导致细胞损伤,但它可以被过氧化氢酶分解(Duan et al, 2015)。本研究益生菌处理阶段,复合益生菌能够显著提高对虾CAT活性。桂琳等(2015)研究也发现,水体添加复合益生菌能显著提高草鱼(Ctenopharyngodon idellus)血清中CAT活性。本研究攻毒阶段,阳性对照组CAT活性呈上升、下降、再上升、再下降的趋势。赵伟等(2017)使用副溶血弧菌攻毒,36 h内观察对凡纳滨对虾CAT的影响,发现实验组凡纳滨对虾肝胰腺CAT活性呈先升高后降低的趋势,与本研究阳性对照组结果相似,说明副溶血弧菌对凡纳滨对虾的这种天然免疫系统造成了破坏; 而本研究中,实验组CAT活性则呈逐渐上升的趋势,这种逐渐上升的趋势说明实验组对虾的这种免疫机制仍然完善。分析实验结果,益生菌增强对虾抗弧菌感染能力,可能与益生菌能够提高对虾的CAT活性有关。
4 结论凡纳滨对虾养殖水体中添加的复合益生菌能显著提高对虾感染副溶血弧菌后的成活率,增加水体和对虾肠道中可培养细菌量。在益生菌处理时期,复合益生菌能够不同程度的提高对虾抗病相关基因的表达量和CAT活性; 副溶血弧菌攻毒时期,对虾抗病相关基因表达呈现各自不同的情况。实验结果表明,复合益生菌提高凡纳滨对虾抗副溶血弧菌感染能力的原因可能与复合益生菌增加水体和对虾肠道中可培养细菌量、提高凡纳滨对虾抗病相关基因表达和CAT活性有关。
Antony SP, Singh ISB, Jose RM, et al. Antimicrobial peptide gene expression in tiger shrimp, Penaeus monodon in response to gram-positive bacterial probionts and white spot virus challenge. Aquaculture, 2011, 316(1-4): 6-12 |
Balcázar JL, Blas ID, Ruiz-Zarzuela I, et al. The role of probiotics in aquaculture. Veterinary Microbiology, 2006, 114(3-4): 173-186 |
Chai PC. Application of Bacillus firmus PC465 in shrimp cuture and the evaluation of effects on growth, disease resistance of L. vannamei. Masterˊs Thesis of Shanghai Ocean University, 2012 [柴鹏程.坚强芽孢杆菌PC465在凡纳滨对虾养殖中的应用技术及效果评价.上海海洋大学硕士研究生学位论文, 2012]
|
Chen MM, Dong X, Qiu L, et al. Quantitative analysis of acute hepatopancreatic necrosis disease causing Vibrio parahaemolyticus (VpAHPND) in infected Litopenaeus vannamei. Progress in Fishery Sciences, 2018, 39(4): 93-100 [陈蒙蒙, 董宣, 邱亮, 等. 凡纳滨对虾感染致急性肝胰腺坏死病副溶血弧菌(VpAHPND)的定量分析. 渔业科学进展, 2018, 39(4): 93-100] |
Duan Y, Zhang J, Dong H, et al. Oxidative stress response of the black tiger shrimp Penaeus monodon to Vibrio parahaemolyticus challenge. Fish and Shellfish Immunology, 2015, 46(2): 354-365 |
Gao G, Zhu KL, Zhang QQ, et al. Simplified fermentation of a functional probiotics and the application in prawn (Litopenaeus vannamei) bio-floc breeding. Progress in Fishery Sciences, 2017, 38(3): 140-147 [高戈, 朱开玲, 张庆起, 等. 一株功能益生菌的简易发酵及其在凡纳滨对虾(Litopenaeus vannamei)生物絮团养殖中的应用. 渔业科学进展, 2017, 38(3): 140-147] |
Gui L, Wang XQ, Kang Y, et al. Effects of one compound probiotics on growth and antioxidant function of Ctenopharyngodon idellus. Freshwater Fisheries, 2015, 45(5): 83-87 [桂琳, 王晓清, 康银, 等. 一种复合益生菌对草鱼生长和抗氧化功能的影响. 淡水渔业, 2015, 45(5): 83-87] |
Hu Y, Tan BP, Mai KS, et al. Effects of dietary probiotic on growth, immunity and intestinal bacteria of juvenile Litopenaeus vannamei. Journal of Fishery Sciences of China, 2008, 15(2): 244-251 [胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响. 中国水产科学, 2008, 15(2): 244-251] |
Jia D, Shi CY, Huang J, et al. Identification and pathogenicity analysis of bacterial pathogen associated with acute hepatopancreatic necrosis disease (AHPND) in the Pacific shrimp Litopenaeus vannamei. Progress in Fishery Sciences, 2018, 39(3): 103-111 [贾丹, 史成银, 黄倢, 等. 凡纳滨对虾急性肝胰腺坏死病(AHPND)病原分离鉴定及其致病性分析. 渔业科学进展, 2018, 39(3): 103-111] |
Liao WY, Zhou LH, Wang YY, et al. Rencent progress on probiotic mechanisms in intestine and the studying methods. Chinese Journal of Microecology, 2011, 23(2): 184-189 [廖文艳, 周凌华, 王荫榆, 等. 近年来益生菌肠道功能作用机制及研究方法的进展. 中国微生态学杂志, 2011, 23(2): 184-189] |
Liu GB, Wang M, Lu MX, et al. Application of Bacillus subtilis in comprehensive prevention and control of streptococcus disease of tilapia. Guangdong Agricultural Sciences, 2015, 42(13): 123-129 [刘观斌, 王淼, 卢迈新, 等. 枯草芽孢杆菌在罗非鱼链球菌病综合防控中的应用研究. 广东农业科学, 2015, 42(13): 123-129] |
Liu KF, Yeh MS, Kou GH, et al. Identification and cloning of a selenium-dependent glutathione peroxidase from tiger shrimp, Penaeus monodon, and its transcription following pathogen infection and related to the molt stages. Developmental and Comparative Immunology, 2010, 34(9): 935-944 |
Liu WL, Xu H, Tang Y, et al. The effect of diet with Bacillus cereus biofilm on the growth rate, disease resistance and intestinal microflora of Litopenaeus vannamei. Progress in Fishery Sciences, 2017, 38(4): 87-95 [刘文亮, 许华, 唐杨, 等. 饲料中补充蜡样芽孢杆菌(Bacillus cereus)生物膜对凡纳滨对虾(Litopenaeus vannamei)生长、抗病力及其肠道微生物组成的影响. 渔业科学进展, 2017, 38(4): 87-95] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 2001, 25(4): 402-408 |
Ming JH, Xie J, Liu B, et al. Cloning sequence analysis of HSP70 cDNA and effects of heat stress on its mRNA expression in Megalobrama amblycephala. Journal of Fishery Sciences of China, 2009, 16(5): 635-648 [明建华, 谢骏, 刘波, 等. 团头鲂HSP70 cDNA的克隆、序列分析以及热应激对其mRNA表达的影响. 中国水产科学, 2009, 16(5): 635-648] |
Sun BC, Yang YK, Wang HL, et al. Effects of probiotics combination on breeding of Litopenaeus vannamei under zero-water exchange condition. Journal of Shanghai Ocean University, 2019, 28(1): 93-102 [孙博超, 杨运楷, 王海亮, 等. 零换水条件下益生菌组合在凡纳滨对虾育苗生产中的应用. 上海海洋大学学报, 2019, 28(1): 93-102] |
Sun Y, Liu F, Song XL, et al. Effects of adding probiotics in the feed on non-specific immune gene expression and disease resistance of Litopenaeus vannamei. Oceanologia et Limnologia Sinica, 2012, 43(4): 845-850 [孙艳, 刘飞, 宋晓玲, 等. 饲料中添加益生菌对凡纳滨对虾(Litopenaeus vannamei)非特异免疫基因表达量和抗病力的影响. 海洋与湖沼, 2012, 43(4): 845-850] |
Thompson FL, Abreu PC, Cavalli R. The use of microorganisms as food source for Penaeus paulensis larvae. Aquaculture, 1999, 174(1-2): 139-153 |
Wang CD, Song XL, Zhang XJ, et al. Effects of adding Bacillus cereus PC465 to rearing water on disease resistance of Litopenaeus vannamei. Journal of Fishery Sciences of China, 2016, 23(1): 146-155 [王春迪, 宋晓玲, 张晓静, 等. 养殖水体添加蜡样芽胞杆菌PC465对凡纳滨对虾抗病力的影响. 中国水产科学, 2016, 23(1): 146-155] |
Wang HL, Wang CD, Tang Y, et al. Pseudoalteromonas probiotics as potential biocontrol agents improve the survival of Penaeus vannamei challenged with acute hepatopancreatic necrosis disease (AHPND)-causing Vibrio parahaemolyticus. Aquaculture, 2018, 494: 30-36 |
Wang N, Wang HL, Bai N, et al. Isolation of lysogenic phage in Vibrio parahaemolyticus and its relationship with the pathogenicity of the host bacteria. Progress in Fishery Sciences, 2016, 37(2): 105-110 [王娜, 王海亮, 白楠, 等. 副溶血弧菌(Vibrio parahaemolyticus)中溶源噬菌体与其宿主菌致病力的相关性. 渔业科学进展, 2016, 37(2): 105-110] |
Wang XB, Jin S, Chen YE, et al. Temporal expression of the LGBP gene in mainly tissues of Portunus trituberculatas challenged by different pathogens. Journal of Biology, 2013, 30(6): 5-9 [王锡波, 金珊, 陈寅儿, 等. 不同病原菌刺激下三疣梭子蟹主要组织LGBP基因的时序表达. 生物学杂志, 2013, 30(6): 5-9] |
WU X, Vallance BA, Boyer L, et al. Saccharomyces boulardii ameliorates Citrobacter rodentium-induced colitis through actions on bacterial virulence factors. American Journal of Physiology: Gastrointestinal and Liver Physiology., 2008, 294(1): 295-306 |
Zhang HH, Wang XH, Li C, et al. Isolation and identification of a bacterial strain with Vibrios-antagonism from shrimp ponds. Progress in Fishery Sciences, 2016, 37(3): 85-92 [张欢欢, 王秀华, 李晨, 等. 对虾养殖池中一株弧菌拮抗菌的分离鉴定. 渔业科学进展, 2016, 37(3): 85-92] |
Zhang SJ, Song XL, Zhao XJ, et al. Effects of adding probiotics to the feed on anti-infection and five kinds of immune gene expression of Litopenaeus vannamei. Journal of Fisheries of China, 2015, 39(6): 899-907 [张盛静, 宋晓玲, 赵小金, 等. 饲料中添加益生菌对凡纳滨对虾抗感染和5种免疫基因表达的影响. 水产学报, 2015, 39(6): 899-907] |
Zhang SJ, Zhao XJ, Song XL, et al. Effects of adding probiotics on promoting intestinal bacteria, Toll receptors, and lysozyme immune gene expression and resistance to Vibrio harveyi in Litopenaeus vannamei. Journal of Fishery Sciences of China, 2016, 23(4): 846-854 [张盛静, 赵小金, 宋晓玲, 等. 饲料添加益生菌对凡纳滨对虾肠道菌群、Toll受体及溶菌酶基因表达及抗感染的影响. 中国水产科学, 2016, 23(4): 846-854] |
Zhao W, Wang L, Liu M, et al. The effects of Vibrio parahaemolyticus on hepatopancreas antioxidant enzyme activity and gene expression of Litopenaeus vannamei. Journal of Fishery Sciences of China, 2017, 24(6): 1261-1270 [赵伟, 王雷, 刘梅, 等. 副溶血弧菌对凡纳滨对虾肝胰腺抗氧化酶活性和基因表达的影响. 中国水产科学, 2017, 24(6): 1261-1270] |



