2. 美国国际铜专业协会上海代表处 上海 200020
2. International Copper Association, Ltd. (ICA), Shanghai 200020
人类对重金属的开发利用历史悠久,随着现代工业的发展,大量的重金属被排入水体环境中,由于重金属不能被生物降解,因此,已经成为一类典型的传统环境污染物,主要包括铅(Pb)、镉(Cd)、铬(Cr)、汞(Hg)、类金属砷(As)等毒性较强的重金属,也包括铜(Cu)、锌(Zn)、镍(Ni)等有一定毒性的一般重金属(Bhuyan et al, 2017; Järup, 2003)。重金属通过生物富集在海洋生物体内累积并最终通过食物链途径转移到人体体内,危害人类健康(Apeti et al, 2005; 孙元芹等, 2013)。Cu是一种存在于各种岩石和矿物中的微量金属元素,由于其使用广泛,不能被生物降解,易在生物体内积累且对水生生物具有致毒效应毒性而受到广泛关注(Sloman et al, 2005)。水体中溶解态Cu2+对海洋鱼类(Johnson et al, 2007; Monteiro et al, 2009)、微藻(Cid et al, 1995)、甲壳类(Hansen et al, 1992; Young et al, 1979)、无脊椎动物(Iwinski et al, 2016)、贝类(Chang et al, 1996)等会产生氧化应激、DNA损伤、细胞凋亡、蛋白质变性等各类毒性效应。
相比较其他海洋生物,海洋贝类由于其滤食性特点,更容易从周围环境中富集Cu2+等重金属,常被用作重金属污染的指示生物,因此,研究重金属对海洋贝类的毒性效应有重要的现实意义(Nsofor et al, 2014)。厚壳贻贝(Mytilus coruscus)主要分布于中国的渤海、黄东海等地,日本、朝鲜部分区域也有分布,属于滤食性附着生活的双壳贝类。国内外学者利用分子生物标志物研究了Cu2+对厚壳贻贝的毒性效应,Xu等(2016)、Li等(2012)、Wu等(2017)、王昊盛等(2017)、刘慧慧等(2014)从不同角度研究了厚壳贻贝不同组织酶活性及相关基因表达对Cu2+暴露胁迫的响应。张翼飞(2017)研究了Cu2+和苯并芘(BaP)对厚壳贻贝的联合毒性效应。但各类生物标志物对Cu2+的敏感程度不同,诱导程度、变化趋势也存在差异,单独依据个别生物标志物对Cu2+暴露的响应不能有效的评估Cu2+的毒性效应,需要一种能够评估生物标志物整体变化的方法。综合生物标志物响应(Integrated biomarker response, IBR)指数能够综合所有的生物标志物对污染物的响应,转换成一个“压力指数”值,已经应用于评估各类污染物的生物毒性效应研究中(Kim et al, 2016; Xia et al, 2014; Zheng et al, 2013)。
本研究通过Cu2+对厚壳贻贝的暴露实验,比较分析了厚壳贻贝的鳃、内脏团组织超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)、脂质过氧化水平(Lipid peroxidation, LPO)、金属硫蛋白(Metallothioneins, MT)含量等生物标志物在不同Cu2+暴露下的变化及相关关系,应用IBR指数评价组织对Cu2+暴露的响应差异,探讨Cu2+对厚壳贻贝的致毒机理及其生理响应,为基于双壳贝类的重金属污染监测预警提供更多的技术支持。
1 材料与方法 1.1 实验材料厚壳贻贝取自浙江省嵊泗县枸杞岛养殖区,平均体重为(6.06±0.34) g,参考养殖区水环境条件并使用海水晶(溶解于纯净水中,Cu2+浓度为1.3×10–3 mg/L)、纯净水配制实验用海水(盐度为32.5,pH为8.10),水质指标符合《渔业水质标准》(国家环境保护局,1989)的要求。实验容器为10 L的玻璃容器。Cu2+实验母液为100 mg/ml的Cu2+标准溶液(中国标准物质网),实验时稀释到所需浓度。厚壳贻贝在实验开始前暂养3 d,每天投喂角毛藻(Chaetoceros gracilis),每24 h 100%换水1次,水温为(19.0±0.3)℃。
1.2 实验方法 1.2.1 96 h急性毒性实验采用半静态实验方法,先进行预实验,确定厚壳贻贝全部死亡的最低浓度(LC0)和96 h全部存活的最高浓度(LC100),在预实验的基础上,设置6组实验浓度(8.0、4.0、2.0、1.0、0.5、0.25 mg/L,配制海水中的Cu2+浓度极低,忽略不计),同时,设置1组海水对照组,每组3个重复,分别放置30个厚壳贻贝。实验期间,光照比为12:12,水温为(19.0±0.3)℃,容器加入5 L海水,每24 h 100%换水1次,实验期间不投喂饵料,使用微型充气泵充氧,溶解氧(DO)的范围为7.0~7.5 mg/L。及时将死亡的厚壳贻贝捞出,死亡标准是用玻璃棒重复触碰,若厚壳贻贝没有反应确认为死亡。分别于第24、48、72、96小时记录厚壳贻贝的死亡情况。
利用SPSS16.0软件进行数据处理,采用概率单位算法计算96 h LC50,根据公式:SC=96 h LC50×0.1,计算Cu2+的安全浓度。
1.2.2 7 d毒性实验根据96 h急性毒性实验结果(96 h LC50=1.55 mg/L),设置0.04、0.08、0.16 mg/L共3组实验浓度(1/10急性毒性实验浓度),实验进行7 d时,实验条件与96 h急性毒性实验相同,实验前与第0、1、3、7天分别采集8个样品,取鳃、内脏团组织,保存在液氮中。
1.3 毒理学指标的测定使用超纯水(Millipore,美国)配制与厚壳贻贝生理盐度相同的冰水,取约0.5 g鳃、内脏团样品置于4.5 ml生理盐水中,在15000 r/min条件下,使用自动匀浆机(Ika T10b,德国)匀浆,匀浆样品在4℃、1431 r/min条件下,离心20 min,取上清液(Lowe et al, 1995),使用南京建成生物工程研究所试剂盒测定SOD、CAT酶活性及MDA含量(代表LPO水平)。
将鳃、内脏团样品按照1:4的比例(体重/体积比)加入Tris-HCl缓冲液(pH为8.3),冰浴条件下匀浆,然后,将匀浆液在0℃、10000 r/min下离心30 min,取上清液,采用镉–血红蛋白饱和法测定MT含量(Onosaka et al, 1982)。利用原子吸收仪(SOLAARM6, Thermo Fisher Scientific, 美国)分析Cd2+浓度,按照1个MT分子结合6个Cd2+和MT分子量为7000 Da的原则(Narula et al, 1995)计算MT的含量(μg/g)。
1.4 综合生物标志物响应指数应用IBR值的计算方法并参照Kim等(2016)的方法。首先,计算生物标志物在各阶段的平均值(xi)、总平均值(x)、标准差(s),然后,按照下列公式对各阶段的xi进行均一化处理:
| $ {{{x}'}_{i}}=({{x}_{i}}-\bar{x})/s $ | (1) |
式中,
各阶段生物标志物的得分Bi值计算公式:
| $ {{B}_{i}}=Z+\left| {{x}_{\min }} \right| $ | (2) |
式中,|xmin|为各阶段生物标志物均一化处理后的数据最小值的绝对值,Bi值的大小在星状图中以辐射线的长度代表,星状图面积(即图中由相邻生物标志物的辐射线围成的三角形面积Ai之和)按照下列公式计算:
| $ \text{IBR}=\sum\limits_{i=1}^{n}{{{A}_{i}}} $ | (3) |
| $ {{A}_{i}}={{B}_{i}}/2\text{sin}\ \beta ({{B}_{i}}\text{cos}\ \beta +{{B}_{i}}_{+1}\text{sin}\ \beta) $ | (4) |
| $ \beta =\text{arctan}({{B}_{i}}_{+1}\text{sin}\ \text{ }\!\!\alpha\!\!\text{ }/{{B}_{i}}-{{B}_{i}}_{+1}\text{cos}\ \text{ }\!\!\alpha\!\!\text{ }) $ | (5) |
式中,n为生物标志物数量;α为相邻的2条辐射线夹角,α=2π/n;Bn+1=B1。当n=4时,α=π/2,Ai计算公式可以简化为:
| $ {{A}_{i}}={{B}_{i}}{{B}_{i+1}}/2 $ |
所有数据均以平均值±标准差(Means±SD)表示,应用SPSS 16.0软件对数据进行分析,采用单因素方差(One-way ANOVA)对数据进行分析,差异显著时进行Duncan’s test多重比较,显著性水平设为0.05。
2 结果 2.1 Cu2+对厚壳贻贝的96 h急性毒性实验Cu2+浓度与厚壳贻贝的死亡率之间表现为正相关的剂量效应关系,剂量效应关系公式为:
| $ y=0.834x+4.634 $ |
相关系数R2=0.958,96 h LC50浓度为1.55 mg/L,安全浓度为0.16 mg/L。
2.2 Cu2+对厚壳贻贝鳃、内脏团组织SOD、CAT活性及MDA、MT含量的影响 2.2.1 Cu2+对厚壳贻贝鳃、内脏团组织SOD活性的影响各实验组中,厚壳贻贝鳃组织、内脏团的SOD活性均表现为先上升后下降的趋势(图 1)。各实验组厚壳贻贝鳃组织的SOD活性在第1天即达到最高值,其中,0.16、0.08 mg/L组鳃组织的SOD活性均显著高于对照组(P < 0.05),分别为对照组的2.93、2.20倍,0.04 mg/L组中鳃组织的SOD活性与对照组之间无显著差异(P > 0.05);第3天时,仅有0.16 mg/L组鳃组织的SOD活性显著高于对照组(P < 0.05);第7天时,3组实验组中鳃组织的SOD活性与对照组间均无显著差异(P > 0.05)(图 1a)。0.16 mg/L实验组厚壳贻贝内脏团的SOD活性在3个取样阶段均显著高于对照组(P < 0.05),第3天达到峰值,分别为对照组的2.45、3.32、2.80倍;0.08 mg/L组内脏团的SOD活性在第3、7天显著高于对照组,分别为对照组的2.48和2.11倍;0.04 mg/L组鳃组织的SOD活性与对照组间无显著差异(P > 0.05)(图 1b)。

|
图 1 Cu2+对鳃(a)、内脏团(b)SOD活性的影响 Fig.1 Effects of Cu2+ on SOD activities of gill (a) and visceral mass (b) *为与对照组相比差异显著(P < 0.05),下同 Single asterisk (*) indicates significant difference between treatment groups and control group (P < 0.05), the same as below |
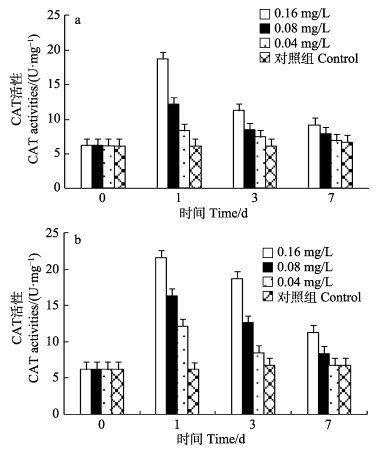
各实验组中,厚壳贻贝鳃组织、内脏团的CAT活性变化呈先上升后下降的趋势(图 2)。各实验组厚壳贻贝鳃组织的CAT活性在第1天即达到最高值,但仅有0.16 mg/L实验组鳃组织的CAT活性显著高于对照组(P < 0.05),为对照组的3.02倍,其余实验组与对照组间均无显著差异(P > 0.05)(图 2a)。各实验组厚壳贻贝内脏团的CAT活性也在第1天即达到最高值,其中,0.16、0.08 mg/L实验组内脏团的CAT活性均显著高于对照组(P < 0.05),分别为对照组的3.50、2.65倍;0.04 mg/L实验组内脏团的SOD活性与对照组间无显著差异(P > 0.05)。第3天仅有0.16 mg/L实验组内脏团组织的CAT活性显著高于对照组(P < 0.05),第7天各实验组内脏团的CAT活性与对照组之间均无显著差异(P > 0.05)(图 2b)。
|
图 2 Cu2+对鳃(a)、内脏团(b)CAT活性的影响 Fig.2 Effects of Cu2+ on CAT activities of gill (a) and visceral mass (b) |
各实验组厚壳贻贝鳃组织、内脏团的MDA含量均呈逐渐上升的趋势(图 3)。第3天开始,0.16、0.08 mg/L实验组鳃组织的MDA含量均显著高于对照组(P < 0.05),0.04 mg/L实验组鳃组织的MDA含量与对照组间无显著差异(P > 0.05)(图 3a)。第1天开始,0.16、0.08 mg/L实验组内脏团的MDA含量均显著高于对照组(P < 0.05),0.04 mg/L实验组内脏团组织的MDA含量与对照组间无显著差异(P > 0.05);第3、7天时,3个实验组内脏团组织的MDA含量均显著高于对照组(P < 0.05)(图 3b)。

|
图 3 Cu2+对鳃(a)、内脏团(b)MDA含量的影响 Fig.3 Effects of Cu2+ on MDA content of gill (a) and visceral mass (b) |
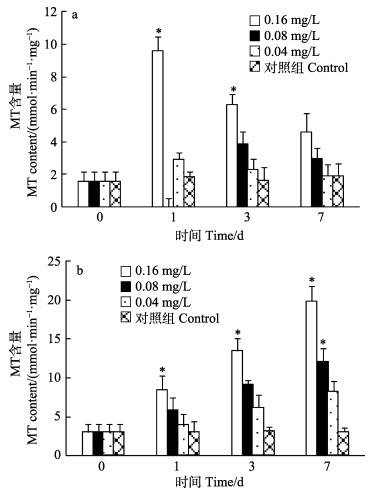
各实验组厚壳贻贝鳃组织的MT含量变化呈先上升后下降的趋势(图 4a)。厚壳贻贝鳃组织的MT含量在第1天即达到最高值,其中,0.16、0.08 mg/L实验组鳃组织的MT含量均显著高于对照组(P < 0.05);分别为对照组的5.25、3.12倍,0.04 mg/L实验组内鳃组织的MT含量与对照组间无显著差异(P > 0.05);第3、7天仅有0.16 mg/L实验组中鳃组织的MT含量均显著高于对照组(P < 0.05),其余2个实验组与对照组间无显著差异(P > 0.05)(图 4a)。各实验组厚壳贻贝内脏团的MT含量变化呈逐渐上升的趋势(图 4b)。第1天开始,仅有0.16 mg/L实验组内脏团的MT含量显著高于对照组(P < 0.05),为对照组的2.76倍,其余2个实验组内脏团的MT含量与对照组间无显著差异(P > 0.05);第3天时,0.16、0.08 mg/L实验组内脏团组织的MT含量均显著高于对照组(P < 0.05),分别为对照组的4.21、2.86倍,0.04 mg/L实验组内脏团组织的MT含量与对照组间无显著差异(P > 0.05);第7天时,3个实验组中内脏团组织的MT含量均显著高于对照组(P < 0.05)。
|
图 4 Cu2+对鳃(a)、内脏团(b)MT含量的影响 Fig.4 Effects of Cu2+ on MT content of gill (a) and visceral mass (b) |
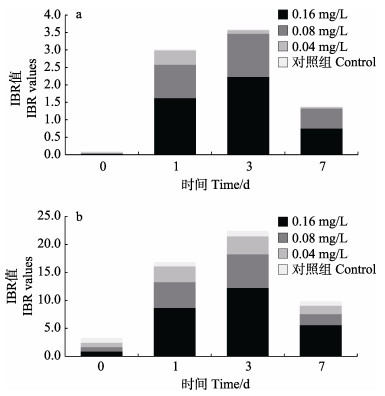
各实验组厚壳贻贝鳃组织、内脏团组织IBR值随暴露时间的变化见图 5。从图 5可以看出,1~7 d各实验组厚壳贻贝鳃组织、内脏团组织IBR值均呈先上升后下降的趋势。其中,0.16、0.08 mg/L实验组中鳃组织均在第3天达到峰值,0.04 mg/L实验组中鳃组织在第1天达到峰值,IBR峰值分别为2.23、1.24、0.41(图 5a)。0.16、0.08、0.04 mg/L实验组内脏团组织均在第3天达到峰值,IBR峰值分别为12.24、5.98、3.22(图 5b)。相同浓度下,内脏团组织IBR值高于鳃组织,各实验组厚壳贻贝鳃组织、内脏团组织IBR值均随实验浓度的下降而下降。
|
图 5 IBR值随时间的变化 Fig.5 IBR values changes over time |
污染物在生物体内的富集可以触发氧化还原反应产生自由基,特别是细胞内ROS,如超氧阴离子、过氧化氢、羟基自由基及其衍生物(Oost et al, 2003)。一般情况下,ROS的产生和消除处于动态平衡,然而,高活性中间体可攻击细胞内外的靶标,当ROS累积到一定程度时,超过抗氧化防御系统的能力时,就会引起脂质过氧化(LPO)(Alzbeta et al, 2012)。SOD能将
在本研究中,各实验组中鳃组织、内脏团组织MDA含量在第1天即开始上升(图 3)。表明Cu2+暴露产生的ROS已对鳃组织、内脏团组织造成了一定的氧化损伤。第1天时,各实验组鳃组织、内脏团组织SOD活性也开始上升,且高浓度暴露组均显著高于对照组(P < 0.05),此时,ROS的大量累积诱导SOD活性发生代偿性上升以清除ROS,随后各实验组鳃组织SOD活性开始下降,内脏团组织SOD活性在第3天开始下降,表明ROS的大量累积超过了SOD清除自由基的能力,对鳃组织、内脏团组织造成了一定的损伤,抑制了SOD的活性。CAT与SOD功能相关,在抗氧化过程中仅次于SOD被诱导(Velisek et al, 2011),各实验组中,鳃组织、内脏团组织CAT活性表现出与SOD活性类似的剂量–效应关系,均呈先上升后下降的变化趋势,SOD转化功能的下降也导致了CAT的诱导量下降。另外研究也表明,CAT也可以被
Zn、Cu、Cd、Hg等重金属能诱导MT的合成,并与重金属相结合,诱导程度与重金属浓度、种类具有一定的相关性,是生物体解毒代谢重金属的重要途径之一,MT含量的变化可以预测机体组织受重金属胁迫的压力,已经在众多研究中证实(Ridlington et al, 1979; Thirumoorthy et al, 2007)。Cu2+是生物体新陈代谢必需的元素之一,但过量的Cu2+对生物体组织会造成损伤。在本研究中,各实验组中鳃组织、内脏团组织MT含量第1天即开始上升,且高浓度暴露组均显著高于对照组(P < 0.05)(图 4)。此时,机体组织通过MT的合成并与Cu2+结合,减少Cu2+与机体细胞中具有高亲和力的巯基(-SH)基团非特异性结合,最终利用溶酶体将结合物从细胞质中排出,降低Cu2+的毒性(Isani et al, 2000)。同时,各实验组鳃组织、内脏团组织MT含量变化趋势存在差异,鳃组织MT含量在第1天峰值后开始逐渐下降,而内脏团组织MT含量呈逐渐上升趋势,这与不同组织对重金属的富集能力及组织之间的蛋白质代谢变化差异有关,相比较鳃组织,内脏团组织中的蛋白质水平更高(Legras et al, 2000),同时,由于生物体自身的屏障属性,不同组织间的重金属分布状况存在差异,内脏团组织对重金属的富集能力高于鳃组织,MT的含量与重金属含量有一定的正相关关系(Domouhtsidou et al, 2004),上述2个因素共同决定了内脏团组织中MT的含量高于鳃组织。
使用生物标志物评估毒性物质的毒性效应及作用途径是一个常用手段,通常情况下,多种生物标志物会同时出现,以解释不同的毒性效应,但过多的生物标志物混合就使整体的毒性效应及其变化趋势难以解释。本研究中,各浓度实验组生物标志物相比较对照组均表现出一定的变化,从不同角度反映出Cu2+对厚壳贻贝内脏团组织、鳃组织的影响。为了更准确地比较Cu2+对厚壳贻贝的整体胁迫压力,使IBR指数可以通过量化的数值直观比较Cu2+对厚壳贻贝不同组织的暴露毒性。在本研究中,厚壳贻贝的鳃组织、内脏团组织表现出不同的剂量–毒性效应结果(图 5),对相同组织,高浓度实验组的IBR值高于低浓度实验组,而对相同实验浓度,内脏团组织的IBR值高于鳃组织。这个结果不仅验证了内脏团组织的主要解毒代谢功能,更量化了其与鳃组织的差异,表明IBR可以作为一种定量评价污染物毒性效应的有效工具。
Alzbeta S, Jana M, Josef V. Effect of chronic exposure to simazine on oxidative stress and antioxidant response in common carp (Cyprinus carpio L.). Pesticide Biochemistry and Physiology, 2012, 33(2): 334-343 |
Apeti DA, Johnson E, Robinson L. A model for bioaccumulation of metals in Crassostrea virginica from Apalachicola Bay, Florida. American Journal of Environmental Sciences, 2005, 1(3): 239-248 DOI:10.3844/ajessp.2005.239.248 |
Bhuyan MS, Bakar MA, Akhtar A, et al. Heavy metal contamination in surface water and sediment of the Meghna River, Bangladesh. Environmental Nanotechnology, Monitoring and Management, 2017, 8: 273-279 DOI:10.1016/j.enmm.2017.10.003 |
Chang EY, Coon SL, Walch M, et al. Effects of hyphomonas PM-1 biofilms on the toxicity of copper and zinc to Crassostrea gigas and Crassostrea virginica larval set. Journal of Shellfish Research, 1996, 15(3): 589-595 |
Cid A, Herrero C, Torres E, et al. Copper toxicity on the marine microalga Phaeodactylum tricornutum: Effects on photosynthesis and related parameters. Aquatic Toxicology, 1995, 31(2): 165-174 |
Domouhtsidou GP, Dailianis S, Kaloyianni M, et al. Lysosomal membrane stability and metallothionein content in Mytilus galloprovincialis (L.), as biomarkers: Combination with trace metal concentrations. Marine Pollution Bulletin, 2004, 48(5): 572-586 |
Hansen JI, Mustafa T, Depledge M. Mechanisms of copper toxicity in the shore crab, Carcinus maenas. Marine Biology, 1992, 114(2): 253-257 DOI:10.1007/BF00349527 |
Isani G, Andreani G, Kindt M, et al. Metallothioneins (MTs) in marine molluscs. Cellular and Molecular Biology, 2000, 46(2): 311-330 |
Iwinski KJ, Mcqueen AD, Kinley CM, et al. Sediment copper concentrations, in situ benthic invertebrate abundance, and sediment toxicity: Comparison of Treated and Untreated Coves in a Southern Reservoir. Water Air and Soil Pollution, 2016, 227(3): 85 DOI:10.1007/s11270-016-2778-2 |
Järup L. Hazards of heavy metal contamination. British Medical Bulletin, 2003, 68(1): 167-182 DOI:10.1093/bmb/ldg032 |
Johnson A, Carew E, Sloman KA. The effects of copper on the morphological and functional development of zebrafish embryos. Aquatic Toxicology, 2007, 84(4): 431-438 |
Kim JH, Kim WK. Use of the integrated biomarker response to measure the effect ofshort-term exposure to dibenza, h anthracene in common carp (Cyprinus carpio). Bulletin of Environmental Contamination and Toxicology, 2016, 96(4): 1-6 DOI:10.1007/s00128-015-1726-y |
Legras S, Mouneyrac C, Amiard JC, et al. Changes in metallothionein concentrations in response to variation in natural factors (salinity, sex, weight) and metal contamination in crabs from a metal-rich estuary. Journal of Experimental Marine Biology and Ecology, 2000, 246(2): 259-279 DOI:10.1016/S0022-0981(99)00187-2 |
Li YF, Gu ZQ, Liu H, et al. Biochemical response of the mussel Mytilus coruscus (Mytiloida: Mytilidae) exposed to in vivo sub-lethal copper concentrations. Chinese Journal of Oceanology and Limnology, 2012, 30(5): 738-745 DOI:10.1007/s00343-012-1232-6 |
Liu HH, He JY, Zhao RT, et al. Molecular expression pattern of glutathione S-transferase gene in Mytilus coruscus exposed to heavy metals. Oceanologia et Limnologia Sinica, 2014, 45(2): 274-280 [刘慧慧, 何建瑜, 赵荣涛, 等. 重金属胁迫下厚壳贻贝谷胱甘肽S-转移酶基因表达分析. 海洋与湖沼, 2014, 45(2): 274-280] |
Lowe DM, Soverchia C, Moore MN. Lysosomal membrane responses in the blood and digestive cells of mussels experimentally exposed to fluoranthene. Aquatic Toxicology, 1995, 33(2): 105-112 |
Masseroli M, Galati O, Pinciroli F. Protective action of phospholipid hydroperoxide glutathione peroxidase against membrane-damaging lipid peroxidation. In situ reduction of phospholipid and cholesterol hydroperoxides. Journal of Biological Chemistry, 1990, 265(1): 454-461 |
Modesto KA, Martinez CBR. RoundupⓇ causes oxidative stress in liver and inhibits acetylcholinesterase in muscle and brain of the fish Prochilodus lineatus. Chemosphere, 2010, 78(3): 294-299 DOI:10.1016/j.chemosphere.2009.10.047 |
Monteiro SM, Dos Santos NM, Calejo M, et al. Copper toxicity in gills of the teleost fish, Oreochromis niloticus:Effects in apoptosis induction and cell proliferation. Aquatic Toxicology, 2009, 94(3): 219-228 |
Narula SS, Brouwer MY, Armitage IM. Three-dimensional solution structure of Callinectes sapidus metallothionein-1 determined by homonuclear and heteronuclear magnetic resonance spectroscopy. Biochemistry, 1995, 34(2): 620-631 DOI:10.1021/bi00002a029 |
Nsofor CI, Igwilo IO, Ikpeze OO, et al. Bioaccumulation of heavy metals in shellfish Macrobrachium rosenbergi in Niger River at Onitsha, Anambra State, Nigeria. International Journal of Agriculture and Biosciences, 2014, 3(1): 38-40 |
Onosaka S, Cherian MG. Comparison of metallothionein determination by polarographic and cadmium-saturation methods. Toxicology and Applied Pharmacology, 1982, 63(2): 270-274 DOI:10.1016/0041-008X(82)90049-7 |
Oost RVD, Beyer J, Vermeulen NPE. Fish bioaccumulation and biomarkers in environmental risk assessment: A review. Environmental Toxicology and Pharmacology, 2003, 13(2): 57-149 |
Ridlington JW, Fowler BA. Isolation and partial characterization of a cadmium-binding protein from the American oyster (Crassostrea virginica). Chemico-Biological Interactions, 1979, 25(2-3): 127-138 DOI:10.1016/0009-2797(79)90041-3 |
Sloman KA, Wilson RW. Anthropogenic impacts upon behaviour and physiology. Fish Physiology, 2005, 24(5): 413-468 |
Solé M, Porte C, Albaigés J. The use of biomarkers for assessing the effects of organic pollution in mussels. Science of the Total Environment, 1995, 159(2-3): 147-153 DOI:10.1016/0048-9697(95)04182-Z |
Solé M. Assessment of the results of chemical analyses combined with the biological effects of organic pollution on mussels. TrAC Trends in Analytical Chemistry, 2000, 19(1): 1-9 DOI:10.1016/S0165-9936(99)00174-0 |
State Environmental Protection Agency. Fishery water quality standards. Beijing: Chinese Specification Press, 1989 [国家环境保护局. 渔业水质标准. 北京: 中国标准出版社, 1989]
|
Sun YQ, Wu ZH, Sun FX, et al. Accumulation and elimination of Meretrix meretrix to copper. Progress in Fishery Sciences, 2013, 34(1): 126-132 [孙元芹, 吴志宏, 孙福新, 等. 文蛤对重金属Cu的富集与排出特征. 渔业科学进展, 2013, 34(1): 126-132 DOI:10.3969/j.issn.1000-7075.2013.01.019] |
Thirumoorthy N, Manisenthil KK, Shyam SA, et al. Metallothionein: An overview. World Journal Gastroenterology, 2007, 13(7): 993-996 DOI:10.3748/wjg.v13.i7.993 |
Velisek J, Stara A, Li ZH, et al. Comparison of the effects of four anaesthetics on blood biochemical profiles and oxidative stress biomarkers in rainbow trout. Aquaculture, 2011, 310(3): 369-375 |
Wang HS, Song XJ, Dong WQ, et al. The cDNA cloning and characterization of Mytilus coruscus metallothionein 10 as well as its mRNA expression under the Cu2+ stress. Oceanologia et Limnologia Sinica, 2017, 48(4): 864-869 [王昊盛, 宋鑫金, 董文强, 等. 厚壳贻贝(Mytilus coruscus)金属硫蛋白MT-10: cDNA克隆、结构分析及铜离子胁迫下的表达. 海洋与湖沼, 2017, 48(4): 864-869] |
Wu J, Bao M, Ge D, et al. The expression of superoxide dismutase in Mytilus coruscus under various stressors. Fish and Shellfish Immunology, 2017, 70: 361-371 DOI:10.1016/j.fsi.2017.08.018 |
Xia B, Chen B, Sun X, et al. Toxicological effects of crude oil: Integrated biomarker responses in the hepatopancreas of clam Ruditapes philippinarum. Asian Journal of Chemistry, 2014, 26(12): 3631-3638 DOI:10.14233/ajchem.2014.16736 |
Xu M, Jiang L, Shen KN, et al. Transcriptome response to copper heavy metal stress in hard-shelled mussel (Mytilus coruscus). Genomics Data, 2016, 7(C): 152-154 |
Young JS, Gurtisen JM, Apts CW, et al. The relationship between the copper complexing capacity of sea water and copper toxicity in shrimp zoeae. Marine Environmental Research, 1979, 2(4): 265-273 DOI:10.1016/0141-1136(79)90011-4 |
Zhang YF. Complex toxic impacts of heavy metals and benzo (a) pyrene on marine mussels. Master's Thesis of Zhejiang University, 2017 [张翼飞.重金属与苯并芘在贻贝体内的复合毒性效应.浙江大学硕士研究生学位论文, 2017]
|
Zheng Q, Feng M, Dai Y. Comparative antioxidant responses in liver of Carassius auratus exposed to phthalates: An integrated biomarker approach. Environmental Toxicology and Pharmacology, 2013, 36(3): 741-749 |



